Способ получения инозина и 5'-инозиновой кислоты, штамм escherichia coli - продуцент инозина
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Инозин, а также 5’-инозиновую кислоту получают с использованием бактерий Escherichia coli, при этом продукция инозина указанными бактериями увеличена за счет увеличения активности белка, кодируемого геном ydeD. Данное изобретение позволяет увеличить выход инозина и 5’-инозиновой кислоты. 3 с. и 5 з.п. ф-лы, 2 табл., 3 ил.
Реферат
Область техники.
Настоящее изобретение относится к способу получения инозина, являющегося важным исходным реагентом для синтеза 5'-инозиновой кислоты (инозин-5’-фосфата) и к новому микроорганизму, используемому для его продукции.
Предшествующий уровень техники
Традиционно нуклеозиды получают в промышленном масштабе методом ферментации с использованием штаммов микроорганизмов, ауксотрофных по аденину, или этих штаммов, которым дополнительно придана устойчивость к различным соединениям, таким как аналоги пуринов и сульфагуанидин, при этом указанные штаммы принадлежат к роду Bacillus (патентные заявки Японии №38-23039 (1963), 54-17033 (1979), 55-2956 (1980) и 55-45199 (1980), выложенная патентная заявка Японии 56-162998 (1981), патентные заявки Японии 57-14160 (1982) и 57-41915 (1982), выложенная патентная заявка Японии 59-42895 (1984), к роду Brevibacterium (патентные заявки Японии №51-5075 (1976) и 58-17592 (1983), и Agric. Biol. Chem., 42, 399 (1978)), к роду Escherichia (заявка РСТ WO 9903988) и подобные им.
Получение указанных мутантных штаммов обычно состоит из обработки микроорганизмов с целью получения мутаций, такой как облучение УФ-излучением или обработка нитрозогуанидином (N-метил-N’-нитро-N-нитрозогуанидин) с последующей селекцией нужного штамма на подходящей питательной среде для селекции. С другой стороны, также практикуется выращивание мутантных штаммов, принадлежащих к роду Bacillus (выложенные патентные заявки Японии №58-158197 (1983), 58-175493 (1983), 59-28470 (1984), 60-156388 (1985), 1-27477 (1989), 1-174385 (1989), 3-58787 (1991), 3-164185 (1991), 5-84067 (1993) и 5-192164(1993)) к роду Brevibacterium (выложенная патентная заявка Японии 63-248394 (1988)) и к роду Escherichia (заявка WO 9903988), полученных с использованием методов генной инженерии.
Продуктивность штаммов - продуцентов инозина далее может быть улучшена путем увеличения способности к экскреции инозина. В настоящее время общепризнанно, что проникновение метаболитов через цитоплазматическую мембрану обычно происходит с участием более или менее специфических транспортных белков, осуществляющих их выброс (Рао et al, 1998, Microbiol. Mol. Biol. Rev., 62, 1-34; Paulsen et al, 1998, J. Mol. Biol., 277, 573-592; Saier et al, 1999, J. Mol. Microbiol. Biotechnol., 1, 257-279). Ранее авторы настоящего изобретения показали, что штаммы - продуценты инозина или ксантозина, принадлежащие к роду Escherichia и к роду Bacillus и обладающие повышенной активностью белка RhtA, кодируемого геном rhtA (ybiF), продуцировали больше инозина или ксантозина, чем родительские штаммы (патентная заявка РФ №2002101666).
Ранее было показано, что ген ydeD вовлечен в выброс из клеток метаболитов пути биосинтеза цистеина (DaBler et al., Mol. Microbiol., 36, 1101-1112, 2000; US 5972663). Ген ydeD известен как предполагаемая трансмембранная субъединица, кодирующая белок с неизвестной функцией (нуклеотиды с 1618262 по 1619062 в последовательности с инвентарным номером NC_000913, gi: 16129492 в базе данных GenBank).
Описание изобретения
Целью настоящего изобретения является увеличение продуктивности инозина штаммами-продуцентами инозина и предоставление способа получения инозина и 5’-инозиновой кислоты с использованием указанных штаммов.
Данная цель была достигнута путем установления того факта, что ген ydeD, предположительно кодирующий мембранный белок, не вовлеченный в пути биосинтеза пуриновых нуклеозидов, придает устойчивость к аналогу пуриновых оснований, 8-азааденину, в случае, когда природный аллель указанного гена введен в клетки штамма на многокопийной плазмиде. Более того, ген ydeD может увеличивать продукцию нуклеозидов в случае, когда его дополнительные копии введены в клетки соответствующих продуцентов инозина, принадлежащих к роду Escherichia. Таким образом было совершено настоящее изобретение.
Таким образом, настоящее изобретение предоставляет микроорганизм, принадлежащий к роду Escherichia, обладающий способностью к продукции инозина.
В частности, настоящее изобретение предоставляет микроорганизм с повышенной способностью к продукции инозина, основанной на повышении активности белка, вовлеченного, как предполагается, в транспорт пуриновых нуклеозидов из клетки указанного микроорганизма. Более конкретно, настоящее изобретение предоставляет микроорганизм с повышенной способностью к продукции инозина, основанной на повышении экспрессии гена, кодирующего белок, вовлеченный в процесс экскреции пуриновых нуклеозидов.
Далее настоящее изобретение предоставляет способ получения пуринового нуклеозида методом ферментации, включающим стадии выращивания указанного выше микроорганизма в питательной среде с целью продукции и накопления пуринового нуклеозида в питательной среде и выделения пуринового нуклеозида из культуральной жидкости.
Далее настоящее изобретение предоставляет способ получения 5’-инозиновой кислоты, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде, фосфорилирования полученного и накопленного инозина и выделения полученной и накопленной 5’-инозиновой кислоты.
Настоящее изобретение включает в себя следующее:
Изобретение 1. Бактерия, принадлежащая к роду Escherichia, обладающая способностью к продукции инозина, в которой активность белка, описанного в пунктах (А) или (В), в клетке упомянутой бактерии повышена:
(A) белок, который представлен аминокислотной последовательностью, приведенной в списке последовательностей под номером 2;
(B) белок, который представлен аминокислотной последовательностью, включающей делеции, замены, вставки или добавление одной или нескольких аминокислот в аминокислотную последовательность, приведенную в списке последовательностей под номером 2, и который обладает активностью, придающей бактерии повышенную устойчивость к 8-азааденину (здесь и далее белки, описанные в пунктах (А) и (В), упоминаются как “белки согласно настоящему изобретению”).
Изобретение 2. Бактерия в соответствии с Изобретением 1, в которой активности белков, описанных в пунктах (А) или (В), повышены путем трансформации бактерии с помощью ДНК, кодирующей белки, описанные в пунктах (А) или (В), или путем изменения регуляции экспрессии указанной ДНК в хромосоме упомянутой бактерии.
Изобретение 3. Бактерия в соответствии с Изобретением 2, в которой трансформация осуществляется с использованием многокопийного вектора.
Изобретение 4. Способ получения пуринового нуклеозида, включающий стадии выращивания бактерии в соответствии с любым из Изобретений 1-3 в питательной среде и выделения из культуральной жидкости полученного и накопленного в ней инозина.
Изобретение 5. Способ в соответствии с Изобретением 4, в котором бактерия обладает повышенной экспрессией генов биосинтеза пуриновых нуклеозидов.
Изобретение 6. Способ получения 5’-инозиновой кислоты, включающий стадии выращивания бактерии в соответствии с любым из Изобретений 1-3 в питательной среде, фосфорилирования полученного и накопленного инозина и выделения полученной и накопленной 5’-инозиновой кислоты.
Изобретение 7. Способ в соответствии с Изобретением 6, в котором бактерия модифицирована с целью повышения экспрессии генов биосинтеза пуриновых нуклеозидов.
Настоящее изобретение более детально будет описано ниже.
1. Бактерия согласно настоящему изобретению.
Вышеуказанной бактерией согласно настоящему изобретению является бактерия, принадлежащая к роду Escherichia, обладающая способностью к продукции инозина, в которой активность белка, описанного в пунктах (А) или (В), в клетке упомянутой бактерии повышена: (А) белок, который представлен аминокислотной последовательностью, приведенной в списке последовательностей под номером 2; (В) белок, который представлен аминокислотной последовательностью, включающей делеции, замены, вставки или добавление одной или нескольких аминокислот в аминокислотную последовательность, приведенную в списке последовательностей под номером 2, и который обладает активностью, придающей бактерии устойчивость к 8-азааденину.
Термин “бактерия, принадлежащая к роду Escherichia” означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. В качестве примера микроорганизма, принадлежащего к роду Escherichia, использованного в настоящем изобретении, может быть упомянута бактерия Escherichia coli (E.соli).
Использованный здесь термин “способность к продукции инозина” означает способность к продукции и накоплению инозина в питательной среде. Термин “обладающая способностью к продукции инозина” означает то, что микроорганизм, принадлежащий к роду Escherichia, обладает способностью к продукции и накоплению в питательной среде инозина в количестве большем, чем природный штамм Е.coli, такие как штаммы Е.coli W3110 и MG1655, и предпочтительно означает, что микроорганизм способен к продукции и накоплению в питательной среде в количестве не менее чем 10 мг/л, более предпочтительно не менее чем 50 мг/л инозина.
Термин “активность белка, описанного в пунктах (А) или (В), в клетке упомянутой бактерии повышена” означает, что количество молекул указанного белка в клетке повышено или сама активность в пересчете на белок повышена. Термин “активность” означает активность, придающую бактерии устойчивость к 8-азааденину.
К белкам согласно настоящему изобретению относятся белки, описанные в следующих пунктах (А) или (В):
(А) белок, который представлен аминокислотной последовательностью, приведенной в списке последовательностей под номером 2;
(В) белок, который представлен аминокислотной последовательностью, включающей делеции, замены, вставки или добавление одной или нескольких аминокислот в аминокислотную последовательность, приведенную в списке последовательностей под номером 2 и который обладает активностью, придающей бактерии устойчивость к 8-азааденину.
Белок, который представлен аминокислотной последовательностью, приведенной в списке последовательностей под номером 2, является белком YdeD. Белок YdeD является сильно гидрофобным белком, состоящим из 266 аминокислот, содержащим 10 предполагаемых трансмембранных сегментов и обладающим неизвестной функцией. Белок YdeD кодируется геном ydeD. Ген ydeD (нуклеотиды с 1618262 по 1619062 в последовательности с инвентарным номером NC_000913, gi: 16129492 в базе данных GenBank) расположен в хромосоме Е.coli между генами tаrВ и ydeF. Ген ydeD кодирует белок с неизвестной функцией.
Количество “нескольких” аминокислот различается в зависимости от положения и типа аминокислотного остатка в трехмерной структуре белка. Оно может быть от 2 до 27, предпочтительно от 2 до 15 и более предпочтительно от 2 до 5 для белка (А).
Термин “устойчивость к 8-азааденину” означает способность бактерии к росту на минимальной питательной среде, содержащей 8-азааденин в концентрации, при которой штамм дикого типа или родительский штамм не может расти, или способность бактерии расти на питательной среде, содержащей 8-азааденин, с большей скоростью, чем штамм дикого типа или родительский штамм. Упомянутая выше концентрация 8-азааденина составляет обычно от 50 до 5000 мкг/мл, предпочтительно от 100 до 1000 мкг/мл.
Методы увеличения активности белка согласно настоящему изобретению, в особенности методы увеличения количества молекул указанного белка в клетке, включают методы изменения последовательности, регулирующей экспрессию ДНК, кодирующей белок согласно настоящему изобретению, и методы увеличения числа копий гена, но не ограничиваются ими.
Изменение последовательности, регулирующей экспрессию ДНК, кодирующей белок согласно настоящему изобретению, может быть достигнуто путем помещения ДНК, кодирующей белок согласно настоящему изобретению, под контроль сильного промотора. В качестве сильных промоторов известны, например, lac промотор, trp промотор, trc промотор, PL промотор фага лямбда. С другой стороны, промотор может быть усилен, например, путем введения мутации в указанный промотор с целью увеличения уровня транскрипции гена, расположенного после промотора. Далее известно, что замена нескольких нуклеотидов в участке между местом связывания рибосомы (RBS) и старт кодоном, а в особенности в последовательности непосредственно перед старт кодоном, в значительной степени влияет на транслируемость мРНК. Например, было обнаружено 20-кратное изменение уровня экспрессии в зависимости от природы трех нуклеотидов, предшествующих старт кодону (Gold et al., Annu. Rev. Microbiol, 35, 365-403, 1981; Hui et al, EMBO J, 3, 623-629, 1984).
Более того, некий “энхансер” может быть дополнительно введен с целью увеличения уровня транскрипции указанного гена. Введение ДНК, содержащей либо ген, либо промотор в хромосомную ДНК, описано, например, в выложенной патентной заявке Японии №1-215280 (1989).
В качестве альтернативы число копий гена может быть увеличено путем введения гена в многокопийный вектор с образованием рекомбинантной ДНК, с последующим введением такой рекомбинантной ДНК в микроорганизм. Примерами векторов, использующихся для введения рекомбинантной ДНК, являются плазмидные векторы, такие как pMW118, pBR322, pUC19, pBluescript KS+ pACYC177, pACYC184, pAYC32, pMW119, pET22b и подобные им, фаговые векторы, такие как 11059, 1BF101, M13mp9, фаг Mu (выложенная патентная заявка Японии №2-109985) и подобные им, и транспозоны (Berg, D.E. and Berg, C.M., Bio/Technol., 1417 (1983)), такие как Mu, Tn10, Tn5 и подобные им. Кроме того, усиление экспрессии гена может быть достигнуто путем интеграции гена в бактериальную хромосому методом гомологичной рекомбинации или подобным.
Методы использования сильного промотора или “энхансера” могут быть скомбинированы с методами увеличения числа копий гена.
Методами получения хромосомной ДНК, гибридизации, полимеразной цепной реакции (ПЦР), получения плазмидной ДНК, расщепления и лигирования ДНК, трансформации, выбора олигонуклеотидов в качестве затравок и подобными методами могут являться традиционные методы, хорошо известные специалисту в данной области. Эти методы описаны в книге Sambrook, J. and Russell D. "Molecular Cloning A Laboratory Manual, Third Edition", Cold Spring Harbor Laboratory Press (2001) и других подобных изданиях.
Для выведения микроорганизма, принадлежащего к роду Escherichia и обладающего повышенной экспрессией гена, кодирующего белок согласно настоящему изобретению, необходимые участки генов могут быть получены с помощью ПЦР на основе уже доступной информации о генах Е.coli. Например, ген ydeD, который, как предполагается, кодирует транспортер, может быть клонирован из хромосомной ДНК штаммов Е.coli К 12 W3110 и Е.coli MG1655 с использованием метода ПЦР. Хромосомная ДНК, используемая для этого, также может быть получена из любого другого штамма Е.coli.
К белкам согласно настоящему изобретению относятся мутанты и варианты белка YdeD, которые могут существовать вследствие природного разнообразия, при условии, что указанные мутанты и варианты демонстрируют функциональные свойства белка YdeD, по крайней мере устойчивость к 8-азааденину. ДНК, кодирующая указанные мутанты и варианты, может быть получена путем выделения ДНК, которая гибридизуется с геном ydeD (SEQ ID NO:1) или частью указанного гена в жестких условиях и которая кодирует белок, увеличивающий продукцию пуриновых нуклеотидов. Термин “жесткие условия”, упомянутый здесь, означает условия, при которых образуются так называемые специфические гибриды, а неспецифические - не образуются. Например, к жестким условиям относятся условия, при которых гибридизуются ДНК, обладающие высокой степенью гомологии, к примеру, ДНК, обладающие гомологией не менее 70% друг относительно друга. В качестве варианта примером жестких условий являются условия соответствующие условиям отмывки при гибридизации по Саузерну, например, 60° С, 1× SSC, 0.1% SDS, предпочтительно 0.1× SSC, 0.1% SDS. В качестве зонда для ДНК, кодирующей варианты и гибридизующейся с геном ydeD, также может быть использована часть нуклеотидной последовательности под номером 1. Зонд подобного рода может быть получен в результате ПЦР с использованием в качестве затравок олигонуклеотидов, полученных на основе нуклеотидной последовательности под номером 1, и фрагмента ДНК, содержащего нуклеотидную последовательность под номером 1, в качестве матрицы. В случае, когда в качестве зонда используется фрагмент ДНК длиной около 300 пар оснований, условия отмывки при гибридизации соответствуют, например, 50° C, 2× SSC и 0.1%SDS.
Бактерия согласно настоящему изобретению может быть получена путем введения вышеуказанных ДНК в бактерию, уже обладающую способностью к продукции пуриновых нуклеозидов. С другой стороны, бактерия согласно настоящему изобретению может быть получена путем придания бактерии, уже содержащей указанные ДНК, способности к продукции пуриновых нуклеозидов.
В качестве родительского штамма - продуцентов инозина, в которым активности белков согласно настоящему изобретению будут повышены, может быть использован штамм Е.coli AJ13732 (FADRaddeddyicPpgixapA(pMWKQ)) (WO 9903988). Указанный штамм является производным от известного штамма W3110, содержащего мутации, введенные в ген purF, кодирующий PRPP амидотрансферазу, ген purR, кодирующий репрессор биосинтеза пуринов, ген deoD, кодирующий фосфорилазу пуриновых нуклеозидов, ген рurА, кодирующий сукцинил-АМР-синтазу, ген add, кодирующий аденозиндеаминазу, ген edd, кодирующий 6-фосфоглюконатдегидразу, ген pgi, кодирующий фосфоглюкозоизомеразу, ген харА, кодирующий ксантозинфосфорилазу (purF-, purA-, deoD-, purR-, add-, edd-, pgi-, харА-), а также содержащего плазмиду pMWKQ - производную от вектора pMW218, в которой находятся гены purFKQ, кодирующие PRPP амидотрансферазу, нечувствительную к гуанозин монофосфату (GMP) (WO 9903988).
Чтобы увеличить саму активность в пересчете на белок согласно настоящему изобретению, также возможно ввести мутацию в структурную часть гена, кодирующего белок, чтобы увеличить активность белка. Для того чтобы ввести мутацию в ген, могут быть использованы сайт-специфический мутагенез (Kramer, W. and Frits, H.J., Methods in Enzymology, 154, 350 (1987)), методы рекомбинантной ПЦР (PCR Technology, Stockton Press (1989)), химический синтез специфических участков ДНК, обработка нужного гена с помощью гидроксиламина, обработка микробных штаммов, содержащей нужный ген, с помощью УФ-излучения или химического реагента, такого как нитрозогуанидин или азотистая кислота, или подобным методом. Микроорганизм, в котором активность указанного белка повышена, может быть отобран как штамм, растущий на минимальной среде, содержащей 8-азааденин.
Бактерия согласно настоящему изобретению может быть в дальнейшем улучшена за счет увеличения экспрессии одного или нескольких генов, вовлеченных в биосинтез пуринов. Примерами таких генов являются гены риг регулона из Е.coli (Escherichia coli and Salmonella, Second Edition, Editor in Chief: F.C.Neidhardt, ASM Press, Washington D.C., 1996). Описан штаммом Е.coli - продуцент инозина, содержащий мутантный ген purF, кодирующий PRPP амидотрансферазу, свободную от ингибирования GMP и АМР по типу обратной связи, инактивированный ген purR, кодирующий репрессор биосинтеза пуринов (WO 9903988).
Механизмом, увеличивающим продукцию пуриновых нуклеозидов бактерией путем увеличения активности белков согласно настоящему изобретению, является, как можно предположить, повышенная экскреция целевого пуринового нуклеозида из клетки бактерии.
2. Способ получения пуриновых нуклеозидов.
К способам согласно настоящему изобретению относится способ получения инозина, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления инозина в питательной среде и выделения инозина из культуральной жидкости.
Согласно настоящему изобретению выращивание, выделение и очистка пуринового нуклеозида из культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам ферментации, в которых пуриновый нуклеозид продуцируется с использованием микроорганизма. Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, неорганические ионы и другие необходимые органические компоненты. К источникам углерода относятся различные углеводы, такие как глюкоза, лактоза, галактоза, фруктоза, арабиноза, мальтоза, ксилоза, трехалоза, рибоза и гидролизат крахмала; спирты, такие как глицерин, маннитол и сорбитол; различные органические кислоты, такие как глюконовая кислота, фумаровая кислота, лимонная кислота и янтарная кислота и подобные им. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как сульфат аммония, хлорид аммония и фосфат аммония, органические источники азота, такие как гидролизат соевых бобов; газообразный аммиак, раствор аммония и подобные соединения. Желательно, чтобы подходящие небольшие количества витаминов, таких как витамин Bi, и других необходимых веществ, например, нуклеиновых кислот, таких как аденин и РНК, или дрожжевой экстракт и подобные соединения присутствовали в питательной среде в качестве органических питательных компонент. Кроме того, небольшие количества фосфата кальция, сульфата магния, ионов железа, ионов марганца и подобных соединений могут быть добавлены, если необходимо.
Выращивание осуществляется предпочтительно в аэробных условиях в течение 16-72 часов, температура при выращивании поддерживается в пределах от 30 до 45° С и рН в пределах от 5 до 8. рН среды может регулироваться неорганическими или органическими кислотными или щелочными веществами, а также газообразным аммиаком.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрацией через мембрану, а затем целевой пуриновый нуклеозид может быть выделен из культуральной жидкости любым из традиционных методов или любой комбинацией этих методов, таким как ионообменная хроматография и осаждение.
3. Способ получения 5’-инозиновой кислоты.
К способам согласно настоящему изобретению также относится способ получения 5’-инозиновой кислоты, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде, фосфорилирования полученного и накопленного инозина и выделения полученной и накопленной 5'-инозиновой кислоты.
Согласно настоящему изобретению выращивание, выделение и очистка инозина из культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам ферментации, в которых инозин продуцируется с использованием микроорганизма. Далее согласно настоящему изобретению фосфорилирование полученного и накопленного инозина, а также выделение полученной и накопленной 5’-инозиновой кислоты может быть осуществлено методом, подобным традиционным методам, в которых пуриновые нуклеотиды, такие как 5’-инозиновая кислота, получается из пуринового нуклеозида, такого как инозин.
Фосфорилирование пуринового нуклеозида может быть осуществлено ферментативно с использованием различных фосфатаз, нуклеозидкиназ и нуклеозидфосфотрансфераз, или химически с использованием фосфорилирующих агентов, таких как РОСl3 или подобным им. Могут быть использованы фосфатаза, способная к катализу селективного переноса фосфорильной группы пирофосфата в 5’-положение нуклеозида (Mihara et. al, Phosphorylation of nucleosides by the mutated acid phosphatase from Morganella morganii. Appl. Environ. Microbiol. 2000, 66:2811-2816), или кислая фосфатаза, использующая полифосфорные кислоты (их соли), фенилфосфорную кислоту (ее соли) или карбамилфосфорную кислоту (ее соли) в качестве донора фосфорной кислоты (WO 9637603 A1) или подобные им. Также в качестве примера фосфатазы может быть приведена фосфатаза, способная к каталитическому переносу фосфорильной группы в 2’, 3’, 5’-положение нуклеозида с использованием в качестве субстрата п-нитрофенилфосфата (Mitsugi, К., et al, Agric. Biol. Chem. 1964, 28, 586-600), неорганического фосфата (JP42-1186), или ацетил фосфата (JP61-41555), или подобная ей. В качестве примера нуклеозидкиназы может быть приведена гуанозин-инозинкиназа из Е.coli (Mori et. al. Cloning of a guanosine-inosine kinase gene of Escherichia coli and characterization of the purified gene product. J. Bacteriol. 1995. 177:4921-4926; WO9108286) или подобная ей. В качестве примера нуклеозидфосфотрансферазы может быть приведена нуклеозидфосфотрансфераза, описанная Hammer-Jespersen, К. (Nucleoside catabolism, p.203-258. In A Munch-Petesen (ed.), Metabolism of nucleotides, nucleosides and nucleobases in microorganism. 1980, Academic Press, New York) или подобная ей. Химическое фосфорилирование нуклеозидов может быть осуществлено с использованием фосфорилирующего агента, такого как РОСl3 (Yoshikawa et. al. Studies of phosphorylation. III. Selective phosphorylation of unprotected nucleosides. Bull. Chem. Soc. Jpn. 1969, 42:3505-3508) или подобного ему.
В способе согласно настоящему изобретению бактерия согласно настоящему изобретению может быть модифицирована с целью увеличения экспрессии генов биосинтеза пуриновых нуклеозидов.
Подписи к чертежам
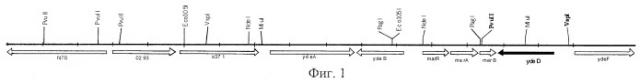
Фиг.1. Схема хромосомного фрагмента ДНК, содержащегося в фазмиде pAZA10, который придавал клеткам устойчивость к 8-азааденину.
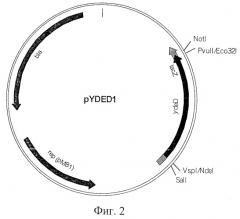
На Фиг.2 показана структура плазмиды pYDED1.
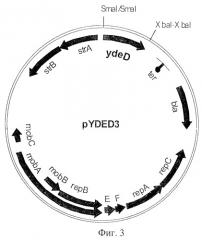
На Фиг.3 показана структура плазмиды pYDED3.
Наилучший способ осуществления изобретения
Пример 1. Клонирование генов, которые придают устойчивость к аналогам пуриновых оснований, из Е.coli в фазмиду mini-Mu.
Гены из E.coli, которые обуславливают устойчивость к аналогам пуриновых оснований, были изначально клонированы in vivo с использованием фазмиды mini-Mu d5005 (Groisman, E.A., et al., J. Bacteriol., 168, 357-364 (1986)). Штамм MG1655, лизогенный по фагу МuСts62, был использован в качестве донора. Свежеприготовленные лизаты были использованы для инфицирования лизогенного по фагу MuCts производного этого штамма. Полученные клетки высевались на минимальную среду М9 с глюкозой, содержащую канамицин (40 мкг/мл) и 8-азааденин (200 мг/мл). Были отобраны колонии, появившиеся после 48 часов культивирования, из колоний была выделена плазмидная ДНК и использована для трансформации штамма MG1655 стандартными методами. Трансформанты были отобраны на чашках с агаризованным L-бульоном, содержащим канамицин, как указано выше. Из трансформантов, устойчивых к 200 мкг/мл 8-азааденина, была выделена плазмидная ДНК. Нуклеотидная последовательность концов хромосомных ДНК вставок определялась с использованием затравок, приведенных в Списке последовательностей под номерами 3 и 4 (SEQ ID NO:3 и 4) соответственно для левого и правого участков присоединения фага Ми. Полная нуклеотидная последовательность генома штамма Е.coli K-12 определена (Science, 277, 1453-1474, 1997). Поэтому полученные данные о нуклеотидной последовательности были сравнены с информацией из GenBank и таким образом были идентифицированы клонированные фрагменты.
Оказалось, что были клонированы несколько типов вставок, принадлежащих к различным участкам хромосомы. Одна из них, AZA-10, являющаяся хромосомной вставкой (8861 т.п.о.) в фазмиду pAZA10, показана на Фиг.1.
Пример 2. Идентификация гена ydeD, придающего устойчивость к 8-азааденину.
Клонирование гена ydeD в вектор pAYCTER3.
Фрагмент AZA-10 содержал по крайней мере 10 генов. Для того чтобы идентифицировать ген, придающий устойчивость к 8-азааденину, каждый из генов был субклонирован в многокопийный вектор pUC21 и проверен на способность придавать устойчивость к указанному реагенту. Более конкретно, ген ydeD, содержащий примерно 250 п.о. перед предполагаемым старт-кодоном, был вырезан из фрагмента AZA-10 с использованием ферментов рестрикции PvuII и VspI и вставлен в вектор pUC21, предварительно обработанный ферментами рестрикции Есо22I и NdeI. Так была получена плазмида pYDED1, содержащая ген ydeD (Фиг.2). Клетки Е. coli, содержащие эту многокопийную плазмиду, на минимальной среде росли плохо. Поэтому ген ydeD был переклонирован из плазмиды pUC21 по сайтам SmaI и ХbаI вектора pAYCTER3, производного от pAYC32. Таким образом была получена плазмида pYDEDS (Фиг.3). Вектор pAYCTER3 является очень стабильным среднекопийным вектором, сконструированным на основе плазмиды RSF1010 (Christoserdov A.Y., Tsygankov Y.D, Plasmid, 1986, v.16, pp.161-167) путем введения в плазмиду pAYC32 полилинкера из плазмиды pUC19 и сильного терминатора гена rrb.
Пример 3. Влияние амплификации гена ydeD на устойчивость штамма Е.coli TG1 к 8-азааденину.
Плазмида pYDED3, а также вектор pAYCTER3 были введены в штамм Е. coli TG1. Так были получены штаммы TG1(pYDED3) и TG1 (pAYCTER3). Затем была определена способность этих штаммов расти в присутствии 8-азааденина на чашках с минимальной агаризованной средой М9 с глюкозой, содержащей ступенчатые концентрации ингибитора. Чашки были засеяны клетками (от 105 до 106) ночной культуры, выращенной на минимальной среде, содержащей 100 мг/мл ампициллина в случае штаммов с плазмидами. Степень роста была оценена после инкубации в течение 44 часов при 37° С. Результаты представлены в Таблице 1.
| Таблица 1 | |||||
| Штамм | Рост на минимальной среде | ||||
| содержащей 8-азааденин, мкг/мл | |||||
| не содержащей | 100 | 300 | 500 | 1000 | |
| добавок | |||||
| TG1 | + | - | - | - | - |
| TG1 (pAYCTER3) | + | - | - | - | - |
| TG1 (pYDED3) | + | + | + | + | ± |
| Пояснения. +: хороший рост; ±: плохой рост; -: отсутствие роста. |
Как видно из Таблицы 1, амплификация гена ydeD в значительной степени увеличила устойчивость клеток к 8-азааденину. Известно, что ген ydeD кодирует белок, вовлеченный в выброс из клеток метаболитов пути биосинтеза цистеина (DaBler et al., Mol. MicrobioL, 36, 1101-1112, 2000; US 5972663). Поэтому можно предположить, что ген ydeD обладает широкой специфичностью и также вовлечен в процесс экскреции производных пуринов.
Пример 4. Влияние амплификации гена ydeD на продукцию инозина штаммом Е.coli - продуцентом инозина.
Штамм AJ13732(pMWKQ) - продуцент инозина был трансформирован вектором pAYCTER3 и плазмидой pYDED3. Так были получены штаммы AJ13732(pMWKQ, pAYCTER3) и AJ13732(pMWKQ, pYDED3). Каждый из этих штаммов выращивался при 37° С в течение 18 часов в L-бульоне, содержащем 100 мг/л ампициллина и 75 мг/л канамицина, и 0.3 мл полученной культуры было перенесено в 3 мл питательной среды для ферментации, содержащей 100 мг/л ампициллина и 75 мг/л канамицина, в пробирке 20× 200 мм и инкубировалось при 37° С в течение 72 часов на роторной качалке.
Состав питательной среды для ферментации (г/л):
Глюкоза 40.0
(NH4)2SO4 16.0
КН2РO4 1.0
MgSO4·7H2O 1.0
FeSO4·7H2O 0.01
MnSO4·5H2O 0.01
Дрожжевой экстракт 8.0
СаСО3 30.0
Глюкоза и сульфат марганца стерилизовались раздельно. СаСО3 стерилизовали нагреванием при 180° С в течение 2 часов. рН поддерживали в районе 7.0. Антибиотики добавляли в среду после стерилизации.
После выращивания количество инозина, накопленное в среде, определялось методом ВЭЖХ. Образец культуральной жидкости (500 мкл) был отцентрифугирован при 1500 об/мин в течение 5 мин, супернатант был разбавлен водой в 4 раза и проанализирован с помощью ВЭЖХ.
Условия для анализа с помощью ВЭЖХ:
Колонка: Luna С18(2) 250× 3 мм, 5 u (Phenomenex, USA). Буфер: 2% v/v C2H5OH; 0.8% v/v триэтиламин, 0.5% v/v уксусная кислота (ледяная), рН 4.5. Температура: 30° С. Скорость потока: 0.3 мл/мин. Объем пробы: 5 мкл. УФ-детектор: 250 нм.
Время удерживания (мин):
Ксантозин 13.7
Инозин 9.6
Гипоксантин 5.2
Гуанозин 11.4
Аденозин 28.2
Результаты представлены в Таблице 2.
| Таблица 2. | ||
| Штамм | OD540 | Инозин, г/л |
| AJ13732(pMWKQ) | 5.5 | 6.3 |
| AJ13732 (pMWKQ, pAYCTER3) | 5.6 | 5.8 |
| AJ13732 (pMWKQ, pYDED3) | 5.3 | 6.7 |
Как видно из Таблицы 2, амплификация гена ydeD увеличивала продукцию инозина штаммом AJ13732 (pMWKQ).
1. Способ получения инозина, включающий стадии выращивания бактерии Escherichia coli в питательной среде и выделения из культуральной жидкости полученного и накопленного в ней инозина, отличающийся тем, что используют бактерию Escherichia coli, способность к продукции инозина которой увеличена за счет повышения активности белков, выбранных из группы (А) белок, который представлен аминокислотной последовательностью, приведенной в списке последовательностей под номером 2 (SEQ ID NO:2); (В) белок, который представлен аминокислотной последовательностью, включающей делеции, замены, вставки или добавление одной или нескольких аимнокислот в аминокислотную последовательность, приведенную в списке последовательностей под номером 2 (SEQ ID NO:2), и который обладает активностью, придающей бактерии повышенную устойчивость к 8-азааденину.
2. Способ по п.1, отличающийся тем, что активности белков, описанных в пунктах (А) или (В), повышены путем трансформации бактерии с помощью ДНК, кодирующей белки, описанные в пунктах (А) или (В), или путем изменения регуляции экспрессии указанной ДНК в хромосоме упомянутой бактерии.
3. Способ по п.2, отличающийся тем, что трансформация осуществляется с использованием многокопийного вектора.
4. Способ по п.1, отличающийся тем, что у указанной бактерии экспрессия генов биосинтеза инозина повышена.
5. Способ по п.1, отличающийся тем, что в качестве продуцента инозина используют штамм Escherichia coli AJ3732 (рMWKQ, pYDED3).
6. Способ получения 5’-инозиновой кислоты, включающий стадии выращивания бактерии Escherichia coli в питательной среде, фосфорилирования полученного и накопленного инозина и выделения полученной 5’-инозиновой кислоты, отличающийся тем, что используют бактерию Escherichia coli, способность к продукции инозина которой увеличена за счет повышения активности белков, выбранных из группы (А) белок, который представлен аминокислотной последовательностью, приведенной в списке последовательностей под номером 2 (SEQ ID NO:2); (В) белок, который представлен аминокислотной последовательностью, включающей делеции, замены, вставки или добавление одной или нескольких аминокислот в аминокислотную последовательность, приведенную в списке последовательностей под номером 2 (SEQ ID NO:2), и который обладает активностью, придающей бактерии повышенную устойчивость к 8-азааденину.
7. Способ по п.6, отличающийся тем, что у указанной бактерии экспрессия генов биосинтеза инозина повышена.
8. Штамм Escherichia coli AJ13732 (pMWKQ, pYDED3)- продуцент инозина.