Штамм lactobacillus paracasei cncm i-2116 (ncc 2461), обладающий способностью предотвращать колонизацию кишечника патогенными бактериями, вызывающими диарею, и предотвращать заражение эпителиальных клеток кишечника ротавирусами, пищевой продукт и фармацевтическая композиция для профилактики и/или лечения заболеваний, связанных с диареей
Иллюстрации
Показать всеИзобретение относится к биотехнологии, может быть использовано в пищевой промышленности и медицине при профилактике и/или лечении заболеваний, связанных с диареей. Штамм Lactobacillus paracasei CNCM I-2116 (NCC 2461) способен прикрепляться к слизистой оболочке кишечника млекопитающегося и расти в присутствии до 0,4% солей желчных кислот и предотвращать заражение эпителиальных клеток кишечника ротавирусами. Пищевой продукт характеризуется содержанием от 1·105 до 1·1012 КОЕ штамма L.paracasei I-2116 (NCC 2461)/г пищевого носителя, выбранного из молока, йогурта, творога, сыра, сухого молока, детского питания и т.п. Фармацевтическая композиция содержит эффективное количество КОЕ штамма L.paracasei CNCM I-2116 (NCC 2461) или надосадочной фракции его культуры и физиологически приемлемый носитель. Изобретение обеспечивает высокий уровень активности против SA-11 серотина 3 и ротавируса Hochi серотипа 4. 3 н.п. ф-лы, 9 ил., 1 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым микроорганизмам рода Lactobacillus, которые применимы для предотвращения (профилактики) диареи, вызванной как патогенными бактериями, так и ротавирусами соответственно. В частности, настоящее изобретение касается использования упомянутых микроорганизмов для приготовления пищевого носителя и содержащей их композиции.
Уровень техники
Организмы, вырабатывающие молочную кислоту в качестве основного метаболического компонента, известны уже в течение длительного времени. Такие бактерии могут быть обнаружены в молоке или на фабриках по переработке молока, соответственно в живых или разлагающихся растениях, а также в кишечнике человека и животных. Такие микроорганизмы, известные под общим названием “молочнокислых бактерий”, представляют собой весьма неоднородную группу и включают, например, роды Lactococcus, Lactobacillus, Streptococcus, Bifidobacterium, Pediococcus и др.
Молочнокислые бактерии могут быть использованы в качестве ферментирующих агентов для консервирования пищевых продуктов, преимущества которых связаны с низким рН и действием продуктов ферментации, образующихся в результате их ферментационной активности по подавлению роста гнилостных бактерий. С учетом этого молочнокислые бактерии используют для приготовления различных пищевых продуктов, таких как сыр, йогурт и другие ферментированные молочные продукты.
Недавно молочнокислые бактерии стали объектом пристального внимания в связи с тем, что для некоторых штаммов были установлены ценные для человека и животных свойства, проявляемые после попадания в организм с пищей. В частности, для конкретных штаммов родов Lactobacillus или Bifidobacterium была установлена способность колонизировать слизистую кишечника и способствовать поддержанию хорошего самочувствия у человека и животного.
В этом отношении европейская патентная заявка ЕР 0-768375 описывает конкретные штаммы рода Bifidobacterium, которые способны имплантироваться в кишечную флору и могут соединяться с клетками кишечника. Было сообщено, что такие Bifidobacterium способствуют иммуномодуляции и способны по конкурентному механизму исключать адгезию патогенных бактерий на кишечных клетках, тем самым способствуя поддержанию здоровья субъекта.
В последние несколько лет исследования также были сосредоточены на возможном использовании молочнокислых бактерий в качестве пробиотических средств. Под пробиотическими средствами понимаются препараты живых микробов, которые способствуют здоровью субъекта за счет защиты нативной микрофлоры кишечника. Обычно микробный препарат может быть принят как пробиотический в том случае, когда активные микробы в его составе и характер их активности известны. Считается, что пробиотические средства присоединяются к слизистой кишечника, колонизируют пищеварительный тракт и тем самым предотвращают присоединение к нему опасных микроорганизмов. Ключевая предпосылка их действия состоит в том, что они должны достигать слизистой кишечника будучи активными и живыми, не подвергаясь разрушению в верхних отделах желудочно-кишечного тракта, особенно под влиянием низких рН, характерных для желудка.
В связи с этим международная патентная заявка WO 97/00078 описывает конкретный штамм, обозначенный Lactobacillus GG (АТСС 53103) в качестве такого пробиотического средства. В частности, данный микроорганизм используется в способе профилактики или лечения реакций гиперчувствительности пищевой этиологии таким образом, что его вводят реципиенту наряду с пищевым продуктом, который был подвергнут гидролитической обработке с помощью пепсина и/или трипсина. Выбранный штамм Lactobacillus описан как проявляющий адгезивные и колонизирующие свойства и обладающий протеазной системой таким образом, что входящий в состав вводимого пищевого продукта белковый материал дополнительно гидролизуется под действием протеаз, секретируемых данным конкретным штаммом
Lactobacillus. Обсуждаемый в указанном документе способ в конечном счете должен приводить в поглощению белкового продукта кишечником в таком виде, который не содержит существенного количества какого-либо аллергенного материала.
Кроме того, ссылка на европейскую патентную заявку ЕР 0-577903 сделана в связи с использованием таких молочнокислых бактерий, обладающих способностью вытеснять Heliobacter pylori, известной в качестве возбудителя развития язвенной болезни, при приготовлении носителя, предназначенного для лечения или профилактики язвенной болезни, связанной с действием Heliobacter pylori.
В международной патентной заявке WO 99/29833 описан конкретный штамм LMG-P-17806, несущий три плазмиды определенного размера. Описано, что данный штамм способен защищать клетки кишечника от инвазии сальмонеллой Salmonella typhimurium,
Учитывая возможность получения известных ценных свойств конкретных штаммов молочнокислых бактерий, в данной области техники имеется необходимость в дополнительных штаммах молочнокислых бактерий, которые бы имели преимущества в обеспечении благополучного состояния человека и/или животного.
Сущность изобретения
Задачей настоящего изобретения является представление дополнительных бактериальных штаммов, которые проявляют новые свойства, полезные для человека и/или животного.
Указанная выше задача была решена путем представления новых микроорганизмов, а именно молочнокислых бактерий, относящихся к роду Lactobacillus, свойствами которых является способность предотвращать колонизацию кишечника патогенными бактериями, вызывающими (диарею) понос, и предотвращать заражение клеток кишечного эпителия ротавирусами. В соответствии с предпочтительным вариантом штаммы Lactobacillus способны соединяться со слизистой кишечника организма-реципиента и способны в существенной степени колонизировать ее.
В соответствии с еще одним предпочтительным вариантом штаммы Lactobacillus способны расти в присутствие вплоть до 0,4% солей желчных кислот, благодаря чему они смогут легко проходить по желудочно-кишечному тракту, по существу сохраняя свою активность.
В соответствии с другим предпочтительным вариантом молочнокислую бактерию выбирают из группы, которая включает Lactobacillus rhamnosus или Lactobacillus paracasei, предпочтительно Lactobacillus paracasei, а наиболее предпочтительно Lactobacillus paracasei CNCM I-2116.
Как было показано, микроорганизмы по настоящему изобретению проявляют следующие свойства: они являются грамположительными, негативными по каталазе, негативными по NН3-образованию аргинина и негативными по выработке CO2. Они вырабатывают L(+)-молочную кислоту, способны расти в присутствии солей желчных кислот в концентрации вплоть до 0,4% и могут в существенной степени предотвращать заражение эпителиальных клеток ротавирусами.
Новые микроорганизмы могут быть использованы для приготовления различных пищевых материалов-носителей, таких как молоко, йогурт, творог, ферментированное молоко, ферментированные молочные продукты, ферментированные продукты переработки хлебных злаков, порошковое молоко, детское питание, и могут быть включены в состав носителей в количестве от примерно 105 КОЕ/г до примерно 1011 КОЕ/г. Для целей настоящего изобретения аббревиатура “КОЕ” должна соответствовать “колониеобразующей единице”, которая определяется как число бактериальных клеток, исходя из микробиологических подсчетов на агаровых пластинах.
Также настоящее изобретение представляет пищевой продукт или фармацевтическую композицию, содержащие, по крайней мере, один из штаммов Lactobacillus, обладающий указанными выше признаками.
Для приготовления пищевой композиции по настоящему изобретению, по крайней мере, один из штаммов Lactobacillus по настоящему изобретению вносят в подходящий носитель в количестве от примерно 105 КОЕ/г до примерно 1011 КОЕ/г, предпочтительно от примерно 106 КОЕ/г до примерно 1010 КОЕ/г, более предпочтительно от примерно 107 КОЕ/г до примерно 109 КОЕ/г.
В случае фармацевтической композиции продукт может быть приготовлен в виде таблеток, жидких бактериальных суспензий, сухих пищевых добавок, влажных пищевых добавок, сухих пищевых тюбиков или влажных пищевых тюбиков и т.п. при количестве вносимых в их состав штаммов Lactobacillus в диапазоне вплоть до 1012 КОЕ/г, предпочтительно от примерно 107 КОЕ/г до примерно 1011 КОЕ/г, более предпочтительно от примерно 107 КОЕ/г до примерно 1010 КОЕ/г.
Активность новых микроорганизмов в кишечнике субъекта по сути своей зависит от дозы. Следовательно, чем больше новых микроорганизмов попадает вместе с указанным выше пищевым продуктом или фармацевтической композицией, тем сильнее защитная и/или терапевтическая активность микроорганизмов. Поскольку новые микроорганизмы не являются вредными для человека и животных и, в конечном счете, были выделены из детских испражнений, то значительное их количество может быть включено таким образом, чтобы значительная часть кишечника субъекта была колонизирована новыми микроорганизмами.
Краткое описание фигур
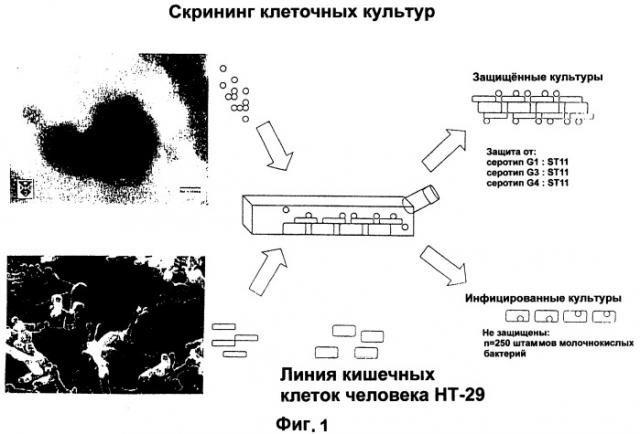
На фигуре 1 показана схема, отображающая скрининг клеточных культур в целью оценки противоротавирусных защитных свойств бактериальных штаммов.
На фигуре 2 показано подкисление культуры L.casei штамма CNMC I-2116 (обозначенного ST11) в различных питательных средах.
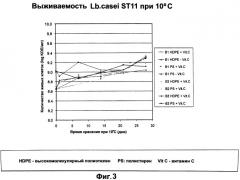
На фигуре 3 показана выживаемость L.casei штамма ST11 при 10°С, измеренная в течение 30 дней.
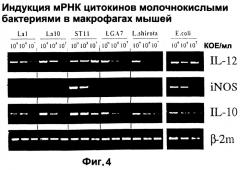
На фигуре 4 показаны параметры мРНК IL-12 и IL-10 в адхерентных мышиных клетках, производных от клеток костного мозга, после инкубации этих клеток с различными разведениями ST11.
На фигуре 5 показан результат дифференцировки Th2, выражающийся в снижении выработки IL-4.
На фигуре 6 показана схема, иллюстрирующая результаты эксперимента по культивированию клеток, в котором культивируемые клетки ST11 используют в тесте на подавление адгезии патогенных бактерий E.coli к эпителиальным клеткам.
На фигуре 7 приведена схема, показывающая результаты эксперимента по культивированию клеток, в котором надосадочную фракцию культуры ST11 используют в тесте на подавление адгезии патогенных бактерий E.coli к эпителиальным клеткам.
На фигуре 8 показана схема, иллюстрирующая результаты эксперимента по культивированию клеток, в котором культивируемые клетки ST11 используют в тесте на подавление инвазии Salmonella typhimurium к эпителиальным клеткам.
На фигуре 9 показана схема, иллюстрирующая результаты эксперимента по культивированию клеток, в котором надосадочную фракцию культуры ST11 используют в тесте на подавление инвазии Salmonella typhimurium в эпителиальные клетки.
Подробное раскрытие изобретения
В ходе интенсивных исследований, приведших к настоящему изобретению, авторы исследовали детские испражнения и выделили из них ряд различных бактериальных штаммов. После этого штаммы были проанализированы по их способности предотвращать заражение эпителиальных клеток ротавирусами и патогенными бактериями, известными как вызывающие диарею.
Некоторые роды бактерий, включая Lactobacillus, Lactococcus, Streptococcus, подвергали скринингу по их ингибирующей способности. По существу тесты проводили с тремя ротавирусными серотипами, представляющими основные этиологические группы возбудителей вирусной диареи человека (серотипы G1, G3 и G4), а также с патогенными E.coli и Salmonella typhimurium, являющимися представителями патогенных микроорганизмов, вызывающих понос у пораженного субъекта.
Различные молочнокислые бактерии выращивали в подходящей культуральной среде, такой как MRS, Hugo-Jago или М17, при температуре от примерно 30 до 40°С, в соответствии с оптимальной для их роста температурой. По достижении фазы стационарного роста культуры бактерий собирали центрифугированием и ресуспендировали в физиологическом растворе NaCl. Между проведением различных тестов бактериальные клетки хранили замороженными (-20°С).
Тесты с ротавирусами
Различные вирусные штаммы были получены путем заражения монослоев слившихся клеток. Перед заражением проводили инкубацию ротавирусов. Клетки инфицировали 20 инфекционными для тканевых культур дозами. Для оценки противоротавирусных свойств использовали два способа. В соответствии с одним из них различные бактериальные штаммы анализировали по их непосредственному взаимодействию с ротавирусами, а в другом способе бактерии подвергали скринингу с целью нахождения таких штаммов, которые взаимодействуют с клеточными ротавирусными рецепторами. Первый способ включает контактирование каждой соответствующей суспензии бактерий с отдельным ротавирусным штаммом и инкубацию в подходящей культуральной среде. После этого смесь бактерий с вирусами наносили на монослой клеток недифференцированной клеточной линии НТ-29 аденомы толстой кишки человека, после чего продолжали инкубацию. После этого оценивали размножение вирусов. Второй способ включает инкубацию соответствующей бактериальной суспензии сначала вместе с клеточным монослоем недифференцированной клеточной линии НТ-29 аденомы толстой кишки человека и затем добавление вируса. После инкубации оценивали размножение вируса. Размножение ротавирусов можно легко оценить с помощью гистоиммунологического окрашивания ротавирусных белков в инфицированных клетках. Эффект по подавлению ротавирусов считается присущим данной бактерии тогда, когда число инфицированных клеток в культуре, зараженной ротавирусом вместе с указанной бактерией, снижается на 90% по сравнению с клетками, инокулированными только ротавирусом.
Из общего числа в 260 различных исходно выделенных бактериальных штаммов только для 9 удалось выявить существенное подавление размножения ротавирусов. Различные
бактерии были идентифицированы как относящиеся к роду Lactobacillus вида rhamnosus или paracasei. Один штамм, обозначенный как Lactobacillus casei ST11, который был депонирован в соответствии с Будапештским Договором с получением депозитарного номера NCC-2461 (I-2116), как было показано, является исключительно эффективным в предотвращении заражения клеток человека ротавирусом. Более того, данный конкретный штамм проявляет отличные ростовые качества, что можно видеть при подкислении различных культуральных сред. Этот штамм также характеризуется хорошей устойчивостью, на что указывает уровень выживаемости в ходе хранения при низких температурах на уровне примерно 10°С, что делает его отличным перспективным компонентом для включения в состав пищевых продуктов или фармацевтических композиций, для которых предусматривается хранение в условиях холодильника.
Тесты на антипатогенные бактерии
Для оценки антибактериальных свойств были выбраны следующие подходы. В соответствии с одним из способов культивируемые штаммы Lactobacillus по настоящему изобретению были исследованы на их способность предотвращать адгезию патогенных бактерий, вызывающих диарею, с клетками кишечника или инвазию в кишечные клетки соответственно. Для этого клетки кишечника контактировали с патогенными бактериями и культивируемыми штаммами Lactobacillus по настоящему изобретению с последующей оценкой уровня адгезии или инвазии соответственно. В соответствии со вторым способом надосадочную фракцию культуры клеток штаммов Lactobacillus по настоящему изобретению добавляли вместе с патогенными микроорганизмами к клеткам кишечника с последующей оценкой уровня адгезии или инвазии соответственно. В процессе эксперимента можно видеть, что подтверждается исключительная эффективность культивируемых молочных бактерий и надосадочной фракции в предотвращении как адгезии, так и инвазии клеток кишечника: это указывает на то, что соединения-метаболиты, секретируемые новыми микроорганизмами, по-видимому, обеспечивают противодиарейную активность, направленную на патогенную бактерии.
В дополнение в сказанному выше неожиданно удалось установить, что штаммы также проявили противоаллергические свойства благодаря тому, что упомянутые штаммы участвуют в регуляции синтеза различных иммунных модуляторов.
В целом известно, что гуморальные иммунные ответы и аллергические реакции опосредуются Т-лимфоцитами CD4+ фенотипа Th2. Клетки Th2 характеризуются выработкой высоких уровней интерлейкина-4 (IL-4) - цитокина, необходимого для секреции IgE, который представляет собой основной класс иммуноглобулинов, связанных с аллергическими реакциями.
Дифференцировка клеток Th2 нарушается γ-интерфероном цитокином, происходящим от проявляющей эффект взаимного исключения популяции СD4-позитивных Т-клеток фенотипа Тh1. Упомянутые клетки Тh1, в свою очередь, интенсивно индуцируются интерлейкином-12 (IL-12). В противоположность этому другой цитокин - IL-10, - как было показано, обладает мощным эффектом супрессии в отношении пролиферации клеток Th1: следовательно, считается, что он участвует в иммуносупрессионных механизмах.
Таким образом, и IL-12 и IL-10 обладают мощным модулирующим действием в отношении дифференцировки Т-клеток CD4+ за счет влияния на развитие популяции Th1. IL-12 является ключевым регуляторным цитокином с точки зрения индукции дифференцировки Th1, что тем самым подавляет выработку ответов Th2. Основным механизмом подавления клеток Th2, следовательно, считается стимуляция синтеза IL-12 вспомогательными клетками.
Хорошо известно, что некоторые компоненты грамотрицательных бактерий, такие как липополисахариды (ЛПС), индуцируют высокие уровни IL-12 в адхерентных (“прилипших”) клетках, таких как макрофаги и дендритные клетки. Следовательно, было установлено, что грамотрицательные бактерии способны обусловливать существенный сдвиг дифференцировки Т-клеток CD4+ в сторону фенотипа Th1.
Микроорганизм ST11, являющийся примером штамма Lactobacillus по настоящему изобретению, был протестирован на его возможное участие в индукции цитокинов, вовлеченных в регуляцию дифференцировки Т-клеток CD4+. В частности, было исследовано влияние ST11 на фенотип Т-клеток CD4+, претерпевающих дифференцировку в направлении Th2.
В связи с этим способность ST11 индуцировать синтез мРНК, кодирующую эти два регуляторных цитокина в адхерентных клетках, происходящих от костного мозга, сравнивали с 4 другими штаммами Lactobacillus и контрольными грамотрицательными бактериями (E.coli K12). мРНК измеряли с помощью полуколичественной RT-PRC через 6 часов инкубации клеток с различными разведениями бактерий в диапазоне от 109 до 107 КОЕ/мл.
Хотя все штаммы Lactobacillus могут в некоторой степени индуцировать транскрипцию мРНК IL-12, штамм ST11, как было показано, оказывается наиболее мощным индуктором, потому что наиболее мощный сигнал в ПЦР может быть выявлен даже при наименьшей дозе бактерий. Действительно, способность ST11 индуцировать транскрипцию мРНК IL-12 была такой же сильной, что и у E.coli. Индукция мРНК IL-10 была в целом слабее по сравнению с мРНК IL-12, поскольку только при наибольших дозах бактерий может быть выявлен сигнал. Однако ST11 был наиболее сильным индуктором мРНК IL-10 по сравнению с другими молочными бактериями и контрольной E.coli.
Таким образом, считается, что ST11 будет индуктором иммунорегуляторных цитокинов, участвующих в дифференцировке Т-клеток CD4+. Его способность к интенсивной индукции IL-12 делает его вероятным средством подавления ответов Th2, a существенная индукция им IL-10 может предотвращать воспалительные ответы.
В дополнение к указанным выше данным также анализировали, проявляет ли ST11 эффект по подавлению Т-клеток CD4+, претерпевающих дифференцировку в Th2, и положительное действие на функции Th1. Использовали хорошо отработанную систему культивируемых клеток, способных дифференцироваться, в которой Т-клетки-предшественики CD4+ активировали по поликлональному типу и направляли на дифференцировку в фенотип либо Th1, либо Th2, что зависело от типа костимулятора, включаемого в культуральную среду. Дифференцировку Тh1/Th2 индуцировали в течение 7-дневной первичной культуры, после чего клетки повторно стимулировали в течение 2 дней во вторичной культуре, содержащей чистую питательную среду, а приобретение конкретного фенотипа (Th1 или Th2) оценивали путем определения типов цитокинов, секретируемых в надосадочную фракцию (γ-интерферон или IL-4).
Известно, что Т-клетки-предшественники CD4+ мышей генетического типа BALB/c предпочтительно дифференцируются в преобладающий фенотип Th2 (высокий уровень IL-4, низкий уровень γ-интерферона в надосадочных фракциях вторичной культуры) после активации в нейтральных условиях (только питательная среда в первичной культуре). Такой фенотип может быть полностью ревертирован в фенотип Th1 (высокий уровень γ-интерферона, низкий уровень IL-4) путем добавления в первичную культуру блокирующего моноклонального антитела, специфичного по отношению к IL-4.
Для изучения возможной роли ST11 в подавлении Th2 очищенные Т-клетки-предшественники CD4+ мышей BALB/c активировали в процессе первичного культивирования в присутствии адхерентных клеток костного мозга, выполняющих функции вспомогательных клеток. Эти клетки культивировали совместно либо только в питательной среде либо в присутствии 1 мг/мл ЛПС, или 108 КОЕ/мл ST11, или 108 КОЕ/мл другого Lactobacillus. После этого клетки промывали, и Т-клетки CD4+ снова очищали и повторно стимулировали во вторичной культуре в “пустой” питательной среде. Цитокины, вырабатываемые дифференцированными Т-клетками CD4+, анализировали через 2 дня. Как и ожидалось, клетки, дифференцировавшиеся в присутствии только питательной среды, проявляли преобладающий фенотип Th2. Добавление ST11 в первичную культуру жестко изменяло результат Тh2-дифференцировки, следствием чего являлось 8-кратное усиление выработки IL-4. Такое подавление было по уровню сходным с подавлением, наблюдаемом в культурах, происходящих от клеток, которые дифференцировались в присутствии ЛПС. Напротив, другие штаммы Lactobacillus не влияли в сколько-нибудь существенной степени на уровни IL-4. Интересно, что уровни γ-интерферона в результате добавления ST11 в первичные культуры не возрастали.
Таким образом, ST11 специфически нарушает выработку IL-4 Т-клетками CD4+, претерпевающими дифференцировку в Th2, но в существенной степени не увеличивает секрецию γ-интерферона. Тот факт, что ST11 не увеличивает выработку γ-интерферона, может объясняться его способностью индуцировать IL-10, следствием чего может являться поддержание низкой воспалительной активности, несмотря на его активность против Th2.
Следовательно, удалось показать, что ST11 является штаммом Lactobacillus, для которого характерно свойство эффективного противодействия Th2, что делает его прекрасным вероятным средством для использования в качестве бактерии, обладающей свойствами противоаллергического пробиотического средства.
Далее настоящее изобретение будет описано с помощью примеров, которые не должны восприниматься как ограничивающие, но как иллюстрирующие осуществимость изобретения
Культуральные среды и растворы
MRS (Difco)
Hugo-Jago (триптон Difco - 30 г/л, дрожжевой экстракт Difco - 10 г/л, лактоза Difco - 5 г/л, КН2РO4 - 5 г/л, мясной экстракт Difco - 2 г/л, агар Difco - 2 г/л)
М17 (Difco),
М199 (Seromed),
физиологический раствор (Oxoid),
ФСБ (NaCl - 8 г/л, КСl - 0,2 г/л, Na2HPO4 - 1,15 г/л, КН2РO4 - 0,2 г/л),
триптозо-фосфатный бульон (Flow),
раствор трипсина-ЭДТА (Seromed).
Ротавирус человека Wa (серотип G1) и обезьяний ротавирус SA-11 (серотип G3) были получены от Р.A.Of fit. Children’s Hospital of Philadelphia, США. Рекомбинантный вирус DS-1×RRV был получен от A.Kapikian, NIH Bethesda, США. Серотип-4 ротавируса человека Hochi был получен от P.Bachmann, University of Munich, Германия. E.coli DAEC-C-1845 получили из Washington University, Seattle, a E.coli JPN15 получили из Center for Vaccine Development, University of Maryland, США. Salmonella typhimurium штамма SL1334 была получена из Department of Microbiology, Stanford University, CA, США.
Пример 1
Выделение молочнокислых бактерий из детских испражнений
Свежие фекалии были взяты из пеленок 16 здоровых детей в возрасте 15-27 дней. По 1 г свежих фекалий помещали в бескислородные условия для доставки в лабораторию, и микробиологический анализ проводили в течение 2 часов на материале серий разведений образца в физиологическом растворе путем высева на селективную среду. Агар MRS с антибиотиками (фосфомицин 80 мкг/мл, сульфаметоксазол 93 мкг/мл, триметоприм 5 мкг/мл), проинкубированный при 37°С в течение 48 часов, использовали для выделения молочнокислых бактерий. Колонии случайным образом вырезали и очищали. На материале изолятов определяли физиологические и генетические характеристики.
Пример 2
Тестирование штаммов в клеточной культуре на противоротавирусную активность
Некоторые роды бактерий, включая Lactobacillus, Lactococcus, Streptococcus, были отобраны и протестированы на их представителей, которые проявляют противоротавирусную активность в тесте на ингибирование в клеточной культуре. Род Lactococcus был представлен единственным видом (L.lactis), включающим два подвида (L.lactis supsp. lactis и L.l.cremoris). Всего было протестировано 30 штаммов. Род Streptococcus был представлен единственным видом (S.thermophilus) с 45 штаммами. Роды Leuconostoc и Propionibacterium были представлены единственными видами (6 штаммов), в то время как роды Enterococcus и Staphylococcus были представлены двумя видами каждый, включая всего 17 штаммов.
Всего на активность по подавлению ротавирусов были протестированы 260 бактериальных штаммов.
1-й способ:
30 мкл бактериальной суспензии (содержащей в среднем 3×106 бактерий) смешивали с 70 мкл среды M199, дополненной 10% триптозо-фосфатного бульона (Flow) и 5% раствора трипсина-ЭДТА (Seromed) (в соотношении 1:4 в случае клеток НТ-29), и 100 мкл вируса в дополненной среде М199. Смесь бактерий с вирусом инкубировали в течение 1 часа при 4°С и в течение 1 часа при 37°С. Недифференцированные клетки аденомы толстой кишки человека НТ-29, растущие до стадии слившегося монослоя на 96-луночных микротитровальных планшетах, трижды промывали фосфатно-солевым буфером (ФСБ: рН 7,2). Смесь бактерий с вирусом добавляли к клеткам, и микротитровальные планшеты инкубировали в течение 18 часов в углекислотном инкубаторе (Heraeus). Размножение вируса оценивали в соответствии с описанным далее.
2-й способ:
30 мкл бактериальной суспензии (см. выше) смешивали с 70 мкл среды М199, дополненной 10% триптозо-фосфатного бульона (Flow) и 5% раствора трипсина-ЭДТА (Seromed) (в соотношении 1:4 в случае клеток НТ-29), и вносили непосредственно в клетки на микротитровальных планшетах. После 1-часовой инкубации при 37°С к клеткам на микротитровальных планшетах добавляли 100 мкл вируса в дополненной среде M199. Инкубацию продолжали в течение 18 часов в углекислотном инкубаторе (Heraeus). Размножение вируса оценивали в соответствии с описанным далее.
Размножение ротавирусов оценивали с помощью гисто-иммунологического окрашивания ротавирусных белков в инфицированных клетках в соответствии с описанным здесь далее.
Через день после инфицирования культуральную среду удаляли из микротитровальных планшетов, и клетки фиксировали абсолютным этиловым спиртом в течение 10 минут. Этанол удаляли, и планшеты трижды промывали в буфере ФСБ. После этого
50 мкл антиротавирусной сыворотки (в основном специфична в отношении белка VP6), сформированной кроликами (полученных от ISREC, University of Lausanne) и разведенной 1:2000 в ФСБ, добавляли в каждую лунку и инкубировали в течение 1 часа при 37°С, накрыв покровным стеклом для предотвращения обсыхания лунок. После этого антисыворотку удаляли, и планшеты трижды промывали в ФСБ. Затем 50 мкл козьей антикроличьей иммуноглобулиновой-G (IgG) антисыворотки, соединенной с пероксидазой (GAR-IgG-PO; Nordic), добавляли в разведении 1:500 в ФСБ в каждую лунку, и планшеты инкубировали в течение 1 часа при 37°С. Сыворотку удаляли, и планшеты опять три раза промывали в ФСБ. Затем в каждую лунку добавляли по 100 мкл следующей субстратной смеси: 10 мл 0,05 М Трис-гидрохлорида (рН 7,8), 1 мл Н2O2 (30% Suprapur, разведение 1:600 в воде: Merck) и 200 мкл 3-амино-9-этилкарбазола (0,1 г на 10 мл этанола, хранение в 200-мкл аликвотах при -80°С; А-5754, Sigma). Планшеты инкубировали в течение по крайней мере 30 минут при комнатной температуре. Субстрат удаляли, и лунки заполняли 200 мкл Н2О для остановки реакции. Очаги инфицированных клеток подсчитывали с помощью инверсионного микроскопа (Diavert, Leitz).
Только очень небольшое число бактериальных штаммов взаимодействовало с ротавирусами. Всего 9 из 260 исходно отобранных бактериальных клеток подавляли размножение ротавирусов по крайней мере в одном из способов. Lactobacillus paracasei NCC-2461 (ST11) показала исключительно высокий уровень активности против ротавируса серотипа 1, ротавируса SA-11 серотипа 3 и ротавируса Hochi серотипа 4.
Пример 3
Культивирование клеток Сасо-2
Для тестов на подавление (патогенных) бактерий клеточную линию Сасо-2 использовали в качестве модели кишечника. Для этой клеточной линии характерны такие свойства кишечных клеток, как, например, поляризация, экспрессия кишечных ферментов, выработка специфичных структурных полипептидов и т.п.
Клетки культивировали на трех разных носителях, а именно на корнинговских пластмассовых чашках (25 см2: Corning) для роста и размножения, на обезжиренных и стерилизованных 6-луночных стеклянных планшетах (22 × 22 мм; Corning) для тестов на адгезию и на 24-луночных стеклянных планшетах (Corning) для тестов на ингибирование.
Со второго дня культивирования питательную среду (DMEM) заменяли ежедневно. Перед использованием культуральную среду дополняли 100 ед./мл пенициллина/стрептомицина, 1 мкг/мл амфотерина и 20% ПТС, инактивированной нагреванием до 56°С в течение 30 минут. Культивирование проводили при 37°С в атмосфере, содержащей 90% воздуха и 10% СO2. Клетки расщепляли каждые шесть дней. Клетки отделяли от стенок лунок с помощью обработки ФСБ с 0,25% трипсина и 3 мМ ЭДТА при рН 7,2. Для нейтрализации действия трипсина равный объем ПТС добавляли к полученной клеточной суспензии, смесь центрифугировали (10 минут при 1000 об/мин), и полученный осадок опять ставили в культуру. Примерно 3,5×105 клеток переносили в новый сосуд для культивирования и культивировали до стадии слияния монослоя.
Пример 4
Культивируемые бактерии ST11:
Бактериальный штамм хранили при -20°С в культуральной среде MRS, содержащей 15% глицерина. Этот штамм культивировали при бескислородных условиях в MRS и дважды переносили в новую среду с интервалами в 24 часа перед использованием в тестах на подавление. Для анализа использовали концентрацию 2×109 КОЕ/мл.
Надосадочную фракцию собирали центрифугированием в течение 1 часа при 20000 об/мин, и полученную надосадочную фракцию после этого проверяли на присутствие бактерий.
E.coli:
Использовали два штамма E.coli - E.coli DAEC-C-1845 (диффузная адгезионная E.coli) и E.coli JPN15 (ЕРЕС; энтеропатогенная кишечная палочка E.coli).
Первый пересев после оттаивания проводили на агар CFA -Muller Hinton, который пригоден для обеспечения экспрессии бактерией адгезионных факторов.
Перед каждым экспериментом бактериальные клетки инкубировали при 37°С с переносом в новую среду, осуществляемым дважды по прошествии каждых 24 часов. Поскольку штамм JPN15 несет ген резистентности к ампициллину, то упомянутый антибиотик использовали для отбора в процессе роста.
Salmonella:
В экспериментах использовали Salmonella typhimurium штамма SL1334, которую до использования культивировали в среде LB.
Пример 5
Тест на подавление E.coli
После второго пересева в новую питательную среду штаммы патогенных бактерий помечали радиоактивным изотопом с использованием 14С-ацетата при дозе 10 мКи/мл в среде LB. Инкубацию штаммов в этой культуральной среде проводили в течение 18 часов при 37°С.
После этого бактериальную суспензию подвергали центрифугированию (1041 g, 15 минут) таким образом, чтобы удалить надосадочную фракцию с остатками 14С-ацетата. Сгусток суспендировали и промывали в ФСБ, и клетки суспендировали при концентрации примерно 108 клеток на 1 мл в 1%-ной стерильной маннозе. Известно, что манноза подавляет неспецифическую адгезию.
Различные патогенные бактериальные штаммы (E.coli) приводили в контакт с монослоем клеток Сасо-2 (37°С, 10% СO2, 90% воздуха) в течение 3 часов. Такой же эксперимент проводили с использованием надосадочной фракции (полученной путем центрифугирования при 20000 об/мин в течение 40 минут).
В качестве контроля патогенных бактерий контактировали с монослоем Сасо-2 без одновременного добавления ST11 или культуральной надосадочной фракции соответственно.
После инкубации в течение 3 часов культуральную среду заменяли, и монослой трижды промывали в ФСБ. Каждый этап промывки включает 20х перемешивание в растворе ФСБ таким образом, чтобы удалить по существу всю неспецифическую адгезию. После этого клетки лизировали добавлением 1 мл карбоната натрия и 40-минутной инкубацией при 37°С. После гомогенизации аликвоту (250 мкл) разводили в 5 мл сцинтилляционной жидкости (Hionic-fluor Packcard) и проводили подсчет (Packard-2000). Процент адгезии патогенных клеток с клетками Сасо-2 подсчитывали как отношение к контролю, умноженное на 100% (уровень адгезии; или инвазии в примере 6).
Пример 6
Тест на подавление сальмонелл
Сальмонеллы - это бактерии, которые инвазируют эпителиальные клетки и размножаются в них. Для определения ингибиторной активности ST11 клетки Salmonella typhimurium штамма SL1334 инкубировали в соответствии с описанным выше в среде, содержащей 14С-ацетат, и включали в эксперимент, описанный в примере 5.
После инкубации клетки Сасо-2 промывали в ФСБ так, чтобы удалить все несоединившиеся клетки. После этого добавляли культуральную среду, содержащую гентамицин (20 мкг/мл), и инкубацию продолжали в течение 1 часа при 37°С. Гентамицин является антибиотиком, не проникающим в кишечные клетки, в результате чего все внеклеточные микроорганизмы уничтожаются, в то время как сальмонеллы, уже проникшие в клетки кишечника, остаются живыми. После двукратной промывки клеток в ФСБ их лизировали добавлением стерильной дистиллированной воды, и уровень радиоактивности измеряли в соответствии с описанным в примере 4.
Результаты экспериментов 5 и 6 показаны на фигурах 6-9. Можно видеть, что культивируемые клетки ST11 и культуральная надосадочная фракция были исключительно эффективными в предотвращении адгезии и инвазии кишечных клеток патогенными микроорганизмами, вызывающими диарею.
Пример 7
Свойства ST11
ST11 инкубировали в модели желудочного сока. Модельный желудочный сок приготавливали путем суспендирования пепсина (3 г/л) в стерильном физиологическом растворе (0,5%; маc/об) с доведением рН до 2,0 и рН 3 соответственно с помощью
концентрированной НСl. ST11 культивировали при различных количествах указанной выше среды с определением резистентности микроорганизмов.
Полученные результаты суммированы ниже в таблице 1.
| Таблица 1 | |||||
| рH | КОЕ/мл при Т=0 | КОЕ/мл при Т=1 мин | КОЕ/мл при Т=15 | КОЕ/мл при Т=30 | КОЕ/мл при Т=60 |
| 2,0 | 2,0×109 | 1,8×109 | 1,2×109 | 3,7×108 | 7,0×103 |
| 3,0 | 2,0×109 | 1,9×109 | 1,7×109 | 1,7×108 | 8,4×108 |
ST11 обладает следующими свойствами в соответствии с определениями с помощью способов, описанных в "Genera of lactic acid bacteria", eds. B.J.B.Wood & W.H.Holzapfel, Blackie A&P.:
- грамположительные;
- негативные по каталазе;
- негативные по NН3-образованию аргинина;
- негативные по выработке СО2;
- выработка L(+)-молочной кислоты;
- рост в присутствии солей желчных кислот в концентрации вплоть до примерно 0,4%.
Пример 8. Рост ST11 при различных условиях
ST11 инкубировали при 37°С в среде на основе помидора (4% помидорного порошка, регидратированного дистиллированной водой), дополненной сахарозой (0, 0,5, 1 или 2%) или соевым пептоном (0,5%), или глюкозой (0,5%) в течение различных периодов времени. Полученные результаты показаны на фиг.2.
ST11 дополнительно добавляли в количестве 2,5% к культуральной среде, составленной рисовой мукой (3%), пшеничной мукой (2%) и сахарозой (3%), и инкубировали при 37°С до достижения рН 4,4. После охлаждения полученный продукт расфасовывали с добавлением витамина С или без него и хранили при 10°С.
Пример 9
Индукция синтеза мРНК IL-12 и IL-10 в адхерентных клетках мыши ST11
Костномозговые клетки были выделены из бедренной и большеберцовой костей 8-недельных, свободных от конкретного патогена мышей линии C57BL/6, и проинкубированы при концентрации 2×106 клет