Предшественники витамина d, способ их получения и промежуточные продукты
Иллюстрации
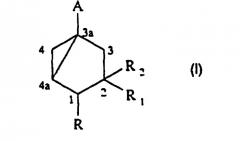
Показать всеИзобретение относится к предшественникам А-кольца витамина D формулы (I)
в которой: А представляет группу –CH2OH, -CH2-OCOR’, -COR’’ или этинил; R представляет водород или (С1-С6)алкил; R1 представляет водород, (С1-С6)алкил или группу (СН2)nОР; R2 представляет водород или группу -ОР; R’ представляет фенил; R’’ представляет водород, гидроксил, (С1-С6)алкокси; Р представляет водород или группу -Si(R3)3, в которой каждый R3, независимо, представляет (С1-С6)алкил или фенил; n равно 0 или 1, при условии, что, когда конфигурацией соединения (I) является 2S, 3aS, 4aS, А представляет формил, гидроксиметил, этинил или метоксикарбонил и R и R2, оба, представляют водород, тогда R1 не является группой -OSi(R3)3. Изобретение относится также к способу получения соединений формулы (I), включающему следующие стадии: (i) взаимодействие соединения формулы 1
в которой А представляет (C1-C6) алкоксикарбонил или ди (С1-С3)алкиламинокарбонил, с липазой в винилалканоате или ангидриде кислоты и (ii) превращение образовавшегося соединения формулы 2 или 2'
в которой Z представляет алкил, предпочтительно (C1-С3)алкил, в соответствующее соединение формулы (I) посредством образования уходящей группы и циклизации путем обработки основанием с образованием требуемого бицикло[3.1.0]гексана, причем превращение далее включает одну или несколько следующих стадий: защита гидроксигрупп, омыление сложного эфира, инверсия 3- или 5-гидроксигруппы, превращение карбоалкокси или карбамоильной функциональной группы в требуемый заместитель А. Указанные предшественники получают в больших масштабах способом, являющимся более эффективным, чем ранее описанные способы. 2 с. и 6 з.п. ф-лы.
Реферат
Данное изобретение относится к предшественникам, которые можно эффективно использовать для синтеза аналогов 19-нор-витамина D, а также к способу и промежуточным продуктам для их получения. Более конкретно, изобретение относится к предшественникам А-кольца указанных аналогов витамина D, где А-кольцо представлено указанной ниже структурой
(см., например, Mazur et al.. Tetrahedron Letters 1995, 2987).
Синтез производных бицикло[3.1.0]гексана, как предшественников 19-нор-А-кольца, был разработан из (-)-хинной кислоты или циклогексантриола М. Vandewalle et al. (Tetrahedron Letters, 1995, 36 (45), 8299-8302) и основан на хорошо известной сигматропной перегруппировке циклопропилового спирта в гомоаллиловый спирт. Возможность данной перегруппировки в природный витамин D была впервые продемонстрирована Masur et al. (цитированная статья). Описан также альтернативный синтез из 2,4-пентандиона (S.Z. Zhou, S. Anne, M. Vanderwalle, Tetrahedron Letters, 1996, 37 (42), 7637-7640). 3-Циклопентенол можно также использовать в качестве исходного продукта для указанного получения (W. Yong, M. Vanderwalle; Synlett, 1996, 9, 911-912).
Указанные способы, однако, имеют следующие недостатки:
- Получение из (-)-хинной кислоты включает радикальное дезоксигенирование, которое трудно регулировать при проведении дезоксигенирования в больших количествах, и использование токсичного трибутилоловогидрида.
- Способ из циклогексантриола является многостадийным (12) и требует проведения двух ферментативных реакций.
- Исходный материал, 3-циклопентенол, не является коммерчески доступным. Его получают из циклопентадиена посредством стадии гидроборирования с низким выходом (30%). Кроме того, циклопропанирование и введение формильной группы являются затруднительными.
- Синтез, использующий в качестве исходного продукта 2,4-пентандион (10 стадий) отличается низкими выходами на первой стадии для получения промежуточного бисэпоксида. Кроме того, вследствие их низкой молекулярной массы некоторые промежуточные продукты являются весьма летучими и трудно подвергаются очистке при проведении способа в больших масштабах.
Теперь обнаружено, что широкий диапазон предшественников 19-нор-А-кольца можно получить, исходя из производных 3,5-дигидроксибензойной кислоты или их 4-алкилзамещенных гомологов. Указанные предшественники можно получить в больших масштабах способом, который является более эффективным, чем ранее описанные способы.
Таким образом, изобретение относится к способу получения соединения формулы (I):
в которой:
- А представляет группу –CH2OH, -CH2-OCOR’, -COR’’, -CSR’’ или этинил;
- R представляет водород или (C1-С6) алкил;
- R1 представляет водород, (C1-C6) алкил или группу -(СН2)n-ОР;
- R2 представляет водород или группу -ОР;
- R’ представляет (C1-C6) алкил или фенил;
- R” представляет водород, гидроксил, (C1-C6) алкил, (С1-С6)алкокси, (С1-С6)алкилтио или ди (C1-С3) алкиламино;
- Р представляет водород; (С1-С6)алканоил; бензоил, в котором фенил, необязательно, замещен (C1-C4)алкилом, галогеном или нитро; (C1-C6)алкоксикарбонил; группу -Si(R3)3, в которой каждый R3, независимо, представляет (C1-C6)алкил или фенил; моно- или ди (C1-C6) алкокси (C1-C6) алкил; тетрагидрофуранил или тетрагидропиранил;
- n равно 0, 1, 2, 3 или 4, предпочтительно 0 или 1, включающему следующие стадии:
(i) взаимодействие соединения формулы 1
в которой А представляет (C1-C6) алкоксикарбонил, предпочтительно метоксикарбонил или ди(С1-С3)-алкиламинокарбонил, и R имеет указанные выше значения, с липазой в винилалканоате или ангидриде кислоты и
(ii) превращение образовавшегося соединения формулы 2 или 2’
в которой Z представляет алкил, такой как (C1-C6)алкил, предпочтительно (C1-С3)алкил, в соответствующее соединение формулы (I).
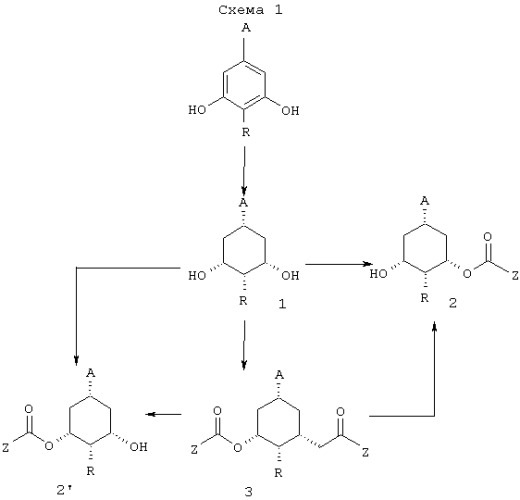
Как показано в общей схеме 1, исходный материал для получения предшественников А-кольца получают гидрированием метил-3,5-дигидроксибензойной кислоты или ее эфира, или их 4-алкилзамещенных гомологов согласно модифицированной методике, описанной Р. Wang and J. Adams in J. Am. Chem. Soc. 1994, 116, 3296-3305.
Первая стадия включает катализируемую ферментом асимметризацию 1-алкокси или (диалкиламино)карбонил-3,5-дигидроксициклогексана, или его 4-алкилзамещенных гомологов в растворителе, таком как винилалканоат, например винилацетат, винилпропионат или винилбутират, или ангидрид кислоты, например уксусный ангидрид, пропионовый ангидрид или масляный ангидрид, и с использованием липазы, такой как SAM II (липаза из Pseudomonas fluorescens), CCL (липаза из Candida cylindrcea), PPL (липаза из свиной поджелудочной железы), PSL (липаза из Pseudomonas cepacia), GCL (липаза из Cotrichum candidum), при температуре между 10°С и 40°С, предпочтительно 20°С, в течение от 6 до 72 часов, что дает соответствующий алкил- (или диалкил)-(1S,3S,5R)-3-алкилкарбонилокси-5-гидрокси- или (1S,3S,4R,5R)-4-алкил-3-алкилкарбонилокси-5-гидроксициклогексанкарбоксилат (или карбоксамид) 2 или соответствующий алкил- (или диалкил)-(1S,3S,5R)-5-алкилкарбонилокси-3-гидрокси- или (1S,3S,4R,5R)-4-алкил-5-алкилкарбонилокси-3-гидроксициклогексанкарбоксилат (или карбоксамид) 2’.
Кроме того, асимметризацию через энантиотопоселективный, катализируемый ферментом гидролиз сложных диэфиров 3 подходящим ферментом можно проводить для получения того же семейства соединений.
В схемах 2 и 3 описывается синтез всех диастереомеров общей формулы (I) с R1=Н и R2=ОР, из соединений 2 и 2’, описанных в схеме 1.
Как показано на указанных схемах, превращение соединения 2 или 2’ в соединение (I) проводят посредством одной или нескольких следующих стадий, порядок которых можно частично или полностью менять в зависимости от конечного диастереоизомера: (1) защита гидроксигрупп (Р=,например, TBDMS, TBDPS), (2) омыление сложного эфира, (3) инверсия 3- или 5-гидроксигруппы, (4) образование уходящей группы (L=,например, OTos, OBros, OMs), 5) включающая обработку основанием циклизация в требуемый бицикло[3.1.0]гексан, (6) превращение функциональной группы карбоалкокси или карбамоил (А) в требуемый заместитель А.
Стадии (2) и (4) представляют собой общепринятые реакции, хорошо известные специалистам в данной области. Стадию (1) можно проводить в соответствии с J. Am. Chem. Soc. 1972, 94, 6190 или Protective groups in Organic Synthesis, T.W. Greene, John Wiley Sons, New York. Стадию (3) можно проводить в соответствии с Synthesis, 1981, 1, или двухстадийным способом (элиминирование, гидроборирование). Стадию (5) можно проводить в соответствии с Tetrahedron Letters, 1995, 36 (45), 8299-8302. Стадию (6) можно проводить в соответствии с J. Gen. Chem. USSR 1964, 34, 1021.
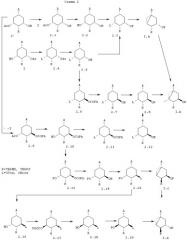
В схеме 2, в частности, раскрыт синтез всех диастереомеров с конфигурацией 3aS (α-ориентированное циклопропильное кольцо).
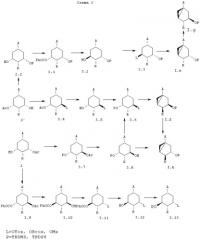
В схеме 3, в частности, раскрыт синтез всех диастереомеров с конфигурацией 3aR (β-ориентированное циклопропильное кольцо).
Как показано на общей схеме 4, 3а-гидроксиметилзамещенные соединения бицикло[3.1.0]гексана (I) с R=Н и А=СН2OН можно также использовать для синтеза предшественников А-кольца аналогов витамина D, модифицированных у С-1. Данная возможность получения иллюстрируется, исходя из I.a (R=H, P=TBDPS, А=СН2ОН) через кетон 4.2 в качестве ключевого промежуточного продукта. Реакция Гриньяра (например, R1=Me или Et) приводит диастереоселективно к третичным спиртам I.i с последующим удалением защитной эфирной функциональной группы. С другой стороны, метиленирование 4.2 дает 4.3. Самый лучший результат (выход 68%) был получен с процедурой Ломбарде (Lombardo) (Tetrahedron Lett. 1982, 23, 4293). В альтернативном случае реакция Виттига или Теббе (J. Org. Chem., 1985, 50, 1212) дает соответствующие выходы 39% и 54%.
Дигидроксилирование 4.3 дает ожидаемый диол I.m. в качестве основного продукта наряду с эпимером 4.4 (отношение 85:15, не показано). С другой стороны, гидроборирование 4.3 дает 2R- и 2S-гидроксиметилсоединения в отношении 75:25 (73%). Указанные эпимерные спирты разделяли с получением I.j и I.k после образования простого эфира TBDPS (81%) и последующего гидролиза сложного эфира (81%). Опосредованное ацетатом ртути присоединение воды к 4.3 дает третичный спирт I.1 наряду с I.i в отношении 75:25.
Указанный новый способ получения предшественников 19-нор-А-кольца, исходя из производных 3,5-дигидроксибензойной кислоты, является более коротким, чем ранее описанный способ. Практической важностью вышеуказанного пути является в основном тот факт, что большинство промежуточных продуктов являются кристаллическими и их можно очистить кристаллизацией, которая является более легкой операцией при проведения ее в больших масштабах, чем традиционная очистка хроматографией на силикагеле, и гарантирует высокую степень энантиомерной чистоты.
Все соединения (I), полученные таким образом, являются новыми, за исключением соединений с конфигурацией 2S, 3аS, 4aS, где А представляет формил, гидроксиметил, этинил или метоксикарбонил, R и R2, оба, представляют водород и R1 представляет группу -OSi(R3)3.
Изобретение относится к указанным новым соединениям.
Предпочтительные соединения (I) включают соединения, у которых
- А представляет группу –СН2ОН, -СНОСОR’, -COR’’ или этинил;
- R1 представляет (С1-С6)алкил или группу -(СН2)n-ОР;
- R’ представляет фенил;
- R’’ представляет водород;
- Р представляет водород или группу -Si(R3)3;
- n равно 0 или 1.
Соединения (I) можно использовать для синтеза витамина D (19-нор, 1α, 25-(ОН)2-D3) в соответствии с примером следующей схемы, как описано в Tetrahedron Letters, 1996; 37(42): 7634-7640:
Изобретение далее относится к промежуточным продуктам для получения соединения (I). В частности, изобретение относится к диастереоизомерному соединению формулы (II):
в которой:
- А и R имеют указанные выше значения,
- R4 и R5, каждый независимо, представляют группу Р, как указано выше, или мезильную, тозильную, брозильную или трифтормезильную группу,
при условии, что, когда А представляет метоксикарбонил и R представляет водород, соединение (II) не имеет конфигурацию 1R, 3R, 5R.
В объем изобретения включены также соединения формулы 2 или 2'
в которой
- А и R имеют указанные выше значения;
- Z представляет алкил,
а также соединения формулы 1
в которой А имеет указанные выше значения и R представляет (C1-С6) алкил.
Предполагается, что в настоящем описании и прилагаемой формуле изобретения термин “(C1-С3) алкил”, “(C1-C4) алкил” или “(C1-C6)алкил” означают неразветвленную или разветвленную углеводородную цепь, имеющую от 1 до 3 (соответственно, 4 или 6) атомов углерода, такую как, например, метильный, этильный, пропильный, изопропильный, бутильный, изобутильный, трет-бутильный, пентильный, изопентильный или гексильный радикал.
Предполагается, что термин “(C1-C6) алкокси” или “(C1-C6) алкилтио” означает группу OR или, соответственно, SR, в которой R представляет (C1-C6)алкил, как указано выше.
Изобретение теперь будет иллюстрировано следующими получениями и примерами.
ПОЛУЧЕНИЕ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ ФОРМУЛЫ 1
а) цис,цис-3,5-Дигидрокси-1-(метоксикарбонил)-циклогексан: 1.А (R=Н, А=СООСН3).
Метил 3,5-дигидроксибензоат гидрируют в МеОН в условиях, аналогичных описанным Peng Wang and Julian Adams в J. Am. Chem. Soc. 1994, 116, 3296-5505 для гидрирования 3,5-дигидроксибензойной кислоты.
Метил 3,5-дигидроксибензоат (57,6 г, 0,629 моль, 97%), 5% Rh/Al2О3 (5,76 г) в МеОН (400 мл), содержащем 0,1% АсОН, добавляют в автоклав (1 л). В автоклав два раза вводят струю водорода (от 130 атм до 40 атм). Давление водорода достигает 130 атм, и температуру повышают до 80-85°С. В процессе повышения температуры давление водорода снижается. Когда давление снижается до 90 атм, давление водорода снова устанавливают 130 атм. Гидрирование проводят в течение 12 час при 80-85°С и 130 атм, затем температуру повышают до 150°С и соответственно давление достигает приблизительно 155 атм. Реакцию продолжают в течение 36 час. Катализатор отфильтровывают. Фильтрат концентрируют и остаток кристаллизуют из смеси EtOAc/изооктан, получая при этом 1.А (31,1 г, выход 50%). Т. пл.: 135,9°С.
УФ (EtOH): 211,4 нм (ε=90,9);
ИК (КВr): 3284, 1734, 1259, 1015 см-1
1H-ЯМР (DMSO-d6): δ 1,13 (3Н, м); 2,06 (3Н, м); 2,30 (1Н, м); 3,47 (2Н, м); 3,61 (3Н, с); 4,70 (2Н, д) м.д.
Аналогичным образом, как описано выше, но с заменой 3,5-дигидроксибензоата метил-3,5-дигидрокси-4-метилбензоатом или метил-3,5-дигидрокси-4-этилбензоатом получают следующие соединения:
- Метил все-цис-3,5-дигидрокси-4-метилциклогексанкарбоксилат: 1.B (R=Me, А=СООСН3), т. пл.: 123°С;
1H-ЯМР (500 МГц, CD3OD): δ 3,698 (2Н, дт, J=4,0, 12,0 Гц); 3,666 (3Н, с); 2,40 (2Н, тт, J=4,0, 13,0 Гц); 2,23 (1H, м); (2Н, дт, J=4,0, 13,0 Гц); 1,54 (2Н, кв, J=13,0 Гц); 0,88 (3Н, д, J=7,08 Гц) м.д.
- Метил все-цис-4-этил-3,5-дигидроксициклогексанкарбоксилат: 1.C (R=Et, A=СООСН3), т. пл.: 94-96°С;
1H-ЯМР (500 МГц, MeOD): δ 3,72 (2Н, дт, J=10,9, 4,1 Гц), 3,66 (3Н, с), 2,42 (1H, м), 1,86 (1H, уш.с), 1,79 (2Н, дт, J=12,8, 4,1 Гц), 1,59 (2Н, д, J=9,0 Гц), 1,46 (2Н, м), 1,02 (3Н, т, J=7,5 Гц) м.д.
ПОЛУЧЕНИЕ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ ФОРМУЛ 2 И 2’ (схема 1)
I) Ферментативная этерификация диолов общей формулы (I)
1а) Метил (1S,3S,5R)-3-ацетокси-5-гидроксициклогексанкарбоксилат: 2.А (R=Н, Z=Me, А=СООСН3)
Метил-цис,цис-3,5-дигидроксициклогексанкарбоксилат 1.А (R=Н, А=СООСН3) (15,2 г, 87 ммоль) и липазу из свиной поджелудочной железы (PPL - 16,8 Е/мг, 9,12 г) помещают в круглодонную колбу с последующим добавлением винилацетата (450 мл) при комнатной температуре. Колбу продувают азотом. Суспензию перемешивают в темноте в течение 22 час, затем фильтруют через подушку целита для удаления липазы. Фильтрат концентрируют упариванием. Остаток разделяют фильтрованием через подушку силикагеля (70-200 меш, 45 г). Элюирование толуолом (210 мл) с последующим элюированием смесью 75/25 (об./об, 210 мл), затем 50/50 (об./об., 210 мл) толуол/этилацетат и, наконец, этилацетатом (240 мл) дает после концентрирования 2.A (R=Н, Z=Me, A=СООСН3) (22,3 г, количественный выход) в виде желтого масла.
ИК (пленка): 3447, 1734, 1243 см-1;
1H-ЯМР (СDСl3): δ 1,4 (3Н, м), 2,1 (3Н, с), 2,3 (5Н, м), 3,7 (3Н, с), 3,75 (1Н, м), 4,7 (1Н, м) м.д.:
[α]
| 25 |
| D |
Ib) Метил (1R,3S,4S,5R)-5-ацетокси-3-гидрокси-4-метилциклогексанкарбоксилат: 2’.В (R=Me, Z=Me, A=СООСН3) и метил (1R,3S,4S,5R)-5-ацетокси-3-гидрокси-4-этилциклогексанкарбоксилат: 2’.С (R=Et, Z=Me, A=СООСН3)
Способом, аналогичным способу, описанному для I.a, но с заменой PPL на SAM II, PSL или CCL, соответственно, из
- метил все-цис-3,5-дигидрокси-4-метилциклогексанкарбоксилата: 1.В (R=Me, A=СООСН3)
- метил все-цис-3,5-дигидрокси-4-этилциклогексанкарбоксилата: 1.C (R=Et, A=СООСН3) были получены следующие соединения:
- метил (1R,3S,4S,5R)-5-ацетокси-3-гидрокси-4-метилциклогексанкарбоксилат: 2’.В (R=Me, Z=Me, A=СООСН3)
ИК (пленка): 3434, 1731, 1439, 1243, 1027 см-1;
1H ЯМР (500 МГц, СDСl3): δ 4,84 (1Н, дт, J=4,3, 4,3 Гц); 3,82 (1Н, м); 3,69 (3Н, с); 2,45 (1Н, м); 2,32 (1H, д, J=6,4 Гц); 2,05 (3Н, с); 1,92 (2Н, дт, J=4,0, 4,0 Гц); 1,77 (3Н, м); 0,96 (3Н, д, J=7,0 Гц) м.д.;
MS (м/z): 231 (М+,1); 213; 199; 186; 170; 152; 127; 111; 83; 87; 67; 43 (основной пик);
[α]
| 25 |
| D |
- метил (1R,3S,4S,5R)-5-ацетокси-4-этил-3-гидроксициклогексанкарбоксилат: 2’.С (R=Et, Z=Me, A=СООСН3)
ИК (пленка): 3421, 2958, 2360, 1733, 1437, 1239, 1027, 739 см-1
1H-ЯМР (500 МГц, СDСl3): δ 4,98 (1Н, т, J=4,1 Гц), 3,87 (1Н, м), 3,69 (3Н, с), 2,60 (1Н, уш.с), 2,16 (2Н, м), 2,02 (3Н, с), 1,84 (2Н, м), 1,72 (1Н, уш.с), 1,59 (2Н, м), 1,47 (1Н, м), 0,97 (3Н, т, J=7,5 Гц) м.д.;
MS (м/z): 245 (M++1), 233, 206, 184, 166, 141, 125, 111, 95, 87, 57, 43 (основной пик),
[α]
| 25 |
| D |
II) ФЕРМЕНТАТИВНОЕ ОМЫЛЕНИЕ СЛОЖНЫХ ДИЭФИРОВ ФОРМУЛЫ 3
IIа) Метил (1S,3S,5R)-3-ацетокси-5-гидроксициклогексанкарбоксилат: 2.А (R=Н, Z=Me, А=СООСН3)
К раствору мезо-диацетата 3.А (R=H, Z=Me, A=СООСН3) (92,1 мг, 0,36 ммоль) в 3,0 мл СН3СN добавляют 27,0 мл буфера с рН 7,0 с последующим добавлением SAM II (13,8 мг, 46,8 Е/мг). Образовавшуюся смесь перемешивают при комнатной температуре и поддерживают рН 7,0 добавлением 1,0 М раствора NaOH. Мониторинг реакции проводят анализом ТСХ. Реакцию заканчивают добавлением NaCl до насыщения реакционного раствора. Реакционную смесь экстрагируют AcOEt (3×50 мл). Объединенные органические экстракты промывают насыщенным раствором соли (3×10 мл), сушат над МgSO4 и концентрируют. Остаток очищают ВЭЖХ с элюированием смесью изооктан/EtOAc (6:4), получая при этом моноацетат 2.A (R=Н, Z=Me, А=СООСН3) (30,1 мг, 38,9%) в виде бесцветного масла.
IIb) Метил (1S,3R,4R,5S)-3-бутаноилокси-5-гидрокси-4-метилциклогексанкарбоксилат: 2.В (R=Me, Z=н-С3Н7, А=СООСН3)
К раствору 1.В (R=Me, A=СООСН3) (0,2 г, 1,10 ммоль) в 2 мл CH2Cl2 добавляют масляный ангидрид (538 мкл, 3,29 ммоль) при комнатной температуре и затем раствор TMSOTf (триметилсилилтрифторметансульфонат) (25 мкл, 1 М). Смесь перемешивают при комнатной температуре в течение 30 мин и затем добавляют 2,5 мл МеОН и смесь перемешивают в течение еще 2 час и гасят 5% NаНСО3. Реакционный раствор промывают насыщенным раствором соли (3×20 мл), сушат над MgSO4 и концентрируют, получая при этом остаток. Остаток очищают хроматографией на силикагеле с элюированием смесью изооктан:AcOEt (9:1), получая при этом дибутират 3.В (R=Me, Z=н-С3Н7, А=СООСН3) (3,9 г, 98,8%) в виде бесцветного масла. К раствору данного сложного мезо-диэфира (110 мг, 0,34 ммоль) в 2,0 мл СН3СN добавляют 22,0 мл буфера (рН 7,0) с последующим добавлением SАМ II (37 мг, 46,8 Е/мг). Образовавшуюся смесь перемешивают при комнатной температуре и рН устанавливают при 7,0 добавлением 1,0 М раствора NaOH. Мониторинг реакции проводят анализом ТСХ. Реакцию завершают добавлением NaCl к реакционному раствору. Реакционную смесь экстрагируют EtOAc (3×50 мл), сушат над МgSO4 и концентрируют, получая при этом остаток. Остаток очищают ВЭЖХ с элюированием смесью изооктан/EtOAc (7:3), получая при этом монобутират 2.В (R=Me, Z=н-С3Н7, А=СООСН3) (78 мг, 90%) в виде бесцветного масла.
ИК (пленка): 3495, 2964, 2878, 1731, 1438, 1281, 1183, 990 см-1,
1H-ЯМР (СDСl3): 4,83 (1Н, дт), 3,83 (1H, м), 3,68 (3Н, с), 2,45 (1H, м), 2,32 (1H, м), 2,28 (2Н, т, J=7,9 Гц), 1,91 (2Н, м), 1,82-1,62 (5Н, м), 0,95 (6Н, м).
[α]
| 25 |
| D |
MS: 259 (M++1), 227, 214, 187, 170, 152, 127, 111, 93, 71, 43
IIс) Метил (1S,3R,4R,5S)-3-ацетокси-5-гидрокси-4-метилциклогексанкарбоксилат: 2.С (R=Me, Z=Me, A=СООСН3)
Из мезо-диацетата 3.С (R=Me, Z=Me, A=СООСН3), как описано для IIа). [α]
| 25 |
| D |
IId) Метил (1R,3S,4S,5R)-5-ацетокси-3-гидрокси-4-метилциклогексанкарбоксилат: 2’.В (R=Me, Z=Me, A=СООСН3)
Из мезо-диацетата 3.С (R=Me, Z=Me, A=СООСН3), как описано для IIа), но с PPL в качестве липазы.
[α]
| 25 |
| D |
ПРИМЕР 1: (2S,3aS,4aS)-2-трет-бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.b.1 (A=СООСН3, R=Н, Р=TBDMS)
a) Метил (1R,3S,5R)-3-ацетокси-5-тозилоксициклогексанкарбоксилат: 2.4.a (R=Н, L=OTos, A=СООСН3)
п-Толуолсульфонилхлорид (13,3 г, 70 ммоль) добавляют к раствору метил (1S,3S,5R)-3-ацетокси-5-гидроксициклогексанкарбоксилата 2.A (R=Н, Z=Me, А=СООСН3) (10,1 г, 43,7 ммоль) и диметиламинопиридина (0,1 г) в смеси триэтиламина (50 мл) и метиленхлорида (10 мл) при 0°С. Раствор перемешивают в течение 1 час при 0°С, затем 22 час при комнатной температуре. Реакцию гасят водой (300 мл) и экстрагируют метиленхлоридом. Органический слой промывают водой, сушат над MgSO4, фильтруют и концентрируют. Сырой продукт кристаллизуют из EtOH, получая при этом 2.4.а (R=Н, L=OTos, А=СООСН3) (13,2 г, 81,6%). Т. пл. 83,1°С.
ИК (КВr): 1734, 1175 см-1;
1H-ЯМР (СDСl3): δ 1,5 (3Н, м), 2,0 (3Н, с), 2,28 (4Н, м), 2,47 (3Н, с), 3,68 (3Н, с), 4,4 (1Н, м), 4,68 (1Н, м), 7,35 (1Н, д, J=8,5 Гц), 7,8 (2Н, д, J=8,5 Гц) м.д.
b) Метил (1R,3S,5R)-3-гидрокси-5-тозилоксициклогексанкарбоксилат: 2.5.а (R=Н, L=OTos, А=СООСН3)
К суспензии 2.4.а (R=Н, L=OTos, А=СООСН3) (23,35 г, 63 ммоль) в МеОН добавляют карбонат калия (4,36 г, 31 ммоль).
Суспензию перемешивают в течение 30 мин и выливают в воду (1,5 л). Осадок отфильтровывают и сушат, получая при этом 2.5.a (R=Н, L=OTos, A=СООСН3) (18,5 г, 89%).
Т. пл. 98,4°С.
УФ (EtOH): 225 нм (е=11935);
ИК (КВr): 3447, 1719, 1176 см-1;
1H-ЯМР (CDCl3): δ 1,52 (4Н, м), 2,25 (4Н, м), 2,45 (3Н, с), 3,6 (1Н, м), 3,68 (3Н, с), 4,42 (1Н, м), 7,35 (2Н, д, J=8,5 Гц), 7,8 (2Н, д, J=8,5 Гц) м.д.;
[α]
| 25 |
| D |
с) Метил (1R,3R,5R)-3-бензоилокси-5-тозилоксициклогексанкарбоксилат: 2.6.а (R=Н, L=OTos, А=СООСН3)
К раствору 2.5.а (R=Н, L=OTos, А=СООСН3) (18,35 г, 56 ммоль), трифенилфосфина (18,4 г, 70 ммоль) и бензойной кислоты (8,53 г, 70 ммоль) в толуоле (180 мл) и ТГФ (70 мл) при 0°С добавляют диэтилазодикарбоксилат (11 мл, 70 ммоль). Смесь перемешивают при комнатной температуре в течение 30 мин, после добавления гептана (735 мл) ее фильтруют и фильтрат концентрируют. К сырому продукту добавляют толуол и раствор фильтруют через подушку силикагеля (30-70 меш). Элюирование толуолом, затем смесью толуол/метиленхлорид дает после концентрирования остаток, который кристаллизуют из EtOH, получая при этом 2.6.а (R=Н, L=OTos, A=СООСН3) (19,77 г, 82%). Т. пл. 76,2°С.
УФ (ЕtОН): 227 нм (е=20840);
ИК (KBr): 1709, 1177 см-1;
1H-ЯМР (СDСl3): δ 1,7 (3Н, м), 2,14 (2Н, м), 2,35 (3Н, с), 2,48 (1Н, м), 2,83 (1Н, м), 3,18 (3Н, с), 4,75 (1Н, м), 5,43 (1Н, м), 7,2 (2Н, д, J=11,4 Гц), 7,5 (2Н, д, J=8,5 Гц), 7,6 (1Н, м), 7,75 (2Н, д, J=11,4 Гц), 7,94 (2Н, д, J=8,5 Гц) м.д.;
[α]
| 25 |
| D |
d) Метил (1R,3R,5R)-3-гидрокси-5-тозилоксициклогексанкарбоксилат: 2.7.a (R=Н, L=OTos, A=СООСН3)
К суспензии 2.6.а (R=Н, L=OTos, А=СООСН3) (19,77 г, 46 ммоль) в МеОН (260 мл) добавляют карбонат калия (3,16 г, 22,9 ммоль). Смесь перемешивают в течение 6 час при комнатной температуре и выливают в воду (1 л). Водный слой экстрагируют диизопропилоксидом, сушат над МgSO4, фильтруют и концентрируют, получая при этом 2.7. а (R=Н, L=OTos, А=СООСН3) (17,45 г, количеств.) в виде масла.
УФ (EtOH): 224 нм (ε=12262);
ИК (KBr): 3525, 1731, 1174 см-1;
1H-ЯМР (СDСl3): δ 1,67 (3Н, м), 2,1 (3Н, м), 2,45 (3Н, с), 2,85 (1Н, м), 3,7 (3Н, с), 4,3 (1Н, с), 4,82 (1Н, м), 7,35 (2Н, д, J=8,5 Гц), 7,8 (2Н, д, J=8,5 Гц) м.д.;
[α]
| 25 |
| D |
е) Метил (1R,3R,5R)-3-трет-бутилдиметилсилилокси-5-тозилоксициклогексанкарбоксилат: 2.8.а (R=Н, L=OTos, Р=TBDMS, А=СООСН3)
К раствору 2.7. a (R=Н, L=OTos, A=СООСН3) (17,45 г, 46 ммоль) и имидазола (3,9 г, 57 ммоль) в сухом диметилформамиде (80 мл) добавляют трет-бутилдиметилсилилхлорид (8,6 г, 57 ммоль). Смесь перемешивают при комнатной температуре в течение 1,5 час, затем выливают на воду и экстрагируют толуолом. Органический слой промывают водой, затем концентрируют. Сырой продукт кристаллизуют из гептана, получая при этом 2.8. a (R=Н, L=OTos, P=TBDMS, А=СООСН3) (13,94 г, 69%). Т. пл. 68,2°С.
УФ (EtOH): 225 нм (ε=12390);
ИК (КВr): 2853, 1726, 1436, 1359, 1173, 831 см-1;
1H-ЯМР (СDСl3): δ 0,002 (3Н, с), 0,05 (3Н, с), 0,82 (9Н, с), 1,55 (4Н, м), 1,85 (2Н, м), 2,45 (3Н, с), 2,8 (1Н, м), 3,67 (3Н, с), 4,2 (1Н, уш.с), 4,7 (1Н, м), 7,33 (2Н, д, J=8,5 Гц), 7,8 (2Н, д, J=8,5 Гц) м.д.:
[α]
| 25 |
| D |
f) (2S,3aS,4aS)-2-трет-Бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.b.1 (R=Н, P=TBDMS, A=СООСН3)
К перемешиваемому раствору 2.8.а (R=Н, L=OTos, Р=TBDMS, А=СООСН3) (378,5 г, 856 ммоль) в трет-бутаноле при 64°С медленно добавляют в течение 1 час 1 М раствор трет-бутилата калия в трет-бутаноле (1,02 л). Спустя 5 минут после окончания добавления суспензию охлаждают до 30°С и добавляют насыщенный раствор хлорида аммония (3 л). Спустя 10 мин водную фазу экстрагируют диизопропилоксидом. Органический слой промывают водой, сушат над MgSO4, фильтруют и концентрируют. Осадок флэш-хроматографируют на силикагеле с применением смеси гептан/этилацетат в качестве элюирующего растворителя, получая при этом I.b.1 (R=Н, Р=TBDMS, А=СООСН3) (211,3 г, 91,3%) в виде желтого масла.
Eb760: 135°С;
УФ (EtOH): 201 нм (ε=742);
ИК (пленка) 1726 см-1, 1458 см-1, 1437 см-1, 1254 см-1, 837 см-1;
1H-ЯМР (СDСl3): δ 0,01 (6Н, с), 0,83 (9Н, с), 1,28 (2Н, м), 1,8 (2Н, м), 2,11 (3Н, м), 3,65 (3Н, с), 3,9 (1Н, м) м.д.;
[α]
| 25 |
| D |
ПРИМЕР 2: (2S,3aS,4aS)-2-трет-бутилдиметилсилилокси-3а-(гидроксиметил)бицикло[3.1.0]гексан: I.b.2 (R=Н, Р=TBDMS, A=CH2OH)
К раствору (2S,3aS,4aS)-2-трет-бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексана I.b.1 (R=Н, Р=TBDMS, А=СООСН3) (207,5 г, 768 ммоль) в толуоле (2,1 л) при -70°С добавляют 1,5 М раствор диизобутилалюминийгидрида в толуоле (1,25 л) в течение 1,5 час. После завершения добавления медленно добавляют насыщенный раствор тартрата калия и натрия и температуру повышают до 0°С. После перемешивания в течение 2 час реакционную смесь экстрагируют толуолом, органический слой сушат над MgSO4 и концентрируют, получая при этом 142,9 г (88%) указанного в заголовке соединения I.b.2 в виде желтого масла.
ИК (КВr): 3355, 1471, 1255, 835, 774 см-1;
1H-ЯМР (СDСl3): δ 0 (6Н, с), 0,32 (1Н, м), 0,5 (1Н, м), 0,83 (9Н, с), 1,16 (1Н, м), 1,87 (5Н, м), 3,54 (2Н, м), 4,0 (1Н, м) м.д.
ПРИМЕР 3: (2S,3aS,4aS)-2-трет-бутилдиметилсилилокси-3а-формилбицикло[3.1.0]гексан: I.b.3 (R=Н, Р=TBDMS, А=СНО)
К I.b.2 (R=Н, Р=TBDMS, А=СН2ОН) (69,6 г, 287 ммоль) в метиленхлориде (700 мл) при комнатной температуре добавляют хлорхромат пиридиния (68 г, 315 ммоль). Смесь энергично перемешивают в течение 1 час. Температуру затем повышают до 35°С, затем снижают до 25°С. Суспензию фильтруют через подушку целита и промывают метиленхлоридом и диизопропилоксидом. Органический слой промывают последовательно водой, насыщенным раствором гидрокарбоната натрия и водой до рН 6-7. Объединенные органические слои сушат над MgSO4, фильтруют и концентрируют. Остаток (66,8 г) очищают флэш-хроматографией на флорисиле с применением в качестве элюента смеси 95/5 (об./об.) гептан/этилацетат, получая при этом I.b.3 (R=Н, Р=TBDMS, А=СНО) в виде желтого масла (50,33 г, 73%).
УФ (EtOH): 204 нм (ε=6292);
ИК (КВr): 1726, 1253, 1119, 838 см-1;
1H-ЯМР (CDCl3); δ 0 (6Н, с), 0,87 (9Н, с), 1,3 (2Н, м), 1,85 (2Н, м), 2,1 (3Н, м), 4 (1Н, м), 8,9 (1Н, с) м.д.;
[α]
| 25 |
| D |
ПРИМЕР 4: (2R,3aR,4aR)-2-трет-бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.h.1 (R=H, A=СООСН3, P=TBDMS)
а) Метил (1R,3S,5S)-3-ацетокси-5-бензоилоксициклогексанкарбоксилат: 3.9.а (R=Н, А=СООСН3)
Как описано для 2.6.а (R=Н, L=OTos, A=СООСН3), метил (1S,3S,5R)-3-ацетокси-5-гидроксициклогексанкарбоксилат 2.А (R=Н, Z=Me, A=СООСН3) (25 г, 111,3 ммоль) превращают в метил (1R,3S,5S)-3-ацетокси-5-бензоилоксициклогексанкарбоксилат 3.9.а (R=Н, А=СООСН3) (32,4 г, 91%)
1H-ЯМР (CDCl3): δ 1,68 (3Н, м), 2,05 (3Н, с), 2,34 (3Н, м), 2,92 (1Н, м), 3,70 (3Н, с), 5,18 (1Н, м), 5,55 (1Н, м), 7,50 (3Н, м), 8,05 (2Н, м) м.д.;
[α]
| 25 |
| D |
b) Метил (1R,3S,5S)-5-бензоилокси-3-гидроксициклогексанкарбоксилат: 3.10.а (R=Н, А=СООСН3)
Метил (1R,3S,5S)-3-ацетокси-5-бензоилоксициклогексанкарбоксилат: 3.9.a (R=Н, A=СООСН3) (32,4 г, 151,9 ммоль) омыляют, как описано для 2.5.а (R=Н, L=OTos, А=СООСН3). Сырой продукт очищают флэш-хроматографией на силикагеле (гептан/этилацетат 5/5), получая при этом 3.10.а (R=Н, А=СООСН3) (22,38 г, 79,5%).
1H-ЯМР (СDСl3): δ 1,63 (4Н, м), 1,92 (1Н, с), 2,3 (2Н, м), 2,86 (1Н, м), 3,7 (3Н, с), 4,1 (1Н, м), 5,53 (1Н, м), 7,5 (3Н, м), 8,0 (2Н, м) м.д.;
[α]
| 25 |
| D |
с) Метил (1S,3S,5S)-5-бензоилокси-3-тозилоксициклогексанкарбоксилат: 3.11.a (R=Н, L=OTos, А=СООСН3)
Спирт 3.10.а (R=Н, А=СООСН3) (25,2 г, 90,88 ммоль) тозилируют, как описано для 2.4.а (R=Н, L=OTos, А=СООСН3). После очистки флэш-хроматографией (гептан/этилацетат 7/3) и кристаллизации из смеси гептан/EtOH с количественным выходом получают указанное в заголовке соединения 3.11.а (R=Н, L=OTos, A=СООСН3) (39,75 г).
Т. пл. 128,4°С.
ИК (КВr): 2950, 1715, 1175, 939 см-1;
1H-ЯМР (СDСl3): δ 1,7 (3Н, м), 2,18 (2Н, м), 2,38 (3Н, с), 2,5 (1Н, м), 2,85 (1Н, м), 3,68 (3Н, с), 4,76 (1Н, м), 5,43 (1Н, м), 7,19 (2Н, д), 7,5 (2Н, д), 7,58 (1Н, м), 7,77 (2Н, д), 7,96 (2Н, д) м.д.;
[α]
| 25 |
| D |
d) Метил (1S,3S,5S)-5-гидрокси-3-тозилоксициклогексанкарбоксилат: 3.12.а (R=Н, L=OTos, А=СООСН3)
Из 3.11.а (R=Н, L=OTos, А=СООСН3) (38,25 г, 88,4 ммоль), как описано для 2.7. а (R=Н, L=OTos, А=СООСН3), получают метил (1S,3S,5S)-5-гидрокси-3-тозилоксициклогексанкарбоксилат 3.12.а (R=Н, L=OTos, А=СООСН3) (29,25 г) в виде желтого масла с количественным выходом.
1H-ЯМР (CDCl3): δ 1,6 (4Н, м), 2,08 (3Н, м), 2,47 (3Н, с), 2,83 (1Н, м), 3,68 (3Н, с), 4,3 (1Н, м), 4,82 (1Н, м), 7,36 (2Н, д), 7,8 (2Н, д) м.д.
е) Метил (1S,3S,5S)-5-трет-бутилдиметилсилилокси-3-тозилоксициклогексанкарбоксилат: 3.13.a (R=Н, L=OTos, Р=TBDMS, А=СООСН3)
Из 3.12.а (R=Н, L=OTos, А=СООСН3) (29,2 г, 89,07 ммоль), как описано для 2.8.а (R=Н, L=OTos, Р=TBDMS, А=СООСН3). Очистка флэш-хроматографией на силикагеле (гептан/этилацетат 8/2) дает 3.13.а (R=Н, L=OTos, Р=TBDMS, А=СООСН3) (34,8 г, 88%) в виде желтого масла.
ИК (пленка): 2953, 2855, 1725, 1278, 1177, 949 см-1:
1H-ЯМР (СDСl3): δ 0 (6Н, д), 0,85 (9Н, с), 1,55 (3Н, м), 1,88 (2Н, м), 2,38 (1Н, с), 2,48 (3Н, с), 2,82 (1Н, м), 3,7 (3Н, с), 4,2 (1Н, м), 4,7 (1Н, м), 7,8 (2Н, д), 8,09 (2Н, д) м.д.;
[α]
| 25 |
| D |
f) (2R,3aR,4aR)-2-трет-Бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.h.1 (R=Н, Р=TBDMS, А=СООСН3)
Из 3.13. а (R=Н, L=OTos, Р=TBDMS, А=СООСН3) (33,2 г, 75 ммоль), как описано для I.b.1 (из 2.8.1). Очистка флэш-хроматографией на силикагеле (гептан/этилацетат 95/5) дает (2R,3aR,4aR)-2-трет-бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.h.1 (R=Н, Р=TBDMS, А=СООСН3) (15,5 г, 78%) в виде желтого масла.
ИК (пленка): 2952, 2856, 1724, 1113, 837 см-1;
1H-ЯМР (СDСl3): δ 0 (6Н, с), 0,85 (9Н, с), 1,11 (1Н, д), 1,27 (2Н, м), 1,6 (3Н, с), 1,8 (1Н, м), 2,11 (3Н, м), 3,65 (3Н, с), 3,9 (1Н, м) м.д.;
[α]
| 25 |
| D |
ПРИМЕР 5: (2R,3aR,4aR)-2-трет-бутилдиметилсилилокси-3а-(гидроксиметил)бицикло[3.1.0]гексан: I.h.2 (R=H, P=TBDMS, A=CH2OH)
(2R,3aR,4aR)-2-трет-Бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.h.1 (R=H, P=TBDMS, A=СООСН3) (15,15 г, 56 ммоль) превращают в I.h.2 (R=H, Р=TBDMS, А=CH2OH) (11,85 г, 87%) с использованием условий, описанных для I.b.2 (R=H, P=TBDMS, А=CH2OH).
ИК (пленка): 3354, 2928, 2856, 1255, 835 см-1;
1H-ЯМР (CDCl3) δ 0,1 (6Н, с), 0,35 (1Н, т), 0,5 (1Н, т), 0,86 (9Н, с), 1,17 (1Н, с), 1,85 (5Н, м), 3,52 (2Н, м), 4,0 (1Н, м) м.д.;
[α]
| 25 |
| D |
ПРИМЕР 6: (2R,3aR,4aR)-2-трет-бутилдиметилсилилокси-3а-формилбицикло[3.1.0]гексан: I.h.3 (R=H, P=TBDMS, A=CHO)
Из I.h.2 (R=H, P=TBDMS, A=CH2OH) (11,3 г, 46,6 ммоль) по процедуре I.b.3 (R=H, P=TBDMS, А=CHO) I.h.3 (R=H, Р=TBDMS, А=CHO) получают (6,2 г, 55%) в виде желтого масла.
УФ (EtOH): 204,5 мм (ε=6600);
ИК (пленка): 2930, 2880, 2856, 1705, 1119, 1097, 836 см-1;
1H-ЯМР (СDСl3): δ 0 (6Н, с), 0,83 (9Н, с), 0,95 (1Н, т), 1,22 (2Н, м), 1,85 (2Н, м), 2,1 (3Н, м), 4,0 (1Н, кв), 8,87 (1Н, с) м.д.;
[α]
| 25 |
| D |
ПРИМЕР 7: (2R,3aS,4aS)-2-трет-бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.a.1 (R=Н, Р=TBDMS, А=СООСН3)
а) Метил (1R,3S,5R)-3-трет-бутилдиметилсилилокси-5-тозилоксициклогексанкарбоксилат: 2.3.а (R=Н, L=OTos, Р=TBDMS, A=СООСН3)
Функциональную гидроксигруппу метил (1R,3S,5R)-3-гидрокси-5-тозилоксициклогексанкарбоксилата 2.5.а (R=Н, L=OTos, А=СООСН3) (29,3 г, 89,2 ммоль) защищают, как описано для 2.8.а (R=Н, L=OTos, Р=TBDMS, А=СООСН3), получая при этом 2.3. а. (R=Н, L=OTos, Р=TBDMS, А=СООСН3) (36,75 г, 93%). Т. пл. 70,9°С.
ИК (КВr): 2957, 2855, 1734, 1174, 923 см-1;
1H-ЯМР (CDCl3): δ 0 (6Н, с), 0,82 (9Н, с), 1,41 (3Н, м), 2,16 (4Н, м), 2,46 (3Н, с), 3,54 (1Н, м), 3,69 (3Н, с), 4,41 (1Н, м), 7,34 (2Н, д), 7,8 (2Н, д) м.д.;
[α]
| 25 |
| D |
b) (2R,3aS,4aS)-2-трет-Бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.a.1 (R=Н, Р=TBDMS, А=СООСН3)
Из 2.3. a (R=Н, L=OTos, P=TBDMS, A=СООСН3) (34,81 г, 78,6 ммоль), как описано для I.b.l (R=Н, Р=TBDMS, А=СООСН3). Очистка флэш-хроматографией на силикагеле (гептан/этилацетат 5/5) дает I.a.1 (R=Н, Р=TBDMS, А=СООСН3) (16,6 г, 78%) в виде желтого масла.
ИК (пленка): 2953, 2855, 1726, 1148, 836 см-1;
1H-ЯМР (СDСl3): δ 0 (6Н, с), 0,86 (9Н, с), 1,5 (5Н, м), 2,1 (1Н, м), 2,48 (1Н, м), 3,68 (3Н, с), 4,33 (1Н, т) м.д.;
[α]
| 25 |
| D |
ПРИМЕР 8: (2R,3aS,4aS)-2-трет-Бутилдиметилсилилокси-3а-(гидроксиметил)бицикло [3.1.0]гексан: I.а.2 (R=H, P=TBDMS, A=СН2OН)
Из I.a.1 (R=Н, Р=TBDMS, А=СН2OН) (15,6 г, 57,7 ммоль), как описано для I.b.2 (R=Н, Р=TBDMS, А=СН2OН). I.a.2 (R=Н, Р=TBDMS, А=СН2OН) получают в виде желтого масла (11,7 г, 83,7%).
ИК (пленка): 3331, 2927, 2855, 1254, 1094, 1006, 835 см-1;
1H-ЯМР (CDCl3): δ 0 (6Н, с), 0,5 (1Н, м), 0,88 (9Н, с), 1,19 (3Н, м), 1,72 (2Н, м), 2,1 (2Н, м), 3,6 (2Н, с), 4,34 (1Н, т) м.д.;
[α]
| 25 |
| D |
ПРИМЕР 9: (2R,3aS,4aS)-2-трет-бутилдиметилсилилокси-3а-формилбицикло[3.1.0]гексан: I.a.3 (R=Н, Р=TBDMS, А=СНО)
Из I.a.2 (R=Н, Р=TBDMS, А=СН2OН) (11,1 г, 45,5 ммоль), как описано для I.b.3 (R=Н, Р=TBDMS, А=СНО). I.a.3 (R=Н, Р=TBDMS, А=СНО) (8,8 г, 80%) получают в виде желтого масла.
УФ (EtOH): 204,7 нм (ε=6991);
ИК (пленка): 2928, 2855, 1702, 1255, 1072, 837 см-1;
1H-ЯМР (CDCl3): δ 0 (6Н, с), 0,85 (9Н, с), 1,45 (1Н, м), 1,78 (3Н, м), 2,02 (2Н, м), 2,5 (1Н, м), 4,35 (1Н, м), 8,81 (1Н, с) м.д.;
[α]
| 25 |
| D |
ПРИМЕР 10: (2S,3aR,4aR)-2-трет-бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.f.1 (R=Н, Р=TBDMS, А=СООСН3)
а) Метил-(1R,3S,5R)-3-ацетокси-5-трет-бутилдиметилсилилоксициклогексанкарбоксилат: 3.7.а (R=Н, Р=TBDMS, A=СООСН3)
Функциональную гидроксигруппу метил (1S,3S,5R)-3-ацетокси-5-гидроксициклогексанкарбоксилата 2.А (R=Н, А=СООСН3) (45,5 г, 0,210 ммоль) силилируют, как описано для 2.8.а (R=Н, L=OTos, Р=TBDMS, А=СООСН3). Очистка флэш-хроматографией на силикагеле с применением смеси гептан/этилацетат в качестве элюирующего растворителя (9/1) дает 3,7.a (R=H, P=TBDMS, A=СООСН3) в виде желтого масла (69,97 г, 92%).
ИК (пленка): 2953, 2856, 1736, 1240 см-1;
1H-ЯМР (CDCl3): δ 0 (6Н, с), 0,8 (9Н, с), 1,33 (4Н, м), 2 (3Н, с), 2,1 (2Н, м), 2,32 (1Н, м), 3,55 (1Н, м), 3,62 (3Н, с), 4,66 (1Н, м) м.д.
b) Метил (1R,3S,5R)-5-трет-бутилдиметилсилилокси-3-гидроксициклогексанкарбоксилат: 3.8.a (R=H, P=TBDMS, A=СООСН3)
Из 3.7.a (R=Н, Р=TBDMS, А=СООСН3) (63,67 г, 0,1926 ммоль), как описано для 2.5.а (R=Н, L=OTos, А=СООСН3). Очистка флэш-хроматографией на силикагеле с использованием смеси гептан/этилацетат (7/3) в качестве элюента дает 3.8. а (R=Н, Р=TBDMS, А=СООСН3) (46,24 г, 83%) в виде желтого масла.
ИК (пленка): 3404, 2952, 2856, 1736, 837 см-1;
1H-ЯМР (СDСl3): δ 0 (6Н, с), 0,81 (9Н, с), 1,3 (3Н, м), 1,67 (1Н, м), 2,13 (4Н, м), 3,56 (2Н, м), 3,63 (3Н, с) м.д.;
[α]
| 25 |
| D |
с) Метил (1S,3S,5R)-5-трет-бутилдиметилсилилокси-3-тозилоксициклогексанкарбоксилат: 3.6.а (R=Н, L=OTos, Р=TBDMS, А=СООСН3)
Из 3.8.а (R=Н, Р=TBDMS, А=СООСН3) (45,99 г, 0,159 ммоль), как описано для 2.4. а (R=Н, L=OTos, А=СООСН3). Очистка флэш-хроматографией на силикагеле с использованием смеси гептан/этилацетат, 8/2, в качестве элюента с последующей кристаллизацией из EtOH дает 3.6. а (R=Н, L=OTos, Р=TBDMS, А=СООСН3) (53,7 г, 76%).
Т. пл.: 71°С.
ИК (КВr): 2957, 2855, 1734, 1174, 923 см-1;
1H-ЯМР (CDCl3): δ 0 (6Н, с), 0,82 (9Н, с), 1,41 (3Н, м), 2,16 (4Н, м), 2,46 (3Н, с), 3,54 (1Н, м), 3,69 (3Н, с), 4,41 (1H, м), 7,34 (2Н, д), 7,8 (2Н, д) м.д.;
[α]
| 25 |
| D |
d) (2S,3aR,4aR)-2-трет-Бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.f.1 (R=H, P=TBDMS, A=СООСН3)
Из 3.6. a (R=H, L=OTos, P=TBDMS, A=СООСН3) (53,7 г, 0,121 ммоль), как описано для I.b.1 (R=H, Р=TBDMS, А=СООСН3). I.f.1 (R=H, P=TBDMS, А=СООСН3) получают (24,48 г, 74,6%) в виде бледно-желтого масла.
ИК (пленка): 2953, 2856, 1726, 1148, 836 см-1;
1H-ЯМР (CDCl3): δ 0 (6Н, с), 0,86 (9Н, с), 1,5 (5Н, м), 2,1 (1Н, м), 2,48 (1Н, м), 3,68 (3Н, с), 4,33 (1Н, т) м.д.;
[α]
| 25 |
| D |
ПРИМЕР 11: (2S,3aR,4aR)-2-трет-бутилдиметилсилилокси-3а-(гидроксиметил)бицикло[3.1.0]гексан: I.f.2 (R=H, Р=TBDMS, А=СН2ОН)
Из I.f.1 (R=H, Р=TBDMS, А=СООСН3) (10 г, 0,037 ммоль), как описано для I.b.2 (R=H, P=TBDMS, А=СН2OH). I.f.2 (R=H, Р=TBDMS, А=СН2ОН) получают с количественным выходом (10 г) в виде масла.
ИК (пленка): 3331, 2927, 2855, 1254, 1094, 1006, 835 см-1;
1H-ЯМР (CDCl3); δ 0 (6Н, с), 0,5 (1Н, м), 0,88 (9Н, с), 1,19 (3Н, м), 1,72 (2Н, м), 2,1 (2Н, м), 3,6 (2Н, с), 4,34 (1Н, т) м.д.;
[α]
| 25 |
| D |
ПРИМЕР 12: (2S,3aR,4aR)-2-трет-бутилдиметилсилилокси-3а-формилбицикло[3.1.0]гексан: I.f.3 (R=H, P=TBDMS, A=CHO)
Как дл