Фармакокинетическое и фармакодинамическое моделирование введения эритропоэтина
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к фармакологии, и касается определения оптимизированных режимов дозирования эритропоэтина (ЕРО). Для этого предлагается система выбора одного или нескольких режимов дозирования путем использования ФК/ФД - модели для определения ФК/ФД профиля режимов. Затем осуществляют отбор такого режима, который обеспечивает концентрацию ЕРО в сыворотке, превышающую ее до введения в течение 5-30 суток между введениями ЕРО. Изобретение позволяет оптимально использовать ЕРО для коррекции изменений показателей крови и лечения заболеваний, с ними связанных. 15 н. и 35 з.п. ф-лы, 81 ил., 2 табл.
Реферат
Данной заявкой истребуется приоритет в соответствии с предварительной заявкой с регистрационным номером 60/133418, поданной 11 мая 1999 г., содержание которой включено сюда в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к системам и способам достижения оптимизированных режимов дозирования ЕРО для желаемого фармакодинамического/фармакокинетического ответа.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Эритропоэтин (ЕРО) является основным фактором, ответственным за регуляцию продукции красных кровяных клеток в обычных условиях и за ускоренное восстановление массы красных кровяных клеток после кровотечения. ЕРО является гликопротеидным гормоном с молекулярной массой 30 кДа и в значительной степени гликозилирован, что служит для защиты молекулы ЕРО от быстрой деградации in vivo. Концентрации ЕРО в сыворотке человека обычно находятся в пределах от 6 до 32 Ед/л (1), и сообщалось, что время полужизни (t1/2) ЕРО находится в пределах от 2 до 13 часов с объемом распределения, близким к объему плазмы. Как и ожидалось для крупного сиалогликопротеида, менее 10% ЕРО экскретируется с мочой (смотри, например, Lappin et al., 1966, Clin. Lab. Haem. 18:137-145).
Основным местом синтеза ЕРО во взрослых организмах является почка; хотя печень и костный мозг также были включены в рассмотрение, данные остаются недоказанными. Первичным стимулом для повышенного синтеза ЕРО является тканевая гипоксия, которая возникает в результате пониженного доступа кислорода в ткани. Гипоксия может быть результатом потери больших количеств крови, разрушения эритроцитов радиацией или воздействия больших высот. Кроме того, гипоксию вызывают различные формы анемии, так как эритроциты ответственны за транспорт кислорода в организме. В нормальном состоянии повышенный уровень ЕРО стимулирует продукцию новых красных кровяных клеток, тем самым повышая уровень кислорода и снижая или устраняя состояние гипоксии.
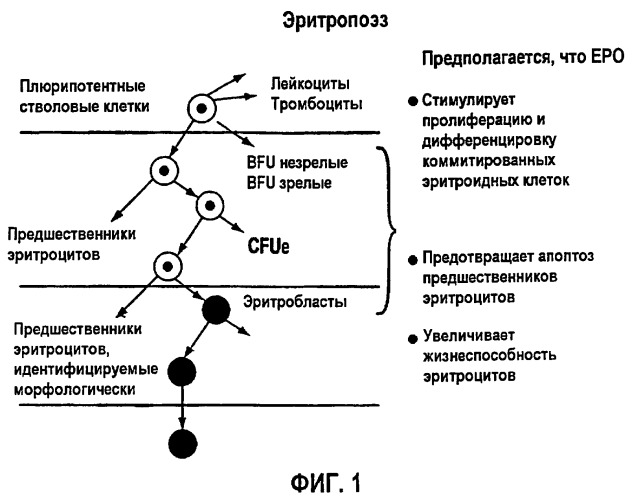
Основная функция ЕРО состоит в том, что он действует синергетически с другими факторами роста, стимулируя пролиферацию и дифференцировку клеток-предшественников эритроцитов в костном мозге, приводя к ретикулоцитозу и повышенному количеству эритроцитов в крови, процессу, также известному как эритропоэз (фигура 1). В ходе эритропоэза дифференцировка клеток эритроидного ряда у человека происходит в течение двухнедельного промежутка времени. Самым ранним предшественником является BFU-E (Burst-Forming Unit-Erythroid, бурст-образующая эритроидная единица), которая невелика по размеру и не обладает отличительными гистологическими характеристиками. Стадией после BFU-E является CFU-E (Colony Forming Unit-Erythroid, колониеобразующая эритроидная единица), которая крупнее, чем BFU-E, и непосредственно предшествует стадии, на которой начинается продукция гемоглобина. Клетками, которые начинают продуцировать гемоглобин, являются юные эритроциты, которые не только начинают продуцировать гемоглобин, но также начинают конденсировать свои ядра, в конечном итоге становясь зрелыми эритробластами. Зрелые эритробласты меньше, чем юные эритроциты, и имеют плотно упакованное ядро, которое вытесняется по мере того, как клетки становятся ретикулоцитами. Ретикулоциты называются так потому, что эти клетки содержат ретикулярные сети полирибосом, и, по мере того как ретикулоциты теряют свои полирибосомы, они становятся зрелыми красными кровяными клетками (RBC).
До последнего времени возможность получения ЕРО была очень ограничена. Несмотря на то, что белок присутствует в моче человека, экскретируемые уровни слишком малы, чтобы сделать мочу практическим источником ЕРО для терапевтического использования. Идентификация, клонирование, экспрессия генов, кодирующих ЕРО, и технологии очистки ЕРО, которые описаны, например, в патентах США №№4703008, 5389541, 5441868, 5614184, 5688679, 5888774, 5888772 и 5856298, сделали ЕРО легко доступными для терапевтических применений. Описание очистки рекомбинантного ЕРО (rHuEPO) из культуральной среды, которая поддерживала рост клеток млекопитающих, содержащих рекомбинантные ЕРО-плазмиды, включено, например, в патент США №4667016. Рекомбинантный ЕРО имеет аминокислотную последовательность, идентичную последовательности эритропоэтина мочи человека, при этом оба эритропоэтина неразличимы в химических, физических и иммунологических тестах. Экспрессия и извлечение биологически активного рекомбинантного ЕРО из хозяйских клеток млекопитающих, содержащих ген ЕРО в рекомбинантных плазмидах, сделали доступными количества ЕРО, пригодные для терапевтических применений. Кроме того, сведения о последовательности гена и доступность больших количеств очищенного белка привели к лучшему пониманию способа действия этого белка.
Биологическая активность белка зависит от его структуры. В частности, первичная структура белка, т.е. его аминокислотная последовательность, обеспечивает информацию, которая делает возможным образование полипептидом вторичной (например, α-спираль или β-складка) и третичной (общая трехмерная укладка) структур во время и после синтеза. Кроме того, биологическая активность белка определяется не только его структурой, но также модификациями, возникающими после того, как белок был транслирован. Действительно, многие белки клеточной поверхности и секреторные белки модифицированы одной или несколькими олигосахаридными группами. Указанная модификация, известная как гликозилирование, может коренным образом влиять на физические свойства белков и может быть важной для стабильности, секреции и субклеточной локализации белка. Правильное гликозилирование может быть существенным для биологической активности.
И ЕРО, полученный из мочи человека, и рекомбинантный ЕРО (экспрессированный в клетках млекопитающих), имеющий последовательность аминокислот 1-165 ЕРО человека, содержат три N-связанных и одну O-связанную олигосахаридные цепи, которые вместе составляют примерно 40% общей молекулярной массы гликопротеида. Было показано, что олигосахаридные цепи модифицированы концевыми остатками сиаловой кислоты. Ферментативная обработка гликозилированного ЕРО для удаления всех остатков сиаловой кислоты в результате приводит к потере активности in vivo, но не влияет на его активность in vitro (Lowy et al., 1960, Nature 185: 102; Goldwasser et al., 1974, J. Biol. Chem. 249: 4202). Такое поведение объяснили быстрым выведением асиалоэритропоэтина из циркулирующей крови при взаимодействии с белком печени, связывающим асиалогликопротеиды (Morrell et al., 1968, J. Biol. Chem. 243: 155; Briggs et al., 1974, Am. J. Physiol. 227: 1385; и Ashwell et al., 1978, Methods of Enzymol. 50: 287). Таким образом, ЕРО обладает биологической активностью in vivo только в том случае, когда он сиалирован, чтобы избежать связывания со связывающим белком печени.
Продукция дефицитного (или неэффективного) ЕРО по отношению к уровню гемоглобина связана с некоторыми формами анемии. Такие анемии включают анемию при почечной недостаточности и конечной стадии заболевания почек, анемию при хронических заболеваниях (хронические инфекции и ревматоидный артрит), аутоиммунном заболевании, синдроме приобретенного иммунодефицита (СПИД) и злокачественной опухоли. Многие из этих состояний связаны с образованием фактора, который, как показано, является ингибитором активности ЕРО. Другие анемии, очевидно, независимы от ЕРО и включают апластическую анемию, железодефицитную анемию, талассемию, мегалобластную анемию, истинную эритроцитарную аплазию и синдромы миелодисплазии.
Измерение уровней ЕРО в сыворотке человека имеет клиническую важность. Определение уровней ЕРО в сыворотке пациентов может быть полезным для того, чтобы отличить такие анемии и полицитемии, которые связаны с пониженными или повышенными уровнями ЕРО, от тех, которые не связаны. Кроме того, обнаружение несоответствующего норме низкого уровня ЕРО в сыворотке позволяет заключить, что для пациента с анемией полезным может быть лечение экзогенным ЕРО.
Эпоэтин-альфа оценили в клинических испытаниях на пациентах с нормальным здоровьем, а также пациентах с различными анемичными состояниями. Эпоэтин-альфа индуцирует быстрый гематологический ответ у здоровых добровольцев, при условии, что достигается адекватное потребление железа, чтобы обеспечить повышенный синтез гемоглобина. В большинстве испытаний исследовали безопасность и эффективность лечения анемии, связанной с почечной недостаточностью. Кроме того, эпоэтин-альфа можно использовать для корректировки анемии у других групп пациентов, включая анемию, связанную с химиотерапией злокачественных опухолей препаратами платины, анемию, связанную с лечением зидовудином больных СПИД, и анемию, связанную с применением других лекарственных препаратов, таких как цисплатин. Введение эпоэтина-альфа также имеет много других потенциальных терапевтических применений: введение эпоэтина-альфа увеличивает способность к аутологичному донорству крови у пациентов, которым запланировано проведение операции, и ослабляет снижение гематокрита, часто наблюдаемое у необработанных аутологичных доноров; введение эпоэтина-альфа увеличивает восстановление красных кровяных клеток после аллогенного - но не аутологичного - трансплантата костного мозга; и показано, что введение эпоэтина-альфа улучшает качество жизни у людей, страдающих ревматоидным артритом.
Альтернативным применением ЕРО является повышение спортивных данных атлетов, за счет того что он вызывает увеличение гематокрита у атлета. Увеличение гематокрита увеличивает объем кислорода, транспортируемого из легких в тренируемые скелетные мышцы. Так как синтез ЕРО осуществляется биоинженерным способом, инъекции атлетов ЕРО, известные также как допинг крови, стали популярными в спорте вообще и, в частности, в велоспорте (Scheen, A.J., 1998. Rev. Med. Liege 53(8): 499-502).
Ныне существует ряд недостатков, связанных со стандартным режимом дозирования ЕРО, вводимого пациентам. При особых показаниях, таких как злокачественная опухоль, пациентов лечат введением 150 ME ЕРО/кг три раза в неделю. Таким образом, остается важная задача изменить принятый в настоящее время режим дозирования на более подходящую схему и режим дозирования. Предполагается, что менее частое введение улучшит переносимость и будет более удобным. Кроме того, стандартные режимы дозирования могут не вызывать максимальный физиологический ответ у пациентов; и стандартные режимы дозирования могут быть не самыми экономически эффективными.
Кроме того, существует ряд недостатков, связанных с путем введения ЕРО: регулярное внутривенное введение неудобно для пациента; внутривенное введение неосуществимо для индивидуумов, страдающих некоторыми состояниями, а именно для пациентов при продолжительном амбулаторном перитонеальном диализе или для не диализуемых пациентов с ограниченным сосудистым доступом; быстрая доставка дозы rHuEPO посредством внутривенного введения приводит к более низкой биодоступности rHuEPO в течение более продолжительных периодов времени и может быть не так эффективна для стимулирования продукции эритроцитов, как требуется.
Следовательно, по всем детально описанным выше причинам необходим лучший путь введения и способы определения эффективной дозы и режима дозирования для введения ЕРО.
Поэтому одним из аспектов данного изобретения является разработка фармакокинетической/фармакодинамической (ФК/ФД) модели для характеристики и предсказания ответов на rHuEPO, тем самым для идентификации наиболее эффективных, экономически эффективных и/или подходящих режимов лечения пациентов. В конкретном варианте данного изобретения предполагается введение ЕРО один раз в неделю или один раз каждые две недели. Другой аспект данного изобретения обеспечивает методологию оценки фармакокинетических и фармакодинамических параметров ЕРО после введения при двух или нескольких режимах дозирования для сравнения клинических последствий наряду с параметрами переносимости и безопасности, проводимого между режимами дозирования ЕРО. Также рассматриваются связанные бизнес-способы и компьютерные системы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ.
Конкретный вариант данного изобретение может включать способ достижения оптимизированных режимов дозирования ЕРО для желаемого фармакодинамического ответа, который может включать в себя выбор одного или нескольких режимов дозирования, затем использование ФК/ФД-модели для определения фармакодинамического профиля одного или нескольких режимов дозирования ЕРО и, наконец, выбор одного из режимов дозирования ЕРО для введения, чтобы достичь желаемого фармакодинамического (ФД) ответа на основе профиля ЕРО. В дополнительном варианте ФД-ответ может включать в себя один или несколько параметров из группы, состоящей из количества ретикулоцитов, количества эритроцитов и уровня гемоглобина.
Альтернативным вариантом данного изобретения также может быть способ достижения оптимизированных режимов дозирования ЕРО для желаемого фармакодинамического ответа, который включает в себя сначала выбор одного или нескольких желаемых фармакодинамических ответов, затем использование ФК/ФД-модели для определения режима дозирования ЕРО, который обеспечивает желаемые ответы, и, наконец, выбор одного из режимов дозирования ЕРО для введения, позволяющего достичь желаемого фармакодинамического ответа. В дополнительном варианте ФД-ответ может включать в себя один или несколько параметров из группы, состоящей из количества ретикулоцитов, количества эритроцитов и уровня гемоглобина.
Дополнительный предпочтительный вариант данного изобретения может включать компьютерную программу, которую можно использовать для достижения оптимизированных режимов дозирования для желаемого фармакодинамического ответа. Компьютерная программа может включать в себя машинный код. В дополнительном варианте, машинный код описывает ФК/ФД-модель для ЕРО и дает возможность пользователю выбрать один или несколько желаемых фармакодинамических ответов. Затем машинный код использует ФК/ФД-модель для определения режимов дозирования ЕРО, которые будут обеспечивать желаемые фармакодинамические ответы. Режим дозирования ЕРО можно вводить еженедельно или один раз каждые две недели, исходя из массы тела, дозы. Предпочтительно еженедельная доза ЕРО может включать в себя введение ЕРО в дозе 40000 МЕ/кг, и режим дозирования ЕРО один раз каждые две недели может включать в себя введение ЕРО в дозе примерно от 80000 до 120000 МЕ/кг. В дополнительном варианте ФД-ответ может включать в себя один или несколько параметров из группы, состоящей из количества ретикулоцитов, количества эритроцитов и уровня гемоглобина.
Альтернативный предпочтительный вариант данного изобретения может включать компьютерную программу для достижения оптимизированных режимов дозирования для желаемого фармакодинамического ответа. В дополнительном варианте компьютерная программа включает в себя машинный код. Машинный код дает возможность пользователю выбрать один или несколько режимов дозирования ЕРО. Затем машинный код использует ФК/ФД-модель для определения фармакодинамического ответа на основании выбранных режимов дозирования ЕРО.
Предпочтительный вариант данного изобретения может включать компьютерную программу для определения оптимизированных режимов дозирования для желаемого фармакокинетического ответа, включающую в себя этапы выбора одного или нескольких режимов дозирования ЕРО, использование ФК/ФД-модели для определения фармакокинетического ответа режимов дозирования ЕРО, и затем выбор желаемого режима дозирования ЕРО на основании фармакокинетического профиля, в особом варианте на основании одного или нескольких ЕРО или ЕРО-подобных соединений. В дополнительном варианте фармакокинетический ответ может включать в себя уровни ЕРО в сыворотке, биодоступность и пороговые уровни ЕРО.
Следующий вариант данного изобретения может включать способ достижения оптимизированных режимов дозирования ЕРО для желаемого фармакокинетического ответа, который включает в себя этапы сначала выбора одного или нескольких желаемых фармакокинетических ответов, затем использования ФК/ФД-модели для определения режима дозирования ЕРО, который обеспечивает один или несколько желаемых фармакокинетических ответов, и, наконец, выбора режима дозирования, который обеспечивает желаемые фармакокинетические ответы.
Дополнительный вариант данного изобретения может включать компьютерную программу для достижения оптимизированных режимов дозирования для желаемого фармакокинетического ответа, которая включает в себя машинный код, который описывает ФК/ФД-модель для ЕРО. В дополнительном варианте машинный код дает возможность пользователю выбрать один или несколько фармакокинетических ответов и затем использует ФК/ФД-модель для определения режимов дозирования ЕРО, которые обеспечивают желаемые фармакокинетические ответы.
Альтернативный предпочтительный вариант данного изобретения может включать компьютерную программу для достижения оптимизированных режимов дозирования для желаемого фармакокинетического ответа. В дополнительном варианте компьютерная программа включает в себя машинный код. Машинный код дает возможность пользователю выбрать один или несколько режимов дозирования ЕРО. Затем машинный код использует ФК/ФД-модель для определения фармакокинетического ответа на основании выбранных режимов дозирования ЕРО. Можно рассчитывать на использование одного или нескольких ЕРО или ЕРО-подобных соединений.
Другой предпочтительный вариант данного изобретения включает в себя ряд способов, включая бизнес-способ предоставления потребителю режима дозирования ЕРО, который включает в себя первую дозу ЕРО с последующей второй дозой ЕРО для пациента. Вторую дозу ЕРО предпочтительно вводят пациенту во временной точке после первой дозы, которая совпадает с ФД-профилем, полученным от первой дозы ЕРО. ФД-профиль может включать количество продуцируемых клеток-предшественников относительно времени, концентрацию ретикулоцитов относительно времени, количество продуцируемых эритроцитов относительно времени и концентрацию гемоглобина относительно времени. Наиболее предпочтительно ФД-профиль будет представлять собой профиль ретикулоцитов для данного режима. Вторую дозу ЕРО предпочтительно вводят так, чтобы она совпала с профилем ретикулоцитов, т.е. когда продукция ретикулоцитов достигает пика. Вторая доза ЕРО способствует созреванию юных эритроцитов в циркулирующей крови до зрелых эритроцитов.
Дополнительный вариант данного изобретения включает бизнес-способ предоставления пациенту режима дозирования ЕРО, который включает в себя первую дозу ЕРО с последующей второй дозой ЕРО для пациента. Вторую дозу вводят пациенту в момент времени после первой дозы, который совпадает с профилем ретикулоцитов пациента. Вторую дозу можно вводить в пределах от 6 до 10 дней после первой дозы. Предпочтительно вторую дозу будут вводить через 7 дней после первой дозы ЕРО.
Бизнес-способ согласно данной заявке относится к коммерческому и другим применениям методологий данного изобретения. В одном аспекте биснез-способ включает маркетинг, реализацию или лицензирование данных методологий в контексте предоставления потребителям, т.е. пациентам, практикующим медикам, поставщикам медицинским услуг и распространителям и производителям фармацевтических препаратов, режимов дозирования ЕРО, предоставляемых данным изобретением. Указанные режимы включают режимы дозирования ЕРО один раз в неделю и один раз каждые две недели.
Другой предпочтительный вариант данного изобретения обеспечивает способ создания фармакокинетической модели подкожного (п/к) введения ЕРО пациентам. Указанный способ может включать в себя получение фармакокинетических данных от пациентов, выбор уравнения, основанного на ФК-данных, собранных от пациентов, и подгонку уравнения в соответствии с ФК-данными. Кроме того, получение ФК-данных может включать в себя нормализацию значений концентрации ЕРО в сыворотке по собранным ФК-данным и создание временных профилей концентрации ЕРО в сыворотке, основанных на нормализованных данных. В следующем варианте ФК-данные могут быть нормализованы посредством получения сначала значений исходного уровня концентрации ЕРО в сыворотке по ФК-данным посредством усреднения значений концентрации ЕРО в сыворотке до введения дозы во множестве временных точек; затем получения значений концентрации ЕРО в сыворотке после п/к-введения ЕРО; затем получения нормализованных значений концентрации ЕРО в сыворотке вычитанием значений концентрации ЕРО перед введением дозы из значений концентрации ЕРО в сыворотке; и, наконец, подсчета средних нормализованных значений концентрации ЕРО в сыворотке в каждой временной точке.
В дополнительном варианте данного изобретения ФК-уравнение может включать в себя выбор уравнения Михаэлиса-Ментен. Можно сделать подгонку ФК-данных и ФК-уравнения с использованием, например, компьютерной программы ADAPT II и оценку параметров можно получить посредством использования наименьших квадратов посредством метода максимального подобия и обобщенной модели наименьших квадратов. В следующем варианте параметры можно выбрать из группы, состоящей из Vmax, Кm, Vd, Fr, τ (более низкие дозы) и τ (более высокие дозы).
Следующий вариант данного изобретения обеспечивает способ расчета биодоступности ЕРО после п/к введения ЕРО. Способ может включать в себя получение ФК-данных, расчет площади под кривой концентрации ЕРО в сыворотке (AUC) против дозы, нормализацию AUC по дозе и, наконец, получение уравнения посредством выполнения линейной регрессии ФК-данных.
Другой предпочтительный вариант данного изобретения обеспечивает способ создания фармакодинамической (ФД) модели после п/к введения ЕРО. Данный способ может включать в себя нормализацию концентраций ЕРО в сыворотке, получение ФД-данных, выбор ФД-модели, получение уравнения на основе ФД-модели и подгонку ФД-данных и ФД-уравнений. В дополнительном варианте нормализация концентраций ЕРО в сыворотке может включать в себя получение исходной концентрации ЕРО в сыворотке (Сbs) для каждой группы доз усреднением значений концентрации ЕРО в сыворотке перед введением дозы во множестве временных точек для каждой группы доз и затем корректировку Сbs добавлением Сbs к концентрации ЕРО в сыворотке, предсказанной ФК-моделью, и при этом скорректированная Сbs может быть использована как вынуждающая функция для ФД-анализа.
В следующем варианте ФД-данные могут быть получены посредством определения среднего количества клеток-предшественников, ретикулоцитов и эритроцитов и концентрации гемоглобина перед введением дозы, и затем получения профилей среднего количества ретикулоцитов, среднего количества эритроцитов и средней концентрации гемоглобина против времени в соответствии с дозой ЕРО.
В дополнительном варианте ФД-модель может включать в себя модель потери и продукции клеток. ФД-данные можно подогнать к уравнению модели, используя, например, компьютерную программу ADAPT II, и затем можно получить как оцениваемые, так и фиксированные параметры благодаря использованию наименьших квадратов посредством метода максимального подобия и обобщенной модели наименьших квадратов. Кроме того, оцениваемые параметры могут включать Ks, SC50 и ТР, тогда как фиксированные параметры могут включать RL, RBCL, Hb и пороговую величину.
Следующий предпочтительный вариант данного изобретения может обеспечивать способ предсказания ФД-ответа у пациента после разных п/к доз ЕРО. Кроме того, данный способ может включать в себя выбор дозы и режима дозирования и затем определение ФД-ответа, основанного на такой конкретной дозе и режиме дозирования, посредством ФК/ФД-модели. В дополнительном варианте ФД-ответ может включать в себя один или несколько параметров из группы, состоящей из количества ретикулоцитов, количества красных кровяных клеток и уровня гемоглобина.
Данное изобретение может быть направлено на удовлетворение потребностей пациентов, у которых может продуцироваться дефицитный или неэффективный в отношении уровня гемоглобина ЕРО, что может быть связано с некоторыми формами анемии. Такие формы могут включать, но не ограничиваются этим, анемию, связанную с конечной стадией заболевания почек или анемию, связанную с почечной недостаточностью, анемию, связанную с химиотерапией злокачественных опухолей препаратами платины, анемию, связанную с лекарственной терапией СПИД, при которой лекарственные средства могут включать цисплатин и зидовудин. Пациенты также могут подвергаться аутологичной трансфузии перед операцией, восстанавливаться после аллогенного трансплантата костного мозга, страдать ревматоидным артритом или относиться к атлетам или иным категориям людей, нуждающихся или желающих увеличить количество эритроцитов и/или содержание гемоглобина.
ФК/ФД-модель согласно данному изобретению имеет много потенциальных терапевтических применений. Например, врач может использовать данную систему ФК/ФД-моделирования, чтобы определить оптимальный режим дозирования ЕРО для введения пациенту, нуждающемуся в повышенном количестве эритроцитов и/или гемоглобина. В частности, врач мог бы иметь выбор либо определения режима дозирования ЕРО на основании желаемого фармакодинамического результата, либо определения фармакодинамического ответа на основании конкретного режима дозирования ЕРО.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1: Процесс эритропоэза.
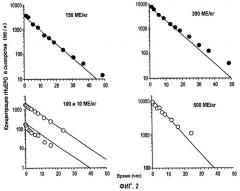
Фигура 2: Профили концентрации rHuEPO против времени после внутривенного введения пяти указанных уровней доз. Данные для доз 150 и 300 МЕ/кг представляют собой средние величины, полученные для шести здоровых субъектов исследования, тогда как другие дозы представляют данные от одного субъекта исследования. Кружки представляют данные, скорректированные относительно концентраций ЕРО исходного уровня, тогда как сплошные линии получены из подгонки данных и уравнений 1, 2 и 3, приведенных ниже.
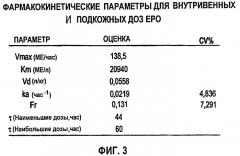
Фигура 3: Фармакокинетические параметры для внутривенных и подкожных доз ЕРО.
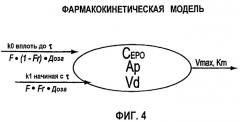
Фигура 4: Схематичное представление фармакокинетической модели согласно данному изобретению, используемой для анализа профилей rHuEPO (CEPO) против времени. Определения используемых символов даны в разделе определений детального описания изобретения ниже.
Фигура 5А: Профили концентрации rHuEPO против времени после подкожного введения доз, равных 300, 450, 600 и 900 МЕ/кг. Точки ввода данных для каждой дозы представляют собой средние значения для пяти здоровых субъектов исследования. Данные скорректированы относительно концентраций ЕРО исходного уровня, тогда как сплошная линия получена из подгонки данных и уравнений 1,2 и 3.
Фигура 5В: Профили концентрации rHuEPO против времени после подкожного введения доз, равных 1200, 1350, 1800 и 2400 МЕ/кг. Точки ввода данных для каждой дозы представляют собой средние значения для пяти здоровых субъектов. Данные скорректированы относительно концентраций ЕРО исходного уровня, тогда как сплошная линия получена из подгонки данных и уравнений 1,2 и 3.
Фигура 6: Площадь под кривой временной зависимости концентрация rHuEPO в сыворотке (AUC) против дозы после подкожного введения восьми уровней доз, указанных на фигурах 4А и 4В. AUC рассчитывали методом Spline.
Фигура 7: Биодоступность (F) rHuEPO против дозы после подкожного ведения восьми указанных уровней доз. Значения F получали из первичных подгонок фармакокинетических данных к модели, как объясняется в тексте. Линейная регрессия давала r2 0,9713, наклон 0,00024952 и точку пересечения 0,3884.
Фигура 8: Значения биодоступности при подкожном введении rHuEPO.
Фигура 9: Профили концентрации rHuEPO в сыворотке против времени в ходе режимов многократного дозирования 150 МЕ/кг т.р.н. (вверху) и 600 МЕ/кг/неделю (внизу). Закрашенные кружки представляют средние данные, в то время как линии представляют значения, предсказанные в модели.
Фигура 10: Схематичное представление фармакодинамической модели, используемой для анализа ретикулоцитов, эритроцитов и концентраций гемоглобина. Определения используемых символов даны в разделе определений детального описания изобретения ниже.
Фигура 11: Профили среднего количества ретикулоцитов против времени для восьми указанных уровней подкожных доз rHuEPO.
Фигура 12А: Профили количества ретикулоцитов против времени после подкожного введения доз, равных 300, 450, 600 и 900 МЕ/кг. Данные для каждой дозы представляют собой средние значения для пяти здоровых субъектов исследования. Символы показывают экспериментальные данные, тогда как сплошные линии получали из подгонки данных и уравнений 4, 5, 6 и 7, представленных ниже.
Фигура 12В: Профили количества ретикулоцитов против времени после подкожного введения доз, равных 1200, 1350, 1800 и 2400 МЕ/кг. Данные для каждой дозы представляют собой средние значения для пяти здоровых субъектов. Символы означают экспериментальные данные, тогда как сплошные линии получали из подгонки данных и уравнений 4, 5, 6 и 7.
Фигура 13: Оцениваемые и задаваемые фармакодинамические параметры для воздействий ЕРО при подкожном введении.
Фигура 14: Профили концентрации гемоглобина против времени после однократного подкожного введения восьми указанных уровней доз rHuEPO. Закрашенные кружки представляют средние данные, тогда как сплошные линии означают предсказания в модели.
Фигура 15: Ответы, выраженные в количестве ретикулоцитов, эритроцитов и гемоглобина, после многократного подкожного дозирования 150 МЕ/кг т.р.н. rHuEPO. Закрашенные кружки представляют измеренные данные, и сплошные линии представляют предсказания в модели.
Фигура 16: Ответы, выраженные в количестве ретикулоцитов, эритроцитов и гемоглобина, после многократного дозирования 600 МЕ/кг/неделю rHuEPO. Закрашенные кружки представляют измеренные данные, и сплошные линии представляют предсказания в модели.
Фигура 17: Краткое описание клинических фармакокинетических исследований эпоэтина-альфа, которые внесли вклад в фармакокинетические и фармакодинамические данные для субъектов исследования в клинических исследованиях EPO-PHI-358, EPO-PHI-359, EPO-PHI-370 и EPO-PHI-373.
Фигура 18А: Краткое описание биофармацевтического исследования в ходе клинического исследования EPO-PHI-373.
Фигура 18В: Краткое описание биофармацевтического исследования в ходе клинического исследования EPO-PHI-370.
Фигура 18С: Краткое описание биофармацевтического исследования в ходе клинического исследования EPO-PHI-358.
Фигура 18D: Краткое описание биофармацевтического исследования в ходе клинического исследования EPO-PHI-359.
Фигура 19: Сводные фармакокинетические данные для клинических исследований EPO-PHI-358, EPO-PHI-359, EPO-PHI-370 и EPO-PHI-373.
Фигура 20: Краткое описание аналитических способов для клинических исследований EPO-PHI-358, EPO-PHI-359, EPO-PHI-370 и EPO-PHI-373.
Фигура 21: Средние±3D демографические и исходные параметры для субъектов, включенных в клинические исследования EPO-PHI-358 и EPO-PHI-359.
Фигура 22: Временные профили средней концентрации эпоэтина-альфа в сыворотке (не корректировали относительно ЕРО исходного уровня) для субъектов клинического исследования EPO-PHI-358.
Фигура 23: Временные профили средней концентрации эпоэтина-альфа в сыворотке (не корректировали относительно ЕРО исходного уровня) для субъектов клинического исследования EPO-PHI-359.
Фигура 24: Средние±3D (%CV) фармакокинетические параметры (клинические исследования EPO-PHI-358 и EPO-PHI-359).
Фигура 25: Взаимосвязь между средним значением±SD Сmax и дозой для субъектов, получавших однократный или многократный п/к режим дозирования в клинических исследованиях EPO-PHI-358 и EPO-PHI-359.
Фигура 26: Взаимосвязь между средним значением±SD CL/F и дозой для субъектов, получавших однократный или многократный п/к режим дозирования в клинических исследованиях EPO-PHI-358 и EPO-PHI-359.
Фигура 27: Временные профили среднего процента ретикулоцитов для четырехнедельного периода исследования (клинические исследования EPO-PHI-358 и EPO-PHI-359).
Фигура 28: Среднее изменение±SD в количестве гемоглобина относительно профилей исходного уровня после введения эпоэтина-альфа 150 МЕ/кг т.р.н. (N=5) и 600 МЕ/кг р.н. (N=5) в течение четырех недель (клинические исследования EPO-PHI-358 и EPO-PHI-359).
Фигура 29: Демографические данные субъектов клинического исследования EPO-PHI-370.
Фигура 30: Временные профили средней концентрации в сыворотке эпоэтина-альфа (не корректировали относительно исходного уровня ЕРО) у здоровых субъектов после получения 150 МЕ/кг т.р.н. (N=24) или 40000 ME р.н. (N=22) в течение четвертой недели дозирования (клиническое исследование EPO-PHI-370).
Фигура 31: Средние±SD (%CV) фармакокинетические параметры (клиническое исследование EPO-PHI-370).
Фигура 32: Профиль среднего изменения процента ретикулоцитов относительно исходного уровня.
Фигура 33: Профиль среднего изменения гемоглобина (г/дл) относительно исходного уровня.
Фигура 34: Средние±SD (%CV) фармакокинетические параметры, скорректированные относительно значения исходного уровня (клиническое исследование EPO-PHI-370).
Фигура 35: Средние±SD демографические данные субъектов клинического исследования EPO-PHI-373.
Фигура 36: Временные профили средней концентрации в сыворотке эпоэтина-альфа (не корректировали относительно исходного уровня ЕРО) у здоровых субъектов после получения 150 МЕ/кг т.р.н. (N=17) или 40000 ME р.н. (N=17) в течение четвертой недели дозирования (клиническое исследование EPO-PHI-373).
Фигура 37: Средние±SD (%CV) фармакокинетические параметры, скорректированные относительно значения исходного уровня (клиническое исследование EPO-PHI-373).
Фигура 38: Профиль среднего изменения процента ретикулоцитов относительно исходного уровня для субъектов клинического исследования EPO-PHI-373.
Фигура 39: Профиль среднего изменения гемоглобина (г/дл) относительно исходного уровня для субъектов клинического исследования EPO-PHI-373.
Фигура 40: Профиль среднего изменения общего количества красных кровяных клеток (×102/л) относительно исходного уровня для субъектов клинического исследования EPO-PHI-373.
Фигура 41: Средние±SD (%CV) фармакокинетические параметры, скорректированные относительно значения исходного уровня для субъектов клинического исследования EPO-PHI-373.
Фигура 42: Средние + SD (%CV) фармакокинетические параметры, скорректированные относительно значения исходного уровня для субъектов клинических исследований EPO-PHI-358, ЕРО-PHI-359, EPO-PHI-370 и EPO-PHI-373.
Фигура 43: Средняя AUC изменений процента ретикулоцитов как функция AUC (дни 0-29) эпоэтина-альфа (клинические исследования EPO-PHI-358 и EPO-PHI-359).
Фигура 44: Средняя AUC изменений процента ретикулоцитов как функция AUC (дни 0-29) эпоэтина-альфа (клинические исследования EPO-PHI-370 и EPO-PHI-373).
Фигура 45: Профиль среднего изменения уровня гемоглобина (г/дл) относительно исходного уровня для субъектов клинического исследования EPO-PHI-373.
Фигура 46: Профиль среднего изменения уровня гемоглобина (г/дл) относительно исходного уровня для субъектов клинического исследования EPO-PHI-370.
Фигура 47: Демографические и исходные характеристики 34 субъектов, которые прошли полное исследование ЕРО (EPO-PHI-373). 18 субъектов составляли часть группы 1, которым вводили режим дозирования ЕРО 150 МЕ/кг т.р.н., и 18 субъектов составляли часть группы 2, которым вводили ЕРО в дозе 40000 р.н. Демографические характеристики включают пол, возраст (годы), массу (кг), рост (см) и расу.
Фигура 48: Концентрации эпоэтина-альфа в сыворотке, не скорректированные относительно концентраций эндогенного эритропоэтина до введения дозы для субъектов группы 1 (150 МЕ/кг т.р.н), обозначенные треугольниками, и группы 2 (40000 ME р.н.), обозначенные кружками.
Фигура 49: Данные концентрации эпоэтина-альфа в сыворотке, скорректированные относительно концентраций эндогенного эритропоэтина до введения дозы для субъектов группы 1 (150 МЕ/кг т.р.н), обозначенные треугольниками, и группы 2 (40000 ME р.н.), обозначенные кружками.
Фигура 50: Средние (SD)[%CV] значения фармакокинетических параметров по данным для индивидуальных субъектов в группе 1 (150МЕ/кг т.р.н.) и группе 2 (40000 ME р.н.).
Фигура 51: Сводные данные среднего изменения (SD) процента ретикулоцитов относительно исходного уровня по дням исследования для эффективной популяции для всех субъектов в группах дозирования 1 (150 МЕ/кг т.р.н.) и группе 2 (