Способ определения примеси муки мягкой пшеницы в крупке (семолине) твердой пшеницы и в готовой продукции макаронной промышленности
Иллюстрации
Показать всеИзобретение относится к пищевой промышленности и может быть использовано для определения качества макаронных изделий и сырья для их изготовления. Для определения примеси муки мягкой пшеницы в крупке (семолине) твердой пшеницы осуществляют полимеразную цепную реакцию (ПЦР) на наличие специфичной для генома мягкой пшеницы (Т. destivum) последовательности ДНК. ПЦР проводят с использованием пары олигонуклеотидных праймеров, гомологичных области внешнего транскрибируемого спейсера высокоповторяющихся генов рибосомных РНК локуса NorD3, принадлежащего исключительно геному D мягкой пшеницы. По факту обнаружения в продуктах ПЦР соответствующей ДНК-последовательности размером 791 п.н. судят о загрязненности (“фальсифицированности”) крупки твердой пшеницы (Т. dirum) мукой из мягкой пшеницы. 3 ил.
Реферат
Изобретение относится к сфере пищевой промышленности, в частности к вопросу определения качества сырья для изготовления макаронных изделий и качества самих макаронных изделий, и может быть использовано на мукомольных комбинатах, хлебопекарных предприятиях и макаронных фабриках для оценки качества как поступающего сырья для производства макаронных изделий, так и готовой продукции.
Наилучшим сырьем для изготовления макаронных изделий является пшеница, в частности особый ее вид Пшеница твердая (Triticum durum). Преимущество твердой пшеницы по сравнению с обычным хлебным видом пшеницы (Пшеница мягкая, Triticum aestivum) заключается в том, что изделия из нее обладают значительно большей устойчивостью при варке и оставленные на некоторое время после варки в воде они не распадаются и не приобретают тестообразный характер. Известно также, что даже незначительные примеси мягкой муки существенно снижают качество макаронных изделий.
Существующие методы определения свойств семолины, идущей на изготовление макаронных изделий высокого качества, включают целый ряд этапов, таких как: определение крупности помола, зольности и цвета, содержания в ней белка или клейковины, а также мелких посторонних частиц [Ирвин Г.Н. Пшеница дурум и макаронные изделия // В кн.: Пшеница и оценка ее качества. - М.: Колос. - 1968. - С.459-475]. Кроме того, необходимо определение активности липоксидазы в семолине и реологических свойств макаронного теста. При отборе сырья для изготовления макаронных изделий обычно руководствуются, как правило, большинством из вышеприведенных показателей. Практически все они характеризуются достаточно высокой трудоемкостью, а также необходимостью проведения повторных анализов. При этом они не дают однозначного ответа на вопрос - есть ли в макаронной крупке из твердых пшениц примесь муки мягкой пшеницы, наличие которой приведет в дальнейшем к снижению качества готовых изделий. Весьма перспективным в этом направлении выглядит анализ качества сырья и готовой продукции на уровне ДНК.
Известно, что культурные формы пшениц являются полиплоидными видами. Определены их геномные формулы: так, тетраплоидный геном твердой пшеницы Triticum durum имеет обозначение ААВВ (АВ - для галоидного набора) и содержит в своем составе 28 хромосом, а мягкая пшеница Triticum aestivum представляет собой гексаплоидный вид с 42 хромосомами и галоидной геномной формулой ABD [Дорофеев В.Ф., Мигушова Э.Ф. Новое в эволюции и систематике пшеницы. // Докл. ВАСХНИЛ. - 1981, №2. - С.6-9.]
Таким образом, основное отличие твердой пшеницы от мягкой заключается в присутствии у последней 7-ми пар дополнительных хромосом, привнесенных в тетраплоидную форму в результате произошедшего ее спонтанного скрещивания с диплоидньм эгилопсом Aegilops tauschii, имеющим галоидный геном D. Очевидно, что обнаружение в семолине твердых пшениц примеси мягкой пшеницы может быть осуществлено на генном уровне путем детекции при помощи высокочувствительного метода ПЦР (полимеразной цепной реакции) определенного участка ДНК, присущего только хромосомам генома D.
Наиболее близким к предлагаемому нами способу такой детекции является определение “фальсифицированной” крупки из твердых пшениц, загрязненной мукой мягкой пшеницы, на основе способа определения D-генома у видов пшениц (заявка WO 98/04737, 05.02.98; PCT/GB 97/01988, 23.07.97; GBN 9615679.9, 25.07.96, C 12 Q 1/68), заключающегося в ПЦР-анализе экстракта ДНК из обработанного пищевого продукта на присутствие в нем нуклеотидной последовательности, характерной для D-генома и являющейся частью либо Dgas44 семейства последовательностей ДНК, высокоповторенных в D-геноме, либо PSR128 интрона, представленного одной копией [Bryan G.J., Dixon A., Gale M.D., Wiseman G. A PCR-based method for the detection of hexaploid bread wheat adulteration of durum wheat and pasta// J.Cereal Sci. 1998. - V.28. - P.135-145].
Серьезным недостатком прототипа является то, что при использовании последовательности Dgas44 возможна некоторая недостоверность анализа, обусловленная присутствием небольшого числа копий данной последовательности нуклеотидов в А- и В-геномах.
Целью предполагаемого изобретения является увеличение чувствительности, повышение достоверности при упрощении и ускорении как способа детекции примеси муки из мягкой пшеницы в макаронной крупке из твердой пшеницы, так и метода выделения ДНК из исследуемых образцов. Предлагаемый способ определения примеси мягкой пшеницы в макаронной крупке (семолине) твердой пшеницы и в готовой продукции макаронной промышленности основывается на выделении ДНК из вышеуказанных продуктов, определении с помощью ПЦР присутствия нуклеотидной последовательности, характерной для D-генома, присущего исключительно мягкой пшенице в сравнении с геномами А и В, характерными как для мягкой, так и для твердой пшеницы, отличает тем, что детекцию нуклеотидных последовательностей D-генома осуществляют при помощи ПЦР-анализа с геном-специфическими олигонуклеотидными праймерами и маркерной последовательности ДНК, обозначенной Dets791, где D - D-геном, ets - external transcribed spacer, 791 - размер амплифицируемого фрагмента ДНК в п.н., который отсутствует в геноме Triticum durum и на основании сравнительного анализа судят о наличии или отсутствии примеси мягкой пшеницы к твердой пшенице в сырье или готовой продукции макаронной промышленности.
В известной на дату подачи заявки на предлагаемое изобретение патентной и научно-технической литературе, научно-исследовательской практике не обнаружено совокупности признаков, аналогичной (тождественной или эквивалентной) заявляемой.
На основе сравнения известных нуклеотидных последовательностей области внешнего транскрибируемго спейсера рДНК NorDS-локуса мягкой пшеницы Triticum aestivum [Lassner M., Anderson О., Dvorak J. Hypervariation associated with a 12-nucleotide direct repeat and inferences on intergenomic homogenization of ribosomal RNA gene spacers based on DNA sequence of a clone from the wheat Nor-D3 locus // Genome. - 1987. - V.29. - P.770-781] с аналогичными участками рДНК локуса NorB2 пшеницы [Barker R.F., Harberd N.P., Jarvis M.G., Flavell R.B. Structure and evolution of the intergenic region in a ribosomal DNA repeat unit of wheat // J. Mol. Biol. - 1988. - V.201. - P.1-17] и являющейся донором генома А диплоидной пшеницы Triticum urartu [Вахитов В.А., Чемерис А.В., Ахметзянов А.А. Нуклеотидная последовательность межгенного и внешнего транскрибируемого спейсеров рДНК диплоидной пшеницы Triticum urartu Thum. ex Gandil. // Молекуляр. биология. - 1989. - Т.23. - С.441-448], было обнаружено, что между этими видами и локусами есть заметные различия, и к таким участкам были подобраны олигонуклеотидные прямой и обратный праймеры D1 и D2, ограничивающие участок внешнего транскрибируемого спейсера рДНК, специфичные только для D-генома. В процессе ПЦР с использованием данных праймеров нарабатывается фрагмент рДНК размером 791 п.н., что позволяет обнаружить присутствие ДНК мягкой пшеницы в составе муки из твердой пшеницы. В качестве позитивного контроля на наличие всех трех геномов (А, В и D) служил основной продукт амплификации ДНК размером 238 п.н., образующийся в процессе ПЦР с использованием пары праймеров АВ1 и АВ2, подобранных соответственно к участку субповторов межгенного спейсера и внешнего транскрибируемого спейсера ДНК. В качестве негативного контроля (на отсутствие генома D) проводится амплификация ДНК, выделенной из 100%-ной макаронной крупки Triticum durum. Наличие значительного количества копий генов рРНК (100-200 для D-генома) и вместе с тем полное отсутствие Dets791 фрагмента ДНК в геноме Triticum durum обеспечивает возможность легко установить примесь муки мягкой пшеницы. Проведенные эксперименты показывают высокую чувствительность этого способа и возможность обнаружения в макаронной крупке даже 0,1% примеси муки мягкой пшеницы.
Таким образом, предлагаемое решение в своей совокупности признаков отвечает критерию “изобретательский уровень”.
Предлагаемый способ определения примеси мягкой пшеницы в макаронной крупке (семолине) твердой пшеницы и в готовой продукции макаронной промышленности иллюстрируется фигурами 1-3.
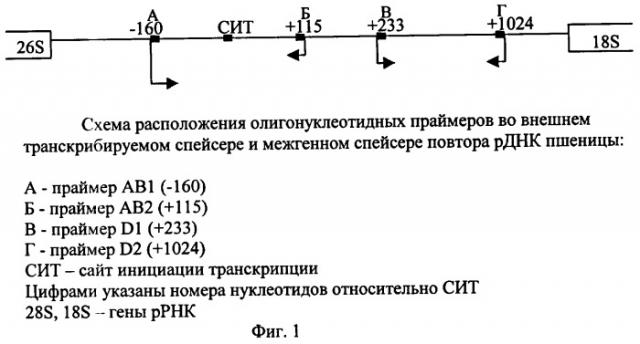
На фиг.1 дана схема расположения последовательностей олигонуклеотидных праймеров во внешнем транскрибируемом спейсере и межгенном спейсере повтора рДНК пшеницы, где А - праймер АВ1, Б - праймер АВ2, В - праймер D1, Г - праймер D2, СИТ - сайт инициации транскрипции.
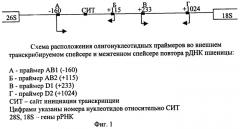
На фиг.2 дана электрофореграмма продуктов амплификации ДНК из разных образцов семолины, муки (и их смеси) пшениц в 1% агарозном геле, где 1, 2 - Д-2067 T.durum; 3, 4 - Лютесценс 62 (яровая) T.aestivum; 5, 6 - Саратовская 60 (яровая) T.aestivum; 7, 8 - Эритроспермум С-2108 (яровая) T.aestivum; 9, 10 - №20 (озимая) T.aestivum; 11, 12 - №29 (озимая) T.aestivum; 13 - T.durum+1% примеси T.aestivum; 14 - T.aestivum (контроль, выделенный из проростков пшеницы).
Образцы 1, 3, 5, 7, 9, 11 амплифицированы с помощью олигонуклеотидных праймеров АВ1 и АВ2, специфичных ко всем трем геномам А, В и D.
Образцы 2, 4, 6, 8, 10, 12, 13, 14 амплифицированы с помощью олигонуклеотидных праймеров D1 и D2, специфичных только к геному D (Dets791).
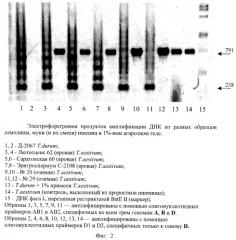
На фиг.3 дана электрофореграмма детекции D-генома в ПЦР-продуктах ДНК, выделенных из муки различных видов пшениц, а также макаронных изделий различных фабрик, где 1 - ДНК из муки мягкой пшеницы; 2 - ДНК из семолины твердой пшеницы (D-геном отсутствует); 3 - ДНК из семолины твердой пшеницы (контроль, АВ-геном); 4 - ДНК из макарон производителя 1 (D-геном отсутствует); 5 - ДНК из макарон производителя 1 (контроль, АВ-геном); 6 - ДНК из макарон производителя 2; 7 - ДНК из макарон производителя 3; 8 - ДНК из макарон производителя 4; 9 - Модельная смесь семолины, содержащей 1% искусственно добавленной примеси муки мягкой пшеницы (D- геном детектируется).
Выделение ДНК из проростков пшеницы, семолины, муки и макарон выполняли по методу Грахама [Graham D.E. The isolation of high molecular weight DNA from whole organisms or large tissue masses // Anal. Biochem. - 1978. - V.85. - P.609-613] следующим образом.
Навеску предварительно измельченных вышеназванных продуктов (100 мг) помещали в 1,5 мл полипропиленовую пробирку, микропестиком суспендировали в 5 объемах (500 мкл) экстрагирующего буфера (0,1М Tris-HCl, 10 мМ EDTA, 1% SDS). Нагревали на водяной бане при 60°С в течение 10 мин, периодически встряхивая пробирку. Охлаждали до комнатной температуры и добавляли перхлорат натрия до 1М (100 мкл 5М NaClO4). Затем проводили депротеинизацию полученного раствора встряхиванием с равным объемом смеси фенол-хлороформа (1:1), последующим центрифугированием в микроцентрифуге при 14 тыс. об/мин в течение 5 мин и отбором верхней фазы. Эту операцию проводили повторно до полного исчезновения интерфазы, последний цикл проводили только с хлороформом. ДНК из верхней водно-солевой фазы осаждали двумя объемами 96% этанола. Осадок ДНК собирали центрифугированием после выдерживания в течение 1 часа при -70°С или в течение 1 мин в жидком азоте (-196°С). Полученный осадок промывали 70% этанолом. Подсушенный на воздухе осадок растворяли в 100 мкл дистиллированной воды. Полученную экстрагированную ДНК использовали для последующего анализа при помощи полимеразной цепной реакции.
Для сравнения составляли искусственно “фальсифицированную” муку из крупки твердой пшеницы с примесью мягкой пшеницы.
Для выделения ДНК из искусственно смешанных макаронной крупки и муки, с целью достижения одинаковой экстрагируемости ДНК, крупку твердой пшеницы предварительно измельчали в фарфоровой ступке до гомогенного порошкообразного состояния, идентичного обычной муке мягкой пшеницы. После этого смешивали 10 г такой измельченной крупки твердой пшеницы с 0,1 г и 0,01 г муки сорта мягкой пшеницы для получения примеси в 1% и 0,1% соответственно. ДНК из таким образом искусственно созданных смесей выделяли, как описано выше. Аналогично макаронные изделия (100 мг) до выделения ДНК измельчали до мелкодисперсного состояния.
В имеющемся запатентованном способе детекции фальсифицированной муки ДНК из готовых макаронных изделий, приготовленных из предварительно смешанных образцов муки из твердой и мягкой пшениц, экстрагировали следующим образом. Муку из 5 г макаронных изделий, приготовленную на мельнице, помещали в 50 мл полипропиленовую пробирку, добавляли 20 мл буфера S (Tris-HCl, pH 8,5; 100 мМ NaCl, 50 мМ EDTA, 2% SDS). Все тщательно перемешивали. К смеси добавляли 100 мкл протеиназы К (исходной концентрации 10 мг/мл до конечной концентрации 0,05 мг/мл). Пробирку в течение 1-2 часов инкубировали при 65°С при перемешивании. Депротеинизацию проводили смесью фенол-хлороформ с изоамиловьм спиртом (24:1). Центрифугировали 20 мин при 2000 об/мин, отбирали верхнюю водную фазу и при необходимости повторяли эту процедуру. Затем к водной фазе добавляли 0,6 объема пропанола, перемешивали и высаживали ДНК центрифугированием при 4°С при 10 тыс. об/мин. Промывали ДНК осадок ДНК 70% этанолом и подсушивали на воздухе. Суспендировали ДНК в 5 мл ТЕ-буфера. Затем добавляли раствор РНКазы, свободной от ДНКазы, и инкубировали 1 час при 37°С. Проводили повторную экстракцию фенол-хлороформом (5 мл) и хлороформом. К водной фазе добавляли 10% объема раствора ацетата аммония до конечной концентрации 0,3 М и 2 объема 96% этанола. Выдерживали 2 часа при - 70°С. После центрифугирования при 10 тыс. об/мин (4°С), промывания 70% этанолом, подсушивания на воздухе, осадок растворяли в 2 мл ТЕ-буфера. (Раствор хранили замороженным при -20°С). Аликвоты ДНК очищали методом хроматографии. Очищенную ДНК растворяли до рабочей концентрации 20 нг/мкл. Полученную таким образом ДНК анализировали методом ПЦР.
Определение присутствия нуклеотидной последовательности ДНК, характерной для D-генома, проводили методом полимеразной цепной реакции.
ПЦР проводили в 20 мкл реакционной смеси, содержащей:
1 мкл ДНК; 2 мкл 10-кратного буфера для Taq-полимеразы; 8 мкл смеси 4-х дезоксинуклеотидтрифосфатов (дАТФ, дГТФ, дЦТФ и ТТФ по 0,2 мМ каждого);
1 мкл прямого праймера (0,005 о.е.), 1 мкл обратного праймера (0,005 о.е.), 0,5 мкл Taq-полимеразы (1 ед. активности), 6,5 мкл Н2O.
Для детекции последовательности Dets791 D-генома в качестве прямого и обратного брали пару праймеров D1 (5'-acggtaaacagtcgcaacggtgtg-3') и D2 (5'-aggatcggcgcagagagtcgca-3'). Для контрольной (позитивной) амплификации (А-, В- и D-геномы) брали пару праймеров АВ1 (5'-cgcgcgccatggaaaactgg-3') и АВ2 (5'-gacgggacatccgaggcaac-3') (фиг.1).
ПЦР проводили при следующих условиях: денатурация двуцепочечной ДНК - 94°С, 30 сек, отжиг праймеров - 55°С, 1 мин, элонгация цепи - 72°С, 1 мин, количество циклов - 25.
Авторы сравниваемого патента использовали достаточно сложную программу ПЦР, задающую постепенное снижение температуры отжига с 62°С до 52°С, для снижения неспецифического связывания праймеров с ДНК-матрицей. Количество циклов варьировало от 25 до 40.
Затем осуществляли электрофорез ПЦР-фрагментов в агарозном геле (фиг.2 и 3).
Продукты полимеразной цепной реакции, в том числе контрольные, анализировали в 1%-ном агарозном геле. Для определения размеров использовали специально приготовленную маркерную ДНК фага лямбда, расщепленную рестрикционной эндонуклеазой BstEII.
Обсуждение
Таким образом, предлагаемый нами метод детекции загрязнения муки из твердых пшениц мукой мягких пшениц имеет следующие преимущества перед уже имеющимся методом. Во-первых, на стадии выделения ДНК из образцов существенно сокращается время экстракции ДНК за счет отсутствия стадий обработки образцов протеиназой К, РНКазой, повторной депротеинизации фенол-хлороформом, а также очистки аликвот ДНК хроматографией. При этом степень чистоты получаемой нами ДНК является достаточной для проведения ПЦР-анализа.
Во-вторых, предлагаемый нами способ имеет преимущества в использовании многокопийной последовательности Dets791, однозначно детектирующей D-геном. Авторы сравниваемого патента использовали многокопийную последовательность Dgas44 для установления факта “загрязнения”, но при этом они наблюдали так называемую “кросс-реакцию” с А- и В-геномами.
В-третьих, при проведении полимеразной цепной реакции нет необходимости использовать сложную программу, в которой задается поэтапное снижение температуры отжига, позволяющее достичь эффекта снижения неспецифического связывания праймеров с матрицей ДНК (однако, тем не менее, не исключающее его полностью в сравниваемом патенте), так как в нашем случае обеспечивается полная гомогенность получаемого продукта (фрагмента ДНК) при заданной температуре отжига.
В целом, патентуемая процедура проведения анализа качества муки или готовых изделий из нее достаточно проста и краткосрочна при выполнении.
Литература, принятая во внимание
Вахитов В.А., Чемерис А.В., Ахметзянов А.А. Нуклеотидная последовательность межгенного и внешнего транскрибируемого спейсеров рДНК диплоидной пшеницы Triticum urartu Thum. ex Gandil. // Молекуляр. биология. - 1989. - Т.23. - С.441-448.
Дорофеев В.Ф., Мигушова Э.Ф. Новое в эволюции и систематике пшеницы. Докл. ВАСХНИЛ. - 1981, №2. - С.6-9.
Ирвин Г.Н. Пшеница дурум и макаронные изделия // В кн.: Пшеница и оценка ее качества. - М.: Колос. - 1968. - С.459-475.
Barker R.F., Harberd N.P., Jarvis M.G., Flavell R.B. Structure and evolution of the intergenic region in a ribosomal DNA repeat unit of wheat // J. Mol. Biol. - 1988. - V.201. - P.1-17.
Bryan G.J., Dixon A., Gale M.D., Wiseman G. A PCR-based method for the detection of hexaploid bread wheat adulteration of durum wheat and pasta // J. Cereal Sci. 1998. - V.28. - P.135-145.
Graham D.E. The isolation of high molecular weight DNA from whole organisms or large tissue masses // Anal. Biochem. - 1978. - V.85. - P.609-613.
Lassner M., Anderson O., Dvorak J. Hypervariation associated with a 12-nucleotide direct repeat and inferences on intergenomic homogenization of ribosomal RNA gene spacers based on DNA sequence of a clone from the wheat Nor-D3 locus // Genome. - 1987. - V.29. - P.770-781.
Murai J., Taira Т., Ohta D. Isolation and characterisation of the three Waxy genes encoding the granule-bound strach synthase in hexaploid wheat // Gene. 1999. - V.234. - P.71-79.
Wiseman G., Bryan G.J., Gale M.D. 1998. Detection of D genome in wheat species //Patent WO 98/04737.
Yan L., Bhave M., Fairclough R., Konik C., Rahman S., Appels R. The genes encoding granule-bound starch synthases at the waxy loci of the A, B, and D progenitors of common wheat // Genome. - 2000. V.43. - P.264-272.
Способ определения примеси муки мягкой пшеницы в крупке (семолине) твердой пшеницы и в готовой продукции макаронной промышленности, отличающийся использованием при анализе ДНК данных продуктов пары специфичных олигонуклеотидных праймеров, гомологичных области внешнего транскрибируемого спейсера высокоповторяющихся генов рибосомных РНК локуса NorD3, принадлежащего исключительно геному D, присущему только мягкой пшенице, что позволяет по факту обнаружения в продуктах амплификации исследуемой ДНК фрагмента размером 791 пара нуклеотидов однозначно судить о наличии примеси муки мягкой пшеницы в макаронной крупке или в макаронном изделии.