Пиразолбензодиазепины в качестве ингибиторов cdk2, промежуточные соединения для их получения и фармацевтическая композиция, их содержащая
Иллюстрации
Показать всеНастоящее изобретение относится к новым пиразолобензодиазепинам, имеющим формулу:
где R1 означает водород, -NO2, -CN, галоид, -OR5, -COOR7, -CONR8R9, -NR10R11, -NHCOR12, -NHSO2R13; R2 и R4 каждый независимо друг от друга означает водород, галоид, -NO2, -CF3; R3 означает водород, циклоалкил, содержащий 3-8 атомов углерода, арил, представляющий собой ароматическую группу, содержащую 6-10 атомов углерода и состоящую из 1 или 2 колец, гетероарил, имеющий 5-10 атомов, 1 или 2 кольца и содержащий 1-3 гетероатома, выбранных из N, О и S, -COOR7, -CN, алкенил, имеющий 2-6 атомов углерода, -CONR8R9, или алкил, имеющий 1-6 атомов углерода, который необязательно замещен группой OR9, F или вышеуказанным арилом; R5 означает алкил, имеющий 1-6 атомов углерода; R7 означает водород или алкил, имеющий 1-6 атомов углерода; R8 и R9 каждый независимо друг от друга означает водород или алкил, имеющий 1-6 атомов углерода, который необязательно замещен гидроксигруппой или NH2; альтернативно R8 и R9 могут образовать морфолиногруппу; R10, R11 и R12 каждый независимо друг от друга означает водород или алкил, имеющий 1-6 атомов углерода; R13 означает алкил, имеющий 1-6 атомов углерода, который необязательно замещен галоидом или -NR14R15; R14 и R15 каждый независимо друг от друга означает водород или алкил, имеющий 1-6 атомов углерода, который необязательно замещен галоидом, или альтернативно -NR14R15 означает морфолиногруппу; или фармацевтически приемлемым солям упомянутых выше соединений. Кроме того, изобретение относится к определенным производным пиразолобензодиазепина, промежуточным тиолактамам для получения соединений формулы (I) и фармацевтической композиции на их основе. Соединения согласно изобретению и фармацевтическая композиция их содержащая ингибируют циклинзависимые киназы CDK2. Они являются антипролиферативными агентами, применяемыми в лечении или контроле нарушений клеточной пролиферации, в частности опухолей грудной железы, ободочной кишки, легкого и предстательной железы. 5 н. и 15 з.п. ф-лы, 16 табл.
Реферат
Настоящее изобретение относится к новым пиразолбензодиазепинам, обладающим способностью ингибировать циклинзависимые киназы (CDK), прежде всего CDK2. Эти соединения и их фармацевтически приемлемые соли, а также пролекарства указанных соединений представляют собой антипролиферативные агенты, которые могут применяться для лечения или приостановления развития болезней, связанных с пролиферацией клеток, прежде всего рака. Изобретение относится также к фармацевтическим композициям, содержащим такие соединения, и к способам лечения и/или предупреждения рака, прежде всего для лечения или приостановления развития солидных опухолей. Предпочтительно соединения по изобретению могут применяться для лечения или приостановления развития опухолей грудной железы, ободочной кишки, легкого или предстательной железы. Изобретение относится также к промежуточным продуктам, которые могут применяться для получения указанных выше антипролиферативных агентов.
Неконтролируемая пролиферация клеток является отличительным признаком рака. Клетки раковых опухолей обычно характеризуются определенной формой нарушения генов, которые прямо или косвенно регулируют цикл клеточного деления.
Циклинзависимые киназы (CDK) представляют собой ферменты, которые имеют решающее значение для контроля клеточного цикла. Эти ферменты регулируют переходы между различными фазами клеточного цикла, например переход от фазы G1 к фазе S (период активного синтеза ДНК) или переход от фазы G2 к фазе М, при которой происходит активный митоз и деление клеток.
CDK состоят из каталитической субъединицы CDK и регуляторной циклиновой субъединицы. Циклиновая субъединица является наиболее важным регулятором активности CDK, при этом каждая CDK взаимодействует с определенным поднабором циклинов: например, с циклином A (CDK1, CDK2). Различные пары киназа/циклин регулируют прохождение через определенные стадии клеточного цикла.
Нарушения системы контроля клеточного цикла приводят к неконтролируемому росту раковых клеток. Имеется обширная литература, посвященная применению соединений, обладающих способностью ингибировать CDK, в качестве антипролиферативных терапевтических агентов.
Настоящее изобретение относится к пиразолбензодиазепинам, обладающим способностью ингибировать активность одной или нескольких CDK, прежде всего CDK2. Такие соединения могут применяться для лечения рака, прежде всего твердых опухолей. В частности, соединения по настоящему изобретению предпочтительно могут применяться для лечения или приостановления развития опухолей грудной железы, ободочной кишки, легкого и предстательной железы. Изобретение относится также к промежуточным соединениям, которые могут применяться при получении вышеуказанных пиразолбензодиазепинов.
Соединения по настоящему изобретению имеют формулу I, приведенную ниже
где
R1 означает водород, -NO2, -CN, галоид, -OR5, -R6OR7, -COOR7, -CONR8R9, -NR10R11, -NHCOR12, -NHSO2R13 или линейный (низш.)алкил, который необязательно замещен гидроксигруппой и/или галоидом;
R2 и R4 каждый независимо друг от друга означает водород, галоид, -NO2, -СF3 или линейный (низш.)алкил;
R3 означает водород, циклоалкил, арил, гетероциклил, гетероарил, -COOR7, -CN, алкенил, -CONR8R9, алкинил или (низш.)алкил, который необязательно замещен гидроксигруппой, OR9, F и/или арилом;
R5 означает (низш.)алкил, который необязательно замещен галоидом;
R6 означает (низш.)алкил;
R7 означает водород или (низш.)алкил;
R8 и R9 каждый независимо друг от друга означает водород или (низш.)алкил, которые необязательно замещены гидроксигруппой и/или -NH2; альтернативно R8 и R9 могут образовать пяти- или шестичленный гетероцикл, который необязательно замещен гидроксигруппой, -NH2 и/или (низш.)алкилом;
R10, R11 и R12 каждый независимо друг от друга означает водород или (низш. )алкил;
R13 означает (низш.)алкил, который необязательно замещен галоидом и/или -NR14R15; и
R14 и R15 каждый независимо друг от друга означает водород или (низш.)алкил, который необязательно замещен галоидом, или альтернативно -NR14R15 означает гетероциклил.
Кроме того, изобретение относится к пролекарствам и фармацевтически активным метаболитам соединений формулы I и к фармацевтически приемлемым солям упомянутых выше соединений.
Кроме того, настоящее изобретение относится к применению соединений формулы I или пролекарств и фармацевтически активных метаболитов соединений формулы I и фармацевтически приемлемых солей упомянутых выше соединений в качестве медикаментов; и к фармацевтическим композициям, включающим фармацевтически эффективное количество одного или нескольких вышеописанных соединений или фармацевтически приемлемую соль пролекарства и фармацевтически приемлемый носитель или наполнитель.
Настоящее изобретение направлено также на применение соединений формулы I, пролекарств или фармацевтически активных метаболитов соединений формулы I или фармацевтически приемлемых солей упомянутых выше соединений в производстве препарата для лечения солидных опухолей, в частности опухолей грудной железы, ободочной кишки, легкого и предстательной железы, более конкретно опухолей грудной железы и ободочной кишки.
В контексте настоящего изобретения следующие термины будут иметь следующие значения.
Термин “арил” означает ароматическую группу, содержащую 6-10 атомов углерода и состоящую из 1 или 2 колец. Примеры арильных групп включают фенил и 1- или 2-нафтил.
Термин “алкенил” означает линейный или разветвленный замещенный или незамещенный алифатический ненасыщенный углеводород, имеющий 2-6, предпочтительно 2-4, атомов углерода и содержащий двойные связи. Типичные алкенильные группы включают этиленовую, пропиленовую, изопропиленовую, бутиленовую и тому подобное. Предпочтительные алкенильные группы являются линейными.
Термин “алкинил” означает линейный или разветвленный замещенный или незамещенный алифатический ненасыщенный углеводород, имеющий 2-6, предпочтительно 2-4 атомов углерода и содержащий тройные связи. Типичные алкинильные группы включают ацетиленовую группу и тому подобное. Предпочтительные алкинильные группы являются линейными.
Термин “циклоалкил” означает неароматическую, частично или полностью насыщенную циклическую алифатическую углеводородную группу, содержащую 3-8 атомов. Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил и циклогексил.
Термин “эффективное количество” означает количество по меньшей мере одного соединения формулы I или его фармацевтически приемлемой соли, пролекарства или метаболита, которое значительно подавляет пролиферацию опухолевых клеток, включая линии человеческих опухолевых клеток.
Термин “галоид” означает фтор, хлор, бром или йод. Предпочтительными галоидами являются фтор и хлор.
Термин “гетероарильные” группы означает ароматические группы, имеющие 5-10 атомов, один или 2 кольца и содержащие один или несколько гетероатомов. Примерами гетероарильных групп являются 2-, 3- или 4-пиридил, тетразолил, оксадиазолил, пиразинил, хинолил, пирролил и имидазолил.
Термин “гетероатом” означает атом, выбранный из N, О и S.
Термин “гетероциклил” означает 3-10-членную неароматическую, частично или полностью насыщенную углеводородную группу, такую как тетрагидрохинолил, которая содержит одно или два кольца и по меньшей мере один гетероатом.
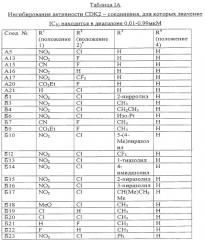
Термин “IC50” относится к концентрации конкретного пиразолобензодиазепина, необходимой для ингибирования 50% специфической измеряемой активности. Величина IС50 может быть измерена, среди прочего, как описано в примере 4 ниже.
Термин “(низш.)алкил” означает линейный или разветвленный, замещенный или незамещенный, насыщенный алифатический углеводород, содержащий 1-6, предпочтительно 1-4, атомов углерода. Типичные (низш.)алкильные группы включают метил, этил, пропил, изопропил, бутил, трет.-бутил, 2-бутил, пентил, гексил и тому подобное.
Термин “фармацевтически приемлемая соль” относится к обычным кислотно-аддитивным солям или к солям присоединения оснований, сохраняющим биологическую эффективность и свойства соединений формулы I и полученным из приемлемых нетоксичных органических или неорганических кислот либо органических или неорганических оснований. Пример кислотно-аддитивных солей включает соли, полученные из неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота и азотная кислота, и соли, полученные из органических кислот, таких как n-толуолсульфокислота, салициловая кислота, метансульфокислота, щавелевая кислота, янтарная кислота, лимонная кислота, яблочная кислота, молочная кислота, фумаровая кислота и тому подобное. Пример солей присоединения оснований включает соли, полученные из гидроксидов аммония, калия, натрия и четвертичного аммония, такие как, например, гидроксид тетраметиламмония.
Термин “фармацевтически приемлемый”, такой как фармацевтически приемлемые носитель, наполнитель, пролекарство и т.д., означает фармакологически приемлемые и фактически нетоксичные для субъекта, которому вводится отдельное соединение.
Термин “фармацевтически активный метаболит” означает продукт метаболизма соединения формулы I, который является фармацевтически приемлемым и эффективным.
Термин “пролекарство” относится к соединению, которое в физиологических условиях или путем сольволиза может превращаться в любое из соединений формулы I или в фармацевтически приемлемую соль соединения формулы I. Пролекарство может быть неактивным при введении субъекту, но in vivo превращаться в активное соединение формулы I.
Термин “замещенный”, как в замещенном алкиле, означает, что замещение может проходить по одному или нескольким положениям и что заместители в каждом положении замещения являются выбранными независимо друг от друга из определенных вариантов, если не указано иначе.
Соединения
В одном варианте воплощения настоящее изобретение направлено на соединения, имеющие формулу:
и пролекарства и фармацевтически активные метаболиты соединений формулы I и фармацевтически приемлемые соли упомянутых выше соединений, где R1 и R15 имеют описанные выше значения.
В предпочтительном варианте воплощения соединений формулы I R1 означает водород, -NO2, -CN, -CONH2, галоид или незамещенный (низш.)алкил. Предпочтительными (низш.)алкилами являются метил и этил. Более предпочтительно R1 означает -NO2, -CN или -CONH2. Предпочтительно R1 находится в положении 7 или 8.
В другом предпочтительном варианте воплощения соединений формулы I R2 находится в положении 2' и означает водород или галоид.
В другом предпочтительном варианте воплощения соединений формулы I R3 означает незамещенный (низш.)алкил, гидрокси(низш.)алкил, циклоалкил, гетероциклил или гетероарил. Предпочтительными (низш.)алкильными группами являются метил, этил и гидроксиметил. Предпочтительными циклоалкильными группами являются незамещенные группы С3-C5.
В другом предпочтительном варианте воплощения соединений формулы I R4 находится в положении 4' и означает водород или галоид, наиболее предпочтительно R4 означает водород.
В другом предпочтительном варианте воплощения соединений формулы I R5 и R6 означают независимо друг от друга метил, этил, каждый из которых необязательно может быть замещен галоидом. Более предпочтительно R5 означает трифторметил.
В другом предпочтительном варианте воплощения соединений формулы I R7 означает водород, метил или этил.
В другом предпочтительном варианте воплощения соединений формулы I R8 и R9 означает каждый независимо друг от друга водород, метил, этил или гидроксиэтил. Когда R8 и R9 образуют гетероцикл, предпочтительными гетероциклическими группами являются 6-членные незамещенные группы, которые наиболее предпочтительно включают два гетероатома. Наиболее предпочтительные гетероатомы выбирают из О и N.
В другом предпочтительном варианте воплощения соединений формулы I R10, R11 и R12 означает каждый независимо друг от друга водород, метил или этил.
В другом предпочтительном варианте воплощения соединений формулы I R13 означает (низш.)алкил, который необязательно может быть замещен водородом, наиболее предпочтительно R13 означает метил, этил или трифторметил.
В другом предпочтительном варианте воплощения соединений формулы I R14 и R15 означает каждый независимо друг от друга водород, метил, этил или гетероцикл. Предпочтительными гетероциклами являются 3-7-членные кольца, которые включают по меньшей мере один азот.
Следующие промежуточные производные являются также примерами дополнительных предпочтительных соединений по настоящему изобретению:
где
R1, R2 и R4 имеют приведенные выше значения;
и
где в каждой из непосредственно предшествующих формул каждый из R1, R2, R3 и R4 имеет значения, приведенные в описании ранее. Эти промежуточные производные применимы в синтезе соединений формулы I.
Соединения, раскрываемые в описании и защищаемые вышеприведенными формулами, могут обладать таутомерией или структурной изомерией. Предполагается, что изобретение охватывает любую таутомерную или изомерную структурную форму этих соединений или смеси этих форм и не ограничено какой-либо одной таутомерной или структурной изомерной формой, использованной выше при написании формул.
Синтез соединений формулы I
Соединения по изобретению могут быть получены способами, известными в этой области. Соответствующие способы синтеза этих соединений приведены в примерах. Как правило, эти соединения можно получать в соответствии с приведенными ниже схемами.
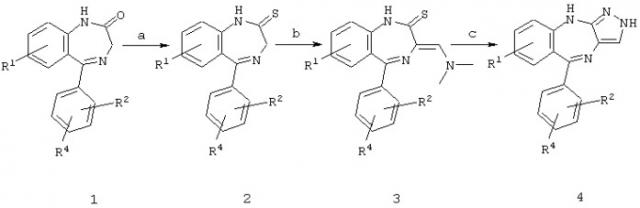
Схема 1
R3=H
а) реагент Лоуссона (известная реакция для большинства замещений);
б) реакция с Me2N-CH(OEt)2;
в) реакция с гидразином.
Соединение 1 или является коммерчески доступным, или его синтезируют способами, известными специалистам.
Схема 2
R3 не означает H
а) реагент Лоуссона (известная реакция для большинства замещений);
г) реакция с R3-CHO в присутствии основания, предпочтительно пиперидина;
в) реакция с гидразином;
д) окисление дигидропиразола в пиразол (в присутствии воздуха в ДМСО, от КТ до 150° С или в присутствии воздуха и основания (Cs2CO3/ДMФ).
Схема 3
Альтернативная схема, когда R3 не означает Н
а) реагент Лоуссона (известная реакция для большинства замещений);
е) реакция с R3-CHO в присутствии основания, предпочтительно диазабициклоундекана или 2,2,6,6-тетраметилпиперидина;
ж) дегидратация путем обработки слабой кислотой (пиридиниевой солью n-толуолсульфокислоты, пиридиниевой солью уксусной кислоты и т.д.);
в) реакция с гидразином;
д) окисление дигидропиразола в пиразол (в присутствии воздуха в ДМСО, от КТ до 150° С или в присутствии воздуха и основания (Сs2СО3/ДМФ).
Схема 4
Трансформация функциональных групп R1 или R3
где R1' может иметь любое из приведенных выше значений для R1, и подобным образом R3' может иметь любое из приведенных выше значений для R3.
Некоторые замещения могут быть осуществлены химической модификацией имеющихся функциональных групп с использованием известных способов, как представлено выше на схеме 4. Например, если требуемый R1=NH2, такое замещение может быть осуществлено восстановлением соответствующей нитрогруппы. Аналогично, если требуемый R1=NHR' (где R' означает -COR12, -SO2R13 или -R10R11), это замещение может быть осуществлено взаимодействием соответствующего соединения, в котором R1=NH2, с хлорангидридом или ангидридом кислоты. Если требуемый R1=CONRR'' (где R означает водород или (низш.)алкил и R'' означает (низш.)алкил), это замещение может быть осуществлено взаимодействием соответствующего соединения, в котором R1 означает йод, с моноксидом углерода и первичным или вторичным амином в присутствии палладиевого катализатора.
Кроме того, если R3 в исходном веществе означает -CO2Et, может быть использована стандартная химическая модификация для получения соединений, содержащих следующие соответствующие группы R3:
-СН2OН (восстановление); -СНО (частичное восстановление); -CH2NMe2 (восстановительное аминирование альдегида); -CH2OMe (алкилирование спирта); -СН=СН2 (олефинирование альдегида); -CONRR'' (где R означает Н или (низш.)алкил и R'' означает Н или (низш.)алкил, аминолиз с соответствующим амином HNRR'', в котором R означает Н или (низш.)алкил и R'' означает Н или (низш.)алкил); -CONHNHR (где R означает Н, (низш.)алкил или арил, гидразинолиз - реакция с гидразином); -CN (дегидратация амида -CONH2).
В предшествующих схемах соединение 1 или является коммерчески доступным, например от фирмы Sigma, или может быть легко синтезировано способами, известными специалистам. Так, соединение 2 получают из соответствующего лактама (соединение 1) по способу Sternbach et al., J. Org. Chem., 29:231 (1964) или взаимодействием с реагентом Лоуссона.
Композиции/препаративные формы
В альтернативном варианте осуществления настоящее изобретение относится к фармацевтическим композициям, включающим по крайней мере одно соединение формулы I или его пролекарство или фармацевтически приемлемую соль соединения формулы I или пролекарство такого соединения.
Такие фармацевтические композиции могут вводиться перорально, например в форме таблеток, филмтаблеток, драже, желатиновых капсул с твердым или мягким покрытием, растворов, эмульсий или суспензий. Они могут вводиться также ректально, например в форме суппозиториев, или парентерально, например в форме растворов для инъекций.
Фармацевтические композиции по настоящему изобретению, включающие соединения формулы I, пролекарства таких соединений или их соли, могут быть получены известным в данной области методом, например с помощью общепринятых процессов смешения, калсулирования, растворения, гранулирования, эмульгирования, включения, дражирования или лиофилизации. Такие фармацевтические композиции могут быть приготовлены с использованием терапевтически инертных неорганических или органических носителей. В качестве таких носителей для таблеток, филмтаблеток, драже и желатиновых капсул с твердым покрытием могут применяться лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли. Приемлемые носители для желатиновых капсул с мягким покрытием включают растительные масла, воски и жиры. В зависимости от природы действующего вещества в случае желатиновых капсул с мягким покрытием обычно не требуется никакого носителя. Пригодными носителями для изготовления растворов и сиропов являются вода, полиолы, сахароза, инвертный сахар и глюкоза. Пригодными носителями для растворов для инъекций являются вода, спирты, полиолы, глицерин, растительные масла, фосфолипиды и поверхностно-активные вещества. Пригодными носителями для суппозиториев являются природные или гидрогенизированные масла, воски, жиры и полужидкие полиолы.
Фармацевтические композиции могут содержать также консерванты, солюбилизирующие агенты, стабилизаторы, смачивающие агенты, эмульгаторы, подслащивающие вещества, красители, корригенты, соли для изменения осмотического давления, буферы, агенты для нанесения покрытия или антиоксиданты. Они могут содержать также другие обладающие терапевтической активностью вещества, включая дополнительные действующие вещества, отличные от соединений формулы I.
Дозы
Как было указано выше, соединения формулы I, их пролекарства и их соли, а также композиции, содержащие эти соединения, могут применяться для лечения или приостановления развития болезней, связанных с пролиферацией клеток, прежде всего онкологических болезней. Эти соединения и композиции, содержащие эти соединения, предпочтительно могут применяться для лечения или приостановления развития твердых опухолей, таких как, например, опухоли молочной железы и ободочной кишки.
В контексте настоящего изобретения понятие “терапевтически эффективное количество соединения” обозначает количество соединения, которое является эффективным в отношении предупреждения, облегчения или улучшения симптомов болезни или увеличивает выживаемость пациента, подвергающегося лечению. Определение терапевтически эффективного количества находится в компетенции специалиста в данной области.
Терапевтически эффективное количество или доза соединения формулы I может варьироваться в широких пределах, и они должны быть выбраны в соответствии с индивидуальными требованиями в каждом отдельном случае. В целом для перорального или парентерального введения взрослым людям весом приблизительно 70 кг может использоваться суточная доза от приблизительно 10 мг до приблизительно 10000 мг, предпочтительно от приблизительно 200 мг до приблизительно 1000 мг, хотя верхний предел может быть превышен при соответствующих показаниях. Суточная доза может вводиться в виде одной дозы или в виде разделенных доз, или в случае парентерального введения она может вводиться путем непрерывной инфузии.
Пример 1: пиразолы, полученные в соответствии со схемой 1
Этап а: реакция лактама (соединения 1) с реагентом Лоуссона с образованием тиолактама (соединения 2)
1.1 Соединение A1: R1=H, R2=F, R4=H
К раствору 5,085 г (20 ммолей) лактама 1 (где R1=H, R2=F и R4=H) в 50 мл диметоксиэтана при 75° С прибавляли 8,9 г (22 ммоля) реагента Лоуссона (2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфида; Pedersen B.S., Schheibye S., Nilsson N.H., Lawesson S.-O., Bull. Soc. Chim. Belg., 1978, 87:223). Смесь перемешивали в течение 30 минут, охлаждали и затем выливали в 10% водный раствор бикарбоната натрия. Водную смесь экстрагировали хлористым метиленом, экстракты промывали водой, сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток перекристаллизовали из смеси хлористый метилен-метанол, получая 4,0 г соединения A1 (тиолактам 2).
1Н-ЯМР (ДМСО-d6, 300 МГц): 12,56 (s, 1Н, NH), 7,10-7,65 (m, 8H), 4,59 (s, 2H).
1.2 Соединение А2: R1=F, R2=R4=H
Соединение А2 получали тем же способом, который описан выше для соединения A1. 1Н-ЯМР (ДМСО-d6, 300 МГц): 12,50 (s, 1H, NH), 7,37-7,56 (m, 7H), 7,06 (dd, J=3,9 Гц, 1H), 4,60 (уш. s, 2H).
Этап б: реакция тиолактама 2 с ацеталем ДМФ с образованием диметиламинометиленового производного 3
1.3 Соединение A3: R1=Сl, R2=Cl, R4=H
Раствор 0,999 г (3,1 ммоля) тиолактама 2 (R1=Cl, R2=Cl, R4=H), 10 мл безводного тетрагидрофурана и 10 мл диэтилацеталя диметилформамида перемешивали при комнатной температуре в течение 2 часов. Летучие вещества удаляли при пониженном давлении, получая остаток красно-оранжевого цвета. Кристаллизация из смеси гексан-этилацетат дала 0,716 г соединения A3 (производное 3, где R1=Cl, R2=Cl, R4=H) в виде красного твердого вещества, tпл 196-198° C.
1Н-ЯМР (ДМСО-d6, 400 МГц): 10,21 (s, 1H), 7,84 (s, 1H), 7,43-7,56 (m, 4H), 7,32 (dd, J=3,9 Гц, 1H), 7,00 (d, J=9 Гц, 1H), 6,60 (d, J=3 Гц, 1Н), 3,27 (s, 6H).
Этап в: превращение диметиламинометиленового производного 3 в пиразол 4
1.4 Соединение А4: R1=Cl, R2=Cl, R3=R4=H
5-(2-хлорфенил)-7-хлорпиразоло[3,4][1,4]бензодиазепин.
К раствору 0,265 г (0,71 ммоля) в 10 мл безводного метиленхлорида прибавляли примерно 39,8 мкл (1,27 ммоля) безводного гидразина. Смесь перемешивали в атмосфере аргона в течение 85 минут, затем растворяли в метиленхлориде и промывали водой, сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая 0,219 г соединения А4 (пиразол 4, где R1=Cl, R2=Cl, R3=R4=H) в виде желтовато-коричневого твердого вещества. Аналитический образец фильтровали через невысокий слой силикагеля, элюируя этилацетатом, и затем перекристаллизовали из этилацетата, tпл>300° C.
1Н-ЯМР (ДМСО-d6, 400 МГц): 12,07 (s, 1H, NH), 8,03 (s, 1H, NH), 7,58 (s, 1H), 7,4-7,5 (m, 4H), 7,17 (dd, J=2,9 Гц, 1H), 6,79 (d, J=9 Гц, 1Н), 6,25 (s, 1H).
Следующие пиразолы (соединение 4) получали в соответствии со схемой 1 и как описано выше в этапах а-в.
1.5 Соединение А5: R1=NO2, R2=Cl, R3=H, R4=H
5-(2-хлорфенил)-7-нитропиразоло[3,4][1,4]бензодиазепин,
1Н-ЯМР (AMCO-d6, 300 МГц): 9,16 (s, 1H, NH), 7,90 (dd, J=2,8 Гц, 1H), 7,4-7,6 (m, 5Н), 7,08 (d, J=2 Гц, 1H), 6,75 (d, J=8 Гц, 1Н).
1.6 Соединение А6: R1=Cl, R2=H, R3=H, R4=H
5-фенил-7-хлорпиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДMCO-d6, 200 МГц): 7,97 (s, 1H, NH), 7,62 (s, 1 H), 7,35-7,60 (m, 5H), 7,29 (dd, J=2,9 Гц, 1H), 6,93 (d, J=9 Гц, 1H), 6,60 (d, J=2 Гц, 1H).
1.7 Соединение А7: R1=Cl, R2=F, R3=H, R4=H
5-(2-фторфенил)-7-хлорпиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДMCO-d6, 400 МГц): 12,10 (s, 1H, NH), 8,01 (s, 1H), 7,60 (s, 1H), 7,5 (m, 2H), 7,18-7,33 (m, 3H), 6,83 (d, J=8 Гц, 1H), 6,47 (s, 1H).
1.8 Соединение А8: R1=Cl, R2=Cl, R3=H, R4=Cl
5-(2,4-дихлорфенил)-7-хлорпиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДMCO-d6, 400 МГц): 12,09 (s, 1H, NH), 8,05 (s, 1H, NH), 7,68 (s, 1H), 7,56 (s, 1H), 7,52 (d, J=10 Гц, 1H), 7,48 (d, J=10 Гц, 1H), 7,19 (dd, J=2, 9 Гц, 1H), 6,78 (d, J=9 Гц, 1H), 6,27 (d, J=2 Гц, 1H).
1.9 Соединение А9: R1=H, R2=H, R3=H, R4=H
5-фенилпиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДMCO-d6, 300 МГц): 12,04 (s, 1H), 7,77 (s, 1H), 7,58 (s, 1H), 7,32-7,47 (m, 5H), 7,22 (dt, J=2, 8 Гц, 1H), 6,92 (d, J=8 Гц, 1H), 6,76 (d, J=8 Гц, 1H), 6,67 (dd, J=1, 8 Гц, 1H).
1.10 Соединение А10: R1=H, R2=F, R3=H, R4=H
5-(2-фторфенил)пиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДМСО-d6, 200 МГц): 12.00 (s, 1H, NH), 7,79 (s, 1H), 7,32-7,56 (m, 3H), 7,00-7,32 (m, 3H), 6,78 (d, J=6 Гц. 1H), 6,48 (d, J=6 Гц, 1H).
1.11 Соединение A11: R1=F, R2=F, R3=H, R4=H
5-(2-фторфенил)-7-фторпиразоло[3,4][1,4]бензодиазепин.
1H-ЯМР (ДМСО-d6, 200 МГц): 12,10 (s, 1H, NH), 7,85 (s, 1H), 7,4-7,7 (m, 3H), 7,18-7,39 (m, 2H), 7,05 (m, 1H), 6,86 (m, 1H), 6,26 (уш. d, J=8 Гц, 1H).
1.12 Соединение А12: R1=СН3О, R2=Cl, R3=H, R4=H
5-(2-хлорфенил)-7-метоксипиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДМСО-d6, 200 МГц): 12,00 (s, 1H, NH), 7,35-7,60 (m, 5H), 6,81 (d, J=8 Гц, 1H), 6,75 (d, J=8 Гц, 1H), 5,89 (s, 1H), 3,46 (s, 3H).
1.13 Соединение А13: R1=NO2, R2=F, R3=H, R4=H
5-(2-фторфенил)-7-нитропиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДMCO-d6, 300 МГц): 12,14 (s, 1H, NH), 9,06 (s, 1H, NH), 7,89 (dd, J=2,9 Гц, 1H), 7,55 (s, 1H), 7,4-7,5 (m, 2H), 6,76 (d, J=9 Гц, 1Н).
1.14 Соединение А14: R1=СН3SO2, R2=H, R3=H, R4=H
5-фенил-7-метансульфопилпиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДМСО-d6, 400 МГц): 12,18 (s, 1H, NH), 8,54 (s, 1 H, NH), 7,72 (dd, J=2,9 Гц, 1H), 7,64 (s, 1H), 7,43 (m, 5H), 7,14 (d, J=2 Гц, 1Н), 7,06 (d, J=9 Гц, 1H), 3,01 (s, 3H).
1.15 Соединение А15: R1=CN, R2=F, R3=H, R4=H
5-(2-фторфенил)-7-цианопиразоло[3,3][1,4]бензодиазепин.
1Н-ЯМР (ДMCO-d6, 300 МГц): 12,16 (s, 1H, NH), 8,63 (s, 1H, NH), 7,59 (s, 1H), 7,4-7,58 (m, 3H), 7,2-7,37 (m, 2H), 6,82 (dd, J=2,8 Гц, 1Н), 6,78 (s, 1H).
1.16 Соединение А16: R1=NO2, R2=H, R3=H, R4=H
5-фенил-7-нитропиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДМСО-d6, 400 МГц): 12,19 (s, 1H, NH), 8,96 (s, 1H, NH), 8,03 (dd, J=2, 9 Гц, 1H), 7,62 (s, 1H), 7,35-7,5 (m, 6Н), 6,94 (d, J=9 Гц, 1Н).
1.17 Соединение А17: R1=NO2, R2=CF3, R3=H, R4=H
5-(2-трифторметилфенил)-7-нитропиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДMCO-d6, 300 МГц): 12,12 (s, 1H, NH), 9,18 (s, 1H, NH), 7,45-7,9 (m, 6H), 7,00 (s, 1H), 6,71 (d, J=9 Гц, 1Н).
1.18 Соединение А18: R1=CO2CH3, R2=H, R3=H, R4=H
5-фенил-7-карбометоксипиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДMCO-d6, 300 МГц): 12,15 (s, 1H, NH), 8,42 (s, 1H, NH), 7,78 (dd, J=2,9 Гц, 1H), 7,62 (s, 1H), 7,35-7,45 (m, 5H), 7,29 (d, J=2 Гц, 1H), 6,93 (d, J=9 Гц, 1H), 3,66 (s, 3H).
1.19 Соединение А19: R1=I, R2=F, R3=H, R4=H
5-(2-фторфенил)-7-иодпиразоло[3,4][1,4]бензодиазепин.
1H-ЯМР (ДMCO-d6, 300 МГц): 12,09 (s, 1H, NH), 7,99 (s, 1H, NH), 7,58 (s, 1H), 7,4-7,55 (m, 3H), 7,19-7,35 (m, 2H), 6,76 (s, 1H), 6,62 (d, J=8 Гц, 1Н).
1.20 Соединение А20: R1=CO2Et, R2=F, R3=H, R4=H
5-(2-фторфенил)-7-карбоэтоксипиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДМСО-d6, 300 МГц): 12,08 (s, 1H, NH), 8,50 (s, 1H, NH), 7,62 (d, J=8 Гц, 1H), 7,57 (s, 1H), 7,4-7,5 (m, 2H), 7,18-7,35 (m, 2H), 7,14 (s, 1H), 6,80 (d, J=8 Гц, 1Н), 4,15 (q, J=6 Гц, 2Н), 1,17 (t, J=6 Гц, 3Н).
1.21 Соединение A21: R1=H, R2=Cl, R3=H, R4=H
5-(2-хлорфенил)пиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДMCO-d6, 300 МГц): 11,95 (s, 1H), 8,40 (s, 1H), 7,84 (s, 1H), 7,53 (s, 1H), 7,38-7,48 (m, 4H), 7,09 (t, J=8 Гц, 1H), 6,78 (t, J=8 Гц, 1H), 6,61 (t, J=8 Гц, 1H), 6,34 (d, J=8 Гц, 1H).
Пример 2: превращение тиолактама 2 в замещенный пиразол 7 в соответствии со схемами 2 и 3
2.1 Соединение Б1: R1=NO2, R2=Cl, R3=2-пирролил, R4=H (схема 2)
3-(2-пирролил)-5-(2-хлорфенил)-7-нитропиразоло[3,4][1,4]бензодиазепин.
Смесь 0.995 г (3 ммоля) тиолактама 2 (R1=NO2, R2=Cl, R3=2-пирролил, R4=H), 0,571 г (6 ммолей) пиррол-2-карбоксальдегида, 0,383 г (4,5 ммоля) пиперидина (Aldrich) и 10 мл диметоксиэтана перемешивали под аргоном в течение 2 часов. Смесь растворяли в этилацетате и промывали последовательно 0,1 М серной кислотой, водой, затем насыщенным раствором соли, сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Соответствующий олефин 5 выделяли хроматографией на силикагеле (элюирование смесью гексан/этилацетат (1:1)) в виде красного твердого вещества (0,309 г) и непосредственно использовали на следующем этапе. Олефин 5 (0,309 г) растворяли в 6 мл диметилсульфоксида и вводили в реакцию с 72,5 мг (2,2 ммоля) гидразина в атмосфере аргона. Через 20 мин смесь растворяли в этилацетате и промывали последовательно водой и насыщенным раствором соли, сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая смесь дигидропиразолов 6 (0,296 г). Смесь соединений 6 растворяли в диметилсульфоксиде и нагревали в присутствии воздуха при 130°С в течение 2 часов, охлаждали, растворяли в этилацетате и промывали последовательно водой и затем насыщенным раствором соли. Экстракт сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Продукт 7 (соединение Б1) очищали хроматографией на силикагеле (элюирование смесью гексан-этилацетат, 25/75).
1Н-ЯМР (ДМСО-d6, 300 МГц): 12,12 (s, 1Н, NH), 10,39 (s, 1H, NH), 9,07 (s, 1H, NH), 7,96 (dd, J=2, 8 Гц, 1H), 7,45-7,65 (m, 4H), 7,15 (d, J=2 Гц, 1H), 6,90 (s, 1H), 6,79 (d, J=8 Гц, 1H), 6,48 (s, 1H), 6,12 (d, J=2 Гц, 1H).
2.2 Соединение Б2: R1=NO2, R2=Cl, R3=CO2Et, R4=H (схема 3)
3-карбоэтокси-5-(2-хлорфенил)-7-нитропиразоло[3,4][1,4]бензодиазепин.
Смесь 5,0 г (15,1 ммоля) тиолактама 2 (R1=NO2, R2=Cl), 6 мл 50% раствора этилового эфира глиоксалевой кислоты в толуоле, 4,5 мл (31 ммоль) диазабициклоундекана и 100 мл диметоксиэтана перемешивали в атмосфере аргона в течение 30 минут при комнатной температуре. Смесь подкисляли 0,005 М серной кислотой, экстрагировали этилацетатом. Объединенные экстракты сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Альдольный аддукт 8 получали в виде смеси диастереомеров (5,6 г) с помощью хроматографии на силикагеле (элюирование смесью гексан-этилацетат, 60/40).
Смесь 4,7 г (10,8 ммоля) альдольного аддукта 8, полученного выше, 100 мл пиридина и 6,9 мл (54,4 ммоля) триметилхлорсилана перемешивали в течение 10 минут при комнатной температуре и затем нагревали при 120° С в течение 1,5 часа. Смесь охлаждали, растворяли в 1 л этилацетата и промывали последовательно водой и насыщенным раствором соли, органический слой сушили над безводным сульфатом натрия. После фильтрации и упаривания летучих веществ при пониженном давлении неочищенный остаток фильтровали через слой силикагеля, элюируя смесью гексан-этилацетат (1:1), получали 4,3 г олефина 5.
Раствор 4,3 г олефина 5, полученного выше, в 210 мл дихлорметана перемешивали с 0,68 мл (21,6 ммоля) безводного гидразина в течение 30 минут. Затем смесь распределяли между водой и дихлорметаном, водную фазу экстрагировали дихлорметаном. Объединенные экстракты сушили над безводным сульфатом натрия, фильтровали и концентрировали при уменьшенном давлении. Остаток, который содержал смесь дигидропиразолов 6, растворяли в 50 мл диметилсульфоксида и нагревали при 130° С в присутствии воздуха в течение 3 часов. Реакционную смесь охлаждали, растворяли в этилацетате и промывали водой. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Продукт выделяли хроматографией на силикагеле, элюируя смесью гексан-этилацетат (40/60), получали 0,580 г соединения Б2 (R1=NO2, R2=Cl, R3=CO2Et2, R4=H).
1Н-ЯМР (ДМСО-d6, 400 МГц): 13,33 (s, 1H), 9,15 (s, 1H), 8,02 (dd, J=2, 9 Гц, 1H), 7,46-7,55 (m, 4H), 7,18 (d, J=2 Гц, 1H), 6,89 (d, J=9 Гц, 1 Н), 4,25 (q, J=7 Гц, 2Н), 1,27 (t, J=7 Гц, 3Н).
Следующие пиразолы (соединение 7) получены в соответствии со схемой 2 или 3, как описано выше.
2.3 Соединение Б3: R1=NO2, R2=Cl, R3=CH3, R4=H (схема 2)
3-метил-5-(2-хлорфенил)-7-нитропиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДМСО-d6, 300 МГц): 11,85 (s, 1H, NH), 9,04 (s, 1H, NH), 7,83 (dd, J=2,9 Гц, 1H), 7,39-7,52 (m, 4H), 7,05 (d, J=2 Гц, 1Н), 6,69 (d, J=9 Гц, 1Н), 1,98 (s, 3H).
2.4 Соединение Б4: R1=NO2, R2=Cl, R3=СН2СН3, R4=H (схема 2)
3-этил-5-(2-хлорфенил)-7-нитропиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДМСО-d6, 300 МГц): 11,91 (s, 1H, NH), 9,05 (s, 1H, NH), 7,85 (dd, J=2,8 Гц, 1H), 7,35-7,58 (m, 4H), 7,04 (d, J=2 Гц, 1H), 6,71 (d, J=8 Гц, 1H), 2,41 (q, J=7 Гц, 2Н), 1,06 (t, J=7 Гц, 3Н).
2.5 Соединение Б5: R1=NO2, R2=Cl, R3=CH2CH2Ph, R4=H (схема 2)
3-(2-фенилэтил)-5-(2-хлорфенил)-7-нитропиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДМСО-d6, 200 МГц): 11,95 (s, 1H, NH), 9,05 (s, 1H, NH), 7,82 (dd, J=2,8 Гц, 1H), 7,05-7,60 (m, 10Н), 6,70 (d, J=8 Гц, 1H), 2,82 (m, 2Н), 2,64 (m, 2H).
2.6 Соединение Б6: R2=NO2, R2=Cl, R3=i-Pr, R4=H (схема 2)
3-(1-метилэтил)-5-(2-хлорфенил)-7-нитропиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДМСО-d6, 300 МГц): 11,90 (s, 1H, NH), 9,02 (s, 1H, NH), 7,84 (dd, J=2, 9 Гц, 1H), 7,35-7,55 (m, 4H), 7,04 (d, J=2 Гц, 1H), 6,74 (d, J=9 Гц, 1H), 2,86 (sept, J=9 Гц, 1H), 1,14 (d, J=9 Гц, 6Н).
2.7 Соединение Б7: R1=CN, R2=F, R3=СН3, R4=H (схема 2)
3-метил-5-(2-фторфенил)пиразоло[3,4][1,4]бензодиазепин-7-карбонитрил.
1Н-ЯМР (ДМСО-d6, 300 МГц): 12,05 (s, 1H, NH), 8,55 (s, 1H, NH), 7,45 (m, 3Н), 7,25 (m, 2H), 6,78 (d, J=8 Гц, 1H), 6,71 (s, 1H), 2,03 (s, 3Н).
2.8 Соединение Б8: R1=NO2, R2=Cl, R3=CH2Ph, R4=H (схема 2)
3-(фенилметил)-5-(2-хлорфенил)-7-нитропиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДМСО-d6, 300 МГц): 12,08 (s, 1H, NH), 9,08 (s, 1H), 7,85 (d, J=9 Гц, 1H), 7,40-7,56 (m, 4H), 7,16-7,34 (m, 5Н), 7,06 (уш. s, 1 Н), 6,71 (d, J=9 Гц, 1Н), 3,71 (s, 2H).
2.9 Соединение Б9: R1=CO2Et, R2=F, R3=СН3, R4=H (схема 2)
3-метил-5-(2-фторфенил)-7-карбоэтоксипиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДМСО-d6, 300 МГц): Rl=CO2Et, R2=F, R3=СН3, R4=H (схема 2)
3-метил-5-(2-фторфенил)-7-карбоэтоксипиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДМСО-d6, 300 МГц): 11,81 (s, 1H), 8,37 (s, 1H), 7,59 (dd, J=2,9 Гц, 1H), 7,39-7,51 (m, 2H), 7,16-7,31 (m, 2H), 7,09 (s, 1H), 6,74 (d, J=9 Гц, 1H), 4,08 (q, J=7 Гц, 2H), 2,04 (s, 3Н), 1,12 (t, J=7 Гц, 3Н).
2.10 Соединение Б10: R1=NO2, R2=Cl, R3=5-(4-Ме)пиразолил, R4=H (схема 2)
3-(4-метилпиразол-5-ил)-5-(2-хлорфенил)-7-нитропиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДMCO-d6, 400 МГц): 12,58 (s, 1H), 9,26 (s, 1H), 8,75 (уш. s, 1H), 7,95 (d, J=8 Гц, 1H), 7,42-7,6 (m, 5H), 7,12 (s, 1H), 6,81 (d, J=8 Гц, 1H), 2,32 (s, 3Н).
2.11 Соединение Б11: R1=NO2, R2=Cl, R3=CH2-iPr, R4=H (схема 2)
3-(2-метилпропил)-5-(2-хлорфенил)-7-нитропиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (ДМСО-d6, 400 МГц): 11,91 (s, 1H), 9,06 (s, 1H), 7,87 (dd, J=2,9 Гц, 1H), 7,4-7,56 (m, 4H), 7,08 (d, J=2 Гц, 1H), 6,74 (d, J=9 Гц, 1H), 2,28 (d, J=7 Гц, 2H), 1,89 (d, J=7 Гц, 1H), 0,88 (d, J=7 Гц, 6Н).
2.12 Соединение Б12: R1=NO2, R2=Cl, R3=СF3, R4=H (схема 3)
3-трифторметил-5-(2-хлорфенил)-7-нитропиразоло[3,4][1,4]бензодиазепин.
1Н-ЯМР (CDCl3+ДMCO-d6, 300 МГц): 7,98 (dd, J=2,9 Гц, 1H), 7,2-7,6 (m, 6H), 7,02 (уш. s, 1H), 6,62 (d, J=9 Гц, 1H).
2.13 Соеди