Ингибиторы фермента, конвертирующего интерлейкин-1-
Иллюстрации
Показать всеИзобретение относится к новым классам соединений общей формулы
где R1 представляет собой:
или
значения радикалов указаны в формуле изобретения, которые являются ингибиторами фермента, конвертирующего интерлейкин-1β. Ингибиторы ICE настоящего изобретения характеризуются специфическими структурными и физикохимическими свойствами. Данное изобретение относится также к фармацевтическим композициям, включающим эти соединения. Соединения и фармацевтические композиции настоящего изобретения особенно хорошо подходят для ингибирования активности ICE и, следовательно, могут успешно использоваться в качестве препаратов против IL-1, апоптоз-, IGIF- и IFN-γ-опосредованных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний, костно-деструктивных нарушений, пролиферативных заболеваний, инфекционных заболеваний, дегенеративных заболеваний и некротических заболеваний. Настоящее изобретение также относится к способам ингибирования ICE активности для лечения интерлейкин-1-, апоптоз-, IGIF- и IFN-γ-опосредованных заболеваний и уменьшение продукции IGIF- и IFN-γ с помощью соединений и композиций настоящего изобретения. Настоящее изобретение также относится к способам получения N-ациламино соединений. 8 н. и 56 з.п. ф-лы, 30 табл., 14 ил.
Реферат
Настоящее изобретение относится к новым классам соединений, которые являются ингибиторами фермента, конвертирующего интерлейкин-1β ("ICE"). Данное изобретение относится также к фармацевтическим композициям, включающим эти соединения. Соединения и фармацевтические композиции данного изобретения особенно хорошо подходят для ингибирования активности ICE и, следовательно, могут успешно использоваться в качестве лекарственных средств против заболеваний, опосредованных интерлейкином-1 ("IL-1"), апоптозом, фактором, индуцирующим интерферон гамма, ("IGIF") и интерфероном-γ ("IFN-γ "), включающих воспалительные заболевания, аутоиммунные заболевания, деструкцию костей, пролиферативные нарушения, инфекционные заболевания и дегенеративные заболевания. Данное Настоящее изобретение относится к новым классам соединений, которые являются ингибиторами фермента, конвертирующего интерлейкин-1β ("ICE"). Данное изобретение относится также к фармацевтическим композициям, включающим эти соединения. Соединения и фармацевтические композиции данного изобретения особенно хорошо подходят для ингибирования активности ICE и, следовательно, могут успешно использоваться в качестве лекарственных средств против заболеваний, опосредованных интерлейкином-1 ("IL-1"), апоптозом, фактором, индуцирующим интерферон гамма, ("IGIF") и интерфероном-γ ("IFN-γ "), включающих воспалительные заболевания, аутоиммунные заболевания, деструкцию костей, пролиферативные нарушения, инфекционные заболевания и дегенеративные заболевания. Данное изобретение относится также к способам ингибирования ICE активности и уменьшения продукции IGIF и IFN-γ и к способам лечения заболеваний, опосредованных интерлейкином-1, апоптозом, фактором, индуцирующим интерферон гамма, и интерфероном-γ с использованием соединений и композиций данного изобретения. Настоящее изобретение относится также к способам получения N-ациламино соединений.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Интерлейкин-1-("IL-1") является основным проинфламматорным и иммунорегуляторным белком, который стимулирует дифференциацию и пролиферацию фибробластов, продукцию простагландинов, коллагеназы и фосфолипазы синовиальными клетками и хондроцитами, дегрануляцию базофилов и эозинофилов и активацию нейтрофилов. Oppenheim, J. H. et al, Immunology Today, 7, рр 45-56 (1986). В таком качестве он включен в патогенез хронических и острых воспалительных и аутоиммунных заболеваний. Например, при ревматоидном артрите IL-1 является медиатором как воспалительных симптомов, так и деструкции хрящевого протеогликана в пораженных суставах. Wood, D.D. et al., Arthritis Rheum. 26, 975, (1983); Pettipher, E. J. et al., Proc. Natl. Acad. Sci. UNITED STATES OF AMERICA 71, 295 (1986); Arend, W. P. and Dayer, J.M., Artritis Rheum. 38, 151 (1995). IL-1 является высокоактивным агентом, вызывающим костную ресорбцию. Jandiski, J. J., J. Oral Path. 17, 145 (1988); Dewhirst, F.E. et al., J. Immunol. 8, 2562 (1985). Альтернативно он упоминается как "фактор, активирующий остеокласты" при костнодеструктивных заболеваниях, таких, как остеоартрит и множественная миелома. Bataille, R. et al., Int. J. Clin. Lab. Res. 21 (4), 283 (1992). В некоторых пролиферативных заболеваниях, таких, как острая миелогенная лейкемия и множественная миелома, IL-1 может способствовать росту и адгезии опухолевых клеток. Bani, M. R., J. Natl. Cancer Inst. 83, 123 (1991); Vidal-Vanaclocha, F., Cancer Res. 54, 2667 (1994). При этих заболеваниях IL-1 также стимулирует продукцию других цитокинов, таких, как IL-6, который модулирует развитие опухоли (Tartour et al., Cancer Res. 54, 6243 (1994). IL-1 преимущественно продуцируется моноцитами периферической крови, как часть воспалительного ответа, и существует в двух различных агонистических формах, IL-1α и IL-1β . Mosely, В. S. et аl., Proc. Natl. Acad. Sci., 84, pp.4572-4576 (1987); Lonneman, G. et al., Eur. J. Immunol., 19, pp.1531-1536 (1989).
IL-1β синтезируется как биологически неактивный предшественник, pIL-1β . В pIL-1β не хватает обычной ведущей последовательности, и он не подвергается воздействию сигнальной пептидазы. March, С. J., Nature, 315, pp.641-647 (1985). Вместо этого pIL-1β расщепляется под действием интерлейкин-1β конвертирующего фермента ("ICE") между Asp-116 и Ala-117 с получением биологически активного С-концевого фрагмента, обнаруженного в человеческой сыворотке и синовиальной жидкости. Sleath, Р. R., et al., J. Biol. Chem., 265, pp.14526-14528 (1992); A.D.Howard et al., J. Immunol., 147, pp.2964-2969 (1991). ICE является цистеин-протеазой, локализованной преимущественно в моноцитах. Она превращает предшественник IL-1β в зрелую форму. Black, R. A. et al., FEBS Lett., 247, рр.386-390 (1989); Kostura, M. J. et al., Proc. Natl. Acad. Sci. UNITED STATES OF AMERICA 86. pp.5227-5231 (1989). Воздействие ICE необходимо также для транспорта зрелого IL-1β через клеточную мембрану.
Кроме того, очевидно, что ICE, или его гомологи, включены в регуляцию запрограммированной смерти клетки, или апоптоза. Yuan, J. et al., Cell. 75, pp.641-652 (1993); Miura, M. et al., Cell. 75, pp.653-660 (1993); Nett-Fiordalisi, M. A. et al., J. Cell Biochem., 17B, р.117 (1993). В частности, считается, что ICE, или его гомологи, связаны с регуляцией апоптоза при нейродегенеративных заболеваниях, таких, как болезни Альцгеймера и Паркинсона. Marx, J. and M. Baringa, Science, 259, pp.760-762 (1993); Gagliardini, V. et al., Science, 263, pp.826-828 (1994). Терапевтическое применение ингибирования апоптоза может включать лечение болезней Альцгеймера, Паркинсона, удара, инфаркта миокарда, спинной атрофии и старения.
Продемонстрировано, что ICE опосредует апоптоз (программируемую смерть клетки) в некоторых типах тканей. Steller, Н., Science, 267, р.1445 (1995); Whyte, M. and Evan, G, Nature, 376, p.17 (1995); Martin, S. J. and Green, D. R., Cell. 82, p.349,(1995); Alnemri, E. S., et al., J. Biol. Chem., 270, p.4312 (1995); Yuan, J. Curr. Opin. Cell Biol., 7, p.211 (1995). Трансгенные мыши, лишенные гена ICE, являются дефицитными в отношении Fas-опосредованного апоптоза (Kuida, К. et al., Science. 267, р.2000 (1995)). Эта активность ICE отличается от его роли как фермента, процессирующего pro-IL1β . Предполагают, что в некоторых типах тканей ингибирование ICE может не оказывать влияния на секрецию зрелого IL-1β , но может ингибировать апоптоз.
Обладающий ферментативной активностью ICE был ранее описан как гетеродимер, состоящий из двух субъединиц, р20 и р10 (с молекулярным весом соответственно 20 кДа и 10 кДа). Эти субъединицы получаются из профермента с молекулярным весом 45 кДа (р45) через форму р30, посредством автокаталитического механизма активации. Thomberry, N. A. et al., Nature, 356, pp.768-774 (1992). Профермент ICE делится на несколько функциональных доменов: продомен (р14), р22/20 субъединица, связующий полипептид и р10 субъединица. Thomberry et al., supra: Casano et al., Genomics. 20, pp.474-481 (1994).
Профермент р45 с полной длиной цепи был охарактеризован по его кДНК и аминокислотной последовательности. РСТ патентные заявки WO 91/15577 и WO 94/00154. Также известны кДНК и аминокислотные последовательности для р20 и р10. Thornberry et al., supra. Также были клонированы и секвенированы мышиный и крысиный ICE. Их аминокислотные и нуклеотидные последовательности имеют высокую степень гомологии с человеческим ICE. Miller, D. К. et al., Ann. N.Y. Acad. Sci., 696, pp.133-148 (1993); Molineaux, S. M. et. al., Proc. Nat. Acad. Sci., 90, pp.1809-1813 (1993). Трехмерная структура ICE определена на атомном уровне с помощью рентгеновской кристаллографии. Wilson, К.Р., et al., Nature, 370, pp.270-275 (1994). Активный фермент существует в виде тетрамера, состоящего из двух р20 и двух р10 субъединиц.
Кроме того, у человека обнаружены гомологи ICE, имеющие сходства в аминокислотных последовательностях регионов активных участков ферментов. Такие гомологи включают ТХ (или ICEreI-II или ICH-2) (Faucheu, et al., EMBO J., 14, р.1914 (1995); Kamens J., et al., J. Biol. Chem., 270, p.15250 (1995); Nicolson et al., J. Biol. Chem., 270, p.15870 (1995)), TY (или ICEreI-III) (Nicolson et al., J. Biol. Chem., 270, p.15870 (1995)); ICH-1 (или Nedd-2) (Wang, L. et al., Cell. 78, p.739 (1994)), MCH-2 (Femandes-Alnemri, Т. et al., Cancer Res., 55, p.2737 (1995)), CPP 32 (или YAMA, или апопейн) (Femandes-Alnemri, Т. et al., J. Biol. Chem. 269, p.30761 (1994); Nicolson D. W. et al., Nature. 376, p.37 (1995)), и СМН-1 (или МСН-3) (Lippke, et al., J. Biol. Chem., (1996); Femandes-Alnemri, Т. et al., Cancer Res., (1995)). Каждый из этих гомологов ICE, так же, как и сам ICE, способен индуцировать апоптоз при повышенной экспрессии в трансфицированных клеточных линиях. Ингибирование одного или нескольких таких гомологов пептидильным ингибитором ICE Tyr-Val-Ala-Asp-хлорметилкетоном приводит к ингибированию апоптоза в первичных клетках клеточных линий. Lazebnik et al., Nature, 371, р.346 (1994). Описанные здесь соединения также способны ингибировать один или несколько гомологов ICE (см. Пример 5). Следовательно, эти соединения могут использоваться для ингибирования апоптоза в тканях, содержащих гомологи ICE, но которые не содержат активный ICE и не продуцируют зрелый IL-1β .
Интерферон-гамма индуцирующий фактор (IGIF) является полипептидом с молекулярной массой приблизительно 18 кДа, стимулирующим продукцию интерферона-гамма (IFN-γ ) Т-клетками. IGIF продуцируется in vivo активированными клетками Купфера и макрофагами и экспортируется из этих клеток при стимуляции эндотоксином. Таким образом, соединение, уменьшающее продукцию IGIF, может использоваться, как ингибитор стимуляции таких Т-клеток, что, в свою очередь, приводит к уменьшению уровня продукции IFN-γ этими клетками.
IFN-γ является цитокином, обладающим иммунорегуляторным действием на ряд иммунных клеток. В частности, IFN-γ участвует в активации макрофагов и селекции Thl клеток (F. Belardelli, APMIS, 103, р.161 (1995)). IFN-γ оказывает свое действие частично путем модуляции экспрессии генов через STAT и IRF механизмы (С.Schindler and J.E.Damell, Ann. Rev. Biochem., 64, p.621 (1995); Т.Taniguchi, J. Cancer Res. Clin. Oncol., 121, p.516 (1995)).
Мыши, утратившие IFN-γ или его рецептор, обладают множественными дефектами в функциях иммунных клеток и являются устойчивыми к эндотоксическому шоку (S.Huang et al., Science. 259, р.1742 (1993); D.Dalton et al., Science, 259, p.1739 (1993); В.D.Car et al., J. Exp. Med., 179, p.1437 (1994)). Очевидно, что вместе с IL-1β , IGIF является мощным стимулятором продукции IFN-γ Т-клетками (Н.Okamura et al., Infection and Immunity. 63, р.3966 (1995); H.Okamura et al., Nature, 378, p.88 (1995); S.Ushio et al., J.Immunol., 156, p.4274 (1996)).
Продемонстрировано, что IFN-γ вносит вклад в патологические состояния, ассоциированные с рядом воспалительных, инфекционных и аутоиммунных нарушений и заболеваний. Таким образом, соединения, способные уменьшать продукцию IFN-γ , могут применяться для улучшения патологических состояний, опосредованных IFN-γ .
Механизмы биологической регуляции IGIF и, таким образом, IFN-γ , не выяснены. Известно, что IGIF синтезируется в виде белкового предшественника, называемого "про-IGIF". Однако, остается неясным, каким образом про-IGIF расщепляется и имеет ли его процессинг биологическое значение.
Соответственно, композиции и способы, регулирующие превращение про-IGIF в IGIF, могут применяться для уменьшения продукции IGIF и IFN-γ in vivo и, таким образом, для уменьшения вредного воздействия этих белков, которые вносят вклад в нарушения и заболевания человека.
Однако ICE и другие члены ICE/CED-3 семейства ранее не связывали с превращением про-IGIF в IGIF или с продукцией IFN-γ in vivo.
Ингибиторы ICE представляют собой класс соединений, применяемых для подавления воспаления или апоптоза или обоих. Описаны пептидные и пептидильдые ингибиторы ICE. PCT патентные заявки WO 91/15577; WO 93/05071; WO 93/09135; WO 93/14777 и WO 93/16710; и европейская патентная заявка 0547699. На мышиных моделях воспалительных процессов (vide infra) обнаружено, что такие пептидильные ингибиторы ICE блокируют продукцию зрелого IL-1β и подавляют рост лейкемических клеток in vitro (Estrov et al., Blood 84, 380a (1994)). Однако, из-за своей пептидной природы такие ингибиторы обычно характеризуются нежелательными фармакологическими свойствами, такими, как низкая клеточная проницаемость и клеточная активность, низкая оральная абсорбция, низкая стабильность и быстрый метаболизм. Planner, J.J. and D.W.Norbeck, in Drug Discovery Technologies, C.R.Clark and W.H.Moos, Eds. (Ellis Horwood, Chichester, England, 1990), pp.92-126. Это затрудняет разработку на их основе эффективных лекарственных препаратов.
Сообщалось также о непептидильных соединениях, ингибирующих ICE in vitro. РСТ патентная заявка WO 95/26958; патенты US 5552400; Dolle et al., J. Med. Chem., 39, pp.2438-2440 (1996). Однако, не ясно, имеют ли эти соединения соответствующий фармакологический профиль для терапевтического применения.
Кроме того, применяющиеся способы получения таких соединений не выгодны. В этих способах используется гидрид трибутилолова, токсичный, чувствительный к влаге реагент. Следовательно, эти способы не удобны для проведения, представляют риск для здоровья и создают проблемы с утилизацией токсичных отходов. Кроме того, соединения, полученные с помощью этих способов, трудно очищать.
Соответственно, существует потребность в соединениях, которые могут эффективно ингибировать действие ICE in vivo, для применения их в качестве агентов, использующихся для профилактики и лечения хронических и острых форм IL-1-опосредованных заболеваний, апоптоз-, IGIF- или IFN-γ -опосредованных заболеваний, так же, как для воспалительных, аутоиммунных, костно-деструкционных, пролиферативных, инфекционных или дегенеративных заболеваний. Существует также необходимость в разработке способов получения таких соединений.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет новые классы соединений и их фармацевтически приемлемые производные, которые используются как ингибиторы ICE. Эти соединения могут использоваться одни, или в сочетании с другими терапевтическими или профилактическими агентами, такими, как антибиотики, иммуномодуляторы, или другие анти-воспалительные агенты, для лечения или профилактики заболеваний, опосредованных IL-1, апоптозом, IGIF или IFN-γ . Соответственно предпочтительному воплощению, соединения данного изобретения способны связываться с активным участком ICE и ингибировать активность этого фермента. Кроме того, они имеют повышенную клеточную активность, улучшенную фармакокинетику и/или улучшенную оральную биодоступность по сравнению с пептидильными ингибиторами ICE.
Главным объектом данного изобретения является предоставление новых классов соединений, которые являются ингибиторами ICE, представленных формулами;
α
различные заместители которых описаны в этом разделе.
Следующим предметом данного изобретения является предоставление способа получения N-ациламино соединений в результате сочетания карбоксильной кислоты с alloc-защищенным амином.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1А. ICE расщепляет пpo-IGIF in vivo. Клеточные лизаты Cos клеток, трансфицированных различными плазмидами, экспрессирующими упомянутые выше ферменты, или контрольных клеток, анализировали на наличие IGIF путем разделения белков методами SDS-PAGE и иммуноблотинга с анти-IGIF антисывороткой (линия 1, имитация трансфицированных клеток; линия 2, npo-IGIF один; линии 3-12, npo-IGIF в сочетании с ICE, ICE-C285S, СРР32, CPP32-C163S, СМН-1, CMH-1-C186S, Тх, Tx-C258S, соответственно). Подвижности npo-IGIF и зрелого IGIF с молекулярной массой 18 кДа указаны справа. Маркеры молекулярного веса, который указан в кДа, показаны слева (Пример 23).
Фиг.1В. ICE расщенляет пpo-IGIF по аутентичному процессирующему участку in vitro, что продемонстрировано окрашиванием с помощью Кумасси синего продуктов протеолитической реакции, разделенных методом SDS-PAGE (Пример 23). Использовали следующие протеазы и ингибиторы: линия 1, буферный контроль; линия 2, 0,1 нМ ICE; линия 3, 1 нМ ICE; линии 4 и 5, 1 нМ ICE с 10 нМ Cbz-Val-Ala-Asp-[(2,6-дихлорбензоил)окси]метилкетоном и 100 нМ Ас-Туr-Val-Ala-Asp-альдегидом, соответственно; линии 6 и 7, 15 нМ СРР32 с 400 нМ Ac-Asp-Glu-Val-Аsр-альдегидом (D.W.Nicholson et al., Nature, 376, р.37 (1995)) соответственно; линия 8, 100 нМ СМН-1; линия 9, 10 ед./мл гранзима В; и М, маркеры молекулярной массы, указанной в кДа.
Фиг.1С. В результате расщепления под действием ICE неактивный npo-IGIF превращается в активный IGIF, который индуцирует продукцию IFN-γ в Тhl хелперных клетках. Нерасщепленный (пpo-IGIF), расщепленный под действием ICE (пpo-IGIF/ICE), расщепленный под действием СРР32 (npo-IGIF/CPP32), и рекомбинантный зрелый IGIF (rIGIF) инкубировали с А.Е7 Thl клетками в концентрации 12 нг/мл (незаштрихованная колонка) и 120 нг/мл (заштрихованная колонка) в течение восемнадцати часов и уровни высвобождающегося в культуральную среду IFN-γ анализировали с помощью ELISA-теста (Пример 23). Клетки А.Е7, инкубировавшиеся с буфером, ICE (ICE) или СРР32 (СРР32) анализировали подобным образом как негативные контроли. Полученные значения представляют собой средние величины из трех определений.
Фиг.2А. Зрелый IGIF (18 кДа) продуцируется Cos клетками, со-трансфицированными плазмидами, экспессирующими про-IGIF и ICE. Клеточные лизаты (слева) и инкубационная среда (справа) Cos клеток, трансфицированных про-IGIF экспрессирующей плазмидой, в отсутствие (-) или присутствии экспрессирующей плазмиды, кодирующей дикий тип (ICE) или неактивный мутант (ICE-C285S) ICE. Трансфицированные клетки метаболически метили 35S-метионином, белки из клеточных лизатов и инкубационной среды подвергали иммунопреципитации с помощью анти-IGIF антисыворотки и разделяли методом SDS-PAGE (Пример 24). Подвижности про-IGIF и зрелого IGIF с молекулярным весом 18 кДа показаны справа. Маркеры молекулярной массы, указанной в кДа, показаны слева.
Фиг.2В. Определяли IFN-γ индуцирующую активность в Cos клетках, со-трансфицированных плазмидами, экспрессирующими про-IGIF и ICE. Клеточные лизаты (заштрихованные колонки) и инкубационную среду (незаштрихованные колонки) Cos клеток, трансфекцированных плазмидами, экспрессирующими про-IGIF, в отсутствие (про-IGIF) или присутствии (про-IGIF/ICE) экспрессирующей плазмиды, кодирующей дикий тип (ICE), анализировали на уровни IFN-γ (нг/мл) с помощью ELISA-теста. Cos клетки, трансфицированные буфером (имитация), или только ICE-экспрессирующей плазмидой (ICE), служили негативными контролями (Пример 24).
Фиг.ЗА. Клетки Купфера от мышей, утративших ICE, являются дефективными в отношении экспорта IGIF. Клетки Купфера от дикого типа мышей (ICE+/+), или ICE-дефицитных мышей, гомозиготных в отношении ICE мутации, (ICE-/-), изолировали и обрабатывали LPS в течение 3 часов. Уровни иммуноактивных полипептдов IGIF в инкубационной среде (нг/мл) клеток дикого типа определяли с помощью ELISA-теста (Пример 25). N.D. (not detectable) означает, что концентрация IGIF меньше 0,1 нг/мл.
Фиг.3В. Клетки Купфера от мышей, утративших ICE, являются дефективными в отношении экспорта зрелого IGIF. Клетки Купфера от дикого типа мышей (ICE+/+), или ICE-дефицитных мышей, гомозиготных в отношении ICE мутации, (ICE-/-), изолировали и обрабатывали LPS в течение 3 часов. Обработанные клетки метаболически метили 35S-метионином, белки из клеточных лизатов и инкубационной среды подвергали иммунопреципитации с помощью анти-IGIF антисыворотки и разделяли методом SDS-PAGE (Пример 25). Подвижности про-IGIF и зрелого IGIF с молекулярным весом 18 кДа показаны справа. Маркеры молекулярной массы, указанной в кДа, показаны слева.
Фиг.3С. Сыворотка ICE-дефицитных мышей содержит пониженные уровни IGIF. Образцы сыворотки мышей дикого типа (ICE+/+), или ICE-дефицитных мышей, гомозиготных в отношении ICE мутации, (ICE-/-), анализировали на уровни IGIF (нг/мл) с помощью ELISA-теста (Пример 25).
Фиг.3D. Сыворотка ICE-дефицитных мышей содержит пониженные уровни IFN-γ . Образцы сыворотки мышей дикого типа (ICE+/+), или ICE-дефицитных мышей, гомозиготных в отношении ICE мутации, (ICE-/-), анализировали на уровни IFN-γ (нг/мл) с помощью ELISA-теста (Пример 25).
Фиг.4. Уровень IFN-γ в сыворотке после массированного введения LPS был значительно понижен у ICE-дефицитных мышей (Пример 26). Образцы сыворотки мышей дикого типа (затемненные квадраты), или ICE-дефицитных мышей (затемненные круги), анализировали на уровни IFN-γ (нг/мл) с помощью ELISA-теста как функцию от времени (в часах) после введения LPS. Температура животных на протяжении всего периода времени показана в градусах Цельсия для дикого типа мышей (незатемненные квадраты) или ICE-дефицитных мышей (незатемненные круги).
Фиг.5. Ингибитор ICE, AcYVAD-альдегид (AcYVAD-CHO), ингибирует синтез IL-1β и IFN-γ человеческими мононуклеарными клетками периферической крови (РВМС), стимулированный LPS. Процент (%) ингибирования приведен для синтеза IL-1β (незакрашенное квадраты) и IFN-γ (незакрашенные ромбы) как функция от концентрации ингибитора (мкМ).
Фиг.6. Соединение 214е ингибирует продукцию IL-1β в мышах в ответ на введение LPS. Образцы сыворотки мышей CD1 после введения LPS анализировали на уровни IL-1β (пг/мл) с помощью ELISA-теста. Соединение 214е вводили путем интраперитонеальной инъекции (IP) через один час после введения LPS. Кровь собирали через семь часов после введения LPS (Пример 7).
Фиг.7. Соединение 217е ингибирует продукцию IL-1β в мышах в ответ на введение LPS. Образцы сыворотки мышей CD1 после введения LPS анализировали на уровни IL-1β (пг/мл) с помощью ELISA-теста. Соединение 217е вводили путем интраперитонеальной инъекции (IP) через один час после введения LPS. Кровь собирали через семь часов после введения LPS (Пример 7).
Фиг.8. Соединение 214е, но не соединение 217е, при принудительном введении в ротовую полость, ингибирует продукцию IL-1β в мышах в ответ на введение LPS. В этом исследовании определяли оральную абсорбцию при условиях, описаных для фиг.6 и 7. Эти результаты показывают, что соединение 214е является потенциально активным ингибитором ICE при оральном применении (см. Пример 7).
Фиг.9. Соединение 214е и его аналоги также ингибируют продукцию IL-1β при IP введении. Эти результаты получены в условиях, описанных для фиг.6 и 7 и в Примере 7.
Фиг.10. Соединение 214е и его аналоги также ингибируют продукцию IL-1β при пероральном (РО) введении. Эти результаты получены в экспериментальных условиях, описаных для фиг.6 и 7 и в Примере 7.
Фиг.11А/В. Соединения 302 и 304а демонстрируют детектируемые клеточные уровни в крови при пероральном введении (50 мг/кг, в 0,5% карбоксиметилцеллюлозе) мышам.
Образцы крови собирали через 1 и 7 часов после приема дозы. Соединения 302 и 304а являются предшественниками 214е и метаболизируются в 214е in vivo. Определяемый в крови уровень соединения 214е не превышает 0,10 мкг/мл при пероральном введении (Пример 8).
Фиг.12. Соединение 412f блокирует прогрессию коллаген-индуцированного артрита II типа у самцов мышей DBA/1J (Wooley, Р.H., Methods in Enzymology, 162, pp.361-373 (1988) and Geiger, Т., Clinical and Experimental Reumatology, 11, pp.515-522 (1993)). Соединение 412f вводили перорально через зонд дважды в день (10, 25 и 50 мг/кг), с интервалом приблизительно в 7 часов. Воспаление определяли по Шкале Тяжести Артрита от 1 до 4 баллов (увеличение числа баллов соответствует увеличению тяжести заболевания). Добавляли число баллов по двум передним лапкам, получая конечное число баллов (см. Пример 21).
Фиг.13. Соединение 412d блокирует прогрессию коллаген-индуцированного артрита II типа у самцов мышей DBA/1J. Эти результаты получены в условиях, описаных для фиг.12 и в Примере 21.
Фиг.14. Соединение 696а блокирует прогрессию коллаген-индуцированного артрита II типа у самцов мышей DBA/1J. Эти результаты получены в условиях, описаных для фиг.12 и в Примере 21.
СОКРАЩЕНИЯ И ОПРЕДЕЛЕНИЯ
Сокращения
Обозначения Реагент или фрагмент
Ala аланин
Arg аргинин
Asn аспарагин
Asp аспарагиновая кислота
Cys цистеин
Gln глутамин
Glu глутаминовая кислота
Gly глицин
His гистидин
Ile изолейцин
Leu лейцин
Lys лизин
Met метионин
Phe фенилаланин
Pro пролин
Ser серин
Thr треонин
Trp триптофан
Tyr тирозин
Val валин
Ac2O уксусный ангидрид
n-Bu нормальный бутил
DMF диметилформамид
DIEA N,N-диизопропилэтиламин
EDC гидрохлорид 1-(3-диметиламинопропил)-3-
этилкарбодиимида
Et2O диэтиловый эфир
EtOAc этилацетат
Fmoc 9-флуоренилметоксикарбонил
HBTU гексафторфосфат O-бензотриазол-1-ил-
N,N,N’,N’-тетраметилурония
HOBT гидрат 1-гидроксибензотриазола
MeOH метанол
TFA трифторуксусная кислота
Alloc аллилоксикарбонил
Определения
В данном описании применяются следующие термины:
Термин "фактор, индуцирующий интерферон гамма", или "IGIF", относится к фактору, способному стимулировать эндогенную продукцию IFN-γ .
Термин "ингибитор ICE" относится к соединению, способному ингибировать этот фермент. Ингибирование ICE можно определять с помощью методов, описанных здесь, или включенных в качестве ссылки. Опытным специалистам известно, что ингибитор ICE in vivo не обязательно является ингибитором ICE in vitro. Например, в тестах in vitro соединение в форме пролекарства обычно демонстрирует отсутствие активности, или низкую активность. Такие пролекарственные формы могут изменяться под действием метаболических или других биохимических процессов в организме пациента, с образованием in vivo ингибитора ICE.
Термин "цитокин" относится к молекулам, которые опосредуют взаимодействия между клетками.
Термин "состояние" относится к любому заболеванию, нарушению, или воздействию, имеющему вредные биологические последствия для субъекта.
Термин "субъект" относится к животному, или к одной или нескольким клеткам, полученным из животного. В предпочтительном варианте животное является млекопитающим, наиболее предпочтительно, человеком. Клетки могут быть в любой форме, включая, не ограничиваясь ими, клетки, сохраняющиеся в тканях, клеточные кластеры, не погибшие клетки, трансфицированные или трансформированные клетки и клетки, полученные от животного, измененного физически или фенотипически.
Термин "активный участок" обозначает любой или все следующие участки ICE: участок, связывающий субстрат, участок, с которым связывается ингибитор, и участок, на котором происходит расщепление субстрата.
Термин "гетероцикл" или "гетероциклический" относится к стабильным моно- или полициклическим соединениям, которые могут необязательно содержать одну или две двойные связи, или одно или несколько ароматических колец. Каждый гетероцикл состоит из атомов углерода и от одного до четырех гетероатомов, независимо выбранных из группы, включающей азот, кислород и серу. Используемые здесь термины "гетероатомы азота" и "гетероатомы серы" включают любую окисленную форму азота или серы и четвертичную форму любого основного азота. Определенные выше гетероциклы включают, например, пиримидинил, тетрагидрохинолил, тетрагидроизохинонлинил, пуринил, пиримидил, индолинил, бензимидазолил, имидазолил, имидазолиноил, имидазолидинил, хинолил, изохинолил, индолил, пиридил, пирролил, пирролинил, пиразолил, пиразинил, хиноксолил, пиперидинил, морфолинил, тиаморфолинил, фурил, тиенил, триазолил, тиазолил, β -карболинил, тетразолил, тиазолидинил, бензофураноил, тиаморфолинил сульфон, бензоксазолил, оксопиперидинил, оксопирролидинил, оксоазепинил, азепинил, изоксазолил, тетрагидропиранил, тетрагидрофуранил, тиадиазолил, бензодиоксолил, бензотиенил, тетрагидротиофенил и сульфоланил. Другие гетероциклы описаны в A.R. Katritzky and С.W. Rees, eds. Comprehensive Heterocyclic Chemistry: The Structure, Reactions, Synthesis and Use of Heterocyclic Compounds. Vol.1-8, Pergamon Press, NY (1984).
Термин "циклоалкил" относится к моно- или полициклическим группам, содержащим от 3 до 15 атомов углерода, и могут необязательно содержать одну или две двойные связи. Примеры включают циклогексил, адамантил и норборнил. Термин "арил" относится к моно- или полициклическим группам, содержащим 6, 10, 12 или 14 атомов углерода, в которых как минимум одно кольцо является ароматическим. Примеры включают фенил, нафтил и тетрагидронафталин.
Термин "гетероароматический" относится к моно- или полициклическим группам, содержащим от 1 до 15 атомов углерода и от одного до четырех гетероатомов, каждый из которых независимо выбран из группы, включающей серу, азот и кислород и которые дополнительно содержат от 1 до 3 пяти- или шестичленных колец, как минимум одно из которых является ароматическим.
Термин "альфа-аминокислота" (α -аминокислота) относится как к встречающимся в природе аминокислотам, так и к другим, "небелковым", α -аминокислотам, обычно использующимся в пептидной химии для получения синтетических аналогов природных пептидов, включающим D и L формы. Природными аминокислотами являются глицин, аланин, валин, лейцин, изолейцин, серин, метионин, треонин, фенилаланин, тирозин, триптофан, цистеин, пролин, гистидин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, γ -карбоксиглютаминовая кислота, аргинин, орнитин и лизин. Примеры "небелковых" α -аминокислот включают гидроксилизин, гомосерин, гомотирозин, гомо-фенилаланин, цитруллин, кинуренин, 4-амино-фенилаланин, 3-(2-нафтил)-аланин, 3-(1-нафтил)-аланин, метионин сульфон, т-бутил-аланин, т-бутилглицин, 4-гидроксифенилглицин, аминоаланин, фенилглицин, винилаланин, пропаргил-глицин, 1,2,4-триазол-3-аланин, 4,4,4-трифтор-треонин, тиронин, 6-гидрокситриптофан, 5-гидрокситриптофан, 3-гидроксикинуренин, 3-аминотирозин, трифторметилаланин, 2-тиенилаланин, (2-(4-пиридил)этил)-цистеин, 3,4-диметоксифенилаланин, 3-(2-тиазолил)-аланин, иботеновую кислоту, 1-амино-1-циклопентанкарбоновую кислоту, 1-амино-1-циклогексанкарбоновую кислоту, хискваловую кислоту, 3-трифторметилфенилаланин, 4-трифторметилфенилаланин, циклогексилаланин, цикло-гексилглицин, тиогистидин, 3-метокситирозин, эластатинал, норлейцин, норвалин, аллоизолейцин, гомоаргинин, тиопролин, дегидропролин, гидроксипролин, изонипектотовую кислоту, гомопролин, циклогексилглицин, α -амино-н-масляную кислоту, циклогексилаланин, аминофенилмасляную кислоту, фенилаланин, замещенный в орто, мета или пара положении фенильного фрагмента одним или двумя из следующих заместителей: (C1-C4) алкил, (C1-C4) алкокси, галоген или нитро группами или замещен метилендиокси группой; β -2- и 3-тиенилаланин, β -2- и 3-фуранилаланин, β -2, 3- и 4-пиридилаланин, β -(бензотиенил-2- и 3-ил)аланин, β -(1- и 2-нафтил)аланин, O-алкилированные производные серина, треонина или тирозина, S-алкилированный цистеин, S-алкилированный гомоцистеин, О-сульфатный, O-фосфатный и O-карбоксильный эфиры тирозина, 3-сульфотирозин, 3-карбокситирозин, 3-фосфотирозин, эфир тирозина с 4-метансульфоновой кислотой, 4-метанфосфониевый эфир тирозина, 3,5-дииодтирозин, 3-нитротирозин, ε -алкиллизин, и дельта-алкилорнитин. Любая из этих α -аминокислот может быть замещена метильной группой в альфа-положении, атомом галогена в любом ароматическом остатке α -амино боковой цепи, или соответствующей защитной фуппой при О, N или S атомах боковой цепи аминокислотных остатков. Соответствующие защитные группы раскрыты в "Protective Groups In Organic Synthesis," T.W.Greene and P.G.M. Wuts, J. Wiley & Sons, NY, NY, 1991.
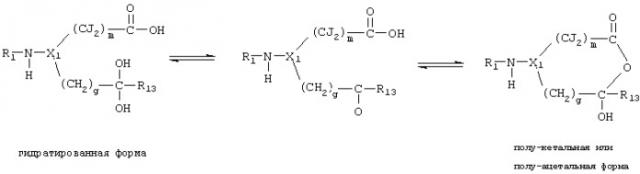
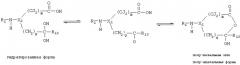
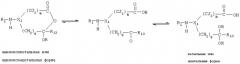
Термин "замещать" подразумевает замещение атома водорода в соединении замещающей группой. В настоящем изобретении атомы водорода, которые составляют часть фрагмента, участвующего в образовании водородной связи, способного образовать водородную связь с карбонильным кислородом Arg-341 ICE или карбонильным кислородом Ser-339 ICE, исключены из замещения. К таким исключенным атомам водорода относятся атомы, входящие в состав -NH-групп, находящихся в альфа-положении по отношению к -СО- группе, и описываются скорее как -NH-, чем как Х группа, или некоторые другие обозначения в следующих диаграммах: (а) через (t), (v) через (z).
Термин "прямая цепь" относится к прилегающей неразветвленной цепочке ковалентно связанных атомов. Прямая цепь может быть замещена, но ее заместители не являются частью прямой цепи.
Термин "Кi" относится к численному значению эффективности соединения при ингибировании активности фермента-мишени, такого, как ICE. Уменьшение значения Кi соответствует увеличению эффективности. Значение Ki получают в результате приведения экспериментально полученных значений скорости к стандартным уравнениям ферментативной кинетики (see I.H.Segel, Enzyme Kinetics, Wiley-Interscience, 1975).
Термин "пациент", используемый в данной заявке, относится к любому млекопитающему, особенно к человеку.
Термин "фармацевтически эффективное количество" относится к количеству, проявляющему эффективное действие при лечении или облегчении IL-I-, апоптоз-, IGIF- или IFN-γ -опосредованных заболеваний у пациента. Термин "профилактически эффективное количество" относится к количеству, обладающему эффективностью в предотвращении или существенном уменьшении риска IL-I-, апоптоз-, IGIF-или IFN-γ - опосредованных заболеваний у пациента.
Термин "фармацевтически приемлемый носитель, или адъювант" относится к нетоксичному носителю или адъюванту, который может быть введен пациенту вместе с соединением данного изобретения и который не нарушает его фармакологическую активность.
Термин "фармацевтически приемлемое производное" обозначает любую фармацевтически приемлемую соль, сложный эфир, или соль такого эфира соединения данного изобретения, или любое другое соединение, которое при введении реципиенту способно производить (прямым или непрямым образом) соединение данного изобретения или анти-ICE активный метаболит или их остаток.
Фармацевтически приемлемые соли соединений данного изобретения включают, например, соли, полученные из фармацевтически приемлемых неорганических и органических кислот и оснований. Примеры подходящих кислот включают хлористоводородную, бромистоводородную, серную, азотную, перхлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную, толуол-п-сульфоновую, винную, уксусную, лимонную, метансульфоновую, муравьиную, бензойную, малоновую, нафталин-2-сульфоновую и бензолсульфоновую кислоты. Другие кислоты, такие, как щавелевая, несмотря на то, что сами по себе не являются фармацевтически приемлемыми, могут применяться при получении солей, использующихся в качестве промежуточных веществ при получении соединений данного изобретения и их фармацевтически приемлемых солей присоединения кислот. Соли, получаемые из соответствующих оснований, включают соли щелочных металлов (напр., натрия), щелочноземельных металлов (напр., магния), аммония и N-(C1-4 aлкил)
| + |
| 4 |
Ингибиторы ICE данного изобретения могут содержать один или несколько "асимметрических" атомов углерода и, таким образом, могут находиться в виде рацематов и рацемических смесей, индивидуальных энантиомеров, смесей диастереомеров и индивидуальных диастереомеров. Все эти изомерные формы соединений специально включены в настоящее изобретение. Каждый стереогенный атом углерода может быть R или S конфигурации. Хотя специфические соединения и строительные блоки, представленные в примерах в этой заявке, могут быть описаны в отдельной стереохимической конфигурации, также рассматриваются соединения и строительные блоки, имеющие каждый противоположную стереохимию в любом данном хиральном центре или их смеси.
Ингибиторы ICE данного изобретения могут включать циклические структуры, которые могут быть необязательно замещены при атомах углерода, азота или других атомах различными заместителями. Такие циклические структуры могут быть замещены одним или несколькими заместителями. Предпочтительно циклические структуры содержат от 0 до 3 заместителей. При множественном замещении каждый заместитель может быть выбран независимо от других, при условии того, что комбинация заместителей приводит к образованию стабильного соединения.
В данном изобретении рассматриваются только те комбинации заместителей и вариации, которые приводят к образованию стабильных соединений. Используемый здесь термин "стабильный" относится к соединениям, обладающим достаточной стабильностью для проведения промышленного производства и введения млекопитающим с помощью известных в этой области методов. Обычно такие соединения являются стабильными при температуре 40°С или ниже, в отсутствие влаги или других химически реактивных условий, в течение как минимум одной недели.
Заместители могут быть представлены в различной форме. Эти формы известны опытным специалистам и являются взаимозаменяемыми. Например, метильный заместитель на фенильном кольце может быть представлен в любой из следующих форм:
Здесь взаимозаменяемо используются различные формы таких заместителей, как метил.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для более полного понимания описываемого изобретения далее приводится его подробное описание.
Ингиби