Замещенные 3-оксо-1,2,3,4-тетрагидрохиноксалины, фармацевтические композиции (варианты), способ их получения и применения
Иллюстрации
Показать всеИзобретение относится к замещенным 3-оксо-1,2,3,4-тетрагидрохиноксалинам общей формулы 1, являющимися высокоэффективными ингибиторами каспазы-3, которые могут быть использованы для получения фармацевтической композиции, для лечения заболеваний, связанных с повышенной активацией апоптоза, и для экспериментального (in vitro, in vivo) исследования процессов апоптоза в качестве “фармакологических инструментов”. В соединениях общей формулы 1:
R1 представляет замещенную сульфанильную группу или замещенную сульфонильную группу, содержащую в качестве заместителей необязательно замещенный С1-4алкил, необязательно замещенный С3-8циклоалкил, необязательно замещенный в арильном и/или алкильном фрагменте арилС1-4алкил, необязательно замещенный в гетероциклическом и/или алкильном фрагменте гетероциклилС1-4алкил, необязательно замещенный арил, необязательно замещенный гетероциклил; R2 и R3 независимо друг от друга представляют атом водорода, галогена, CN, NO2, необязательно замещенную гидроксигруппу или необязательно замещенную аминогруппу, необязательно замещенную карбоксильную группу, необязательно замещенную карбамоильную, необязательно замещенную арилоксикарбонильную группу или необязательно замещенную гетероциклилкарбонильную группу; R4 и R5 независимо друг от друга представляют: атом водорода или инертный заместитель, Изобретение также относится к фармацевтической композиции в форме таблеток, капсул или инъекций помещенных в фармацевтически приемлемую упаковку, а также к способу ее получения и способу лечения. 6 с.п. ф-лы, 3 ил.
Реферат
Данное изобретение относится к новым 1,2,3,4-тетрагидрохиноксалинам, обладающим физиологической активностью. Более конкретно, настоящее изобретение относится к новым замещенным 3-оксо-1,2,3,4-тетрагидрохиноксалинкарбоновым кислотам их эфирам и амидам, обладающим физиологической активностью.
Настоящее изобретение относится также к новому хемотипу веществ, а именно замещенным 1,2,3,4-тетрагидрохиноксалинам, обладающих специфической физиологической активностью, позволяющей использовать их в качестве “молекулярных инструментов”, а также активных лекарственных субстанций, селективно подавляющих программируемую клеточную смерть (апоптоз - Apoptosis: Pharmacological Implications and Therapeutic Opportunities. Kaufmann, S. H., Ed.; Academic Press: San Diego, 1997); а также к фармацевтическим композициям, содержащим указанные соединения в виде активных субстанций; а также к способу лечения и предупреждения развития различных заболеваний, связанных с повышенной активацией апоптоза. Этот исключительно широкий круг заболеваний включает, в частности, кардиоваскулярные (например, острые ишемические поражения - инсульт, инфаркт миокарда); нейродегенеративные, например, болезни Паркинсона и Альцгеймера (Ryan С., Salvesen G. Caspases and neuronal development. Biol Chem. 2003, 384(6):855-861), вирусные заболевания (например, гепатит-С и СПИД), и т.д. (Cryns, V.L.; Yuan, J. The cutting edge: Caspases in apoptosis and disease. In When Cells Die; Lockshin, R.A., Zakeri, Z., Tilly, J.L., Eds.; Wiley-Liss: New York, 1998; p.177-210).
В основе фармакологического эффекта замещенных 1,2,3,4-тетрагидрохиноксалинов лежит высокоэффективное подавление апоптоза, реализуемое посредством ингибирования цистеиновой протеазы - каспазы-3, играющей ключевую роль в развитии апоптоза.
В настоящее время совершенно ясно, что жизнь многоклеточных организмов основана на балансе постоянно протекающих процессов. Деление и рост клеток должны сопровождаться альтернативным процессом удаления старых, поврежденных, мутировавших и других нежелательных для организма клеток. Управляемую форму программированной смерти клетки с характерными морфологическими и биохимическими признаками определяют как апоптоз (греческое слово, соответствующее русскому "листопаду": аро - отделение, ptosis - падение) (Apoptosis: Pharmacological Implications and Therapeutic Opportunities. Kauftnann, S. H., Ed.; Academic Press: San Diego, 1997); (When Cells Die; Lockshin, R.A., Zakeri, Z., Tilly, J.L., Eds.; Wiley-Liss: New York, 1998). На сегодняшний день установлено, что нарушение контроля клеточной гибели ведет к сдвигам гомеостаза и развитию различных патологических состояний (Nicholson D.W. From bench to clinic with apoptosis-based therapeutic agents. Nature (London) 2000, 407:810-816). В случае повышенной активации апоптоза возникают самые серьезные патологии, относящиеся к кардиоваскулярным, нейродегенеративным, инфекционным, метаболическим и т.п. заболеваниям (Cryns V.L.; Yuan J. The cutting edge: Caspases in apoptosis and disease. In When Cells Die; Lockshin, R.A., Zakeri, Z., Tilly, J.L., Eds.; Wiley-Liss: New York, 1998; p.177-210). Так, показано, что протекание СПИДа и ряда тяжелых заболеваний нервной системы (паркинсонизм, болезнь Альцгеймера) характеризуется повышенной активацией апоптоза (Hartmann A., Hunot S., Michel P., Muriel M.-P., Vyas S., Faucheux В., Mouatt-Prigent P., Turmel H., Srinivasan A., Ruberg M., Evan G., Agid Y., Hirsch E. Caspase-3: A vulnerability factor and final effector in apoptotic death of dopaminergic neurons in Parkinson’s disease. PNAS 2000, 97(6):2875-2880). При ишемии мозга и инсульте значительная часть клеток пораженной области умирает именно по механизму апоптоза. Применительно к клеткам животных и человека апоптоз в большинстве случаев связан с протеолитической активацией каскада каспаз - семейства эволюционно консервативных цистеиновых протеаз, которые специфически расщепляют белки после остатков аспарагиновой кислоты. На основе структурной гомологии каспазы подразделяются на подсемейства а) каспазы-1 (каспазы 1, 4, 5), б) каспазы-2 (каспаза-2) и в) каспазы-3 (каспазы 3, 6-10) (Nicholson, D.W.; Thornberry, N.A. Caspases: killer proteases. Trends Biochem. Sci. 1997, 22:299-306); (Nicholson D.W. Caspase structure, proteolytic substrates and function during apoptotic cell death [Review]. Cell. Death. Diff. 1999, 6:1028-1042).
Особенно важную роль, фактически определяющую жизненные перспективы клеток, играет каспаза-3 (Porter, A.G.; Janicke, R.U. Emerging roles of caspase-3 in apoptosis. Cell Death Differ. 1999, 6:99-104).
Поэтому поиск высокоэффективных ингибиторов касазы-3, способных блокировать развитие апоптоза, является весьма перспективным подходом к созданию принципиально новых кардиопротекторов (Chapman J., Magee W., Stukenbrok H., Beckius G., Milici A., Tracey W.A novel nonpeptidic caspase-3/7 inhibitor, (S)-(+)-5-[1-(2-methoxymethylpyrrolidinyl)-sulfonyl]isatin reduces myocardial ischemic injury. Eur. J. Pharmacol. 2002, 456(1-3):59-68), нейропротекторои (Scott С., Sobotka-Briner С., Wilkins D., Jacobs R., Folmer J., Frazee W., Bhat R., Ghanekar S., Aharony D. Novel Small Molecule Inhibitors of Caspase-3 Block Cellular and Biochemical Features of Apoptosis. PharmacoI. Exp. Therap. 2003, 304(1):433-440), гепатопротекторов (Anselmo D., Katori M., Kaldas M., Hoglen N., Valentino K., Busuttil R., Kupiec-Weglinski W., Farmer, D. Apoptosis targeted therapy with the caspase inhibitor IDN-6556, ameliorates ex-vivo liver ischemia reperfusion injury. Am J Transplant 2002, 2(Suppl. 3):920) для лечения и защиты от широкого круга заболеваний, ключевым звеном которых является апоптоз.
Многочисленные исследования, проведенные в последнее время, привели к открытию высокоэффективных ингибиторов каспазы-3 в ряду пептидных (Garcia-Calvo M., Peterson E., Leiting В., Ruel R., Nicholson D., Thornberry N. Inhibition of human caspases by peptide-based and macromolecular inhibitors. J. Biol. Chem. 1998, 273:32608-32613) и пептидомиметических соединений (Karanewsky D., Bai X., Linton S., Krebs J., Wu J., Pham В., Tomaselli K. Conformationally constrained inhibitors ofcaspase-1 and of the human CED-3 homologue caspase-3. Bioorg. Med. Chem. Lett. 1998, 8:2757-2762). Примером такого рода соединений могут служить, например, следующие пептидомиметические производные, разработанные фирмами Idun Pharmaceuticals, Inc. (Tomaselli K.J., Gladstone P.L., Temansky R.J. WO 0179162 October 25, 2001) и Vertex Pharmaceuticals Inc. (Golec, J., Lang, P., Diu-Hercend, A., Knegtel, R., Weber, P., Miller, K., Hercend, Т., Mortimore, M., Miller, A. WO 0285899 October 31, 2002).
Однако такого рода соединения имеют весьма ограниченную возможность клинического применения, что связано с их неудовлетворительными фармакокинетическими и физикохимическими свойствами (Scott С., Sobotka-Briner С., Wilkins D., Jacobs R., Folmer J., Frazee W., Bhat R., Ghanekar S., Aharony D. Novel Small Molecule Inhibitors of Caspase-3 Block Cellular and Biochemical Features of Apoptosis. PharmacoI. Exp. Therap. 2003, 304(1):433-440). В этой связи продолжаются поиски непептидных низкомолекулярных каспазных ингибиторов. Так, были найдены достаточно эффективные ингибиторы (IC50=5-40 nМ) каспазы-3 в ряду изатинов, например, (Chapman J., Magee W., Stukenbrok H., Beckius G., Milici A., Tracey W. A novel nonpeptidic caspase-3/7 inhibitor, (S)-(+)-5-[l-(2-methoxymethylpyrrolidinyl) sulfonyl]isatin reduces myocardial ischemic injury. Eur J. Pharmacol. 2002, 456(1-3):59-68) и (Lee, D., Long, S.A., Murray, J.H. et al. Potent and selective nonpeptide inhibitors ofcaspases 3 and 7. J Med Chem 2001,44(12): 2015-2026)
Однако невысокая селективность соединений этого класса стимулирует дальнейшие поиски ингибиторов каспазы-3. Так, недавно были обнаружены каспазные ингибиторы в ряду хиназолинов, вещества обладают умеренной активностью и селективностью (Scott С., Sobotka-Briner С., Wilkins D., Jacobs R., Folmer J., Frazee W., Bhat R., Ghanekar S., Aharony D. Novel Small Molecule Inhibitors ofCaspase-3 Block Cellular and Biochemical Features of Apoptosis. PharmacoL. Exp. Therap. 2003, 304(1):433-440).
Известны различные 3-оксо-1,2,3,4-тетрагидрохиноксалины, в том числе обладающие различными видами биологической активности (Riess, G.; Kleim, J.-P.; Rosner, M.; Paessens, A.; Blunck, M. Eur. Pat. EP 0655166 B1, 2003. Meichsner, C.; Riess, G.; Winkler, I. Eur. Pat. EP 0708093 B1, 2001. Billhardt, U.-M.; Rosner, M.; Riess, G.; Winkler, I.; Bender, R. Pat. EP 0509398 B1, 2001. Kleim, J.-P.; Bender, R.; Kirsch, R.; Meichsner, C.; Paessens, A. Antimicrob, Agents & Chemoter. 1995, 39(10), 2253-2257).
Однако в научной и патентной литературе до настоящего времени отсутствовали сведения об антипротеазной активности замещенных 1,2,3,4-тетрагидрохиноксалинов и биологической активности замещенных 3-оксо-1,2,3,4-тетрагидрохиноксалинкарбоновых кислот их эфиров и амидов.
В результате проведенных исследований, направленных на поиск новых биологически активных соединений, в том числе селективно подавляющих программируемую клеточную смерть (апоптоз), изобретатели обнаружили, что замещенные 3-оксо-1,2,3,4-тетрагидрохиноксалины являются новым хемотипом непептидных ингибиторов каспаз-3.
Более конкретно данное изобретение относится к “молекулярным инструментам” и активным лекарственным субстанциям, селективно подавляющим программируемую клеточную смерть (апоптоз); а также к фармацевтическим композициям, содержащим в качестве активных субстанций замещенные 3-оксо-1,2,3,4-тетрагидрохиноксалины, в том числе к новые замещенным 3-оксо-1,2,3,4-тетрагидрохиноксалинкарбоновые кислоты их эфиры и амиды, а также к способу их получения и способу ее применения для лечения и предупреждения развития различных заболеваний, связанных с повышенной активацией апоптоза, например, острых ишемических поражений (например, инсульт, инфаркт миокарда), нейродегенеративных (например, болезни Паркинсона и Альцгеймера), вирусных заболеваний (например, гепатит-С и СПИД), и т.д. Данное изобретение относится также к новым замещенным 3-оксо-1,2,3,4-тетрагидрохиноксалинкарбоновым кислотам их эфирам и амидам.
Ниже приведены определения терминов, которые использованы в описании этого изобретения:
“Комбинаторная библиотека” означает коллекцию соединений полученных параллельным синтезом, предназначенную для поиска лидера или оптимизации биологической активности лид-соединения, причем каждое соединение библиотеки соответствует общему скэффолду и библиотека является коллекцией родственных гомологов или аналогов.
“Фокусированная библиотека” означает комбинаторную библиотеку, или совокупность нескольких комбинаторных библиотек, или совокупность библиотек и веществ, специальным образом организованную, с целью увеличения вероятности нахождения хитов и лидеров или с целью повышения эффективности их оптимизации. Дизайн фокусированных библиотек, как правило, связан с направленным поиском эффекторов (ингибиторов, активаторов, агонистов, антагонистов и т.п.) определенных биомишеней (ферментов, рецепторов, ионных каналов и т.п.).
“Лид-соединение” означает соединение с выдающейся активностью, относящейся к определенной болезни.
“Скэффолд” означает общую структурную формулу или молекулярный каркас или инвариантную область соединений, характерную для всех соединений, входящих в комбинаторную библиотеку.
“Хемотип” означает серию соединений, объединенную общей структурной формулой, и обладающую определенным общим свойством, например, каким-то видом физиологической активности. Можно сказать, например, "новый хемотип активаторов калиевых каналов", или "известный хемотип киназных ингибиторов", и т.д. Как правило, наличие общего структурного фрагмента у соединений в рамках одного хемотипа является необходимым и достаточным условием для наличия у них общего свойства.
“Заместитель” означает химический радикал, который присоединяется к скэффолду или полупродукту синтеза в процессе их синтеза. В качестве заместителя могут служить атом галогена, гидроксильная группа, карбоксиалкильная группа, карбоксильная группа, карбамоильная группа или инертный заместитель.
“Инертный заместитель” ("Non-interfering substituent") означает низко- или нереакционоспособный радикал включая, но не ограничивая С1-С7 алкил, С2-С7 алкенил, С2-С7 алкинил, C1-С7 алкокси, С7-C12 аралкил, замещенный аралкил, С7-С12 гетероциклилалкил, замещенный гетероциклилалкил, С7-C12 алкарил, С3-С10 циклоалкил, С3-С10 циклоалкенил, фенил, замещенный фенил, толуил, ксиленил, бифенил, С2-C12 алкоксиалкил, С2-С10 алкилсульфинил, С2-С10 алкилсульфонил, (СН2)m-O-(C1-С7 алкил), -(CH2)m-N(C1-С7 алкил)n, арил, замещенный арил, замещенный алкокси, фторалкил, арилоксиалкил, гетероциклил, замещенный гетероциклил и нитроалкил; где m и n имеют значение от 1 до 7. Предпочтительными “инертными заместителями” являются C1-С7 алкил, С2-С7 алкенил, С2-С7 алкинил, C1-С7 алкокси, С7-C12 аралкил, С7-C12 алкарил, С3-С10 циклоалкил, С3-С10 циклоалкенил, фенил, замещенный фенил, (CH2)m-O-(C1-С7 алкил), -(CH2)m-N(C1-С7 алкил)n, арил, замещенный арил, гетероциклил и замещенный гетероциклил.
“Замещенная группа, замещенный радикал или скэффолд” означают, соответственно группу, радикал или скэффолд, у которых имеется заместитель, включая, но не ограничивая: инертный заместитель, атом галогена, нитрогруппу, цианогруппу, сульфогруппу, гидроксильную группу, аминогруппу, карбоксиалкильную группу, карбоксильную группу, карбамоильную группу. Например, замещенный алкил означает алкил, у которого один или несколько заместителей, например, гидроксиалкил или метилоксикарбонилалкил, аминометоксикарбонилметил, диметиламиноалкил, 2-гидрокси-2-метоксикарбонил-этил и др.; замещенная аминогруппа означает аминогруппу, у которой имеется один или два заместителя, например, ациламиногруппа, N,N-диалкиламиногруппа, N-ацил-N-арил-аминогруппа, ацетил-метоксикарбонилметиламино группа и др.; замещенный фенил означает фенил, у которого имеется один или несколько заместителей, например 2-метоксикарбонилфенил, 4-амино-3-метоксикарбонилфенил, 3,4-диаминофенил и др.
“Необязательно замещенная группа, необязательно замещенный радикал или скэффолд” означают, соответственно группу, радикал или скэффолд, включающие группы, радикалы или скэффолды с заместителями и без заместителей. Например, понятие необязательно замещенная аминогруппа включает: незамещенную аминогруппу и аминогруппы, содержащие любые, не противоречащие химии заместители, включая, но не ограничивая ациламиногруппы, N,N-диалкиламиногруппы, N-ацил-N-ариламиногруппы, ацилметоксикарбонилметиламино группы и др.
“Арил” означает один или более ароматических циклов, каждой из которых включает 5 или 6 атомов углерода. “Арил” может быть конденсированным полициклом, например, как нафталин или неконденсированным, например как бифенил. “Замещенный арил” имеет один или несколько “не мешающих” заместителей.
“Галоген” означает атом фтора, хлора, брома или иода.
“Гетероцикл” означает один или несколько насыщенных или ароматических циклов с 5, 6 или 7 атомами, по крайней мере, один из которых является гетероатомом. Преимущественными гетероатомами являются сера, кислород и азот. “Гетероцикл” может быть конденсированным полициклом, например, как бензимидазол, бензоксазол. бензтиазол, хинолин или неконденсированным, например, как бипиридил.
“Азогетероцикл” означает Гетероцикл, включающий, по крайней мере, один атом азота, например, как бензимидазол, бензоксазол, бензтиазол, хинолин.
“Замещенный гетероцикл” означает гетероцикл, имеющий один или несколько “не мешающих” заместителей.
“Параллельный синтез” означает метод проведения химического синтеза комбинаторной библиотеки индивидуальных соединений.
Целью настоящего изобретения является создание нового хемотипа биологически активных соединений селективно подавляющих программируемую клеточную смерть (апоптоз).
Поставленная цель достигаются физиологически активными замещенным 3-оксо-1,2,3,4-тетрагидрохиноксалинами общей формулы 1
в которой:
R1 представляет замещенную сульфанильную группу или замещенную сульфонильную группу, содержащие в качестве заместителей необязательно замещенный С1-4 алкил, необязательно замещенный С3-8 циклоалкил, необязательно замещенный в арильном и/или алкильном фрагменте арилС1-4алкил, необязательно замещенный в гетероциклическом и/или алкильном фрагменте гетероциклилС1-4алкил, необязательно замещенный арил, необязательно замещенный гетероциклил;
R2 и R3 независимо друг от друга представляют атом водорода, галогена, CN, NO2, необязательно замещенную гидроксигруппу или необязательно замещенную аминогруппу, необязательно замещенную карбоксильную группу, необязательно замещенную карбамоильную, необязательно замещенную арилоксикарбонильную группу или необязательно замещенную гетероциклилкарбонильную группу;
R4 и R5 независимо друг от друга представляют: атом водорода или инертный заместитель; обладающие свойствами ингибиторов каспазы-3 для получения фармацевтической композиции и для экспериментального (in vitro, in vivo) исследования процессов апоптоза в качестве фармакологических инструментов.
Целью настоящего изобретения является также создание новой фармацевтической композиции в форме таблеток, капсул или инъекций помещенных в фармацевтически приемлемую упаковку.
Поставленная цель достигается фармацевтической композицией, обладающей свойствами ингибиторов каспазы-3 в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, содержащей в качестве активной субстанции фармацевтически эффективное количество замещенного 3-оксо-1,2,3,4-тетрагидрохиноксалина общей формулы 1.
Целью настоящего изобретения является также создание новой фармацевтической композиции для лечения и предупреждения развития различных заболеваний теплокровных животных и людей, связанных с повышенной активацией апоптоза в форме таблеток, капсул или инъекций помещенных в фармацевтически приемлемую упаковку.
Поставленная цель достигается фармацевтической композиции для лечения и предупреждения развития различных заболеваний теплокровных животных и людей, связанных с повышенной активацией апоптоза в форме таблеток, капсул или инъекций помещенных в фармацевтически приемлемую упаковку, содержащей в качестве активной субстанции фармацевтически эффективное количество 3-оксо-1,2,3,4-тетрагидрохиноксалина общей формулы 1.
Целью настоящего изобретения является также создание способа получения новой фармацевтической композиции.
Поставленная цель достигается способом получения фармацевтической композиции, обладающей свойствами ингибиторов каспазы-3, смешением активной субстанции с инертным наполнителем, разбавителем и/или растворителем, отличительная особенность которого состоит в том, что в качестве активной субстанции используется фармацевтически эффективное количество 3-оксо-1,2,3,4-тетрагидрохиноксалина общей формулы 1.
Целью настоящего изобретения также является способ лечения и предупреждения развития различных заболеваний теплокровных животных и людей, связанных с повышенной активацией апоптоза.
Поставленная цель достигается путем введения теплокровному животному или человеку фармацевтической композиции, содержащей в качестве активной субстанции фармацевтически эффективного количества 3-оксо-1,2,3,4-тетрагидрохиноксалина общей формулы 1.
Целью настоящего изобретения является создание новых биологически активных 3-оксо1,2,3,4-тетрагидрохиноксалинов.
Поставленная цель достигаются замещенными 3-оксо-1,2,3,4-тетрагидрохиноксалинкарбоновыми кислотами их эфирами или амидами общей формулы 2
в которых:
R1, R2, R4 и R5 имеют вышеуказанное для соединений общей формулы 1 значение, а R6 представляет необязательно замещенную гидроксигруппу, необязательно замещенную амино, необязательно замещенную арилокси или необязательно замещенную гетероциклилгруппу.
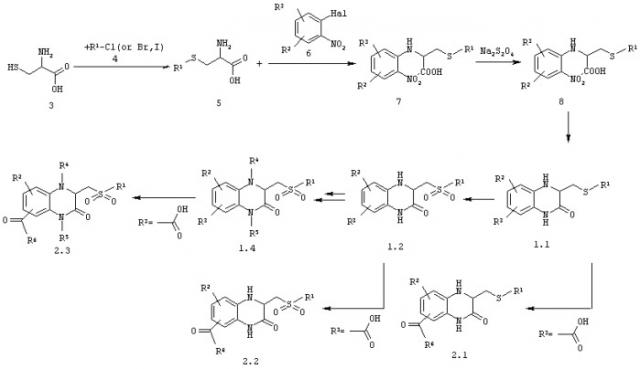
Схема синтеза 3-оксо-1,2,3,4-тетрагидрохиноксалины общей формулы 1 и 2 представлена ниже и основана на известных реакциях.
Для получения 3-оксо-1,2,3,4-тетрагидрохиноксалина общей формулы 1 и 2 могут быть использованы также опубликованные методики (Riess, G.; Kleim, J.-P.; Rosner, M.; Paessens, A.; Blunck, M. Eur. Pat. EP 0655166 B1, 2003. Meichsner, C.; Riess, G.; Winkler, I. Eur. Pat. EP 0708093 Bl, 2001. Billhardt, U.-M.; Rosner, M.; Riess, G.; Winkler, I.; Bender, R. Pat. EP 0509398 Bl, 2001. Kleim, J.-P.; Bender, R.; Kirsch, R.; Meichsner, C.; Paessens, A. Antimicrob, Agents & Chemoter. 1995, 39(10), 2253-2257).
Используемые в качестве исходных реагенты являются коммерчески доступными. Ниже изобретение описывается с помощью конкретных примеров получения конкретных соединений и комбинаторной библиотеки. Структуры полученных соединений подтверждались данными химического, хроматографического и спектрального анализа. Жидко-фазный параллельный синтез новых соединений и комбинаторной библиотеки осуществлялись с использованием специальных синтезаторов "CombiSyn-012-3000" [M.Бару, А.Иващенко, Патент России 2180609, 2002; РСТ WO 02/087740 A1, 2002.] и оборудования [Technology Platform. In Custom Chemistry; Chemical Diversity Labs, Inc.; San Diego, CA, 2002; p.5.].
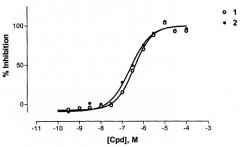
Биологическая (антипротеазная) активность соединений определялась на сериновой протеазе (Каспаза 3), которая вовлечена в регуляцию программированной клеточной смерти (апоптозис). Активность Каспазы 3 определялась по скорости расщепления пептидного субстрата, содержащего флуоресцентную молекулу, (метилкумарин) в соответствии с протоколом, описанным в Техническом Бюллетене фирмы Sigma-Aldrich [www.sigmaaldrich.com/sigma/bulletin/casp3fbul.pdf].
Изобретение иллюстрируется, но не ограничивается следующими примерами. Все растворители и реагенты были получены из коммерческих источников, таких как Акрос (Acros) (Бельгия), Сигма-Олдрич (Sigma-Aldrich) (США), Ланкастер (Lancaster) (Великобритания) и КемДив (ChemDiv) (США). Точки плавления (т.пл.) были получены на приборе фирмы Бюхи (Buchi) (Швейцария) модель В-520. 1Н и 13С ЯМР спектры были получены на спектрометре Gemini-300 (300 и 75 МГц соответственно) фирмы Вариан (Varian) (США) в CDCl3 или диметилсульфоксиде-d6. Химические сдвиги приведены в шкале 6 (ppm). Внутренний стандарт тетраметилсилан.
Содержание основного вещества контролировали с помощью HPLC на приборе Шимадзу (Shimadzu) 10-AV (колонка Luna-C18, Phenomenex, 25 см (4.6 мм, UV детектирование на 215 и 254 нм) и LC-MS (ВЖХ-МС) на приборе Applied Biosystems (Shimadzu 10-AV LC, автоматическая подача образца Gilson-215, масс-спектрометр API 150ЕХ, UV (215 и 254 нм) и ELS детекторы, колонка Luna-C18, Phenomenex, 5 см (2 мм).
Аналитическую ТСХ проводили на силикагеле на алюминиевых пластинках Silufol UV254 (5 см (15 см) (Kavalier, Czech Republic) или на стеклянных пластинках с 0.25-мм слоем силикагеля 60 F254 (Merck, Germany). Визуализация осуществлялась с помощью УФ света на длинне волны 254 нм. Для хроматографической очистки использовали силикагель 5-40 μm (Chemapol, Czech Republic) и 63 μm (EM Science, USA). В соответствии с данными LC/MS все синтезированные соединения имели содержание основного вещества выше 95% (если не указано иначе).
Примеры 1.
Общий способ получения 1,2,3,4-тетрагидрохиноксалинов общей формулы 1 и 2.
А. Общий способ получения 2-амино-3-сульфонилпропионовых кислот 5. В 2 л колбу, снабженную магнитной мешалкой и обратным холодильником, загружают 1 мол D,L-цистеина 3,1,1 мол соответствующего алкилирующего реагента 4, 2.2 мол NaOH и 500 мл воды. Реакционную смесь нагревают при 80-90°С и постоянном перемешивании 2-12 ч. Реакционную массу постепенно охлаждают при перемешивании 10°С и подкисляют 2% соляной кислотой до рН 5. Полученный продукт отделяют, промывают 5 раз по 100 мл воды и сушат. Получают кислоту 5, которую используют в дальнейшем синтезе без дополнительной очистки. Выход 85-95%.
Б. Общий способ получения 2-(2-нитроанилино)-3-сульфанилпропионовых кислот 7. В 2 л колбу, снабженную магнитной мешалкой и обратным холодильником, загружают 1 мол соответствующего 2-галоген-нитробензола 6, 1,1 мол соответствующей 2-амино-3-сульфонилпропионовых кислот 5, 2 мол NaOH и 500 мл воды. Реакционную смесь нагревают при 80-90°С и постоянном перемешивании 8-14 ч. Реакционную массу постепенно охлаждают при перемешивании 10°С и подкисляют 10% соляной кислотой до рН 3-4. Полученный продукт отделяют, промывают 5 раз по 100 мл воды и сушат. Получают кислоту 7, которую используют в дальнейшем синтезе без дополнительной очистки. Выход 70-90%.
Пример 2. Общий способ получения 2-сульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалинов 1.1. Растворяют 1 мол 2-(2-нитроанилино)-3-сульфанилпропионовой кислоты 7 в 500 мл водного аммиака в 4 л колбе. К полученному раствору прибавляют порциями 4 мол дитионита натрия при 50-60°С. Реакционную массу нагревают при перемешивании до кипения и кипятят 1 ч. Реакционную массу охлаждают до комнатной температуры и аккуратно подкисляют 6 N соляной кислотой. Полученную массу, содержащую по данным LC MS 2(-2-аминофениламино)-3-сульфонилпропионовую кислоту 8, выдерживают 4 ч при перемешивании и 60-70°С. А затем охлаждают до комнатной температуры. Осадок отфильтровывают и промывают на фильтре до нейтральных промывных вод по Конго Красному. Полученный продукт сушат до постоянного веса. Получают 1.1 с выходом 60-85%, в том числе:
2-(2-Метил-бензилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1{1}: 1H-NMR (DMSO-d6) 2.35 (s, 3Н, СН3-Ar); 2.85 (s, 2H, -S-СН2-СН); 3.88 (t, 2H, S-CH2-Ar); 4.38 (ws, 1H, -CH-NH); 5.31 (ws, 1H, -NH-CH-); 6.99 (d, 1H, Ar); 7.27-7.64 (m, 6H, Ar); 11.36 (s, 1H, -NH-CO); 13.42 (ws, 1H, -COOH).
2-(2-Хлор-бензилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1 {2}: 1H-NMR (DMSO-d6) 2.94 (s, 2H, -S-CH2-CH); 3.88 (t, 2H, S-CH2-Ar);
4.42 (ws, 1H, -CH-NH); 5.35 (ws, 1H, -NH-CH-); 7.21 (d, 1H, Ar); 7.27-7.99 (m, 6H, Ar);
11.38 (s, 1H, -NH-CO); 12.66 (ws, 1H, -COOH).
2-(3-Фтор-бензилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1{3}: 1H-NMR (DMSO-d6) 2.78 (s, 2H, -S-CH2-CH); 3.22 (t, 2H, S-CH2-Ar); 4.09 (ws, 1H, -CH-NH); 6.44 (s, 1H, -CH-NH); 6.71 (d, 1H, Ar); 6.85-7.88 (m, 6H, Ar); 11.40 (s, 1H, -NH-CO); 13.84 (ws, 1H, -COOH).
2-(2-Фтор-бензилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1 {4}: 1H-NMR (DMSO-d6) 2.76 (s, 2H, -S-CH2-CH); 3.99 (t, 2H, S-CH2-Ar); 4.27 (ws, 1H, -CH-NH); 5.99 (s, 1H, -CH-NH); 6.71 (d, 1H, Ar); 6.66-7.08 (m, 3H, Ar); 7.29-8.08 (m, 3H, Ar); 10.94 (s, 1H, -NH-CO); 13.84 (ws, 1H, -COOH).
2-(3-Бром-бензилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1{5}: Мол. вес 497,29, LC MS, m/z 408 (M+1).
2-(2,5-Диметил-бензилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1{6}: 1H-NMR (DMSO-d6) 2.12 (s, 3H, СН3-Ar); 2.65 (s, 3Н, СН3-Ar); 2.85 (s, 2H, -S-CH2-CH); 3.67 (t, 2H, S-CH2-Ar); 4.21 (ws, 1H, -CH-NH); 5.12 (ws, 1H, -NH-CH-); 6.85 (d, 1H, Ar); 7.17-7.75 (m, 5H, Ar); 10.24 (s, 1H, -NH-CO); 12.42 (ws, 1H, -COOH).
2-(2-Хлор-4-фтор-бензилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1 {7}: 1H-NMR (DMSO-d6) H-NMR 5 2.78 (s, 2H, -S-CH2-CH); 3.60 (t, 2H, S-CH2-Ar); 4.59 (ws, 1H, -CH-NH); 5.92 (ws, 1H, -NH-CH-); 6.64 (d, 1H, Ar); 7.45-8.02 (m, 5H, Ar); 11.39 (s, 1H, -NH-CO); 13.35 (ws, 1H, -COOH).
2-(4-Фтор-бензилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1 {8}
2-(2-Хлор-6-фтор-бензилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1{9}
2-(4-Метил-бензилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1 {10}
2-(4-Хлор-бензилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1 {11}
2-(3-Хлор-бензилсульфанилметил)-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1 {12}
2-Метилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1{13}
2-([1,3]Диоксолан-2-илметилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1 {14}
3-Оксо-2-(пиридин-3-илметилсульфанилметил)-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1 {15}
3-Оксо-2-(пиридин-2-илметилсульфанилметил)-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1 {16}
2-(Октагидрохинолизин-1-илметилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1 {17}
2-(5-Метоксикарбонил-тиофен-2-илметилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1{18}
2-(Аdаmаntаn-1-илметилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.1 {19}.
6-Метил-2-метилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин 1.1 {20}: Мол. вес 222,31, LC MS, m/z 223 (M+1).
8-Фтор-2-метилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин 1.1{21}: Мол. вес 226,27, LC MS, m/z 227 (M+1).
7-Ацетиламино-2-метилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин 1.1{22}: Мол. вес 265,34, LC MS, m/z 266 (M+1).
2-Бензилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин 1.1{23}: Мол. вес 284,38, LC MS, m/z 285 (M+1).
2-Бензилсульфанилметил-7-трифторметил-3-оксо-1,2,3,4-тетрагидрохиноксалин 1.1{23}: Мол. вес 358,38, LC MS, m/z 359 (M+1).
Пример 3. Общий способ получения 2-сульфонилметил-3-оксо-1,2,3,4-тетрагидрохиноксалинов 1.2.
В трехгорлую 1 л колбу, снабженную обратным холодильником, термометром и капельной воронкой, помещают 0,1 мол соответствующего 2-сульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалина 1.1 и 300 мл ледяной уксусной кислоты. К полученному раствору прибавляют по каплям 2.5 мол 20% водной перекиси водорода в течение 1 ч, поддерживая температуру реакционной массы 70-80°С (интенсивное охлаждение).
Реакционную массу кипятят 4 часа, затем медленно охлаждают при перемешивании до 15°С. Осадок отфильтровывают, пятикратно промывают 60 мл порциями холодной воды, а затем трижды 100 мл порциями холодного этанола. Полученный осадок сушат над пятиокисью фосфора до постоянного веса, получают 1.2 с выходом 70-80%, в том числе:
2-(3-Бром-фенилметансульфонилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.2{7}3.38 (m, 1H, CH-CH2-SО2); 3.71 (d, 1H, CH-CH2-SО2, J=6.8 Hz); 4.43-4.62 (m, 3Н, Alk); 6.29 (ws, 1H, -NH-CH-); 6.78-8.65 (т, 7Н, Аr); 10.58 (ws, 1H, -NH-CO); 13.55 (ws, 1H, -СООН).
2-(2-Фтор-бензилсульфонилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.2{2}
3-Oксо-2-n-толилметансульфонилметил-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.2{3}2.26 (s, 3Н, СН3-Аr); 3.21 (m, 1H, CH-CH2-SO2); 3.64 (d, 1H, CH-CH2-SO2, J=7.3 Hz); 4.26-4.44 (m, 3Н, Alk); 6.00 (ws, 1H, -NH-CH-); 6.62 (d, 1H, Ar); 7.15-7.55 (m, 6Н, Аr); 10.12 (ws, 1H, -NH-CO); 12.44 (ws, 1H, -СООН).
2-(4-Фтор-фенилметансульфонилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.2{4}
2-(3-Хлор-фенилметансульфонилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.2(5}
2-(2-Хлор-фенилметансульфонилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.2{6}
2-(3-Фтор-фенилметансульфонилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.2{7}
2-(2,5-Диметил-фенилметансульфонилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.2{8}
2-(2-Хлор-4-фтор-фенилметансульфонилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.2{9}3.92 (m, 1H, CH-CH2-SO2);4.04 (d, 1H, CH-CH2-SO2, J=6.5 Hz); 4.55-4.71 (m, 3Н, Alk); 6.02 (ws, 1H, -NH-CH-); 6.62-8.31 (т, 6Н, Аr); 10.29 (ws, 1H, -NH-CO); 13.65 (ws, 1H, -СООН).
3-Oксо-2-м-толилметансульфонилметил-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.2{10}2.28 (s, 3Н, СН3-Аr); 3.25 (т, 1H, CH-CH2-SO2); 3.34 (d, 1H, CH-CH2-SO2, J=7.1 Hz); 4.00-4.13 (т, 3Н, Alk); 6.32 (ws, 1H, -NH-CH-); 6.44 (d, 1H, Ar); 7.01-7.48 (т, 6Н, Аr); 11.07 (ws, 1H, -NH-CO); 13.14 (ws, 1H, -СООН).
2-(4-Хлор-фенилметансульфонилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.2{11}3.36 (т, 1H, CH-CH2-SО2); 3.85 (d, 1H, CH-CH2-SO2, J=7.1 Hz); 4.48-4.65 (m, 3Н, Alk); 6.12 (ws, 1H, -NH-CH-); 6.68 (d, 1H, Ar); 7.18-7.62 (m, 6H, Ar); 11.26 (ws, 1H, -NH-CO); 13.32 (ws, 1H, -COOH).
3-Oксо-2-о-толилметансульфонилметил-1,2,3,4-тетрагидрохиноксалин-6-карбоновая кислота 1.2{12}2.31 (s, 3Н, СН3-Ar); 3.16 (m, 1H, CH-CH2-SO2); 3.28 (d, 1H, CH-CH2-SO2, J=7.3 Hz); 4.11-4.19 (m, 3Н, Alk); 6.40 (ws. 1H, -NH-CH-); 6.58 (d, 1H, Ar); 7.12-7.51 (m, 6H, Ar); 10.96 (ws, 1H, -NH-CO); 14.00 (ws, 1H, -COOH).
2-Бензилсульфонилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин 1.2{13}: Мол. вес 316,38, LC MS, m/z 317 (M+1).
2-Бензилсульфонилметил-7-трифторметил-3-оксо-1,2,3,4-тетрагидрохиноксалин 1.2{14}: Мол. вес 384,38, LC MS, m/z 385 (M+1).
Пример 4. Общий метод синтеза замещенных амидов 3-оксо-1,2,3,4-тетрагидрохиноксалин-7-карбоновых кислот 2. Растворяют 300 ммол соответствующей кислоты 1.1, 1.2 или 1.3 и 305 ммол карбонил диимидазола, 100 мл безводного диметилформамида выдерживают 10 мин при комнатной температуре, а затем 3 ч полученный раствор выдерживают при 80-90°С. Полученный раствор разбавляют 500 мл безводного диметилформамида, затем распределяют в 120 реакторов комбинаторных синтезаторов (5 мл в реактор, приблизительно 3 ммол имидазолида кислоты). В каждый реактор прибавляют 3,2 ммол соответствующего первичного или вторичного амина в 3 мл безводного диметилформамида. Реакционную массу выдерживают 8 ч при перемешивании и 75-80°С, после чего прибавляют в каждый реактор по 50 мл холодной воды. Осадки отфильтровывают и перекристаллизовывают из смеси этанол-диметилформамид. Получают амиды 2 с выходом 60-80%, в том числе:
2-(2-Метил-бензилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновой кислоты пропиламид 2.1{1}: 1H-NMR (DMSO-d6) 0.91 (t, 3Н, СН3-СН2); 1.52 (q, 2H, CH3-CH2-); 2.29 (s, 3Н, СН3-Ar); 2.78 (s, 2H, -S-CH2-CH); 3.17 (d, 2H, -CH2-NH); 3.75 (t, 2H, S-CH2-Ar); 4.13 (s, 1H, -CH-NH); 6.44 (s, 1H, -NH-CH-); 6.65 (d, 1H, Ar); 7.01-7.31 (m, 6H, Ar); 7.92 (t, 1H, CH2-NH-CO-); 10.42 (s, 1H, -NH-CO).
2-(2-Хлор-бензилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновой кислоты фенетил-амид 2.1{2}: 1H-NMR (DMSO-d6) 2., 72-2.93 (m, 4H, Alk); 3.45 (q, 2H, РП-СН2-СН2); 3.86 (t, 2H, S-CH2-Ar); 4.12 (s, 1H, -CH-NH); 6.28 (s, 1H, -CH-NH); 6.65 (d, 1H, Ar); 7.11-7.42 (m, 11H, Ar); 7.93 (t, 1H, CH2-NH-CO-); 10.42 (s, 1H, -NH-CO).
4-[2-(2-Хлор-бензилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбонил]-пиперазин-1-карбоновой кислоты этиловый эфир 2.1{3}: H-NMR (DMSO-d6) 1.29 (t, 3Н, СН3-СН2O); 2.84 (m, 1H, CH-CH2-S); 3.45, 3.53 (s, s, 8H, 4CH2-пиперазин); 3.87 (t, 2H, S-CH2-Ar); 4.03-4.18 (m, 3H, Alk); 6.31 (s, 1H, -CH-NH); 6.70 (d, 1H, Ar); 6.85 (s, 2H, Ar); 7.22 (s, 2H, Ar); 7.36 (s, 2H, Ar); 10.42 (s, 1H, -NH-CO).
3-(2-Хлор-бензилсульфанилметил)-7-(4-фенилпиперазин-1-карбонил)-3,4-дигидро-1Н-хиноксалин-2-он 2.1{4}: 1H-NMR (DMSO-d6) 2.85 (m, 2H, -S-CH2-CH); 3.2 (s, 4H, (CH2)2N-Ar); 3.70 (s, 4H, (CH2)2N-CO); 3.86 (t, 2H, S-CH2-Ar); 4.10 (s, 1H, -CH-NH); 6.31 (s, 1H, -CH-NH); 6.67-6.94 (m, 6H, Ar); 7.15-7.42 (m, 6H, Ar); 10.42 (s, 1H, -NH-CO).
2-(2-Хлор-бензилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновой кислоты [2-(4-хлорфенил)-этил]-амид 2.1{5}: 1H-NMR (DMSO-d6) 2.74-2.91 (m, 4H, Alk); 3.43 (d, 2H, Ph-CH2-CH2); 3.86 (t, 2H, S-CH2-Ar); 4.11 (s, 1H, -CH-NH); 6.30 (s, 1H, -CH-NH); 6.68 (d, 1H, Ar); 7.12-7.45 (m, 11H, Ar); 7.96 (t, 1H, CH2-NH-CO-); 10.43 (s, 1H, -NH-CO).
3-(2-Хлор-бензилсульфанилметил)-7-[4-(2-фтор-фенил)-пиперазин-1-карбонил]-3,4-дигидро-1Н-хиноксалин-2-он 2.1{6}: 1H-NMR (DMSO-d6) 2.83 (m, 2H, -S-CH2-CH); 3.07 (s, 4H, (CH2)2N-Ar); 3.52 (s, 4H, (CH2)2N-CO); 3.86 (t, 2H, S-CH2-Ar); 4.10 (s, 1H, -CH-NH); 6.28 (s, 1H, -CH-NH); 6.70 (d, 1H, Ar); 6.84-7.14 (m, 6H, Ar); 7.17-7.43 (m, 4H, Ar); 10.43 (s, 1H, -NH-CO).
2-(3-Фтор-бензилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновой кислоты [2-(4-хлор-фенил)-этил]-амид 2.1{7}: 1H-NMR (DMSO-d6) 2.69-2.87 (m, 4H, Alk); 3.42 (m, 2H, Ph-CH2-CH2); 3.74 (t, 2H, S-CH2-Ar); 4.09 (s, 1H, -CH-NH); 6.33 (s, 1H, -CH-NH); 6.65 (d, 1H, Ar); 6.91 (t, 1H, Ar); 7.03-7.33 (m, 9H, Ar); 7.93 (t, 1H, CH2-NH-CO-); 10.40 (s, 1H, -NH-CO).
2-(3-Фтор-бензилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновой кислоты 4-метил-бензиламид 2.1{8}: 1H-NMR (DMSO-d6) 2.31 (s, 3H, СН3-Ar); 2.74 (m, 2H, CH-CH2-S); 3.72 (t, 2H, S-CH2-Ar); 4.08 (s, 1H, -CH-NH); 4.4 (d, 2H, -CH2-NH-CO); 6.33 (s, 1H, -CH-NH); 6.69 (d, 1H, Ar); 6.93 (t, 1H, Ar); 7.03-7.37 (m, 9H, Ar); 8.37 (t, 1H, CH2-NH-CO-); 10.41 (s, 1H, -NH-CO).
7-(3,4-Дигидро-1Н-изохинолин-2-карбонил)-3-(3-фторбензилсульфанилметил)-3,4-дигидро-1Н-хиноксалин-2-он 2.1{9}: 1H-NMR (DMSO-d6) 2.75 (m, 2H, CH-CH2-S); 2.90 (t, 2H, Ar-CH2-CH2); 3.74 (m, 4H, Alk); 4.06 (s, 1H, -CH-NH); 4.65 (s, 2H, Ar-CH2-NH); 6.24 (s, 1H, -CH-NH); 6.69 (d, 1H, Ar); 6.88 (m, 3H, Ar); 7.02-7.15 (m, 6H, Ar); 7.22 (q, 1H, Ar); 10.40 (s, 1H, -NH-CO).
2-(3-Фтор-бензилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновой кислоты 2-метокси-бензиламид 2.1{10}: 1H-NMR (DMSO-d6) 2.75 (m, 2H, CH-CH2-S); 3.64 (t, 2H, S-CH2-Ar); 3.88 (s, 3H, СН3О); 4.11 (s, 1H, -CH-NH); 4.43 (d, 2H, -CH2-NH-СО); 6.37 (s, 1H, -CH-NH); 6.70 (d, 1H, Ar); 6.82-7.42 (m, 10H, Ar); 8.17 (t, 1H, CH2-NH-CO-); 10.45 (s, 1H,-NH-CO).
2-(2-Хлор-4-фтор-бензолсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновой кислоты (фуран-2-илметил)-амид 2.1{11} 2.81 (m, 2H, CH-CH2-S); 3.81 (t, 2Н, S-CH2-Ar); 4.12 (s, 1H, -CH-NH); 4.42 (d, 2H, -CH2-NH-CO); 6.17 (s, 1H, -CH-NH); 6.30 (s, 1H, C-H Furyl); 6.37 (s, 1H, C-H Furyl); 6.65 (d, 1H, Ar); 7.00 (t, 1H, Ar); 7.17 (d, 1H, Ar); 7.25-7.43 (m, 4H, Ar); 8.35 (t, 1H, CH2-NH-CO-); 10.42 (s, 1H, -NH-CO).
3-(3-Фтор-бензилсульфанилметил)-7-(3-метил-4-м-толил-пиперазин-1-карбонил)-3,4-дигидро-1Н-хиноксалин-2-он 2.1 {12}
3-(2-Метил-бензилсульфанил.метил)-7-(4-фенилпиперазин-1-карбонил)-3,4-дигидро-1H-хиноксалин-2-он 2.1{13}
3-(2-Метил-бензилсульфанилметил)-7-(4-фенилпиперазин-1-карбонил)-3,4-дигидро-1H-хиноксалин-2-он 2.1{14}
2-(2-Метил-бензилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновой кислоты 2-хлор-бензиламид 2.1 {15}
2-(2-Метил-бензилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновой кислоты [2-(4-хлор-фенил)-этил]-амид 2.1 {16}
7-[4-(2-Фтор-фенил)-пиперазин-1-карбонил]-3-(2-метил-бензилсульфанилметил)-3,4-дигидро-1Н-хиноксалин-2-он 2.1 {17}
2-(2-Метил-бензилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновой кислоты фенетил-амид 2.1{18}
2-(2-Фтор-бензилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновой кислоты 2-метокси-бензиламид 2.1{19}
4-[2-(2-Фтор-бензилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбонил]-пиперазин-1-карбоновой кислоты этиловый эфир 2.1{20}
3-(2-Фтор-бензилсульфанилметил)-7пиперазин-1-карбонил)-3,4-дигидро-1H-хиноксалин-2-он 2.1{21}
2-(2-Фтор-бензилсульфанилметил)-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновой кислоты фенетил-амид 2.1{22}
7-(1,4-Диокса-8-аза-спиро[4.5]декан-8-карбонил)-3-(2-фтор-бензилсульфанилметил)-3,4-дигидро-1Н-хиноксалин-2-он 2.1{23}
3-(2-Фтор-бензилсульфанилметил)-7-(4-фенил-пиперазин-1-карбонил)-3,4-дигидро-1H-хиноксалин-2-он 2.1{24}
7-[4-(2-Хлор-фенил)-пиперазин-1-карбонил]-3-(2-фтор-бензилсульфанилметил)-3,4-дигидро-1Н-хиноксалин-2-он 2.1 {25}
3-(2-Фтор-бензилсульфанилметил)-7-(4-пиридин-2-ил-пиперазин-1-карбонил)-3,4-дигидро-1Н-хиноксалин-2-он 2.1 {26}
3-(2-Фтор-бензилсульфанилметил)-7-[4-(4-метокси-фенил)-пиперазин-1-карбонил]-3,4-дигидро-1Н-хиноксалин-2-он 2.1 {27}
3-(2-Фтор-бензилсульфанилметил)-7-[4-(2-фтор-фенил)-пиперазин-1-карбонил]-3,4-дигидро-1Н-хиноксалин-2-он 2.1 {28}
7-(4-Бензил-пиперазин-1-карбонил)-3-(2-фтор-бензилсульфанилметил)-3,4-дигидро-1Н-хиноксалин-2-он 2.1{29}
7-(2,3-Дигидро-индол-1-карбонил)-3-(2-метил-бензилсульфанилметил)-3,4-дигидро-1H-хиноксалин-2-он 2.1 {30}
7-(1,4-Диокса-8-аза-спиро[4.5]декан-8-карбонил)-3-(2-метил-бензилсульфанилметил)-3,4-дигидро-1Н-хиноксалин-2-он 2.1{31}
4-{[2-(2-Метил-бензилсульфанилметил)-3-оксо-1,2,3,4-тетрагидро-хиноксалин-6-карбонил]-амино}-пиперидин-1-карбоновой кислоты этиловый эфир 2.1 {32}
2-(2-Метил-бензилсульфанилметил-3-оксо-1,2,3,4-тетрагидрохиноксалин-6-карбоновой кислоты (3-дипропиламин