Фармацевтическая форма для парентерального введения и способ ее получения (варианты)
Иллюстрации
Показать всеИзобретение относится к фармацевтической химии, в частности к фармацевтической форме, подходящей для парентерального введения, содержащей пептиды, имеющие тенденцию к агрегации, в виде их солей: ацетатов, глюконатов, глюкуронатов, лактатов, цитратов, бензоатов или фосфатов, которые растворены или диспергированы, кроме того, кислоты содержатся в виде свободных кислот, а также к способу ее получения. Изобретение обеспечивает снижение тенденции к агрегации и улучшенное высвобождение активного вещества, что приводит к улучшению биодоступности пептидных активных веществ. 5 н. и 17 з.п. ф-лы, 10 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым галеновым формам для парентерального введения пептидов, имеющих тенденцию к агрегации, прежде всего, аналогов LHRH или антагонистов и агонистов LHRH, а также к способам их получения и применения.
Уровень техники
В документе ЕР 0299402 использованы фармацевтически активные декапептиды, такие как SB-030, SD-075 (цетрореликс) и SB-088 в форме их фармацевтически приемлемых, не токсичных кислотно-аддитивных солей, таких как гидрохлориды, гидробромиды, сульфаты, фосфаты, фумараты, глюконаты, таннаты, малеаты, ацетаты, цитраты, бензоаты, сукцинаты, альгинаты, памоаты, аскорбаты и тартраты и т.д.
Кроме того, в заявке JP 06321800-А описан лиофилизированный пептидный или белковый препарат, содержащий глюконаты в качестве стабилизаторов. В одном примере описан раствор, содержащий 2,5% глюконата магния, при этом в качестве активного вещества среди прочих используют вазопрессин, LHRH и инсулин.
Из литературных данных (среди прочих см. статьи Powell M.F., Pharmaceutical Research (1991), т.8, стр.1258-1263; Dathe M., Int. J. Peptide Protein Res. (1990), т.36, стр.344-349 и Szejtli, J. Pharmaceutical Technology International (1991), стр. 16-22) известно, что олигопептиды, и в особенности те, что содержат концевую функцию амида кислоты, имеют тенденцию к гелеобразованию.
В патентной заявке DE 19911771 описаны антагонисты LHRH общей формулы I
в которой А означает ацетильную или 3-(4-фторфенил)пропионильную группы, Ххх1 означает D-Nal(1) или D-Nal(2),
Ххх2-Ххх3 означает D-Cpa-D-Pal(3) или простую связь,
Ххх4 означает Ser, Ххх5 означает М-Ме-Туr,
Ххх6 означает D-Cit, D-Hci или остаток D-аминокислоты общей формулы (II)
где n означает число 3 или 4, а R1 означает группу общей формулы III
где р означает целое число от 1 до 4, R2 означает водород или алкильную группу, а R3 означает незамещенную или замещенную арильную группу или гетероарильную группу, или R1 означает 3-амино-1,2,4-триазол-5-карбонильную группу, или R1 означает кольцо общей формулы IV
в которой q означает число 1 или 2, R4 означает атом водорода или алкильную группу, R5 означает атом водорода или алкильную группу, а Х означает атом кислорода или атом серы,
Ххх7 означает Leu или NIe, Xxx8 означает Аrg или Lys(iPr),
Ххх9 означает Pro и Ххх10 означает Ala или Sar,
и их соли с фармацевтически
приемлемыми кислотами, такие как ацетаты, трифторацетаты или эмбонаты.
Предпочтительными соединениями являются такие, в которых Ххх6 означает D-[ε-N’-(имидазолидин-2-он-4-ил)формил]-Lуs, D-(3-амино-1,2,4-триазол-3-карбонил)-Lуs, сокращенно D-Lys(Atz), или D-[∈-N’-4-(4-амидинофенил)амино-1,4-диоксобутил]-Lуs, сокращенно D-Lys(B).
В частности, описаны такие предпочтительные антагонисты LHRH, как Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Hci6-Nle7-Arg8-Pro9-D-Ala10-NH2, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Lys(Atz)6-Leu7-Arg8-Pro9-D-Ala10-NH2, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Lys(B)6-Leu7-Lys(iPr)8-Pro9-D-Ala10-NH2, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Lys(B)6-Leu7-Arg8-Pro9-D-Ala10-NH2, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Hci6-Nle7-Lys(iPr)8-Pro9-Ala10-NH2, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Hci6-Nle7-Lys(iPr)8-Pro9-Sar10-NH2, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Sеr4-N-Ме-Туr5-D-Нci6-Nle7-Аrg8-Рrо9-Sаr10-NН2 и 3-(4-фторфенил)пропионил-D-Nal(1)1-Ser4-N-Me-Tyr5-D-Lys(Atz)6-Leu7-Arg8-Pro9-D-Ala10-NH2, а также их соли с фармацевтически приемлемыми кислотами.
В патенте США 5942493 предложены пептиды общей формулы V Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-Tyr5-D-Xxx6-Leu7-Arg8-Pro9-D-Ala10-NH2(V), где D-Xxx представлено остатком аминокислоты общей формулы II, приведенной выше, в которой R1 означает кольцо общей формулы IV, приведенной выше. Предпочтительными пептидами, соответствующими формуле V, согласно данному патенту являются такие, в которых Ххх является [ε-N’-4-(4-амидинофенил)амино-1,4-диоксобутил]-Lуs или [∈-N’-(имидазолидин-2-он-4-ил)формил]-Lуs. Соли с фармацевтически приемлемыми кислотами предпочтительно являются слаборастворимыми в воде. Особенно предпочтительными являются соли 4,4’-метилен-бис(3-гидрокси-2-нафтоевой кислоты), известной также под названием эмбоновой кислоты, или памовой кислоты.
Соединения, описанные в данном патенте, обладают высокой антагонистической активностью и лишены нежелательных побочных эффектов. Когда они находятся не в форме солей с фармацевтически приемлемыми кислотами, плохо растворимыми в воде, они дополнительно имеют хорошую растворимость в воде. Более того, соединения обладают высоким сродством к рецептору человеческого LHRH, т.е. являются сильными потенциальными ингибиторами высвобождения гонадотропинов из гипофиза млекопитающих, включая человека, демонстрируют длительную супрессию тестостерона у крыс и вызывают минимальное высвобождение гистамина in vitro.
Проблема получения стерильных лиофилизированных препаратов из образующихся солей пептидов в данном изобретении не решена.
В патентном документе ЕР 0175506 водный раствор пептида обрабатывают 1 н. уксусной кислотой и затем его лиофилизируют, чтобы получить ацетат пептида. Таким образом, объектом данной заявки является синтез соли пептида.
Однако показано, что получение стерильных растворов ацетатов известных пептидов (например, антагонистов LHRH), имеющих тенденцию к агрегации, для парентерального введения путем фильтрации вполне возможно при высоких концентрациях, но возможно образование агрегатов после растворения лиофилизата непосредственно перед инъекцией. Образование агрегатов приводит к зависимому от концентрации снижению биодоступности, начиная с концентрации пептида 0,5 мг/мл.
Упомянутая проблема относится не только к растворам для инъекций, которые применяют для быстрого высвобождения активного вещества, но также наблюдается при использовании препаратов для введения с замедленным высвобождением активного вещества. Таким образом, пептиды включенные в матрицу, которая должна регулировать скорость высвобождения активного вещества, могут приводить к нежелательному снижению скорости высвобождения активного вещества по причине тенденции пептида к агрегации. В данном случае также снижается биодоступность.
Сущность изобретения
С учетом того факта, что предпочтительной формой применения фармацевтически активных пептидов, таких как агонисты и антагонисты LHRH, например антареликс и цетрореликс, является парентеральная лекарственная форма, существует необходимость получения стабильных инъекционных препаратов с приемлемой биодоступностью, которые легко поддаются обработке, стерилизации и переработке в готовую лекарственную форму. Это относится, прежде всего, к инъекционным препаратам в форме восстановленных, т.е. повторно растворенных, лиофилизированных образцов, полученных из растворимых солей пептидов, и к микрочастицам, микрокапсулам или имплантатам.
Указанные факты имеют особое значение с точки зрения общеизвестной, все более развивающейся, многосторонней области применения антагонистов LHRH.
Особый интерес представляет широкий выбор парентеральных, стабильных пептидных растворов, прежде всего, для подкожной инъекции, с учетом быстро расширяющейся области показаний указанного класса веществ.
Указанная задача решена в настоящем изобретении, согласно которому разработаны фармацевтические формы для введения, подходящие для парентерального применения и содержащие пептиды, имеющие тенденцию к агрегации, в растворимой или диспергированной форме, причем такие фармацевтические формы характеризуются тем, что пептиды присутствуют в виде их солей, образованных с такими кислотами, как уксусная, глюконовая, глюкуроновая, молочная, лимонная, аскорбиновая, бензойная или фосфорная, и что упомянутые формы могут, кроме того, содержать вышеназванные кислоты в свободной форме, а также при необходимости прочие добавки и вспомогательные вещества из класса кислот, ПАВ, полимеров, липидов или сахаров.
Указанные фармацевтические формы для введения могут присутствовать в растворимой или диспергированной форме в воде или в водных смесях растворителей.
Согласно другому варианту воплощения настоящего изобретения фармацевтические формы для введения могут также присутствовать в растворимой или диспергированной форме в физиологически приемлемом масле, предпочтительно в триглицеридах со средней длиной цепи (нейтральное масло, Miglyol®) или в касторовом масле, кунжутном масле, хлопковом масле, кукурузном масле, арахисовом масле, оливковом масле или в смеси указанных масел.
В случае пептидов, пригодных для использования, речь идет об антагонистах LHRH, таких как антид, А-75998, ганиреликс и Nal-Glu-антагонист, прежде всего, цетрореликс, антареликс, а также антагонисты согласно патентам US 5942493 и DE 19911771.3.
В качестве кислот в виде вспомогательных веществ используют глюконовую кислоту, глюкуроновую кислоту, галактуроновую кислоту, глюкаровую кислоту, лимонную кислоту, аскорбиновую кислоту и аминокислоты.
Таким образом, становится возможным подавить агрегацию пептида и тем самым удовлетворить требованиям для препарата с удовлетворительной биодоступностью, расширяя таким образом арсенал лекарственных средств, причем - с использованием эффективной галеновой технологии.
Кроме того, неожиданно было показано, что при добавлении глюконовой, глюкуроновой, лимонной, молочной или аскорбиновой кислот значительно увеличивается стабильность различных солей цетрореликса.
Таким образом, согласно настоящему изобретению является возможным получение и переработка стерилизованных фильтрованием стабильных препаратов без осложнений в готовую лекарственную форму.
Кроме того, целесообразным является добавление подходящих вспомогательных веществ. В качестве таких вспомогательных веществ можно использовать кислоты, ПАВ, полимеры, липиды или сахара. Примерами кислот являются глюконовая кислота, глюкуроновая кислота, галактуроновая кислота, глюкаровая кислота, молочная кислота, лимонная кислота, аскорбиновая кислота и аминокислоты. В качестве ПАВ можно использовать полиэтиленгликоль-12-(гидрокси)стеарат (Solutol®), полиоксиэтиленрицинолеат (Cremophor®), полисорбат, полиоксамер, фосфолипиды, лецитин или бензалькония хлорид. Подходящими полимерами являются альбумин, полиэтиленгликоль, производные целлюлозы, производные крахмала или поливинилпирролидон. Примерами сахаров являются циклодекстрин или производные циклодекстрина. В качестве добавок или вспомогательных веществ могут быть также использованы так называемые хаотропные агенты, такие как мочевина.
Область применения составов по настоящему изобретению включает, прежде всего, профилактику и лечение всех состояний и заболеваний, зависимых от аналогов LHRH, то есть от агонистов LHRH и антагонистов LHRH, и связанных с половыми гормонами. К таким заболеваниям относятся доброкачественная гиперплазия предстательной железы, карцинома предстательной железы, преждевременное половое развитие, гирсутизм, гиперплазия эндометрия, а также сопутствующие явления, карцинома эндометрия, оплодотворение in vitro (IVF/COS/ART), контрацепция, предменструальный синдром (ПМС), миоматоз матки, рак груди, окклюзия маточной трубы (ОМТ), рак яичников, карцинома матки. Для составов по настоящему изобретению в качестве антагонистов LHRH предпочтительно используют, прежде всего, следующие соединения: цетрореликс, антареликс, антид, А-75998, ганиреликс, антагонист Nal-Glu, а также антагонисты LHRH согласно патентам US 5942493 и DE 19911771.3.
Сведения, подтверждающие возможность осуществления изобретения
Пример 1
Исследование агрегации растворов различных солей цетрореликса в присутствии или в отсутствие добавок вспомогательных веществ проводят с помощью поляризационного микроскопа. Агрегированные растворы пептидов проявляют себя в поляризационном световом микроскопе характерной крестообразной поляризационной картиной, которая подобна жидкокристаллическим структурам. Не содержащие агрегатов растворы пептидов не проявляют таких эффектов.
| Таблица 1Влияние добавки глюконовой кислоты на агрегатные свойства растворов ацетата цетрореликса | |||
| Концентрация ацетата цетрореликса, мг/мл | Содержание глюконовой кислоты в растворителе, % | Величина рН | Сутки без агрегации |
| 2,5 | 0 | 4,7 | 1 |
| 2,5 | 0,0071 | 4,5 | 2 |
| 2,5 | 0,071 | 3,7 | 2 |
| 2,5 | 0,71 | 3,1 | 12 |
Таким образом, добавка глюконовой кислоты позволяет увеличить стабильность растворов ацетата цетрореликса, при этом агрегация замедляется или предотвращается.
Дальнейшие исследования сфокусированы на глюконате цетрореликса в присутствии или в отсутствие глюконовой кислоты. Основные данные приведены в таблице 2.
| Таблица 2Агрегатные свойства различных растворов, содержащих в качестве основного компонента глюконат цетрореликса | ||||
| Добавка глюконовой кислоты | Да | Нет | ||
| Концентрация цетрореликса, мг/мл | pН | Сутки без агрегации | pН | Сутки без агрегации |
| 2,5 | 3,0 | >30 | ||
| 5 | 3,6 | 4 | 4,8 | 1 |
| 5 | 3,8 | 4 | 4,7 | 1 |
| 7,5 | 3,4 | 1 | 4,7 | 0 |
| 7,5 | 3,7 | 1 | 4,8 | 0 |
Глюконат цетрореликса обладает преимуществом по сравнению с ацетатом. Добавка глюконовой кислоты позволяет повысить срок действия растворов глюконата цетрореликса.
Кроме того, исследуют стабилизирующее влияние глюконовой кислоты на растворы ацетата цетрореликса, а также на агрегатные свойства другой соли, глюкуроната цетрореликса. Результаты приведены в Таблице 3.
| Таблица 3Агрегатные свойства растворов ацетата и глюкуроната цетрореликса с различной концентрацией в присутствии или в отсутствие добавки глюкуроновой кислоты | |||||
| Добавка глюкуроновой кислоты | Да | Нет | |||
| Форма соли | Концентрация цетрореликса, мг/мл | pН | Сутки без агрегации | pН | Сутки без агрегации |
| Ацетат | 2,5 | 3,0 | >21 | 4,7 | 0 |
| Ацетат | 5 | 3,0 | 0 | ||
| Глюкуронат | 2,5 | 2,9 | >30 | 4,5 | 3 |
| Глюкуронат | 5 | 2,7 | >30 | 4,6 | 0 |
При замене ацетатной соли на глюкуронат можно наблюдать значительное увеличение устойчивости к агрегации растворов цетрореликса, сходной с глюконатной солью. В результате добавления глюкуроновой кислоты к растворам глюкуроната цетрореликса можно наблюдать еще большее увеличение стабильности к агрегации указанных растворов.
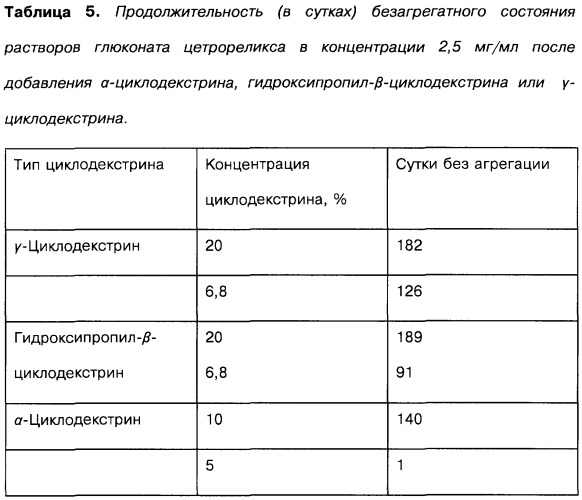
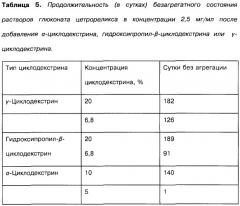
| Таблица 4Продолжительность (в сутках) безагрегатного состояния растворов ацетата цетрореликса после добавления 10% α-циклодекстрина, 20% гидроксипропил-β-циклодекстрина или 20% γ-циклодекстрина. | |||
| Концентрация ацетата цетрореликса, мг/мл | α-Циклодекстрин | Гидроксипропил-β-циклодекстрин | γ-Циклодекстрин |
| 2,5 | 7 | 24 | 98+(168,182,189) |
| 5 | 0 | 7 | 31+(140,147,182) |
| 7,5 | 0 | 10 | 5+(20,20,20) |
| 10 | 0 | 2 | 2+(4,4,4) |
| 15 | 0 | 0 |
В результате добавления гидроксипропил-β-циклодекстрина и, прежде всего, γ-циклодекстрина можно значительно повысить стабильность к агрегации растворов ацетата цетрореликса.
В результате добавления гидроксипропил-β-циклодекстрина или γ-циклодекстрина можно значительно повысить стабильность к агрегации растворов глюконата цетрореликса.
| Таблица 6Продолжительность (в сутках) безагрегатного состояния растворов ацетата цетрореликса после добавления поливинилпирролидона (Kollidon® 12 РF или 17 PF) | |||
| Концентрация цетрореликса, мг/мл | Концентрация Kollidon®, % | Сутки без агрегации в присутствии Kollidon® 12 PF | Сутки без агрегации в присутствии Kollidon® 17 PF |
| 2,5 | 0 | 0 | 0 |
| 5 | 1 | 2 | |
| 10 | 1 | 2 | |
| 15 | 77 | 63 | |
| 20 | 84 | 98 | |
| 5 | 15 | 0 | 1 |
| 20 | 0 | 1 | |
В результате добавления различных типов поливинилпирролидона можно значительно повысить стабильность к агрегации растворов ацетата цетрореликса.
| Таблица 7Агрегатные свойства растворов ацетата цетрореликса после добавления различных вспомогательных веществ, определенные по данным поляризационной микроскопии и виду оптической картины (внешний вид) | ||||
| Вспомогательное вещество | Концентрация вспом. вещества | Концентрация цетрореликса | Агрегация (данные микроскопии) | Внешний вид |
| Solutol® HS 15 | 5,00% | 2,5 мг/мл | да, через 14 сут | Прозрачный раствор |
| 10,00% | 2,5 мг/мл | ≥112 сут без агрегации | Прозрачный раствор | |
| 20,00% | 2,5 мг/мл | ≥112 сут без агрегации | Прозрачный раствор | |
| Cremophor® EL | 5,00% | 2,5 мг/мл | да, через 10 сут | Прозрачный раствор |
| 10,00% | 2,5 мг/мл | ≥112 сут без агрегации | Прозрачный раствор | |
| 20,00% | 5 мг/мл | да, через 1 сут | Прозрачный вязкий раствор | |
| L-Глютаминовая кислота | 0,80% | 2,5 мг/мл | да, через 2 сут | Прозрачный раствор, рН 3,8 |
| Глюкаровая кислота | 2,50% | 2,5 мг/мл | ≥12 сут без агрегации | Прозрачный раствор, рН 2,5 |
| Галактуроновая кислота | 2,50% | 2,5 мг/мл | ≥12 сут без агрегации | Прозрачный раствор, рН 2,6 |
Пример 2
Основной компонент, цетрореликс, растворяют в 30% уксусной кислоте при концентрации 10 мг/мл и разбавляют водным раствором добавки в 3% уксусной кислоты до конечной концентрации пептида 1 мг/мл. Затем этот раствор стерилизуют и лиофилизируют (по 5 мг во флаконе).
После восстановления (повторного растворения) этих лиофилизированных препаратов в растворах (2,5 мг/мл цетрореликса) исследуют образование агрегатов и свойства высвобождения активного вещества следующими методами:
- Поляризационная микроскопия (поляр.микр.): сутки без агрегации (сут б/агр).
- Фильтруемость (фильт-сть) в %: растворы цетрореликса получают стандартным способом и фильтруют через фильтр с размером пор 0,22 мкм или 0,45 мкм с использованием центрифугирования. Концентрацию цетрореликса в фильтрате определяют с помощью ВЭЖХ в % в расчете на исходную концентрацию перед фильтрованием (фильтруемость в %).
- Высвобождение in vitro из формы быстрого высвобождения (высвобождение в растворе Рингера, ВРР): % высвобождения через 1 ч и 6 ч. Характеристики высвобождения in vitro определяют проточным методом с использованием раствора Рингера в качестве среды при 37°С. Концентрацию определяют методом ВЭЖХ. Образцы цетрореликса, соответствующие 10 мг основания цетрореликса, помещают в проточную ячейку, смешивают с 4 мл воды и перемешивают в течение 10 мин. После добавления к образцу 6 мл раствора Рингера при перемешивании через ячейку равномерно прокачивают поток раствора Рингера со скоростью 0,5 мл/мин.
- Испытания на крысах: остаточное содержание цетрореликса в мышцах в % от введенной дозы определяют через 168 ч после внутримышечного введения (в/м).
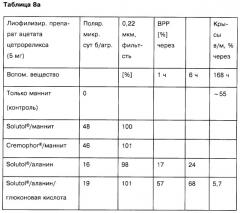
В таблице 8а приведены составы полученных лиофилизированных препаратов ацетата цетрореликса и соответствующие данные испытаний с использованием полученных растворов ацетата цетрореликса с концентрацией 2,5 мг/мл; н/о - не определено.
На основании приведенных примеров представляется очевидным, что при использовании многочисленных испытанных вспомогательных веществ из различных групп соединений (ПАВ, кислоты, аминокислоты, полимеры, сахара, многоатомные спирты, циклодекстрины, консерванты) в отдельности или в смеси можно получить стабилизирующий эффект in vitro (поляризационная микроскопия, фильтруемость, высвобождение in vitro) и in vivo. Такая сниженная тенденция к агрегации и улучшенное высвобождение активного вещества приводит к улучшенной биодоступности пептидных активных веществ и к снижению остаточного содержания в мышцах, как показано в экспериментах на крысах.
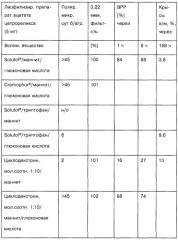
Другие данные испытаний in vitro и in vivo различных солей цетрореликса в присутствии или в отсутствие стабилизирующих вспомогательных веществ приведены в следующей таблице 8б.
Пример 3
Содержащие цетрореликс составы, которые характеризуются более слабой/более медленной способностью к агрегации (улучшенная фильтруемость/поляризационная микроскопия) и более высокой скоростью высвобождения in vitro в растворе Рингера, отличаются незначительным остаточным содержанием цетрореликса в мышцах крыс через 168 ч. Следует ожидать, что такие составы будут обладать более высокой биодоступностью.
Некоторые данные, полученные в экспериментах на мышцах крыс, приведены в таблицах 8а и 8б.
В таблице 9 приведены результаты дальнейших экспериментов на мышцах крыс, в которых наряду с остаточным содержанием в мышцах определяют содержание (часть) цетрореликса в плазме. На основании этих данных также отчетливо проявляется стабилизирующее действие исследованных вспомогательных веществ.
Кроме того, при замене ацетатов на другие соли цетрореликса достигается увеличение биодоступности и при этом снижается остаточное содержание в мышцах, определенное в экспериментах на крысах.
1. Фармацевтическая форма для парентерального введения, содержащая пептидные антагонисты LHRH, имеющие тенденцию к агрегации, в растворимой или диспергированной форме, отличающаяся тем, что пептиды содержатся в виде их солей с кислотами, выбранными из группы, включающей в себя уксусную кислоту, глюконовую кислоту, глюкуроновую кислоту, молочную кислоту, лимонную кислоту, аскорбиновую кислоту, бензойную кислоту или фосфорную кислоту, причем указанная форма для введения дополнительно содержит одну из кислот, выбранных из группы, включающей глюконовую кислоту, глюкуроновую кислоту, лимонную кислоту, молочную кислоту и аскорбиновую кислоту в виде свободных кислот, а также при необходимости другие добавки и вспомогательные вещества, выбранные из таких классов, как кислоты, ПАВ, полимеры, липиды или сахара.
2. Фармацевтическая форма по п.1, отличающаяся тем, что она присутствует в растворимой или диспергированной форме в воде или в водной смеси растворителей.
3. Фармацевтическая форма по п.1, отличающаяся тем, что она присутствует в растворимой или диспергированной форме в физиологически приемлемом масле, выбранном из группы, включающей в себя предпочтительно триглицериды со средней длиной цепи (нейтральное масло) или касторовое масло, кунжутное масло, хлопковое масло, кукурузное масло, арахисовое масло, оливковое масло или их смесь.
4. Фармацевтическая форма по п.1, отличающаяся тем, что антагонисты LHRH выбраны из группы, включающей цетрореликс, антареликс, антид, А-75998, ганиреликс и Nal-Glu-антагонист, а также антагонисты Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-Tyr5-D-Xxx6-Leu7-Arg8-Pro9-D-Ala10-NH2, гдe D-Xxx является [∈-N’-4-(4-амидинофенил)амино-1,4-диоксобутил]-Lуs(D-Lуs(В)) или [∈-N’-(имидазолидин-2-он-4-ил)формил]-Lуs, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Hci6-Nle7-Arg8-Pro9-D-Ala10-NH2, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Lys(Atz)6-Leu7-Arg8-Pro9-D-Ala10-NH2, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Lys(B)6-Leu7-Lys(iPr)8-Pro9-D-Ala10-NH2, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Lys(B)6-Leu7-Arg8-Pro9-D-Ala10-NH2, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Hci6-Nle7-Lys(iPr)8-Pro9-Ala10-NH2Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Hci6-Nle7-Lys(iPr)8-Pro9-Sar10-NH2, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Hci6-Nle7-Arg8-Pro9-Sar10-NH2 и 3-(4-фтopфeнил)пpoпиoнил-D-Nal(1)1-Ser-N-Me-Tyr5-D-Lys(Atz)6-Leu7-Arg8-Pro9-D-Ala10-NH2.
5. Фармацевтическая форма по п.1, отличающаяся тем, что в качестве кислот с функцией вспомогательных веществ она содержит глюконовую кислоту, глюкуроновую кислоту, галактуроновую кислоту, глюкаровую кислоту, молочную кислоту, лимонную кислоту, аскорбиновую кислоту или аминокислоты.
6. Фармацевтическая форма по п.1, отличающаяся тем, что в качестве ПАВ она содержит полиэтиленгликоль-12-(гидрокси)стеарат, полиоксиэтиленрицинолеат полисорбат, полиоксамер, фосфолипиды, лецитин, или ПАВ в виде консервантов, предпочтительно бензалькония хлорид или ацетат фенилртути.
7. Фармацевтическая форма по п.1, отличающаяся тем, что в качестве полимеров она содержит альбумин, полиэтиленгликоль, производные целлюлозы, производные крахмала или поливинилпирролидон.
8. Фармацевтическая форма по п.1, отличающаяся тем, что в качестве сахаров она содержит циклодекстрин или его производные, а также многоатомные спирты.
9. Фармацевтическая форма по п.1, отличающаяся тем, что в качестве вспомогательного вещества она содержит мочевину или другие хаотропные агенты.
10. Фармацевтическая форма по одному из пп.1, 2 или 4, отличающаяся тем, что соли пептидов и уксусной кислоты, глюконовой кислоты, глюкуроновой кислоты, молочной кислоты, лимонной кислоты или аскорбиновой кислоты содержатся в растворах с концентрацией более 0,5 мг/мл.
11. Фармацевтическая форма по одному из пп.1, 2 или 4, отличающаяся тем, что в качестве пептидов она содержит цетрореликс или антареликс, присутствующие в растворах при концентрации более 0,5 мг/мл.
12. Фармацевтическая форма по одному из пп.1-4, отличающаяся тем, что в качестве добавки она содержит полимеры, предпочтительно гомо- или сополимеры молочной и гликолевой кислот, замедляющие скорость высвобождения активного вещества.
13. Фармацевтическая форма по одному из пп.1-4, отличающаяся тем, что она предназначена для парентерального введения и представляет собой препарат для инъекций, в частности подкожных.
14. Фармацевтическая форма по одному из пп.1, 2 или 4, отличающаяся тем, что она предназначена для парентерального введения, при этом антагонист LHRH является цетрореликсом, присутствующим в виде его солей, выбранных из ацетатов, глюконатов или глюкуронатов в растворимой или диспергированной форме в воде или водной смеси растворителей, а упомянутая форма при необходимости содержит глюконовую кислоту или глюкуроновую кислоту в форме свободных кислот и при необходимости другие добавки и вспомогательные вещества.
15. Фармацевтическая форма по п.14, отличающаяся тем, что добавки и вспомогательные вещества выбраны из группы, включающей предпочтительно маннит, а также полиэтиленгликоль-12-(гидрокси)стеарат, полиоксиэтиленрицинолеат, глицин, лимонную кислоту и циклодекстрин.
16. Фармацевтическая форма по п.14, отличающаяся тем, что она получена растворением лиофилизата, содержащего соль цетрореликса, а также при необходимости другие добавки и вспомогательные вещества, в водной среде для восстановления, содержащей глюконовую кислоту или глюкуроновую кислоту в виде свободных кислот.
17. Способ получения фармацевтической формы, определенной в п.1, отличающийся тем, что добавляют к соли пептида кислоту, выбранную из уксусной кислоты, глюкуроновой кислоты, глюконовой кислоты, молочной кислоты, лимонной кислоты или аскорбиновой кислоты, с получением стехиометрического количества соответствующей соли, затем полученную соль растворяют в воде для инъекций, при необходимости смешивают с вспомогательными веществами по пп.4-8 и после этого стерилизуют, разливают во флаконы для инъекций и лиофилизируют, а перед парентеральным введением лиофилизат растворяют в среде для восстановления.
18. Способ по п.17, отличающийся тем, что среда для восстановления содержит одну из кислот, выбранных из группы, включающей глюконовую кислоту, глюкуроновую кислоту, лимонную кислоту, молочную кислоту и аскорбиновую кислоту.
19. Способ получения фармацевтической формы по п.12, отличающийся тем, что добавляют к соли пептида кислоту, выбранную из уксусной кислоты, глюкуроновой кислоты, глюконовой кислоты, молочной кислоты, лимонной кислоты или аскорбиновой кислоты, с получением стехиометрического количества соответствующей соли пептида, затем известным методом полученную соль вводят в микрочастицы с замедленным высвобождением, состоящие из гомо- или сополимеров молочной и гликолевой кислот, и полученные микрочастицы суспендируют в физиологически приемлемой среде для инъекций.
20. Применение пептидного антагониста LHRH в качестве активного ингредиента при получении фармацевтической формы для парентерального введения по одному из пп.1-10, 12 или 13 для профилактики или лечения зависимых от половых гормонов доброкачественных или злокачественных заболеваний, выбранных из группы, включающей доброкачественную гиперплазию предстательной железы, карциному предстательной железы, преждевременное половое развитие, гирсутизм, гиперплазию эндометрия, а также сопутствующие явления, карциному эндометрия, оплодотворение in vitro (IVF/COS/ART), контрацепцию, предменструальный синдром (ПМС), миоматоз матки, рак груди, окклюзию маточной трубы (ОМТ), рак яичников и карциному матки.
21. Применение по п.20 антагониста LHRH, выбранного из группы, включающей цетрореликс, антареликс, антид, А-75998, ганиреликс, Nal-Glu-антагонист или антагонисты, выбранные из Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Sеr4-Туr5-D-Ххх6-Lеu7-Аrg8-Рrо9-D-Аla10-NH2, где D-Xxx является [∈-N’-4-(4-амидинофенил)амино-1,4-диоксобутил]-Lуs (D-Lys(B)) или [∈-N’-(имидазолидин-2-он-4-ил)формил]-Lуs, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Hci6-Nle7-Arg8-Pro9-D-Ala10-NH2, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Lys(Atz)6-Leu7-Arg8-Pro9-D-Ala10-NH2, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Lys(B)6-Leu7-Lys(iPr)8-Pro9-D-Ala10-NH2, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Lys(B)6-Leu7-Arg8-Pro9-D-Ala10-NH2, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Hci6-Nle7-Lys(iPr)8-Pro9-Ala10-NH2Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Hci6-Nle7-Lys(iPr)8-Pro9-Sar10-NH2, Ac-D-Nal(2)1-D-Cpa2-D-Pal(3)3-Ser4-N-Me-Tyr5-D-Hci6-Nle7-Arg8-Pro9-Sar10-NH2 и 3-(4-фтopфeнил)пpoпиoнил-D-Nal(1)1-Ser-N-Me-Tyr5-D-Lys(Atz)6-Leu7-Arg8-Pro9-D-Ala10-NH2.
22. Применение цетрореликса в качестве активного ингредиента при получении фармацевтической формы для парентерального введения по одному из пп.14-16 для профилактики или лечения зависимых от половых гормонов доброкачественных или злокачественных заболеваний, выбранных из группы, включающей доброкачественную гиперплазию предстательной железы, карциному предстательной железы, преждевременное половое развитие, гирсутизм, гиперплазию эндометрия, а также сопутствующие явления, карциному эндометрия, оплодотворение in vitro (IVF/COS/ART), контрацепцию, предменструальный синдром (ПМС), миоматоз матки, рак груди, окклюзию маточной трубы (ОМТ), рак яичников и карциному матки.