Антиидиотипическое антитело к антителам, ингибирующим связывание иммуноглобулина с его высокоаффинным рецептором
Иллюстрации
Показать всеИзобретение относится к иммунологии и биотехнологии и может найти применение в медицине. В изобретении описывается антиидиотипическое моноклональное антитело (мимеотело) или его фрагмент к антителу BSW17, оказывающему воздействие на связывание Сε3-области IgE с высокоаффинным рецептором IgE. Аминокислотная последовательность представлена в описании. Антиидиотипическое антитело может быть использовано в качестве ингредиента фармацевтической композиции для лечения болезней, опосредуемых IgE, а также в составе вакцины для лечения таких заболеваний. Использование изобретения позволяет предотвратить аллергические и воспалительные реакции за счет ингибирования упомянутым мимеотелом взаимодействий Cε3-области IgE с высокоаффинным рецептором IgE. 2 н. и 5 з.п. ф-лы, 19 ил., 4 табл.
Реферат
Настоящее изобретение относится к антиидиотипическим антителам. Оно относится к ингибированию взаимодействий, которые обычно вызывают стимуляцию тучных клеток и базофилов, индуцированную связыванием с клеткой аллергена, сшитого с IgE, что приводит к выделению гистамина и других медиаторов, а также к синтезу de novo цитокинов, вовлеченных в регуляцию аллергических и воспалительных реакций. Изобретение относится к антиидиотипическим антителам или фрагментам антител, которые оказывают воздействие на связывание Сε 3-области IgE с рецептором, обладающим высокой аффинностью к IgE (высокоаффинным рецептором IgE.). Выявление специфических сайтов связывания на IgE, которые взаимодействуют с его высокоаффинным рецептором (Fcε RI), обеспечивает основу для получения антител, которые препятствуют этому взаимодействию путем распознавания связывающих эпитопов. Индукция таких антител путем вакцинации позволяет создать новый и имеющий всеобъемлющее применение метод лечения аллергии. В частности, настоящее изобретение относится к выявлению и получению фрагментов рекомбинантного антитела, которые могут входить в состав вакцины для производства антител к IgE, что может обеспечивать защиту от индукции опосредуемых IgE аллергических ракций.
Аллергические симптомы вызываются выделением из клеток в окружающую ткань и в сосудистые структуры вазоактивных аминов (медиаторов), прежде всего, гистамина. Гистамин в норме запасается в специализированных клетках, называемых тучными клетками и базофильными гранулоцитами. Тучные клетки распределены в ткани животного, а базофилы циркулируют в сосудистой системе. Эти клетки синтезируют и накапливают гистамин внутри клетки до тех пор пока не происходит определенная последовательность событий, стимулирующая его выделение.
Роль антител в виде IgE в опосредовании аллергических реакций хорошо известна. IgE представляет собой сложную, состоящую из полипептидных цепей структуру, которая так же, как и у других иммуноглобулинов, состоит из двух легких и двух тяжелых цепей, сшитых вместе дисульфидными связями в виде "Y-образной" конфигурации. Каждая легкая цепь имеет две области, одну вариабельную область (VL), сшитую с областью, имеющей относительно постоянную аминокислотную последовательность, которая называется константной областью (СL). В противоположность этому, тяжелые цепи имеют одну вариабельную область (VH), и в случае IgE, четыре константных области (CH1, CH2, СH3, СH4, также известные как Сε 1, Сε 2, Сε 3, Сε 4). Два "плеча" антитела, ответственные за связывание антигена, имеют области с вариабельной полипептидной структурой, и их называют Fab'-фрагментами или F(аb')2, они представляют собой два Fаb'-плеча, сшитых вместе дисульфидными связями. "Хвост", или центральная ось антитела, содержит фиксированную или постоянную последовательность пептидов и его называют Fc-фрагментом. Fc-фрагмент содержит интерактивные сайты, которые дают возможность антителу взаимодействовать с другими молекулами или клетками иммунной системы, связывая его с их Fc-рецепторами. Fc-рецепторы представляют собой молекулы, которые специфически связываются с активными молекулярными сайтами внутри Fc-областей иммуноглобулина. Fc-рецепторы могут существовать в виде связанных с мембраной протеинов в наружной плазматической мембране клетки или могут существовать в виде свободных "растворимых" молекул, которые свободно циркулируют в плазме крови или в других жидкостях организма. В организме человека высокоаффинное связывание IgE с рецептором Fcε RI происходит в результате сложного взаимодействия протеин-протеин, в котором участвуют различные части домена третьей константной области тяжелой цепи (Сε 3) IgE и ближайший к мембране иммуноглобулинподобный домен (α 2) субъединицы Fcε RIα . Хотя было установлено, что остатки внутри Сε 3-домена константной области тяжелой цепи Fсε и областей, принадлежащих к α 2-домену рецептора Fcε RIa, имеют большое значение для связывания, детальный механизм процесса связывания пока остается неясным. Экспериментальные данные позволили установить, что человеческий IgE принимает изогнутую форму, которая, как предполагается, придает исключительно высокую аффинность IgE к Fcε RI (Кd≤10-10 М). Кроме того, считается, что эта изогнутая форма также ответственна за образование эквимолярного комплекса между IgE и связанным с клеткой или растворимым Fcε RIα , хотя на молекуле IgE могут образовываться идентичные эпитопы на двух Сε 3-доменах, ответственных за связывание с рецептором. Эта моновалентность является функционально необходимой, если требуется избежать стимуляции рецептора в отсутствие аллергена.
Интерактивные сайты, в зависимости от их функции, могут уже быть доступными и, следовательно, обладать способностью связываться с клеточными рецепторами. Альтернативно этому, они могут быть скрыты до момента связывания антитела с антигеном, после чего антитело может изменить строение и вследствие этого станут доступными другие активные сайты, которые далее могут стимулировать специфическую иммунную активность. Было высказано предположение о том, что конформационное преобразование, оказывающее воздействие на связывание Сε 3 с рецептором, является причиной стехиометрического соотношения 1:1 комплекса Fcε /Fcε RI на поверхности клетки.
Аллергическое (иммунологическое) выделение медиаторов в организм из тучных клеток и базофилов может происходить только при следующих обстоятельствах: молекула IgE должна присоединиться или прикрепиться с помощью своего Fc-фрагмента к сайту клеточного Fc-рецептора, в результате чего происходит прикрепление молекулы IgE к тучной клетке или базофилу; и Fab'-фрагменты связанных с клеткой молекул IgE должны быть перекрестно сшиты с определенным совместимым с ними антигеном (аллергеном). Когда такое взаимодействие происходит, в тучной клетке или в базофиле автоматически стимулируется выделение гистамина в локальную окружающую среду, вызывая известные симптомы аллергии (фиг.1). На последней фазе реакции происходят другие биохимические процессы, которые приводят к синтезу de novo и выделению цитокинов и других медиаторов.
Общепринятые подходы к лечению аллергии включают системную терапию с использованием антигистаминных препаратов или десенсибилизацию пациентов; эти подходы не направлены на вмешательство в основное взаимодействие IgE - тучная клетка/базофил. Другой подход основан на получении полипептидных цепей, способных блокировать связывание антитела в виде IgE с Fc-рецепторами на поверхностях клеток, и на вытеснении IgE из сайтов связывания, с которыми IgE уже связан, кроме того, были проведены исследования с целью выяснения природы предполагаемого "эффекторного" сайта внутри Fc-области IgE, который, вероятно, создает иммунологический сигнал, стимулирующего выделение гистамина тучными клетками/базофилами.
Также были сделаны попытки применения рекомбинантных фрагментов IgE в качестве иммуногенов для получения защитной анти-IgE вакцины, и они оказались эффективными. Основной аргумент против такой вакцины обусловлен опасением того, что использование для иммунизации больших фрагментов IgE может инициировать не только производство ингибиторных антител, но также может приводить к поперечному связыванию и тем самым продуцировать образование у пациентов анафилактогенных антител.
Целью стратегии, позволяющей преодолеть эту проблему, является выявление наименьшего возможного фрагмента IgE, в идеале состоящего только из сайта связывания рецептора, который после связывания оказывается скрытым внутри комплекса IgE/IgERI и, таким образом, более не доступным для поперечного связывания при генерируемом вакциной иммунном ответе. Маловероятно, чтобы попытки реконструировать такую сложную молекулярную структуру оказались успешными, учитывая пространственное удаление различных областей Сε 3, вовлеченных во взаимодействие IgE/IgERI.
Проблемы, присущие "классическому" подходу, основанному на применении вакцин, могут быть преодолены путем использования для активной иммунизации коротких мимеотопных пептидов либо в виде синтезированных химическим путем пептидов, сшитых с соответствующими носителями, либо в виде рекомбинатных слитых конструкций, например, с овальбумином или IgG. Такие пептиды являются структурными мимиками эпитопа, распознаваемого моноклональным антителом BSW17, которое распознает конформационный эпитоп на Fcε , в том числе, те его части, которые находятся в Сε 3-области и которые находятся в Сε 4-области. Линия клеток гибридомы, продуцирующая BSW17, депонирована 19 декабря 1996 г. в соответствии с Будапештским договором о депонировании микроорганизмов в Европейской коллекции культивируемых клеток животных (ЕСАСС) под регистрационным номером 96121916. Это антитело обладает представляющим интерес профилем биологических активностей, что обобщено на фиг.2. Оно само является неанафилактогенным и защищает тучные клетки и базофилы человека от зависящего от IgE выделения гистамина, индуцируемого триггер-сигналами. BSW17 или BSW17-пoдoбныe антитела, циркулирующие в сосудистой системе, защищают от аллергических реакций путем а) ингибирования стимуляции тучных клеток и базофилов с помощью конкурентного ингибирования взаимодействия IgE/IgERI, и б) снижения уровней IgE в сыворотке с помощью понижающей регуляции синтеза IgE на уровне В-клеток. В качестве структурных мимиков эпитопа антитела к IgE, синтезированные химическим путем BSW17-мимеотопные пептиды, индуцируют иммунный ответ, приводящий к продуцированию BSW17-подобных антител в хозяине. Поскольку установлено, что BSW17 являются неанафилактогенными, ингибируют связывание IgE/IgERI и синтез IgE на поверхности В-клеток, то эти антитела, секретируемые в ответ на введение вакцин на основе BSW17-мимеотопного пептида, обладают аналогичными защитными свойствами. Возможным недостатком таких вакцин на основе ВSW17-мимеотопного пептида может являться необходимость связывания синтезированных химическим путем пептидов с носителями-протеинами для усиления иммуногенности пептидов. Кроме того, структурная гибкость коротких пептидов позволяет им принимать различные стерические конформации. Таким образом, только фракция поликлонального антимимеотопного иммунного ответа может быть терапевтически активной при перекрестной реакции с человеческим IgE.
Настоящее изобретение лишено возможных недостатков, присущих подходу, основанному на применении мимеотопных пептидов. Оно основано на применении антител или фрагментов антител, которые являются антиидиотипическими по отношению к антителам, которые воздействуют на связывание IgE с его высокоаффинным рецептором, в частности на применении рекомбинантных антиидиотипических антител к BSW17. Согласно схематичной теории Jerne (Jerne N., Ann. Immunol. 125C [1974] 373), гипервариабельные участки антитела (Ат1) сами могут являться антигенами. Продуцируемые таким путем антитела известны как антиидиотипические (anti-id) антитела (Ат2), поскольку они связываются с идиотипической областью первого антитела (фиг.3). Такие anti-id-антитела направлены к антигенсвязывающему центру (паратопу) первого антитела (Ат1) и, таким образом, представляют собой "внутренний образ" исходного антигена. Следовательно, anti-id-антитела (Ат2), называемые антителами "внутреннего образа" или Ат2β , также обладают способностью стимулировать образование антител с помощью их гипервариабельных участков. Эти антитела к anti-id-антителам (Ат3) напоминают по структуре паратоп Ат1 и, следовательно, обладают биологическими свойствами, аналогичными антителу Ат1. В случае системы hIgE/BSW17, IgE представляет собой исходный антиген, а BSW17 - антитело Ат1. Паратоп антиидиотипического антитела к BSW17, т.е. Ат2, таким образом, является структурным мимиком hIgE-области (эпитоп), распознаваемой BSW17. Структурно паратоп Ат2 является эквивалентом описанных выше синтезированных химическим путем BSW17-мимеотопных пептидов. Если такое (рекомбинантное) антиидиотипическое антитело к BSW17 используется в качестве вакцины, то у вакцинированного пациента должен индуцироваться ВSW17-подобный иммунный ответ (Ат3). Подобно BSW17, эти поликлональные иммуноглобулины в виде Ат3 могут оказывать воздействие на связывание IgE с его высокоаффинным рецептором, таким образом, действуя в качестве антиаллергических агентов. В противоположность гибким синтетическим мимеотопным пептидам паратоп Ат2 должен присутствовать в окружающей среде в структурно жесткой конформации. Таким образом, иммунный ответ к определенному эпитопу hIgE должен быть более специфическим. Кроме того, при таком подходе отпадает необходимость в гетерологичном иммуногенном носителе. При этом удается избежать возможных побочных воздействий, которые связаны с протеином-носителем типа столбнячного токсина или токсоида дифтерии.
Настоящее изобретение относится к антителам или фрагментам антител, которые являются антиидиотипическими по отношению к таким антителам, как Е25 (олизумаб) или CGP56901 или предпочтительно BSW17, оказывающим воздействие на связывание Сε 3-области IgE с высокоаффинным рецептором IgE; далее в контексте настоящего описания они кратко обозначены как "мимеотела по изобретению". В случае, когда они являются антиидиотипическими по отношению к BSW17, то их кратко обозначают как "BSW17-мимеотела".
Таким образом, мимеотела по изобретению представляют собой антиидиотипические антитела или фрагменты антител, которые специфично связываются с эпитопом, который представляет собой паратоп антитела к IgE, распознающий сайт Сε 3-области молекулы IgE, связывающейся с высокоаффинным рецептором IgE (Fcε RI).
Если мимеотела по изобретению предназначены для введения людям, то они главным образом являются человеческими. Предпочтительно они являются рекомбинантными. Предпочтительно они являются моноклональными. Предпочтительно они представляют собой фрагменты антител, например содержат или включают:
- либо как тяжелые, так и легкие цепи (например, Fab-фрагменты), либо только тяжелые или легкие цепи (например, димеры легких цепей), предпочтительно в сочетании с участками компонента их константной области, которые, например, представлены на фиг.4 (Seq.id. no. 35, 36, 37 и 38), где под "константной областью" следует также понимать константную область, имеющую незначительные стерические модификации, такие как присутствующие в аллотипических вариантах, например в 1-5 положениях, как правило, только в 1 положении аминокислоты в константной области;
- или их части, в частности, по меньшей мере их определяющие специфичность части, например, представленные на фиг.5а-5г (Seq.id. no. 2, 4, 6, 8);
- или их подчасти, например, по меньшей мере их гипервариабельные участки, такие как пептиды, состоящие из участков аминокислотных последовательностей, включающих по меньшей мере один CDR, например, включающих по меньшей мере один CDR, или предпочтительно два или еще более предпочтительно три CDR, представленных на фиг.5а, 5б, 5в или 5г (Seq.id. no. 2, 4, 6, 8), необязательно в сочетании с соседними каркасными последовательностями, например, включающими вплоть до примерно 10 аминокислот на одном или обоих концах CDR.
Мимеотела по изобретению представляют собой выделенные и практически чистые антитела или фрагменты антител, полученные из встречающихся в естественных условиях anti-id-антител к IgE. В частности, они практически не содержат других антител. Под "практической чистотой" следует понимать чистоту, составляющую по меньшей мере примерно 60 мас.%, предпочтительно примерно 90 мас.%, более предпочтительно примерно 99 мас.% или более.
Изобретение также относится к фармацевтическим композициям, прежде всего вакцинам, включающим мимеотела по изобретению либо в виде отдельной молекулы, либо в виде конъюгата протеина, химически связанного с молекулой иммуногенного носителя, при необходимости в сочетании с адъювантом или другими общепринятыми эксципиентами.
Оно также относится к мимеотелам по изобретению, предназначенным для применения в качестве фармацевтических агентов, в частности, в качестве вакцин, прежде всего, для лечения опосредуемых IgE болезней.
Оно также относится к применению антител, которые оказывают воздействие на связывание Сε 3-области IgE с высокоаффинным рецептором IgE, такого как BSW17, для идентификации мимеотела по изобретению с помощью общепринятых методов, таких как технология воспроизводства фага.
Кроме того, оно относится к способу лечения опосредуемых IgE болезней, в частности, путем вакцинации, предусматривающему введение терапевтически эффективного количества мимеотела по изобретению пациенту, который нуждается в таком лечении или вакцинации.
Оно также относится к применению мимеотела по изобретению для приготовления лекарственного средства для лечения опосредуемых IgE болезней, в частности вакцины.
Оно также относится к применению мимеотел по изобретению для создания поликлональных или моноклональных антител, предназначенных для пассивной иммунизации; для получения поликлональных или моноклональных антител к мимеотелам по изобретению для пассивной иммунизации либо путем введения мимеотел по изобретению приемлемому животному (не человеку) и выделения и очистки полученных таким образом антител, либо с помощью общепринятых методов на основе гибридом; и к применению поликлональных или моноклональных антител, полученных с использованием мимеотел по изобретению, для лечения опосредуемых IgE болезней с помощью пассивной иммунизации.
Оно также относится к способу идентификации мимеотел по изобретению, предусматривающему
- идентификацию встречающихся в естественных условиях антиидиотипических антител к IgE;
- выделение их фрагментов; и
- отбор их рекомбинантных фрагментов путем связывания с приемлемым моноклональным антителом к IgE, таким как BSW17, которое оказывает воздействие на связывание Сε 3-области IgE с высокоаффинным рецептором IgЕ.
После их идентификации и изучения свойств мимеотела по изобретению могут быть получены обычным образом, например, с помощью рекомбинантной ДНК или путем химического синтеза.
Для идентификации антиидиотипических антител, обладающих такой же специфичностью, что и указанные выше мимеотопные пептиды (т.е. выбранные эпитопы на молекуле IgE), может использоваться доступная библиотека бактериофага, которая экспрессирует Fab-область популяции человеческих антител. Эту библиотеку конструируют, например, из группы В-клеток, полученных из миндалин людей, а иммобилизованное антитело BSW17 используют в качестве мишени для биологического пэннинга. Фаговые частицы, экспрессирующие человеческие Fab-фрагменты, специфично распознающие BSW17, выделяют и увеличивают их количество. Таким образом, эти рекомбинантные Fab-фрагменты являются мимеотелами по изобретению и представляют собой антиидиотипы к гипервариальным областям BSW17. При применении в качестве вакцины они индуцируют иммунный ответ, который приводит к производству BSW17-пoдoбныx антител у страдающего аллергией пациента. Поскольку BSW17 является неанафилактогенным и ингибирует связывание IgE/IgERI и синтез IgE на поверхности В-клеток, то поликлональные антитела, секретируемые в организме пациента в ответ на введение вакцин на основе антиидиотипических Fab-фрагментов BSW17, обладают аналогичными свойствами. Иммунный ответ является очень специфическим и безопасным, поскольку в противоположность "классическому подходу, основанному на применении вакцин" не присутствуют никакие происходящие из IgE фрагменты протеина, которые могли бы обеспечивать поперечное связывание антител у иммунизированных пациентов, кроме того, могут применяться композиции, в которых отсутствует носитель.
Эти BSW17-мимеотела представляют собой рекомбинантные антитела или фрагменты антител, состоящие из вариабельных областей (V-областей) и константных областей (С-областей), происходящих из человеческого иммуноглобулина G. Два различных клона (клоны 52 и 43), которые несут различные фрагменты мимеотел на своей поверхности, были выявлены путем биологического пэннинга библиотек фаговых антител на иммобилизованном антителе BSW17. Структура мимеотела имитирует BSW17-эпитоп на фрагментах человеческого IgE внутри гипервариабельных участков (CDR) и соседних каркасных участков (FR) V-областей. кДНК и аминокислотные последовательности тяжелой и легкой цепей V-областей клона 52 и клона 43 представлены на фиг.5а-5г (Seq. id. no. 1-8). Конструкция легкой цепи клона 52 (L.C.)2 включает димерный "Fab-подобный" фрагмент легкой цепи. Полная структура этих BSW17-мимеотел схематично представлена на фиг.4А-4В, при этом следует понимать, что части константной области также могут иметь незначительные стерические модификации, такие как присутствующие в описанных выше аллотипических вариантах. Аминокислотная последовательность каждой полной тяжелой и легкой цепи этих клонов представлена на фиг.12а-12г (Seq.id. no. 35-38).
Мимеотела по изобретению обладают фармакологической активностью. Вследствие этого они могут применяться в качестве фармацевтических агентов, например антигенов для вакцин. Будучи практически неспособными вызывать нецитолитическое выделение гистамина, они способны стимулировать появление антител, обладающих сильной серологической перекрестной реактивностью по отношению к аминокислотным последовательностям-мишеням Fc-фрагмента IgE.
Начальная доза мимеотела по изобретению составляет, например, от приблизительно 0,05 мг до приблизительно 5 мг, предпочтительно приблизительно 1 мг; она может вводиться, например, назально или подкожно или внутримышечно, после чего спустя 14-28 дней вводят повторные (бустерные) дозы этого же препарата. Дозы, естественно, должны зависеть в определенной степени от возраста, веса и общего состояния здоровья пациента и могут регулироваться соответствующим образом.
Непосредственную вакцинацию, которая называется активной иммунизацией мимеотелами по изобретению, предпочтительно осуществляют с помощью рекомбинантных пептидов (Fab-фрагмента легкой цепи или тяжелой цепи), которые могут быть получены с помощью общепринятой методики в различных экспрессионных системах-хозяевах, например бактериях, грибах или эукариотических клетках.
Предпочтительным является введение свободного рекомбинантного мимеотела. Однако также возможно дополнительно повышать иммуногенность иммунногена путем химического связывания с иммуногенным носителем. Под понятием "иммуногенный носитель" в контексте настоящего описания подразумевают материалы, которые обладают способностью независимо вызывать иммуногенный ответ у животного-хозяина и которые могут быть ковалентно сшиты с полипептидом либо непосредственно путем образования пептидных или сложноэфирных связей между свободной карбоксильной, амино- или гидроксильной группами в полипептиде и соответствующими группами на материале иммуногенного носителя, либо в альтернативном варианте путем связи через обычную бифункциональную сшивающую группу.
Примеры таких носителей включают: альбумины сыворотки животных, глобулины сыворотки животных, тироглобулины животных, гемаглобины животных, гемоцианины животных (в частности, гемоцианин лимфы улитки [KLH]); протеины, экстрагируемые из аскарид, например экстракты аскарид, описанные в J. Immun. 111 [1973] 260-268, J. Immun. 122 [1979] 302-308, J. Immun. 98 [1967] 893-900 и в Am. J. Physiol. 199 [1960] 575-578, или их очищенные продукты; полилизин, полиглутаминовую кислоту, сополимеры лизина и глутаминовой кислоты, сополимеры, содержащие лизин или орнитин, и т.д. В настоящее время вакцины производятся с использованием в качестве материала иммуногенного носителя токсоида дифтерии, такого как CRM197, или столбнячного токсоида (Lepow M.L. и др., J. Infectious Diseases 150 [1984] 402-406; Coen Beuvery E. и др., Infection and Immunity 40 [1983] 39-45), и эти токсоидные материалы также могут применяться согласно настоящему изобретению. В противоположность химически детоксицированному токсину дифтерии, предпочтительно применяют рекомбинантный мутантный токсин дифтерии CRM197. В CRM197 остаток глицина в положении 52 заменен глутаминовой кислотой с образованием нетоксичного продукта. CRM197 представляет собой хорошо известный нетоксичный носитель-протеин, и он применяется в зарегистрированной человеческой вакцине. Очищенное протеиновое производное туберкулина (PPD) является особенно предпочтительным для использования в схеме "активной" иммунизации, поскольку (1) оно не индуцирует сам Т-клеточный ответ (т.е. оно является в действительности "Т-клеточным гаптеном"), но еще ведет себя как полностью процессированный антиген и поэтому распознается Т-клеткой; (2) известно, что оно является одним из наиболее сильных гаптеновых "носителей" с точки зрения механизма распознавания; и (3) оно может применяться для иммунизации людей без дополнительного тестирования.
В качестве агентов, связывающих гаптен с носителем, могут использоваться агенты, обычно применяемые в препаратах антигенов. Ковалентное сшивание мимеотел по изобретению с иммуногенным материалом носителя может быть осуществлено общепринятым методом. Так, например, для непосредственного ковалентного сшивания предпочтительно использовать в качестве сшивающего агента производные бис-N-сукцинимидила, более предпочтительно бис(сульфосукцинимидил)суберат (BSS), или глутаровый альдегид или карбодиимид, наиболее предпочтительно дициклогексилкарбодиимид (DC) или 1-этил-3-(3-диметиламинопропил) карбодиимид.
Соотношение гаптена, агента, связывающего гаптен с носителем, и носителя может быть легко оценено общепринятым способом, но предпочтительно, чтобы применяемое массовое соотношение носителя и гаптена составляло от приблизительно 1 до приблизительно 6, предпочтительно от приблизительно 1 до приблизительно 5 в пересчете на массу гаптена, а соотношение молярных эквивалентов агента, связывающего гаптен с носителем, и гаптена составляло от приблизительно 5 до приблизительно 10. С помощью описанной выше реакции сочетания носитель связывают с гаптеном с помощью агента, связывающего гаптен с носителем, получая нужную композицию антигена в виде комплекса пептид-носитель, состоящего из мимеотопа по изобретению и носителя.
После завершения реакции полученный иммуноген может быть легко выделен и очищен общепринятым методом, например диализом, гель-фильтрацией или методом фракционированного осаждения.
Предпочтительным вариантом осуществления настоящего изобретения является активная иммунизация путем непосредственной вакцинации; однако также возможна и пассивная иммунизация. В последнем случае мимеотела по изобретению вводят пригодному животному (не человеку) и полученные антитела выделяют и очищают, а затем вводят человеку, для того чтобы вызвать облегчение аллергических симптомов.
Мимеотела по изобретению могут применяться в качестве фармацевтических агентов, прежде всего вакцин, в частности, для лечения опосредуемых IgE болезней, таких как аллергия, например, астма, атопический дерматит, аллергические формы эозинофилии, риниты, хроническая крапивница и пищевые аллергии.
Под понятием "лечение" следует понимать профилактическую, а также и лечебную иммунизацию. Хозяин предпочтительно представляет собой человека, однако при внесении соответствующих изменений изобретение также применимо практически к любому млекопитающему, например кошке или собаке. При рассмотрении настоящей заявки на интернациональной фазе в качестве ссылок были рассмотрены следующие прототипы:
Dl Progr. Allergy Clin. Immunol. (Proc. Int. Congress Allergol. Clin. Immunol., 16-й) 4 [1997] 339-342;
D2 Int. Arch. Allergy Immunol. 118 [1999] 119-121;
D3 Tumor Biology 18 [1999] Suppl. 2, 59;
D4 Tanox WO 89/06138;
D5 Panent Abstracts of Japan 4 [1999] [С.А. 130 [1999] 138296k] [JP 11/000174].
Пояснение к чертежам:
Фиг.1: Взаимодействие между IgE и его высокоаффинным рецептором.
Фиг.2: Свойства моноклонального антитела BSW17 к hIgE.
Фиг.3: Схема антиидиотипического взаимодействия:
Эпитоп hIgE, распознаваемый BSW17, и антиидиотипический паратоп схематически показаны черными точками. Черными окружностями обозначены гипервариабельные области антитела BSW17 (Ат1) и поликлонального антитела 3 (Ат3), индуцированного иммунизацией с использованием антиидиотипического антитела Ат2.
Фиг.4: Строение трех рекомбинантных BSW17-мимеотел:
A: Anti-id-BSW17 (аптиидиотипическое антитело к BSW17),
клон 52 (SDS426); легкая цепь: (L.C.)2 (Seq.id. no. 36)
Б: Anti-id-BSW17, клон 52 (SDS427); Fab: FАВ (Seq.id. no. 35 и 36)
В: Anti-id-BSW17, клон 43 (SDS463); Fab: FАВ (Seq.id. no. 37 и 38)
Фиг.5.: Клоны Fab-фрагментов антител к BSW17: последовательность ДНК человеческого иммуноглобулина, выявленного с использованием бактериофага, и выведенная аминокислотная последовательность:
Гипервариабельные участки (CDR) показаны курсивом:
Фиг.5а: клон 52; вариабельная область тяжелой цепи (Seq.id. no. 1 и 2) (CDR1: Seq.id. no. 39 и 40; CDR2: Seq.id. no. 41 и 42; CDR3: Seq.id. no. 43 и 44);
Фиг.5б: клон 52; вариабельная область легкой цепи (Seq.id. no. 3 и 4) (CDR1: Seq.id. no. 45 и 46; CDR2: Seq.id. no. 47 и 48; CDR3: Seq.id. no. 49 и 50);
Фиг.5в: клон 43; вариабельная область тяжелой цепи (Seq.id. no. 5 и 6) (CDR1: Seq.id. no. 51 и 52; CDR2: Seq.id. no. 53 и 54; CDR3: Seq.id.no. 55 и 56);
Фиг.5г: клон 43; вариабельная область легкой цепи (Seq.id. no. 7 и 8) (CDR1: Seq.id. no. 57 и 58; CDR2: Seq.id. no. 59 и 60; CDR3: Seq.id. no. 61 и 62).
Фиг.6: Гомология аминокислотных последовательностей rFab-фрагментов антител к BSW17 и Сε 3-домена человеческого IgE:
А: anti-id-Fab, клон 52, тяжелая цепь (hIgE, Сε 3: Seq.id. no. 25; клон 52: Seq.id. no.26):
anti-id Fab, клон 52, легкая цепь, сравнительный анализ последовательностей 1 (hIgE, Cε 3: Seq.id. no. 27; клон 52: Seq.id. no.28);
anti-id-Fab, клон 52, легкая цепь, сравнительный анализ последовательностей 2 (hIgE, Cε 3: Seq.id. no. 29; клон 52: Seq.id. no.30) соответственно;
Б: anti-id-Fab, клон 43, тяжелая цепь (hIgE, Сε 3: Seq.id. no. 31; клон 43: Seq.id. no.32);
anti-id-Fab, клон 43, легкая цепь (hIgE, Сε 3: Seq.id. no. 33; клон 43: Seq.id. no.34) соответственно.
Сравнительный анализ аминокислотных последовательностей: идентичные остатки обозначены закрашенными прямоугольниками, аналогичные аминокислоты обозначены серыми прямоугольниками (Lipman и Pearson). Положения Fcε -остатков обозначено над каждой парой сравниваемых последовательностей. Положение гипервариабельных (CDR) и каркасных участков (FR) рекомбинантных Fab-фрагментов обозначено под каждой парой последовательностей.
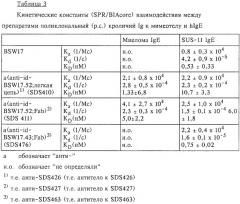
Фиг.7: Конкурентное связывание rFab-фрагмента anti-id-BSW1 на поверхности примированных IgE СНОα -клетках с использованием меченного с помощью ФИТЦ BSW17.
Фиг.8: Связывание с человеческим IgE очищенных с помощью аффинной хроматографии кроличьих иммунолобулинов антитела к ВSW17-мимеотелу:
Выявление комплексов hIgE/антитело к мимеотелу с помощью сэндвич-ELISA: hIgE и очищенные с помощью иммунноаффинной хроматографии препараты антител к ВSW17-мимеотелу смешивали в эквимолярной концентрации и инкубировали при 4° С. После инкубации смеси добавляли в лунки титрационного микропланшета, сенсибилизированные моноклональным антителом к hIgE LE27 (1 мкг/мл) в качестве иммобилизирующего антитела. Связанный IgG мимеотела выявляли с помощью комплекса: козий антикроличий IgG-HRP:
□ обозначает комплексы hIgE/SDS410;
Ο обозначает комплексы hIgE/SDS411.
Фиг.9: Иммунный ответ на антитело к ВSW17-мимеотелу у мышей линии Balb/c:
▪ обозначает мышь 1; • обозначает мышь 2; ▿ обозначает мышь 3; Δ обозначает мышь 4; обозначает мышь 5
A: anti-id-BSW17.52; легкая цепь (SDS426);
Б: anti-id-BSW17.52; Fab (SDS427);
В: anti-id-BSW17.43; Fab (SDS463).
Величины ОП представляют собой значения оптической плотности, скорректированные для фонового связывания в несенсибилизированных лунках. Приведены средние значения по двум повторностям. Вариации обычно составляют <0,05 ОП.
Фиг.10: Ингибирование связывания hIgE/Fcε RIα с использованием очищенных с помощью иммуноаффинной хроматографии антител к мимеотелу:
А: ▪ обозначает BSW17;
• обозначает клон 52 антитела; легкая цепь (SDS410);
Δ обозначает клон 52 антитела; Fab (SDS411);
▿ обозначает клон 52 антитела; легкая цепь (пропущенная через колонку);
Б: ▪ обозначает BSW17;
• обозначает клон 43 антитела; Fab (SDS476).
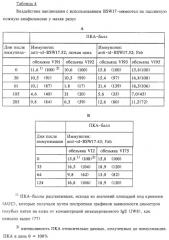
Фиг.11: Профили ПКА-баллов групп макак резус (n=2), иммунизированных различными препаратами мимеотел:
А: Иммуноген: anti-id-BSW17.52; легкая цепь (SDS426);
Б: Иммуноген: anti-id-BSW17.52; Fab (SDS427);
В: Иммуноген: anti-id-BSW17.43; Fab (SDS463).
Представлены данные о пассивной кожной анафилактической (ПКА) реакции кожи макак резус через различные промежутки времени после иммунизации. Значения ПКА-баллов обозначают интенсивности ПКА-реакций, рассчитанные на основе величин площадей под кривыми (AUC), которые получены путем построения графика зависимости диаметров голубых пятен на коже от концентраций инъецированного IgE (JW8). Баллы обозначают средние значения для каждой группы, состоящей из 2 обезьян, которых иммунизировали одним и тем же препаратом мимеотела, и их рассчитывали исходя из данных для каждой обезьяны, приведенных в таблице 4. Вариации приведены на графике в виде отрезков прямой, характеризующих значение погрешности результата. Статистические значения р показаны над отрезками прямой, характеризующими значение погрешности результата. Моменты времени, в которые производились бустер-инъекции, обозначены под осью абсцисс.
фиг.12: Полные аминокислотные последовательности тяжелой и легкой цепей трех рекомбинантных BSW17-мимеотел:
Фиг.l2a: Anti-id-BSW17, клон 52: вариабельная и первая константная области тяжелой цепи (Seq.id. no. 35);
Фиг.12б: Anti-id-BSW17, клон 52: вариабельная и константная области легкой цепи каппа-типа (Seq.id. no. 36);
Фиг.12в: Anti-id-BSW17, клон 43: нариабельная и первая константная области тяжелой цепи (Seq.id. no. 37);
Фиг.12г: Anti-id-BSW17, клон 43: вариабельная и константная области легкой цепи лямбда-типа (Seq.id. no. 38).
Клон 52 мимеотела (L.C.)2 включает легкую цепь, представленную на фиг.12б (Seq.id. no. 36), связанную дисульфидными мостиками, как показано на фиг.4А.
Fab-фрагмент клона 52 мимеотела включает легкую цепь, представленную на фиг.12б (Seq.id. no. 36), и тяжелую цепь, представленную на фиг.12а (Seq.id. no. 35), связанные дисульфидными мостиками, как показано на фиг.45.
Fab-фрагмент клона 43 мимеотела включает легкую цепь, представленную на фиг.12г (Seq.id. no. 38), и тяжелую цепь, представленную на фиг.12в (Seq.id. no. 37), связанные дисульфидными мостиками, как показано на фиг.4В.
Ниже изобретение проиллюстрировано на примерах, не огранивающих его объем. Температуры даны в градусах Цельсия. В описании использованы следующие сокращения:
anti-id = антиидиотипическое
ABTS = [2,2'-азиноди(3-этилбензтиазолин)сульфонат]
БСА = бычий сывороточный альбумин
BSW17 = мышиное моноклональное антитело к человеческому IgE; Сε 3 - специфическое
CDR = гипервариабельные участки
Сε 3 = домен третьей константной области тяжелой цепи IgE;
Сε 4 = домен четвертой константной области тяжелой цепи IgE
Сε Е = мимеотопный пептид, имитирующий Сε 3-эпитопную область, распознаваемую BSW17
Сε М = мимеотопный пептид, имитирующий Сε 4-эпитопную область, распознаваемую BSW17
КОЕ = колониеобразующая единица
ELISA = твердофазный иммуноферментный анализ
Fab = фрагмент антител, лишенный константных областей 2 и 3 тяжелой цепи
Fcε RI; IgERI = высокоаффинный рецептор IgE
Fcε RIα = высокоаффинный рецептор IgE, α -цепь
ТФС = фетальная телячья сыворотка
FR = каркасные участки
ФИТЦ = конъюгированная с флуоресцинизотиоцианатом
HRP = пероксидазпероксидаза из хрена
ЧСА = человеческий сывороточный альбумин
(h)IgE = (человеческий) иммуноглбулин Е
mАт = моноклональное антитело
MNC = мононуклеарные клетки
NIP = 3-нитро-4-гидроксийодфенилуксусная кислота
p.c. = поликлональный
Phab = фаг, предоставляющий Fab-фрагменты (Fab-экспрессирующий бактериофаг)
ЗФР = забуференный фосфатом физиологический раствор
ПКА = пассивная кожная анафилаксия
PWM =митоген лаконоса
r = рекомбинантый
KT = комнатная температура
SPR = поверхностный плазменный резонанс
Пример 1: Конструирование доступных библиотек фага
а) Источник лимфоцитов
В качестве доноров для получения мононуклеарных клеток (MNC) из периферической крови использовали двух взрослых мужчин. Первому взрослому мужчине, который являлся атопическим донором, имеющим клинические симптомы аллергии, вводили с помощью внутримышечной бустер-инъекции 0,5 мл адсорбированного на квасцах столбнячного токсоида (Те Anatoxal Bern, Swiss Serum and Vaccine Institute, Берн, Швейцария). Через 7 дней MNC выд