Глюкопиранозилоксибензилбензольные производные, лекарственные композиции, содержащие эти производные, и промежуточные соединения для получения указанных производных
Иллюстрации
Показать всеНастоящее изобретение относится к новым производным глюкопиранозилоксибензилбензола, представленным общей формулой:
где R1 представляет атом водорода или гидрокси(низший)алкил; а R2 представляет низшую алкильную группу, низшую алкоксигруппу и низшую алкилтиогруппу, каждая из которых необязательно замещена гидрокси или (низшей)алкокси группой, или его фармацевтически приемлемым солям. Изобретение также относится к фармацевтической композиции, обладающей гипогликемической активностью, а также к способу лечения и предупреждения заболеваний, связанных с гипергликемией, таких как диабет, ожирения и т.п., а также к их промежуточным соединениям. Цель - получение новых производных глюкопиранозилоксибензилбензола, которые обладают превосходной ингибирующей активностью по отношению к SGLT2 человека. 4 н. и 9 з.п. ф-лы, 2 табл.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к глюкопиранозилоксибензилбензольным производным и к фармацевтически приемлемым солям, которые могут быть использованы в качестве лекарственных средств, к фармацевтическим композициям, содержащим указанные производные, и к их промежуточным соединениям.
Предшествующий уровень техники
Диабет является одним из заболеваний, связанных с образом жизни и развивающихся на фоне изменения пищевых привычек и отсутствия физической нагрузки. Поэтому пациентам с диабетом показана диетотерапия и лечебная гимнастика. Кроме того, если достаточный контроль и продолжительность такой терапии представляет определенные трудности, то одновременно проводят лекарственную терапию. В настоящее время в качестве антидиабетических средств используются бигуаниды, сульфонилмочевины и агенты, снижающие инсулинорезистентность. Однако, иногда, бигуаниды и сульфонилмочевины дают побочные эффекты, такие как молочнокислый ацидоз и гипогликемия, соответственно. В случае использования агентов, понижающих резистентность к инсулину, иногда наблюдаются такие побочные эффекты, как отеки, а также прогрессирующее ожирение. Следовательно, для решения этих проблем необходимо разработать антидиабетические средства, обладающие новым механизмом действия.
За последние годы наблюдается большой прогресс в разработке антидиабетических средств нового типа, которые стимулируют выделение глюкозы с мочой и снижение уровней глюкозы в крови путем предупреждения реабсорбции избыточной глюкозы в почках (J.Clin. Invest., Vol.79, pp.1510-1515 (1987)). Кроме того, сообщалось, что SGLT2 (Na+/антипорт глюкозы 2) присутствует в сегменте S1 проксимальных почечных канальцев и участвует, главным образом, в реабсорбции глюкозы, фильтруемой через клубочки (J.Clin. Invest., Vol.93, pp.397-404 (1994)). В соответствии с этим ингибирование активности человеческого SGLT2 приводит к предупреждению реабсорбции избыточной глюкозы в почках, а следовательно, и к стимуляции выделения избыточной глюкозы через мочу, и, тем самым, к нормализации уровня глюкозы в крови. Поэтому необходима скорейшая разработка антидиабетических средств, которые обладали бы ингибирующей активностью по отношению к SGLT2 человека, и которые обладали бы новым механизмом действия. Кроме того, поскольку указанные агенты стимулируют выделение избыточной глюкозы через мочу, а следовательно, и снижение накопления глюкозы в организме, то также предполагается, что они будут оказывать действие, направленное на предупреждение ожирения.
Описание изобретения
Авторами настоящего изобретения были проведены серьезные исследования, направленные на получение соединений, обладающих ингибирующей активностью по отношению к SGLT2 человека. В результате этих исследований было обнаружено, что глюкопиранозилоксибензилбензольные производные, представленные нижеследующей общей формулой (I), обладают превосходной ингибирующей активностью в отношении SGLT2 человека, как будет показано ниже, и этот факт был положен в основу настоящего изобретения.
Настоящее изобретение относится к нижеследующим глюкопиранозилоксибензилбензольным производным и к их фармацевтически приемлемым солям, которые обладают ингибирующей активностью по отношению к SGLT2 человека In vivo и обнаруживают гипогликемическое действие посредством выделения избытка глюкозы с мочой, предупреждая, тем самым, реабсорбцию указанной глюкозы в почках, а также к фармацевтическим композициям, содержащим указанные производные и их промежуточные соединения.
Таким образом, настоящее изобретение относится к глюкопиранозилоксибензилбензольному производному, представленному общей формулой:
где R1 представляет атом водорода или гидрокси(низший)алкил; а R2 представляет низшую алкильную группу, низшую алкоксигруппу, низшую алкилтиогруппу, гидрокси(низший)алкил или группу:гидрокси(низший)алкокси, гидрокси(низший)алкилтио, низший алкокси-замещенный низший алкил, низший алкокси-замещенный низший алкокси или низший алкокси-замещенный низший алкилтио, или к его фармацевтически приемлемой соли.
Настоящее изобретение относится к фармацевтической композиции, содержащей в качестве активного ингредиента глюкопиранозилоксибензилбензольное производное, представленное вышеуказанной общей формулой (I), или к его фармацевтически приемлемой соли.
Настоящее изобретение относится к способу предупреждения или лечения заболевания, связанного (ассоциированного) с гипергликемией, предусматривающему введение глюкопиранозилоксибензилбензольного производного, представленного вышеуказанной общей формулой (I) или его фармацевтически приемлемой соли.
Настоящее изобретение относится к использованию глюкопиранозилоксибензилбензольного производного, представленного вышеуказанной общей формулой (I) или его фармацевтически приемлемой соли в целях изготовления фармацевтической композиции для предупреждения или лечения заболевания, ассоциированного с гипергликемией.
Настоящее изобретение также относится к бензилфенольному производному, представленному общей формулой:
где R11 представляет атом водорода или защищенную гидрокси(низший)алкил; а R12 представляет низшую алкильную группу, низшую алкоксигруппу, низшую алкилтиогруппу, защищенный гидрокси(низший)алкил, защищенный гидрокси(низший)алкокси, защищенный гидрокси(низший)алкилтио, низший алкокси-замещенный низший алкил, низший алкокси-замещенный низший алкокси или низший алкокси-замещенный (низший)алкилтио; при условии, что R12 не является метильной группой, этильной группой, изопропильной группой, трет-бутильной группой или метоксигруппой, когда R11 представляет атом водорода; или к его соли.
В настоящем изобретении термин "низшая алкильная группа" означает прямую или разветвленную алкильную группу, имеющую от 1 до 6 атомов углерода, такую как метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа, неопентильная группа, трет-пентильная группа, гексильная группа или т.п.; термин "низшая алкоксигруппа" означает прямую или разветвленную алкоксигруппу, имеющую от 1 до 6 атомов углерода, такую как метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа, трет-бутоксигруппа, пентилоксигруппа, изопентилоксигруппа, неопентилоксигруппа, трет-пентилоксигруппа, гексилоксигруппа или т.п.; а термин "низшая алкилтиогруппа" означает прямую или разветвленную алкилтиогруппу, имеющую от 1 до 6 атомов углерода, такую как метилтиогруппа, этилтиогруппа, пропилтиогруппа,, изопропилтиогруппа, бутилтиогруппа, изобутилтиогруппа, втор-бутилтиогруппа, трет-бутилтиогруппа, пентилтиогруппа, изопентилтиогруппа, неопентилтиогруппа, трет-пентилтиогруппа, гексилтиогруппа или т.п. Термин "гидрокси(низший)алкил" означает прямую или разветвленную гидроксиалкильную группу, имеющую от 1 до 6 атомов углерода, такую как гидроксиметильная группа, 2-гидроксиэтильная группа, 1-гидроксиэтильная группа, 3-гидроксипропильная группа, 2-гидроксипропильная группа, 1-гидроксипропильная группа, 2-гидрокси-1-метилэтильная группа, 4-гидроксибутильная группа, 3-гидроксибутильная группа, 2-гидроксибутильная группа, 1-гидроксибутильная группа, 5-гидроксипентильная группа, 4-гидроксипентильная группа, 3-гидроксипентильная группа, 2-гидроксипентильная группа, 1-гидроксипентильная группа, 6-гидроксигексильная группа, 5-гидроксигексильная группа, 4-гидроксигексильная группа, 3-гидроксигексильная группа, 2-гидроксигексильная группа, 1-гидроксигексильная группа или т.п.; термин "гидрокси(низший)алкилокси" означает прямую или разветвленную гидроксиалкоксигруппу, имеющую от 1 до 6 атомов углерода, такую как 2-гидроксиэтоксигруппа, 3-гидроксипропоксигруппа, 2-гидроксипропоксигруппа, 2-гидрокси-1-метилэтоксигруппа, 4-гидроксибутоксигруппа, 3-гидроксибутоксигруппа, 2-гидроксибутоксигруппа, 5-гидроксипентилоксигруппа, 4-гидроксипентилоксигруппа, 3-гидроксипентилоксигруппа, 2-гидроксипентилоксигруппа, 6-гидроксигексилоксигруппа, 5-гидроксигексилоксигруппа, 4-гидроксигексилоксигруппа, 3-гидроксигексилоксигруппа, 2-гидроксигексилоксигруппа или т.п.; термин "гидрокси(низший)алкилтио" означает прямую или разветвленную гидроксиалкилтиогруппу, имеющую от 1 до 6 атомов углерода, такую как гидроксиметилтиогруппа, 2-гидроксиэтилтиогруппа, 1-гидроксиэтилтиогруппа, 3-гидроксипропилтиогруппа, 2-гидроксипропилтиогруппа, 1-гидроксипропилтиогруппа, 2-гидрокси-1-метилэтилтиогруппа, 4-гидроксибутилтиогруппа, 3-гидроксибутилтиогруппа, 2-гидроксибутилтиогруппа, 1-гидроксибутилтиогруппа, 5-гидроксипентилтиогруппа, 4-гидроксипентилтиогруппа, 3-гидроксипентилтиогруппа, 2-гидроксипентилтиогруппа, 1-гидроксипентилтиогруппа, 6-гидроксигексилтиогруппа, 5-гидроксигексилтиогруппа, 4-гидроксигексилтиогруппа, 3-гидроксигексилтиогруппа, 2-гидроксигексилтиогруппа, 1-гидроксигексилтиогруппа или т.п. Термин "низший алкил-замещенный низший алкил группа" означает вышеуказанную гидрокси(низший)алкил группу, O-алкилированную вышеуказанной низшей алкильной группой; термин "низший алкокси-замещенный низший алкокси" означает вышеуказанную гидрокси(низший)алкилокси, O-алкилированную вышеуказанной низшей алкильной группой; а термин "низший алкокси-замещенный низший алктилтио" означает гидрокси(низший)алкилтиогруппу, O-алкилированную вышеуказанной низшей алкильнои группой.
Термин "гидроксизащитная группа" означает гидроксизащитную группу, используемую в общих органических реакциях, такую как бензильная группа, метоксиметильная группа, ацетильная группа или т.п.
В качестве заместителя R1 предпочтительными являются атом водорода и гидроксиалкильная группа, имеющая от 1 до 3 атомов углерода. В качестве заместителя R2 предпочтительными являются низшая алкильная группа, низшая алкоксигруппа и гидрокси(низший)алкил, а более предпочтительными являются алкильная группа, имеющая от 1 до 4 атомов углерода, алкоксигруппа, имеющая от 1 до 3 атомов углерода и гидроксиалкильная группа, имеющая от 1 до 3 атомов углерода.
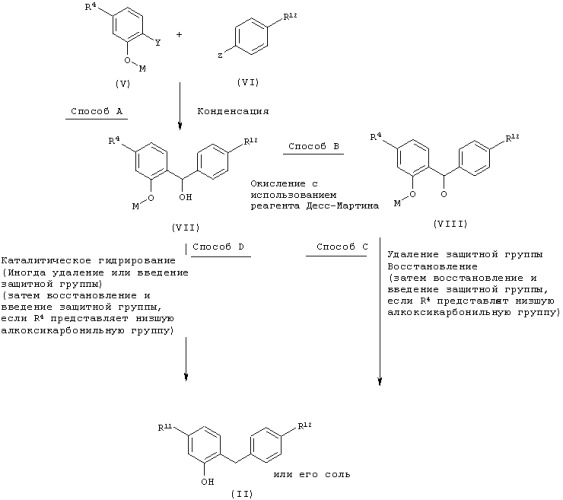
Так, например, соединения, представленные вышеуказанной общей формулой (I) настоящего изобретения, могут быть получены с использованием бензилфенольного производного настоящего изобретения, представленного общей формулой (II) в соответствии с нижеследующей процедурой:
где R11 представляет атом водорода или защищенный гидрокси(низший)алкил; R12 представляет низшую алкильную группу, низшую алкоксигруппу, низшую алкилтиогруппу, защищенный гидрокси(низший)алкил, защищенный гидрокси(низший)алкокси, защищенный гидрокси(низший)алкилтио, низший алкокси-замещенный низший алкил, низший алкокси-замещенный низший алкокси или низший алкокси-замещенный (низший)алкилтио; Х представляет уходящую группу, такую как трихлорацетоимидоилоксигруппу, ацетоксигруппу, атом брома или атом фтора; а R1 и R2 имеют значения, определенные выше.
Способ 1
Глюкозид, представленный вышеуказанной общей формулой (IV), может быть получен глюкозидированием бензилфенольного производного, представленного вышеуказанной общей формулой (II), или его соли, с использованием донора гликозил, представленного вышеуказанной общей формулой (III), такого как 2,3,4,6-тетра-О-ацетил-1-О-трихлорацетоимидоил-α-D-глюкопираноза, 1,2,3,4,6-пента-О-ацетил-β-D-глюкопираноза, 2,3,4,6-тетра-О-ацетил-α-D-глюкопиранозилбромид и 2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилфторид в присутствии активирующего реагента, такого как комплекс трифторид бора - диэтиловый эфир, трифторметансульфонат серебра, хлорид олова (IV) или триметилсилилтрифторметансульфонат в инертном растворителе. Примерами используемого растворителя могут служить дихлорметан, толуол, ацетонитрил, нитрометан, этилацетат, диэтиловый эфир, хлороформ, смесь указанных растворителей и т.п. Температура реакции обычно составляет в пределах от -30°С до температуры кипения с обратным холодильником (дефлегмации), а время реакции обычно составляет от 10 минут до 1 дня, в зависимости от используемых исходного материала, растворителя и температуры реакции.
Способ 2
Соединение (I) настоящего изобретения может быть получено щелочным гидролизом глюкозида, представленного вышеуказанной общей формулой (IV), с удалением гидроксизащитных групп. Примерами используемого растворителя могут служить вода, метанол, этанол, тетрагидрофуран, смесь указанных растворителей и т.п., а в качестве щелочных материалов могут быть использованы гидроксид натрия, метоксид натрия, этоксид натрия или т.п. Температура обработки обычно составляет в пределах от 0°С до температуры дефлегмации, а время обработки обычно составляет от 30 минут до 6 часов, в зависимости от исходного материала, растворителя и температуры обработки. Такая обработка может быть осуществлена путем соответствующей модификации данной процедуры или путем проведения дополнительной процедуры стандартным способом в зависимости от используемой гидроксизащитной группы.
Так, например, соединения настоящего изобретения, представленные вышеуказанной общей формулой (II), и их соли, которые используются в качестве исходных материалов в вышеупомянутом способе получения, могут быть получены в соответствии с нижеследующей процедурой.
где М представляет атом водорода или гидроксизащитную группу; R4 представляет атом водорода, защищенную гидрокси(низший)алкил или низшую алкоксикарбонильную группу; один из У и Z представляет МgВr, МgСl, Мgl или атом лития, а другой представляет формильную группу; и R11 и R12 имеют значения, определенные выше.
Способ А
Соединения, представленные вышеуказанной общей формулой (VII), могут быть получены конденсацией бензальдегидного производного, представленного вышеуказанной общей формулой (V), с реактивом Гриньяра или литиевым реагентом, представленным вышеуказанной общей формулой (VI), или конденсацией реактива Гриньяра или литиевого реагента, представленного вышеуказанной общей формулой (V), с бензальдегидным производным, представленным вышеуказанной общей формулой (VI), в инертном растворителе. Примерами используемого растворителя могут служить тетрагидрофуран, диэтиловый эфир, смесь этих растворителей и т.п. Температура реакции обычно составляет в пределах от -78°С до температуры дефлегмации, а время реакции обычно составляет от 10 минут до 1 дня в зависимости от используемых исходного материала, растворителя и температуры реакции.
Способ В
Соединение, представленное вышеуказанной общей формулой (VIII) может быть получено окислением соединения, представленного вышеуказанной общей формулой (VII), с использованием реагента Десс-Мартина в инертном растворителе. Примерами используемого растворителя могут служить дихлорметан, хлороформ, ацетонитрил, смесь этих растворителей и т.п. Температура реакции обычно составляет в пределах от 0°С до температуры дефлегмации, а время реакции обычно составляет от 1 часа до 1 дня в зависимости от используемого исходного материала, растворителя и температуры реакции.
Способ С
Соединение, представленное вышеуказанной общей формулой (II), может быть получено удалением защитной группы М у соединения, представленного вышеуказанной общей формулой (VIII), (1) конденсации полученного соединения с метилхлорформиатом в присутствии основания, такого как триэтиламин, диизопропилэтиламин или N,N-диметиламинопиридин, в инертном растворителе, и (2) восстановления полученного карбонатного производного с использованием восстановителя, такого как борогидрид натрия. В качестве растворителя, используемого в реакции (1), могут служить тетрагидрофуран, дихлорметан, ацетонитрил, этилацетат, диэтиловый эфир, смесь указанных растворителей и т.п. Температура реакции обычно составляет в пределах от 0°С до температуры дефлегмации, а время реакции обычно составляет от 30 минут до 1 дня, в зависимости от используемого исходного материала, растворителя и температуры реакции. В качестве растворителя, используемого в реакции (2), может служить смешанный растворитель из тетрагидрофурана и воды и т.п. Температура реакции обычно составляет в пределах от 0°С до температуры дефлегмации, а время реакции обычно составляет от 1 часа до 1 дня, в зависимости от используемого исходного материала, растворителя и температуры реакции. В случае, когда R4 представляет низшую алкоксикарбонильную группу, соединения настоящего изобретения, представленные вышеуказанной общей формулой (II), могут быть получены восстановлением указанной группы до гидроксиметильной группы с использованием восстановителя, такого как алюмогидрид лития, в инертном растворителе и защиты гидроксигруппы стандартным способом. Примерами используемого растворителя могут служить диэтиловый эфир, тетрагидрофуран, смесь этих растворителей и т.п. Температура реакции обычно составляем в пределах от 0°С до температуры дефлегмации, а время реакции обычно составляет от 10 минут до 1 дня, в зависимости от используемого исходного материала, растворителя и температуры реакции. Соединения настоящего изобретения, представленные вышеуказанной общей формулой (II), могут быть превращены в их соль, такую как натриевая или калиевая соль, стандартным способом.
Способ D
Соединение настоящего изобретения, представленное вышеуказанной общей формулой (II), может быть получено каталитическим гидрированием соединения, представленного вышеуказанной общей формулой (VII), с использованием палладиевого катализатора, такого как порошкообразный палладий на угле, в отсутствие или в присутствии кислоты, такой как соляная кислота в инертном растворителе, и удаления или введения защитной группы стандартным способом, если это необходимо. В качестве растворителя, используемого в реакции каталитического гидрирования, могут служить метанол, этанол, тетрагидрофуран, этилацетат, уксусная кислота, изопропанол, смесь указанных растворителей и т.п. Температура реакции обычно составляет в пределах от комнатной температуры до температуры дефлегмации, а время реакции обычно составляет от 30 минут до 1 дня, в зависимости от используемых исходного материала, растворителя и температуры реакции. В случае, если R4 представляет низшую алкоксикарбонильную группу, то соединения настоящего изобретения, представленные вышеуказанной общей формулой (II), могут быть получены восстановлением указанной группы до гидроксиметильной группы с использованием восстановителя, такого как алюмогидрид лития, в инертном растворителе, и защиты указанной гидроксигруппы стандартным способом. В качестве растворителя, используемого в указанной реакции восстановления, могут служить диэтиловый эфир, тетрагидрофуран, смесь этих растворителей и т.п. Температура реакции обычно составляет в пределах от 0°С до температуры дефлегмации, а время реакции обычно составляет от 10 минут до 1 дня, в зависимости от используемых исходного материала, растворителя и температуры реакции. Соединение настоящего изобретения, представленное вышеуказанной общей формулой (II), может быть превращено в его соль, такую как натриевая или калиевая соль, стандартным способом.
Соединения настоящего изобретения, полученные вышеуказанными способами, могут быть выделены и очищены стандартными способами разделения, такими как фракционированная перекристаллизация, очистка с использованием хроматографии, экстракция растворителем и твердофазная экстракция.
Глюкопиранозилоксибензилбензольные производные настоящего изобретения, представленные вышеуказанной общей формулой (I), могут быть превращены в их фармацевтически приемлемые соли стандартным способом. Примерами таких солей являются соли неорганических оснований, такие как натриевая соль или калиевая соль.
Соединениями настоящего изобретения, представленными вышеуказанной общей формулой (I), являются их гидраты и их сольваты с фармацевтически приемлемыми растворителями, такими как этанол.
Соединения настоящего изобретения, представленные вышеуказанной общей формулой (I), и их фармацевтически приемлемые соли обладают превосходной ингибирующей активностью по отношению к SGLT2 человека и представляют собой в высокой степени ценные агенты для предупреждения или лечения диабета, осложнений диабета, ожирения или т.п. Так, например, в нижеописанном анализе на ингибирующее действие активности SGLT2 человека соединения настоящего изобретения обнаруживали сильную ингибирующую активность по отношению к SGLT2 человека.
При применении фармацевтических композиций настоящего изобретения для практического лечения могут быть использованы различные лекарственные формы в зависимости от целей их использования. Примерами таких лекарственных форм являются порошки, гранулы, тонкодисперсные гранулы, сухие сиропы, таблетки, капсулы, инъекции, растворы, мази, суппозитории, припарки и т.п., которые вводят перорально или парентерально.
Указанные фармацевтические композиции могут быть получены смешиванием с соответствующими фармацевтическими добавками или разбавлением указанными добавками или растворения в указанных добавках, таких как наполнители; дезинтегрирующие агенты; связующие агенты; смазывающие агенты; разбавители; буферы; агенты, придающие изотоничность; антисептики; увлажнители; эмульгаторы; диспергирующие агенты; стабилизаторы; вещества, способствующие растворению, и т.п., и получения смеси стандартным способом.
При применении фармацевтических композиций настоящего изобретения для практического лечения дозу соединения настоящего изобретения, представленного вышеуказанной общей формулой (I), или его фармацевтически приемлемой соли, используемых в качестве активного ингредиента, назначают в зависимости от возраста, пола, массы тела, тяжести симптомов и фазы лечения каждого отдельного пациента, и эта доза приблизительно составляет от 0,1 до 1,000 мг в день для взрослого человека в случае перорального введения, и приблизительно в пределах от 0,01 до 300 мг в день для взрослого человека в случае парентерального введения, при этом суточная доза может быть соответствующим образом введена в виде одной разовой дозы или нескольких доз в день.
Наилучшие варианты осуществления изобретения
Настоящее изобретение более подробно проиллюстрировано в нижеследующих Сравнительных примерах, в Примерах и в Примерах испытаний. Однако настоящее изобретение не ограничивается приведенными примерами.
Сравнительный пример 1
4-(3-бензилоксипропил)бромбензол
Суспензию гидрида натрия (60%, 0,97 г), 3-(4-бромфенил)-1-пропанола (1,0 г) и бензилбромида (0,69 мл) в бензоле (24 мл) перемешивают в течение 7 часов при кипячении с обратным холодильником. После охлаждения до комнатной температуры к реакционной смеси добавляют насыщенный водный раствор хлорида аммония (50 мл) и смесь экстрагируют этилацетатом (100 мл). Органический слой промывают водой (40 мл) и насыщенным раствором соли (40 мл) и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 20/1) с получением 4-(3-бензилоксипропил)бромбензола (1,4 г).
1Н-ЯМР (СDСl3) δ м.д.:
1,85-2,00 (2Н, м), 2,60-2,75 (2Н, м), 3,47 (2Н, т, J=6,2 Гц), 4,50 (2Н, с), 7,00-7,10 (2Н, м), 7,20-7,45 (7Н, m).
Сравнительный пример 2
Метил-4-(4-этилбензил)-3-гидроксибензоат
К раствору 1-бром-4-этилбензола (0,41 мл) в тетрагидрофуране (15 мл) добавляют 1,45 моль/л раствора трет-бутиллития в н-пентане (2,3 мл) в атмосфере аргона при -78°С. После перемешивания смеси при -78°С в течение 10 минут к реакционной смеси добавляют раствор метил-4-формил-3-гидроксибенэоата (0,18 г) в тетрагидрофуране (5 мл). После перемешивания смеси при охлаждении льдом в течение 45 минут к реакционной смеси добавляют насыщенный водный раствор хлорида аммония и воду и смесь экстрагируют этилацетатом. Экстракт промывают водой и сушат над безводным сульфатом магния и растворитель удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 3/1) с получением дефенилметанольного соединения (0,27 г). Полученное дифенилметанольное соединение (0,27 г) растворяют в метаноле (5 мл) и к раствору добавляют концентрированную соляную кислоту (0,08 мл) и 10% порошкообразный палладий на угле (54 мг). После перемешивания смеси в атмосфере водорода при комнатной температуре в течение 18 часов катализатор удаляют фильтрацией и фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат=3/1) с получением метил-4-(4-этилбензил)-3-гидроксибензоата (0,20 г).
1H-ЯМР (СDСl3) δ м.д.:
1,22 (3Н, т, J=7,6 Гц), 2,62 (2Н, kb, J=7,6 Гц), 3,89 (3Н, с), 4,00 (2Н, с), 5,01 (1Н, с), 7,05-7,25 (5Н, м), 7,47 (1Н, д, J=1,6 Гц), 7,56 (1Н, дд, J=1,6, 7,8 Гц).
Сравнительный пример 3
Метил-3-гидрокси-4-(4-пропоксибензил)бензоат
К раствору 1-аллилокси-4-бромбензола (3,1 г) в тетрагидрофуране (70 мл) добавляют 1,45 моль/л раствора трет-бутиллития в н-пентане (11 мл) в атмосфере аргона при -78°С. После перемешивания смеси при -78°С в течение 5 минут к реакционной смеси добавляют раствор метил-4-формил-3-гидроксибензоата (0,89 г) в тетрагидрофуране (15 мл). После перемешивания смеси при охлаждении льдом в течение 30 минут к реакционной смеси добавляют насыщенный водный раствор хлорида аммония и воду и смесь экстрагируют этилацетатом. Экстракт промывают водой и сушат над безводным сульфатом магния и растворитель удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат=3/1) с получением дифенилметанольного соединения (0,99 г). Полученное дифенилметанольное соединение (0,99 г) растворяют в метаноле (10 мл) и к раствору добавляют 10% порошкообразный палладий на угле (0,30 г). После перемешивания смеси в атмосфере водорода при комнатной температуре в течение 24 часов катализатор удаляют фильтрацией и фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат=3/1) с получением метил-3-гидрокси4-(4-пропоксибензил)бензоата (0,50 г).
1H-ЯМР (CDCl3) δ м.д.:
1,02 (3Н, т, J=7,4 Гц), 1,70-1,85 (2Н, м), 3,80-3,95 (5Н, м), 3,97 (2Н, с), 4,99 (1Н, с), 6,75-6,90 (2Н, м), 7,05-7,20 (3Н, м), 7,47 (1Н, д, J=1,5 Гц), 7,56 (1Н, дд, J=1,5, 7,8 Гц).
Сравнительный пример 4
Метил-3-гидрокси-4-[4-(2-гидроксиэтил)бензил]бензоат
К раствору 2-(бромфенил)этилового спирта (1,7 г) в тетрагидрофуране (100 мл) добавляют 1,45 моль/л раствора трет-бутиллития в н-пентане (12,6 мл) в атмосфере аргона при -78°С. После перемешивания смеси при -78°С в течение 10 минут к реакционной смеси добавляют раствор метил-4-формил-3-гидроксибензоата (0,50 г) в тетрагидрофуране (10 мл). После перемешивания смеси при охлаждении льдом в течение 30 минут к реакционной смеси добавляют насыщенный водный раствор хлорида аммония и воду и смесь экстрагируют этилацетатом. Экстракт промывают водой и сушат над безводным сульфатом магния и растворитель удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат=1/3) с получением дифенилметанольного соединения (0,28 г). Полученное дифенилметанольное соединение (0,28 г) растворяют в метаноле (5 мл) и к раствору добавляют 10% порошкообразный палладий на угле (0,14 г). После перемешивания смеси при комнатной температуре в течение 14 часов в атмосфере водорода, катализатор удаляют фильтрацией и фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент:гексан/этилацетат=1/1) с получением метил-3-гидрокси- 4-[4-(2-гидроксиэтил)бензил]бензоата (0,26 г).
1H-ЯМр (CDCl3) δ м.д.:
1,37 (1Н, т, J=5,9 Гц), 2,84 (2Н, т, J=6,5 Гц), 3,75-3,95 (5Н, м), 4,01 (2Н, с), 5,10 (1Н, с), 7,05-7,25 (5Н, м), 7,47 (1Н, д, J=1,6 Гц), 7,56 (1Н, дд, J=1,6, 7,8 Гц).
Сравнительный пример 5
2-(4-изобутилбензил)фенол
Реактив Гриньяра получают из 2-бензилоксибромбензола (0,20 г), магния (0,026 г), каталитического количества иода и тетрагидрофурана (1 мл). Полученный реактив Гриньяра добавляют к раствору 4-изобутилбензальдегида (0,16 г) в тетрагидрофуране (2 мл) и смесь перемешивают при комнатной температуре в течение 30 минут. Реакционную смесь очищают колоночной хроматографией на аминопропилсиликагеле (элюент: тетрагидрофуран) с получением дифенилметанольного соединения (0,23 г). Полученное дифенилметанольное соединение растворяют в этаноле (3 мл) и концентрированной соляной кислоте (0,1 мл). К раствору добавляют каталитическое количество 10% порошкообразного палладия на угле и смесь перемешивают в атмосфере водорода при комнатной температуре в течение ночи. Катализатор удаляют фильтрацией и фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: дихлорметан/гексан=1/1) с получением 2-(4-изобутилбензил)фенола (0,10 г).
1H-ЯМР (СDСl3) δ м.д.:
0,89 (6Н, д, J=6,6 Гц), 1,75-1,90 (1Н, м), 2,43 (2Н, д, J=7,2 Гц), 3,97 (2Н, с), 4,66 (1Н, с), 6,75-6,85 (1Н, м), 6,85-6,95 (1Н, м), 7,00-7,20 (6Н, м).
Сравнительный пример 6
2-(4-изопропоксибензил)фенол
Указанное в заголовке соединение получают способом, описанным в сравнительном примере 5, с использованием 4-изопропоксибензальдегида вместо 4-изобутилбензальдегида.
1H-ЯМР (CDCl3) δ м.д.:
1,31 (6Н, д, J=6,1 Гц), 3,93 (2Н, с), 4,50 (1Н, гептет, J=6,1 Гц), 4,72 (1Н, с), 6,75-6,85 (3Н, м), 6,85-6,95 (1Н, м), 7,05-7,20 (4Н, м).
Сравнительный пример 7
2-(4-этоксибензил)фенол
Реактив Гриньяра получают из 4-этоксибромбензола (1,5 г), магния (0,19 г) и каталитического количества иода и тетрагидрофурана (2 мл) стандартным способом. К полученному раствору реактива Гриньяра добавляют по каплям добавляют раствор 2-бензилоксибензальдегида (1,1 г) в тетрагидрофуране (15 мл) и смесь перемешивают при комнатной температуре в течение 30 минут. К реакционной смеси добавляют насыщенный водный раствор хлорида аммония (10 мл) и воду (20 мл) и смесь экстрагируют этилацетатом (100 мл). Экстракт промывают водой (20 мл) и насыщенным раствором соли (20 мл) и сушат над безводным сульфатом натрия. Затем растворитель удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат=5/1) с получением дифенилметанольного соединения (1,7 г). Полученное дифенилметанольное соединение (1,7 г) растворяют в этаноле (25 мл). К раствору добавляют концентрированную соляную кислоту (0,42 мл) и каталитическое количество 10% палладия на угле и смесь перемешивают в атмосфере водорода при комнатной температуре в течение 18 часов. Катализатор удаляют фильтрацией и фильтрат концентрируют при пониженном давлении. К остатку добавляют этилацетат (100 мл) и смесь промывают насыщенный водным раствором бикарбоната натрия (30 мл) и насыщенным раствором соли (30 мл). Органический слой сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат=8/1) с получением 2-(4-этоксибензил)фенола (0,85 г).
1H-ЯМР (CDCl3) δ м.д.:
1,39 (3Н, т, J=7,1 Гц), 3,93 (2Н, с), 4,00 (2Н, кв, J=7,1 Гц), 4,72 (1Н, с), 6,75-6,85 (3Н, м), 6,85-6,95 (1Н, м), 7,05-7,20 (4Н, м).
Сравнительный пример 8
2-[4-(3-бензоилоксипропил)бензил]фенол
Реактив Гриньяра получают из 4-(3-бензилоксипропил)бромбензола (3,2 г), магния (0,25 г), каталитического количества иода и тетрагидрофурана (10,5 мл). К полученному раствору реактива Гриньяра добавляют раствор 2-(метоксиметокси)бензальдегида (1,1 г) в тетрагидрофуране (24 мл) и смесь перемешивают при 65°С в течение 25 минут. После охлаждения до комнатной температуры к реакционной смеси добавляют насыщенный водный раствор хлорида аммония (10 мл) и воду (20 мл) и смесь экстрагируют этилацетатом (100 мл). Экстракт промывают водой (20 мл) и насыщенным раствором соли (20 мл). После сушки экстракта над безводным сульфатом натрия растворитель удаляют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат=5/1) с получением дифенилметанольного соединения (2,5 г). Полученное дифенилметанольное соединение (2,5 г) растворяют в этаноле (42 мл), к раствору добавляют каталитическое количество 10% порошкообразного палладия на угле и смесь перемешивают в атмосфере водорода при комнатной температуре в течение 7,5 часов. Катализатор удаляют фильтрацией и фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат=5/2) с получением фенилпропанольного соединения (1,6 г). После растворения полученного фенилпропанольного соединения (1,6 г) в дихлорметане (29 мл) к раствору добавляют 4-(диметиламино)пиридин (0,069 г), триэтиламин (1,0 мл) и бензоилхлорид (0,79 мл) и смесь перемешивают при комнатной температуре в течение 3 часов. К реакционной смеси добавляют этилацетат (100 мл) и воду (30 мл) и органический слой отделяют. Экстракт промывают насыщенным раствором соли (30 мл), сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат=20/1) с получением сложноэфирного соединения (2,2 г). Смесь полученного сложноэфирного соединения (2,2 г), моногидрата п-толуолсульфоновой кислоты (0,21 г) и метанола (28 мл) перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь концентрируют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат=5/1) с получением
2-[4-(3-бензоилоксипропил)бензил]фенола (1,8 г).
1H-ЯМР (СDСl3) δ м.д.:
2,00-2,15 (2Н, м), 2,70-2,80 (2Н, м), 3,96 (2Н, с), 4,33 (2Н, т, J=6,5 Гц), 4,74 (1Н, шир. с), 6,75-6,85 (1Н, м), 6,85-6,95 (1Н, м), 7,05-7,20 (6Н, м), 7,35-7,50 (2Н, м), 7,50-7,65 (1Н, м), 8,00-8,10 (2Н, м).
Сравнительный пример 9
2-[4-(2-бензоилоксиэтил)бензил]фенол
Указанное в заголовке соединение получают способом, описанным в сравнительном примере 8, с использованием 4-(2-бензилоксиэтил)бромбензола вместо 4-(3-бензилоксипропил)бромбензола.
1H-ЯМР (CDCl3) δ м.д.:
3,04 (2Н, т, J=7,1 Гц), 3,98 (2Н, с), 4,51 (2Н, т, J=7,1 Гц), 4,66 (1Н, с), 6,75-6,85 (1Н, м), 6,85-6,95 (1Н, м), 7,05-7,25 (6Н, м), 7,35-7,50 (2Н, м), 7,50-7,60 (1Н, м), 7,95-8,05 (2Н, м).
Сравнительный пример 10
5-ацетоксиметил-2-(4-этилбензил)фенол
К суспензии алюмогидрида лития (95 мг) в диэтиловом эфире (10 мл) добавляют раствор метил-4-(4-этилбензил)-3-гидроксибензоата (0,27 г) в диэтиловом эфире (5 мл) при охлаждении льдом. После кипячения смеси с обратным холодильником в течение 45 минут к реакционной смеси при охлаждении льдом последовательно добавляют воду (0,1 мл), 15% водный раствор гидроксида натрия (0,1 мл) и воду (0,3 мл). После перемешивания смеси при комнатной температуре в течение 5 минут реакционную смесь выливают в 0,5 моль/л соляной кислоты и полученную смесь экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и растворитель удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат=1/1) с получением восстановленного соединения (0,22 г). После растворения полученного восстановленного соединения (0,22 г) в тетрагидрофуране (2 мл) к раствору добавляют винилацетат (2 мл) и бис(дибутилхлоролово)оксид (24 мг) и смесь перемешивают при 30°С в течение 19 часов. Реакционную смесь непосредственно очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат=3/1) с получением 5-ацетоксиметил-2-(4-этилбензил)фенола (0,21 г).
1H-ЯМР (CDCl3) δ м.д.:
1,21 (3Н, т, J=7,6 Гц), 2,09 (3Н, с), 2,61 (2Н, кв, J=7,6 Гц), 3,95 (2Н, с), 4,74 (1Н, с), 5,03 (2Н, с), 6,80 (1Н, д, J=1,3 Гц), 6,80-6,90 (1Н, м), 7,05-7,20 (5Н, м).
Сравнительный пример 11
5-ацетоксиметил-2-(4-пропоксибензил)фенол
Указанное в заголовке соединение получают способом, описанным в сравнительном примере 10, с использованием метил-3-гидрокси-4-(4-пропоксибензил)бензоата вместо метил-4-(4-этилбензил)-3-гидроксибензоата.
1H-ЯМР (CDCl3) δ м.д.:
1,02 (3Н, т, J=7,4 Гц), 1,70-1,85 (2Н, м), 2,09 (3Н, с), 3,88 (2Н, 7, J=6,6 Гц), 3,91 (2Н, с), 5,02 (2Н, с), 5,28 (1Н, с), 6,70-6,90 (4Н, м), 7,00-7,20 (3Н, м).
Сравнительный пример 12
2-[4-(2-ацетоксиэтил)бензил]-5-ацетоксиметилфенол