Плюрафлавины, способ их получения и композиция на их основе
Иллюстрации
Показать всеНастоящее изобретение относится к новым соединениям - плюрафлавинам формулы I
где R1 представляет собой группу сахара формулы
R2 представляет собой –СООН или –CH2-O-(R7)m, где R7 представляет собой группу сахара формулы
R3 выбран из групп
R5 - атом водорода; R4, R6 вместе представляют собой группу –Х2 с двойной связью, где Х2 = О; R8 и R10 вместе представляют собой группу –Х2 с двойной связью, где Х2 = О, и m = n = 1; ко всем его стереохимическим формам и смесям указанных форм в любом соотношении и к его физиологически приемлемым солям. Соответственно настоящее изобретение относится к способу их получения из культуры микроорганизма актиномицеты HAG 003959, DSM 12931 путем ферментирования, к штамму Actinomycetales HAG 003959, DSM 12931, используемому для получения соединений формулы I, а также к фармацевтической композиции, ингибирующей транскриптазу и обладающей цитотоксическим действием, на основе указанных соединений. Соединения формулы I используются в качестве лекарственных средств, например, в качестве противоопухолевых агентов. 4 н. и 15 з.п. ф-лы, 3 табл.
Реферат
Настоящее изобретение относится к новым соединениям формулы I
где R1, R2, R3, R4, R5, R6, R8, R10 и n определены ниже.
Соединения формулы I ингибируют транскриптазу, обладают цитостатическим действием и являются особенно пригодными для лечения опухолей. Соединения формулы I можно получить путем выращивания в культуральной среде актиномицетов HAG 003959, DSM 12931. Соответственно, настоящее изобретение относится к способу получения соединений формулы I, применению указанных соединений для изготовления лекарственного средства для лечения злокачественных поражений и заболеваний, которые можно лечить ингибированием транскриптазы, а также к фармацевтическим препаратам, включающим, по меньшей мере, одно соединение формулы I.
Рак представляет собой заболевание человека и животных, которое в большинстве случаев является смертельным и которое обычно вызывается неконтролируемым ростом эндогенных клеток. Рак представляет собой термин, который используют для обозначения образования злокачественных опухолей (злокачественность), неоплазм (опухолей или карцином) или для обозначения злокачественной дегенерации и нарушения созревания белых кровяных клеток (лейкоз). Рак или опухолевые клетки обычно образуются путем трансформации эндогенных клеток. Злокачественность раковой клетки выражается в автономности роста, т.е. ее способности к безудержному росту без интеграции в систему органов и к инфильтрации с разрушением ткани. Верным признаком злокачественности является образование метастазов в отдаленных от опухоли областях после гематогенного или лимфогенного распространения опухолевых клеток. Рак представляет собой одну из наиболее частых причин смерти людей, и, таким образом, существует огромная потребность в способах и агентах для излечивания или лечения злокачественных дегенераций.
Помимо радикального подхода - хирургического удаления опухоли, варианты терапии злокачественных опухолей включают облучение рентгеновскими лучами, α-, β-, γ-лучами, иммунотерапию и химиотерапию. В настоящее время применение иммунотерапии все еще ограничено. Под химиотерапией опухолей подразумевается введение клеточных токсинов (цитостатиков) для лечения опухолей и оставшихся опухолевых клеток, обычно после локального хирургического вмешательства или облучения. Указанные вещества специфически вмешиваются в определенные процессы деления клетки, так что ткани, содержащие большую долю делящихся клеток, такие как быстро растущая опухолевая ткань, чувствительно реагируют на данное лечение. Применяющиеся агенты представляют собой алкилирующие соединения, такие как, например, циклофосфамид (The Merck Index, 12-е изд., стр.463), антиметаболиты, такие как метотрексат (The Merck Index, 12-е изд., стр.1025), алкалоиды, такие как винкристин (The Merck Index, 12-е изд., стр.1704) и антибиотики, такие как дауномицин (The Merck Index, 12-е изд., стр.479) и адриамицин (The Merck Index, 12-е изд., стр.581-582). Однако в силу наличия побочных эффектов все указанные агенты имеют значительные недостатки, таким образом смерть заболевшего человека во многих случаях может быть только отсрочена, но не предотвращена. Кроме того, дегенеративные (раковые) клетки могут стать резистентными к используемым агентам; в этом случае обычные лекарственные средства более не оказывают цитостатического действия, но являются токсичными вследствие своих побочных эффектов. Помимо этого, было установлено, что комбинированное и/или последовательное применение цитостатиков превышает активность отдельных цитостатиков (при монотерапии), и, следовательно, возможно, что значительные побочные эффекты при полихимиотерапии не суммируются. По всем этим причинам срочно требуются новые химиотерапевтические препараты, и исследования в этой области проводят во всем мире.
Неожиданно было установлено, что штамм микроорганизма актиномицетов вида HAG 003959, DSM 12931, способен вырабатывать высокоэффективные новые цитостатики, которые ингибируют рост клеток даже в очень низких концентрациях. Далее указанные в настоящем документе указанные новые соединения называются плюрафлавинами, и они являются, вместе с производными плюрафлавинов, одним из объектов настоящего изобретения. Плюрафлавины представляют собой антибиотики, которые включают п-хиноидный кольцевой скелет и различные строительные блоки сахаров. Они ингибируют транскрипцию путем интеркаляции двойных цепей нуклеиновых кислот и, если это возможно, путем дополнительного алкилирования. Кольцевой скелет впервые был описан S. Kondo et al., в Journal of Antibiotics, том 30, страницы 1143-1145, 1977 г., как часть плюрамицина. Позднее указанный кольцевой скелет был обнаружен у множества антибиотиков; кроме плюрамицина и неоплюрамицина, соединения саптомицины (N. Abe et al., J. Antibiotics, 46, 1536-1549, 1993), анкиномицин (Y. Sato et al., J. Antibiotics, 42, 149, 1989), кидамицин (N. Kanda et al., J. Antibiotics, 24, 599, 1971), гедамицин (U. Sequin et al., Tetrahedron, 34, 761, 1978) и альтромицины (G. M. Brill et al., J. Antibiotics, 43, 229-237, 1990) были описаны как структурно родственные соединения. Известные соединения-аналоги часто имеют недостатки, которые проявляются в неудовлетворительной эффективности, высокой токсичности и/или нежелательных побочных эффектах.
Соответственно, настоящее изобретение относится к соединениям формулы (I)
где R1 представляет собой группу сахара,
R2 представляет собой -СООН или -СН2-O- (R7)m, где R7 представляет собой группу сахара, и
R3 выбран из эпоксидсодержащих групп, C1-C6 алкильных групп и С2-С6 алкенильных групп, где указанные алкильные и алкенильные группы необязательно замещены, по меньшей мере, одной группой ОН,
R5 выбран из Н, C1-C6 алкила, C2-C6 алкенила и C2-C6 алкинила,
R4, R6, R8 и R10 каждый независимо выбран из Н, C1-C6 алкила, C2-C6 алкенила, C2-C6 алкинила, -Х2Н и -X2R12 или R4 и R6 вместе и/или R8 и R10 вместе представляют собой X2,
Х2 представляет собой О, NH, N-C1-C6 алкил, N-C2-C6 алкенил, N-C2-C6 алкинил или S,
R12 представляет собой C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, арил или ацил и m и n, независимо друг от друга равны 1 или 2,
во всех их стереохимических формах и смесях указанных форм в любом соотношении, и к их физиологически приемлемым солям.
В формуле (I)
C1-C6 алкил представляет собой неразветвленный или разветвленный алкил, имеющий от 1 до 6 атомов углерода, например метил, этил, изопропил, трет-бутил и гексил.
C2-C6 алкенил представляет собой прямой или разветвленный алкенил, имеющий от 2 до 6 атомов углерода, например аллил, кротил и пентенил.
C2-C6 алкинил представляет собой прямой или разветвленный алкинил, имеющий от 2 до 6 атомов углерода, например пропинил, бутинил и пентинил.
Арил представляет собой ароматическую кольцевую структуру, например фенил, бензил или 1- или 2-нафтил. Арил может быть необязательно замещен, например, галогеном, таким как хлор, бром, фтор, алкилом, имеющим 1-4 атома углерода, например метилом, гидроксилом, алкоксилом, имеющим 1-4 атома углерода, например метоксилом, и/или трифторметилом.
Ацил может представлять собой алифатические или ароматические ацильные группы. Алифатический ацил имеет 1-7 атомов углерода, предпочтительно 1-4 атома углерода, такой как формил, ацетил, пропионил, бутирил, гексаноил, акрилоил, кротоноил, пропиолоил, который также может быть замещен, например, галогеном, таким как хлор, бром, фтор, аминогруппой и/или алкиламиногруппой, имеющей 1-4 атома углерода, такой как метил- или этиламиногруппа. Ароматический ацил может, например, представлять собой бензоил или нафтоил, который также может быть замещен, например, галогеном, таким как хлор, бром, фтор, алкилом, имеющим 1-4 атома углерода, например, метилом, гидроксилом, аминогруппами, такими как, например, этиламиногруппа, или алкосильными группами, имеющими 1-7 атомов углерода, такими как 1-4 атома углерода, например, метоксилом.
Сахар (R1/R7) представляет собой моносахарид (n=1) или дисахарид (n=2), в котором два моносахарида связаны гликозидной связью. Моносахарид может представлять собой гексозу (C6H12O6), например альдогексозу, такую как D-(+)-глюкоза, D-(+)-манноза или D-(+)-галактоза. Моносахариды могут быть одно-, дву- или трехзамещенными, независимо друг от друга, Н, ОН, NH2, NН(алкилом), N(алкилом)2, алкилом и алкоксилом, где Н и/или ОН в моносахариде может быть необязательно заменен заместителями. Термин "сахар", который используется в настоящей заявке, включает аминосахара. Аминосахар представляет собой моносахарид или дисахарид, необязательно замещенный, как описано, в котором, по меньшей мере, одна ОН- или Н-группа моно- или дисахарида заменена аминогруппой, такой как NH2, ИН(алкил) или N(алкил)2.
В одном варианте осуществления m равно 1.
R7 может представлять собой аминосахарную группу формулы (II)
где R13, R14, R16, R18, R20, R22, R24, R26 и R28 каждый независимо выбран из Н, ОН, NH2, NНалкила, N(алкила)2 и алкоксила, где алкил и алкоксил имеют от 1 до 4 атомов углерода.
Примерами C1-C4 алкила являются, например, метил, этил, пропил, изобутил и бутил, в частности метил, а примерами C1-C4 алкоксила являются, например, метокси, этокси, изопропокси или бутокси, в частности метокси.
R7 может представлять собой аминосахар формулы (IIА)
R1 также может представлять собой аминосахар. В одном варианте осуществления n равно 2.
R1 может представлять собой группу формулы (III)
где R30 - R60, независимо друг от друга, представляют собой Н, ОН, NH2, NНалкил, N(алкил)2 или O-алкил, где алкил представляет собой группу C1-C4, такую как метил, этил, пропил, изобутил и бутил, в частности метил, а O-алкил представляет собой C1-C4 алкокси, например метокси, этокси, изопропокси или бутокси, в частности метокси.
В одном варианте осуществления R1 имеет формулу (IIIA)
R3 может представлять собой эпоксидсодержащую группу. Эпоксидсодержащая группа может представлять собой неразветвленную или разветвленную алкильную или алкенильную группу, имеющую от 2 до 12 атомов углерода, например от 2 до 6 атомов углерода, которая включает одно или два эпоксидных кольца (оксирана). Возможными примерами являются следующие:
и
Помимо эпоксидсодержащей группы, R3 может представлять собой неразветвленный или разветвленный алкил, имеющий от 1 до 12 атомов углерода, такой как имеющий от 1 до 6 атомов углерода, например метил, этил, изопропил, трет-бутил, гексил, а также, например, октил, додецил, или неразветвленный или разветвленный алкенил, имеющий от 2 до 12 атомов углерода, такой как имеющий от 2 до 6 атомов углерода, например аллил, кротил, пентенил, а также додеценил, где алкильные или алкенильные группы также могут быть одно- или многозамещенными, такими как дву- или трехзамещенными, например гидроксилом.
Настоящее изобретение, соответственно, относится к плюрафлавину А формулы (IA)
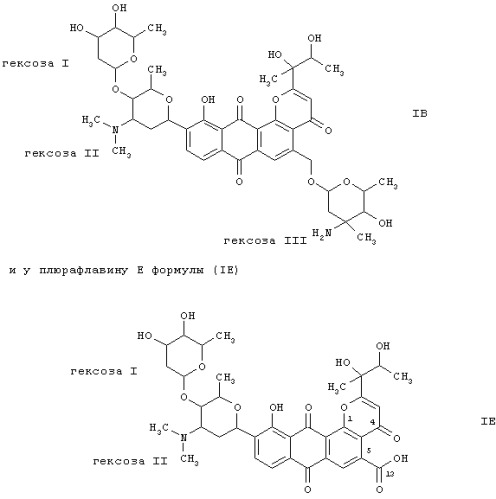
к плюрафлавину В формулы (IB)
где гексоза I представляет собой 2,6-дидезоксиальдогексозу;
гексоза II представляет собой 2,3,6-тридезокси-3-диметиламиногексозу и
гексоза III представляет собой 2,3,6-тридезокси-3-амино-3-метилальдогексозу, во всех их стереохимических формах и смесях указанных форм в любом соотношении, и к их физиологически приемлемым солям.
В одном варианте осуществления настоящего изобретения соединения выбраны из формул (IA), (IB) и (IE), где
гексоза I представляет собой олиозу,
гексоза II представляет собой родозамин и
гексоза III представляет собой 3-эпиванкозамин.
Согласно настоящему изобретению соединения формулы I можно получать посредством культивирования, например, ферментацией актиномицетов HAG 003959, DSM 12931 или его вариантов или мутантов, в подходящих условиях в культуральной среде, до тех пор пока в культуральной среде не будет присутствовать, по меньшей мере, один из плюрафлавинов формулы (IA), (IB) и/или (IE). Затем плюрафлавины можно выделить из культуральной среды и очистить и, если это необходимо, превращать в их химические производные и/или физиологически приемлемые соли.
Настоящее изобретение относится также к способу получения соединения формулы (I), который включает культивирование, например, ферментацией микроорганизма актиномицетов HAG 003959, DSM 12931 или его вариантов или мутантов, в подходящих условиях в культуральной среде, до тех пор пока в культуральной среде не будет присутствовать, по меньшей мере, один из плюрафлавинов формулы (IA), (IB) и/или (IE), выделение из культуральной среды, по меньшей мере, одного из плюрафлавинов и, если это необходимо, превращение его в соответствующие химические производные и/или физиологически приемлемые соли.
Штамм HAG 003959, DSM 12931, его мутанты и/или варианты, в одном из вариантов осуществления настоящего изобретения, культивируют в питательном растворе (также называемом культуральной средой), включающем, по меньшей мере, один источник атомов углерода и, по меньшей мере, один источник атомов азота, а также обычные неорганические соли, до тех пор, пока в культуральной среде не будет присутствовать, по меньшей мере, один новый плюрафлавин; плюрафлавины затем можно выделить из культуральной среды и, если это необходимо, разделить на отдельные активные компоненты.
Культивирование можно осуществлять в аэробных условиях. Культивирование можно осуществлять при температурах от 18 до 35°С и при рН от 6 до 8.
В научной литературе описано большое количество реакций для химической дериватизации хинонов. Соответственно, дериватизацию хиноновых форм настоящих соединений можно осуществлять с помощью химических реакций, известных per se. Восстановление до гидрохиноновых форм соединений может быть достигнуто, например, каталитически, с использованием водорода или гидридов металлов, таких как гидриды алюминия или борогидриды. Еще одним подходящим примером является превращение хинонов с использованием гидроксиламина или его производных в оксимы, которые, в свою очередь, можно подвергать дальнейшим химическим превращениям.
Соответственно, настоящее изобретение относится к соединению формулы (IV)
где R1, R2, R3 и n определены выше,
во всех их стереохимических формах и смесях указанных форм в любом соотношении, и к их физиологически приемлемым солям.
Производные плюрафлавинов формул (IVA), (IVB) и (IVE) (ниже) получены из плюрафлавинов формул (IA), (IB) и (IE) соответственно, и они также составляют часть настоящего изобретения.
Настоящее изобретение относится также к соединению формулы (IVA)
к соединению формулы (IVB)
и к соединению формулы (IVE)
во всех их стереохимических формах и смесях указанных форм в любом соотношении, и к их физиологически приемлемым солям.
Ниже в настоящей заявке на изобретение описано подробно, например, по меньшей мере, один вариант его практического осуществления.
Плюрафлавины по настоящему изобретению вырабатываются видом Actinomycetales, в одном варианте осуществления настоящего изобретения - актиномицеты HAG 003959, DSM 12931. Актиномицеты HAG 003959, DSM 12931 имеют мицелий бежево-красного цвета и могут быть идентифицированы по конидиофорам, которые являются типичными для актиномицетов.
Таксономическое изучение микроорганизма актиномицеты HAG 003959, DSM 12931 дало следующие результаты определения штамма: диагностически важный анализ жирных кислот газовой хроматографией показал высокие пропорции:
антеизо 15:0 жирная кислота,
изо 16:0 жирная кислота (изопальмитиновая кислота),
изо 17:0 жирная кислота (изомаргариновая кислота),
антеизо 17:0 жирная кислота (антеизомаргариновая кислота) и
цис[9] 18:0 жирная кислота (олеиновая кислота), помимо более низких концентраций других жирных кислот.
Такой профиль состава жирных кислот позволяет таксономически идентифицировать актиномицеты HAG 003959 (DSM 12931) как род Saccharothrix.
Изолят микроорганизма был помещен в Deutschen Sammlung von Mikroorganismen und Zellkulturen GmbH, Mascheroder Weg 1B, D 38124, Брауншвейг, Германия, согласно правилам Будапештской конвенции от 16 июля 1999 г., под следующим номером: актиномицеты HAG 003959, DSM 12931.
Вместо штамма актиномицеты HAG 003959, DSM 12931 возможно также использовать его мутанты и варианты, которые синтезируют, по меньшей мере, одно соединение плюрафлавинов по настоящему изобретению. Указанные мутанты можно получить известным способом физическими средствами, например облучением, например ультрафиолетовыми или рентгеновскими лучами, или с помощью химических мутагенов, таких как, например, этилметансульфонат (EMS), 2-гидрокси-4-метоксибензофенон (MOB) или N-метил-N'-нитро-N-нитрозогуанидин (MNNG).
Способ по настоящему изобретению можно использовать для ферментации в масштабах лаборатории (от миллилитра до литра) или в промышленных масштабах (кубические метры). Если не указано иное, все процентные доли являются массовыми. В случае жидкостей соотношения в смесях являются объемными, если не указано иное.
В одном варианте осуществления настоящего изобретения источниками атомов углерода для аэробной ферментации являются усвояемые углеводы и сахарные спирты, такие как глюкоза, лактоза, сахароза или D-маннит, а также содержащие углеводы натуральные продукты, такие как, например, экстракт солода. Подходящими источниками атомов азота для культивирования являются аминокислоты, пептиды и белки, а также продукты их разложения, такие как пептоны или триптоны, кроме того, мясные экстракты, дрожжевые экстракты, размолотые семена, например, кукурузы, пшеницы, бобов, сои или хлопка, остатки дистилляции спиртовых производств, мясная мука или дрожжевые экстракты, но также и соли аммония и нитраты. Неорганические соли, содержащиеся в питательном растворе, могут, например, представлять собой хлориды, карбонаты, сульфаты или фосфаты щелочных металлов или щелочноземельных металлов, железа, цинка, кобальта и марганца.
Выработка плюрафлавинов по настоящему изобретению происходит в культуральной среде, которая включает приблизительно от 0,1 до 5%, например от 0,3 до 2% глюкозы, и от 0,2 до 5%, например, от 0,5 до 3% соевой муки, и от 0,05 до 2%, например от 0,2 до 1 г/л жидкости после замачивания кукурузы, и от 0,05 до 1,0 г/л, например от 0,1 до 0,5% карбоната кальция, и от 0,05 до 1 г/л, например от 0,1 до 1,0 г/л хлорида натрия. Процентные доли в каждом случае являются массовыми от массы всей культуральной среды.
В культуральной среде актиномицеты HAG 003959, DSM 12931 вырабатывают смесь плюрафлавинов. В зависимости от состава культуральной среды доля, по меньшей мере, одного из плюрафлавинов по настоящему изобретению может меняться. Кроме того, через состав среды можно влиять на синтез отдельных плюрафлавинов таким образом, что один или даже более плюрафлавинов не будет синтезироваться микроорганизмом вовсе или синтезироваться в количестве ниже предела обнаружения.
В одном варианте осуществления настоящего изобретения культура включает один поддающийся обнаружению плюрафлавин. В других вариантах осуществления настоящего изобретения образуются плюрафлавины А, В или Е.
Помимо плюрафлавинов А, В и Е (соединений формулы (IA), (IB) и (IE) соответственно), в культуральной среде актиномицеты HAG 003959, DSM 12931 образуются также другие родственные соединения, которые отличаются от соединений, представленных формулами (IA), (IB) и (IE), тем, что они гликозилированы различным образом. Так, в качестве побочного продукта был выявлен еще один плюрафлавин (плюрафлавин С) с молекулярной массой 974 Да и продукт разложения плюрафлавина А с молекулярной массой 692,77, C37H44N2O11. В последнем соединении отсутствует гексоза I; в кислых условиях 2,6-дидезоксиальдогексоза может гидролитически отщепляться от плюрафлавина А.
Микроорганизм культивируют в аэробных условиях, т.е., например, в глубине питательной среды при встряхивании или перемешивании в шейкерных стаканах или ферментерах, если это требуется для подачи воздуха или кислорода. Культивирование можно осуществлять в интервале температур приблизительно от 18 до 35°С, например приблизительно от 25 до 32°С, включая интервал от 27 до 30°С. рН обычно следует поддерживать в пределах от 6 до 8, например от 6,5 до 7,5. В указанных условиях микроорганизм обычно культивируют в течение времени, варьирующего от 24 до 300 часов, например от 36 до 140 часов.
Выгодно осуществлять культивирование в несколько этапов, т.е. получают сначала, по меньшей мере, одну предварительную культуру в жидкой питательной среде, которую затем инокулируют в настоящую промышленную среду, главную культуру, например, в объемном соотношении 1:10. Предварительную культуру получают, например, инокуляцией мицелия в питательный раствор и выращиванием его в течение приблизительно 36-120 часов, например 48-96 часов. Мицелий может быть получен, например, выращиванием штамма в течение приблизительно 3-40 дней, например 4-10 дней, на твердой или жидкой питательной среде, например на солодово-дрожжевом агаре или на агаре с овсяной мукой.
За ходом ферментации можно следить по рН культур или по объему мицелия, а также с помощью хроматографических методик, таких как, например, тонкослойная хроматография или жидкостная хроматография высокого давления, или по испытаниям биологической активности. Плюрафлавины согласно настоящему изобретению могут быть найдены как в мицелии, так и в фильтрате культуры. Способ выделения, описанный ниже, обычно служит для очистки плюрафлавинов по настоящему изобретению, например для очистки плюрафлавинов А, В и Е.
Выделение и/или очистку плюрафлавинов по настоящему изобретению из культуральной среды осуществляют известными способами, принимая во внимание химические, физические и биологические свойства натуральных продуктов. Для проверки концентрации плюрафлавинов в культуральной среде или на отдельных этапах выделения можно использовать тонкослойную хроматографию, например, на силикагеле, с использованием смесей хлороформ/метанол/ледяная уксусная кислота/вода (например, в соотношении 8:1:1:0,2) в качестве подвижной фазы или ВЭЖХ. При разделении с помощью тонкослойной хроматографии определение можно осуществлять, например, используя окрашивающие реагенты, такие как α-нафтол/серная кислота, при котором количество образованного вещества соответствующим образом сравнивают со стандартным раствором.
Согласно настоящему изобретению плюрафлавины можно выделять как из мицелия, так и из культуральной среды. В общих чертах, мицелий сначала отделяют от культуральной среды обычными способами, а затем плюрафлавины экстрагируют из клеточного материала с использованием необязательно смешивающегося с водой органического растворителя. Фаза органического растворителя содержит плюрафлавины по настоящему изобретению; если это необходимо, их концентрируют при пониженном давлении и дополнительно очищают, как описано ниже.
Если это необходимо, фильтрат культуры объединяют с концентратом экстракта мицелия и экстрагируют подходящим не смешивающимся с водой органическим растворителем, например н-бутанолом. Органическую фазу затем отделяют и, если это необходимо, концентрируют при пониженном давлении. Для обезжиривания нужного продукта концентрат можно разбавить неполярным растворителем, в котором плюрафлавины по настоящему изобретению растворяются недостаточно, таком как, например, гексан, петролейный эфир, диэтиловый эфир. Это вызывает осаждение плюрафлавинов, а липофильные примеси остаются растворенными и удаляются обычным разделением твердой и жидкой фаз. Осадок, который содержит все плюрафлавины, подлежащие выделению, растворяют в воде/метаноле объемом 1/30 первонального объема. Осадок полностью растворяется и подвергается лиофильной сушке. Лиофилизат, который далее в настоящей заявке называется сырым продуктом, включает от 0,5 до 50% плюрафлавина и используется для дальнейшего выделения.
Дальнейшую очистку одного или более плюрафлавинов по настоящему изобретению осуществляют хроматографией на подходящих материалах, таких как молекулярные сита или нормальные фазовые носители, такие как, например, силикагель, оксид алюминия, ионообменные агенты или адсорбирующие смолы и/или среды обращенной фазы (RP). С помощью указанной хроматографии плюрафлавины разделяют. Хроматографию плюрафлавинов осуществляют с использованием содержащих буфер водных растворов или смесей водных и органических растворителей.
Под смесями водных или органических растворителей подразумевают все смешивающиеся с водой органические растворители, такие как метанол, пропанол и ацетонитрил, в концентрации, варьирующейся от 10 до 80% растворителя, например от 40 до 60% растворителя, или все содержащие буфер водные растворы, которые смешиваются с органическими растворителями. Буферы, которые следует использовать, могут быть такими же, как указаны выше.
Разделение плюрафлавинов, основанное на их различной полярности, можно осуществлять с помощью хроматографии с обращенной фазой, например, на MCI® (адсорбирующая смола от компании Mitsubishi, Япония) или Amberlite XAD® (TOSOHAAS), на дополнительных гидрофобных материалах, таких как, например, фазы RP-8 или RP-18. Кроме того, разделение можно осуществлять с использованием хроматографии с нормальной фазой, например, на силикагеле, оксиде алюминия и т.п.
Хроматографию плюрафлавинов можно осуществлять с использованием содержащих буфер или подкисленных водных растворов или смесей водных растворов со спиртами или другими смешивающимися с водой органическими растворителями. Используемый органический растворитель может представлять собой пропанол и ацетонитрил.
Под содержащими буфер или подкисленными водными растворами подразумевают, например, воду, фосфатный буфер, ацетат аммония, цитратный буфер в концентрации от 1 мМ до 0,5 М, а также муравьиную кислоту, уксусную кислоту, трифторуксусную кислоту или все коммерческие кислоты, известные специалистам, например, в концентрации, варьирующейся от 0,01 до 3%, например от 0,1%.
Хроматографию можно осуществлять с использованием градиента, начинающегося со 100% водного буфера и заканчивая 100% растворителем, например линейного градиента, варьирующегося от 10 до 50%, с использованием 2-пропанола или ацетонитрила.
Альтернативно, можно также осуществлять гель-хроматографию или хроматографию на гидрофобных фазах.
Гель-хроматографию можно осуществлять на полиакриламидных или смешанных полимерных гелях, таких как, например, Biogel-P 2® (Biorad), Fractogel TSK HW 40® (Merck, Германия, или Toso Haas, США), или на Sephadex® (Pharmacia, Uppsala, Швеция).
Последовательность хроматографий, упомянутых выше, может быть обратной.
Дальнейшим, высокоэффективным этапом очистки плюрафлавинов может быть кристаллизация. Плюрафлавины кристаллизуются из растворов в органических растворителях и из смесей воды с органическими растворителями. Кристаллизацию можно осуществлять способом, известным per se, например, концентрированном или охлаждением насыщенных растворов плюрафлавинов.
Плюрафлавины по настоящему изобретению являются стабильными в твердом состоянии и в растворах с величиной рН, варьирующейся от 3 до 8, например от 4 до 6, и, следовательно, их можно включать в обычные фармацевтические препараты.
Плюрафлавины формулы (I) и полученные из них химические производные можно конвертировать способами, известными специалистам, в соответствующие физиологически приемлемые соли.
Под физиологически приемлемыми солями соединений формулы (I) подразумеваются как их органические, так и неорганические соли, такие, которые описаны в Remington's Pharmaceutical Sciences (17-е издание, страница 1418 (1985)). Основываясь на физической и химической стабильности и растворимости, возможными вариантами кислотных групп являются, inter alia, соли натрия, калия, кальция и аммония; возможными вариантами основных групп являются, inter alia, соли хлористоводородной кислоты, серной кислоты, фосфорной кислоты или карбоновых кислот или сульфоновых кислот, таких как, например, уксусная кислота, лимонная кислота, бензойная кислота, малеиновая кислота, фумаровая кислота, винная кислота и п-толуолсульфоновая кислота.
Настоящее изобретение охватывает также очевидные химические эквиваленты (которые в настоящем документе также упоминаются как "производные") соединений формулы (I), которые имеют незначительные химические различия, т.е. которые имеют ту же активность или которые могут превращаться в соединение по настоящему изобретению в мягких условиях. Упомянутые эквиваленты включают, например, сложные эфиры и простые эфиры, комплексы, а также продукты восстановления соединений по настоящему изобретению.
Производные сложных и простых эфиров и продукты восстановления можно получить способами, описанными в литературе, например, в "Advanced Organic Synthesis", 4-е издание, J.March, John Wiley & Sons, 1992. Карбоксильную группу (формула IE, IVE) и гидроксильные группы соединений формулы (I) можно превращать, например, в сложноэфирную группу или группу простого эфира. Указанные сложные эфиры включают, например, (C1-C4) алкиловые сложные эфиры. Указанные простые эфиры включают, например, ацетали и кетали гидроксильных групп.
Стабильные комплексы соединений формулы (I) могут быть сформированы с физиологически приемлемыми неорганическими катионами, такими как кальций или магний.
Настоящее изобретение охватывает все стереоизомерные формы соединений формулы (I). Центры асимметрии соединений формул (IA), (IB) и (IE), независимо друг от друга, могут в каждом случае иметь S-конфигурацию или R-конфигурацию. Оксираны эпоксидсодержащей группы могут быть в любой позиции, например оксираны, которые включают атомы углерода 2' и 3'. Настоящее изобретение включает все возможные энантиомеры и диастереоизомеры, а также смеси, по меньшей мере, двух стереоизомерных форм, например смеси энантиомеров и/или диастереомеров, в любом соотношении. Таким образом, настоящее изобретение относится также к энантиомерам в энантиомерно чистой форме как левовращающим, так и право вращающим антиподам, R- и S-конфигураций, в форме рацематов и в форме смесей двух энантиомеров в любом соотношении. Если имеет место цис/транс-изомерия, настоящее изобретение относится также как к цис-форме, так и к транс-форме, а также к смесям указанных форм в любом соотношении.
С учетом их полезных фармакологических свойств соединения по настоящему изобретению являются пригодными для применения в качестве лекарственных средств в медицине и/или ветеринарии. Они обладают антибиотической активностью и, помимо антибактериального действия, противогрибковыми, т.е. ингибирующими грибы, включая фитопатогенные грибы, антипротозойными и антипаразитарными свойствами.
Соединения по настоящему изобретению можно применять для лечения раковых заболеваний, например, в качестве химиотерапевтических агентов. Благодаря цитостатическим свойствам, таким как мощная противоопухолевая активность, и антимикробному действию их можно применять, например, в качестве цитостатиков для лечения злокачественных дегенераций у животных и человека.
В случае опухолевых клеток, у которых развилась резистентность к обычным агентам, только новые агенты оказывают терапевтически адекватное действие. Таким образом, плюрафлавины по настоящему изобретению и их производные формулы (I) обладают потенциально высокой активностью даже в отношении проблемных клеточных типов.
Настоящее изобретение относится также к фармацевтическим препаратам, которые включают, по меньшей мере, один плюрафлавин по настоящему изобретению и/или его производные. Плюрафлавины можно использовать в смеси с, по меньшей мере, одним подходящим вспомогательным агентом или наполнителем. Наполнителями, пригодными для применения для человека, могут быть любые фармакологически приемлемые наполнители и/или вспомогательные агенты.
Настоящее изобретение относится также к способу приготовления лекарственного средства по настоящему изобретению путем переведения, по меньшей мере, одного соединения по настоящему изобретению в подходящую для введения форму, с использованием фармацевтически приемлемого и физиологически приемлемого наполнителя, и, если это необходимо, дополнительных подходящих активных соединений, добавок или вспомогательных агентов.
Лекарственные средства по настоящему изобретению обычно вводят перорально, местно или парентерально, однако ректальное введение также возможно. Подходящими твердыми или жидкими лекарственными формами являются, например, гранулы, порошки, таблетки, таблетки в оболочке, (микро)капсулы, суппозитории, сиропы, эмульсии, суспензии, аэрозоли, капли или растворы для инъекций в форме ампул, а также препараты с пролонгированным высвобождением активного соединения, при изготовлении которых обычно используют наполнители и добавки и/или вспомогательные агенты, такие как разрыхлители, связывающие агенты, покрывающие агенты, агенты, обеспечивающие набухание, агенты, обеспечивающие скольжение, или смазывающие агенты, корригенты, подсластители или солюбилизирующие агенты. Часто используемыми наполнителями или вспомогательными агентами, которые можно упомянуть, являются, например, карбонат магния, диоксид титана, лактоза, маннит и другие сахара, тальк, лактопротеин, желатин, крахмал, витамины, целлюлоза и ее производные, животные или растительные масла, полиэтиленгликоли и растворители, такие как, например, стерильная вода, спирты, глицерин и многоатомные спирты.
Если это необходимо, дозированные единицы можно микроинкапсулировать для орального введения, чтобы отсрочить или пролонгировать высвобождение на относительно длительный период времени, например, с помощью нанесения покрытия или заливки активного соединения в виде частиц в подходящие полимеры, воски и т.п.
Фармацевтические препараты можно изготавливать и вводить в виде дозированных единиц, включающих в качестве активного ингредиента определенную дозу, по меньшей мере, одного соединения плюрафлавинов по настоящему изобретению и/или их химических производных. В случае твердых дозированных единиц, таких как таблетки, капсулы и суппозитории, указанная доза может составлять приблизительно до 200 мг, но может составлять приблизительно от 0,1 до 100 мг, а в случае растворов для инъекций в форме ампул - приблизительно до 200 мг, но может составлять приблизительно от 0,1 до 100 мг, в день.
Суточная доза, которую следует вводить, зависит от массы тела, возраста, пола и состояния млекопитающего, подвергаемого лечению. Однако могут потребоваться также более высокие или более низкие дозы. Суточную дозу можно вводить однократно, в виде единственной дозированной единицы или в виде нескольких меньших дозированных единиц, или многократно, с заранее определенными интервалами, в виде разделенных доз.
Настоящее изобретение далее иллюстрируется нижеследующими примерами. Процентные доли являются массовыми. В случае жидкостей соотношения в смесях являются объемными, если не указано иное.
Следующие примеры служат для иллюстрации настоящего изобретения и не ограничивают его объем.
Пример 1
Получение глицериновой культуры актиномицетов HAG 003959, DSM 12931.
100 мл питательного раствора (солодовый экстракт 2,0%, дрожжевой экстракт 0,2%, глюкоза 1,0%, (NН4)2НРO4 0,05%, рН 6,0) в стерильной 300 мл колбе Эрленмейера инокулировали штаммом актиномицетов HAG 003959, DSM 12931 и инкубировали на вращающемся шейкер