Способ карбамоилирования спиртов
Иллюстрации
Показать всеИзобретение относится к способу карбамоилирования спирта, содержащего как спиртовую часть, так и основную часть и/или сульфенильную часть, включающему смешивание цианата с указанным спиртом в инертном растворителе в безводных условиях; охлаждение образующейся реакционной смеси до температуры от примерно -25 до примерно 40°С; добавление кислоты к охлажденной реакционной смеси со скоростью, поддерживающей температуру ниже примерно 0°С; перемешивание реакционной смеси, содержащей кислоту, при температуре от примерно -10°С до примерно 0°С в течение примерно от 8 до 10 часов; и гашение реакционной смеси водой. Указанный способ применим для карбамоилирования каправиринсульфенилового спирта. Технический результат – увеличение конверсии спирта и выхода желаемого карбамата. 2 н. и 9 з.п. ф-лы.
Реферат
Данное изобретение включает в себя способ карбамоилирования спирта цианатом натрия в присутствии метансульфокислоты. Реакция может быть проведена в безводных условиях. Указанный способ подходит для карбамоилирования молекулы, содержащей как спиртовую часть (группу), так и основную часть, и/или молекулы, содержащей как спиртовую часть, так и сульфенильную часть, такой как сульфенилалкогольный предшественник противовирусного агента каправирина.
Ненуклеозидный ингибитор обратимой транскриптазы, известный как каправирин, может быть синтезирован путем, предусматривающим использование хлорсульфонилизоцианата (CSI) для превращения предшествующего каправирину сульфенилового спирта в соответствующий карбамат каправирин. CSI карбамоилирует спирты с высоким выходом в подходящих условиях, но имеет специальные требования к загрузке и обращению, поскольку он высоко реактивен по отношению к воде. Кроме того, CSI в настоящее время доступен с коммерческой точки зрения только из двух источников, каждый из которых находится вне Соединенных Штатов. Указанные факторы наряду с высокой стоимостью делают CSI нежелательным в качестве реагента для превращения спирта в карбамат.
В давно используемом способе карбамоилирования спиртов применяют цианат натрия в присутствии трифторуксусной кислоты и инертного растворителя. Способ дает высокие выходы с различными спиртами, но не работает для всех спиртов. Указанный синтез протекает при генерировании синильной кислоты in situ путем реакции цианата натрия с кислотой. В широко цитируемой статье по указанному способу B.Loev, M.Kormendy (J. Org. Chem., 1963; 28:3421) описана трифторуксусная кислоты (TFA) как необходимая в противоположность другим кислотам для получения карбаматов с хорошим выходом. Например, в указанной статье описано, что замена трифторуксусной кислоты на метансульфокислоту уменьшает выходы карбамата до следовых количеств.
Остается потребность в способе карбамоилирования спиртовых частей в молекуле, содержащей также основную часть и/или сульфенильную часть, такой как каправирин, и использования не трифторуксусной, а другой кислоты.
Данное изобретение включает в себя способ карбамоилирования спирта цианатом натрия в присутствии метансульфокислоты. Реакция может быть проведена в безводных условиях. Указанный способ подходит для карбамоилирования молекулы, содержащей как спиртовую часть, так и основную часть, такой как сульфенилалкогольный предшественник противовирусного агента каправирина, который содержит как пиридильную, так и имидазолильную группы. Указанный способ подходит также для карбамоилирования молекулы, содержащей как спиртовую часть, так и сульфенильную часть, такой как сульфенилалкогольный предшественник противовирусного агента каправирина.
Согласно одному варианту осуществления изобретения, способ предусматривает контактирование спирта с цианатом натрия в присутствии метансульфокислоты в безводных условиях. В другом варианте осуществления способа карбамоилирования спиртовой части молекулы, содержащей также азотсодержащий гетероцикл, сульфенильную часть или и то и другое, способ предусматривает взаимодействие молекулы с цианатом натрия в присутствии метансульфокислоты. В дополнительном варианте осуществления способа карбамоилирования каправиринсульфенилового спирта способ предусматривает взаимодействие каправиринсульфенилового спирта с цианатом натрия в присутствии метансульфокислоты. Каждая из указанных реакций может быть проведена в безводных условиях, предпочтительно в инертном растворителе, таком как ацетонитрил. Способ может также включать гашение реакции и выделение или очистку полученного карбамата.
Данное изобретение включает в себя также способ карбамоилирования спирта цианатом натрия, цианатом калия, цианатом цезия или их смесью в присутствии уксусной кислоты, серной кислоты или их смеси. Реакция может быть проведена в безводных условиях. Указанный способ подходит для карбамоилирования молекулы, содержащей как спиртовую часть, так и основную часть. Указанный способ подходит также для карбамоилирования молекулы, содержащей как спиртовую часть, так и сульфенильную часть.
Определения
Использованный здесь термин "безводный" относится к реакционной смеси, обычно содержащей менее примерно 1 мас.% воды, предпочтительно менее примерно 0,7 мас.% воды, предпочтительно менее примерно 0,5 мас.% воды, или предпочтительно лишенной воды. Согласно данному изобретению, безводные условия, подходящие для проведения данного способа, могут быть получены мерами, известными специалистам в данной области. Предпочтительно исходный спирт сушат с применением известных процедур для сушки спиртов до содержания воды менее примерно 0,2 мас.%. Обычно коммерчески доступные сорта растворителя (например, ацетонитрила) и кислоты (например, метансульфокислоты) могут быть использованы без сушки. Обычно указанные коммерчески доступные растворители и кислоты практически безводны.
Использованный здесь термин "основание" относится к любому из большого класса соединений с одним или более свойствами, такими как горький вкус, ощущение скользкости в растворе, способность окрашивать лакмусовую бумагу в голубой цвет и вызывать характерные цвета с другими индикаторами, или способность реагировать с кислотами (нейтрализация) с образованием солей. Такие основания включают в себя как основания Лоури-Бренстеда, так и основания Льюиса. Основание Лоури-Бренстеда относится к любому молекулярному или ионному соединению, которое может комбинироваться с протоном (ионом водорода) с образованием нового соединения. Основание Льюиса относится к любому веществу, которое дает пару электронов для ковалентной связи с кислотой Льюиса. Использованный здесь термин "основная часть" является таким фрагментом основного соединения, который мог бы быть основанием, если бы был самим соединением. Соединение, включающее основную часть, является основанием. Основания и основные части включают азотсодержащие гетероциклы.
Использованный здесь термин "азотсодержащий гетероцикл" относится к любой углеродсодержащей структуре с замкнутым кольцом, которое содержит атом азота. Примерами азотсодержащих гетероциклов являются пиррол (азол), 2Н-пиррол, 3Н-пиррол, пиразол (1,2-диазол), имидазол, 2Н-имидазол, 1,2,3-триазол, 1,2,4-триазол, изоксазол, оксазол, тиазол, изотиазол, 1,2,3-оксадиазол, 1,2,4-оксадиазол (азоксим), 1,2,5-оксадиазол (фуразан), 1,3,4-оксадиазол, 1,2,3,4-оксатриазол, 1,2,3,5-оксатриазол, 3Н-1,2,3-диоксазол, 1,2,4-диоксазол, 1,3,2-диоксазол, 1,3,4-диоксазол, 5Н-1,2,5-оксатиазол, пиридин, пиридазин, пиримидин, пиразин, пиперазин, s-триазин (1,3,5-триазин), as-триазин (1,2,4-триазин), v-триазин (1,2,3-триазин), 4Н-1,2-оксазин, 2Н-1,3-оксазин, 6Н-1,3-оксазин, 6Н-1,2-оксазин, 1,4-оксазин, 2Н-1,2-оксазин, 4Н-1,4-оксазин, 1,2,5-оксатиазин, 1,4-оксазин, орто-изоксазин, пара-изоксазин, 1,2,5-изоксазин, 1,2,5-оксатиазин, 1,2,6-оксатиазин, 1,4,2-оксадиазин, 1,3,5,2-оксадиазин, морфолин (тетрагидро-пара-изоксазин), азепин, 1,2,4-аиазепин, индол, 3Н-индол (индоленин), 1Н-изоиндол, циклопента[b]пиридин, пирано[3,4-b]пиррол, индазол, индоксазин (бензизоксазол), бензоксазол, антранил, хинолин, изохинолин, циннолин, хиназолин, нафтиридин, пиридо[3,4-b]пиридин, пиридо[3,2-b]пиридин, пиридо[4,3-b]пиридин, 2Н-1,3-бензоксазин, 2Н-1,4-бензоксазин, 1Н-2,3-бензоксазин, 4Н-3,1-бензоксазин, 2Н-1,2-бензоксазин, 4Н-1,4-бензоксазин, карбазол, акридин, хиноксалин, пурин и подобные.
Использованные здесь термины "сульфенильная группа", "сульфенильная часть" или "сульфенил" относятся к соединению, содержащему группу строения RS-, где R означает органическую часть, но не водород. Сульфенильные группы включают сульфиды (простые тиоэфиры). Использованный здесь термин "сульфид" или "простой тиоэфир" относится к соединению, включающему группу, имеющую структуру RSR’, где каждый из R и R’ означает органическую часть, но не водород.
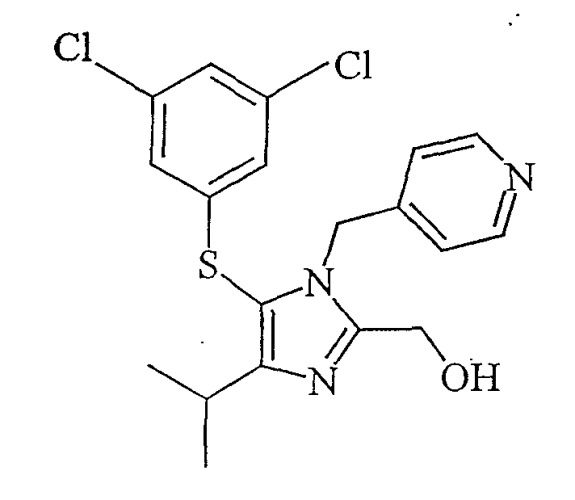
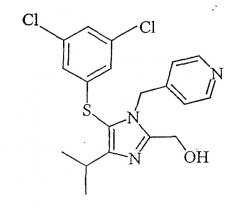
Использованный здесь термин "каправиринсульфениловый спирт" относится к соединению, представленному структурной формулой:
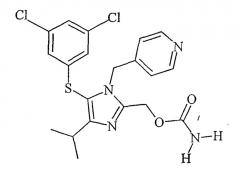
Использованный здесь термин "каправирин" относится к соединению, представленному структурной формулой:
Использованный здесь термин "примерно", модифицирующий количество ингредиента, соотношение ингредиентов или температуру, использованные в способе изобретения, относится к отклонениям в численном количестве, которое может быть получено, например, при обычном взвешивании, измерении, обработке жидкости, сушке или контроле за температурой процесса, использованных для приготовления смесей в реальных условиях; благодаря нечаянной ошибке в указанной процедуре; благодаря различиям в производстве, источнике или чистоте ингредиентов, использованных для проведения способа, и подобное. Будучи модифицированными или нет термином "примерно", пункты формулы изобретения относятся к эквивалентным количествам.
Способ карбамоилирования спирта
Данное изобретение включает в себя способ карбамоилирования спирта. В одном варианте осуществления изобретения способ предусматривает использование метансульфокислоты в безводных условиях для карбамоилирования спирта цианатом натрия. Предпочтительно спирт является частью молекулы, содержащей также основную группу. Предпочтительно спирт является частью молекулы, содержащей также либо азотсодержащий гетероцикл, сульфенильную группу, либо и то и другое. Предпочтительным продуктом реакции карбамоилирования является карбамат со структурой, в остальном произведенной от исходного спирта.
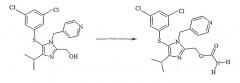
В предпочтительном варианте осуществления изобретения спирт является частью сульфенилалкогольного предшественника противовирусного агента каправирина. Схема I ниже иллюстрирует как предшественник, так и каправирин.
Схема 1
Карбамоилирование сульфенилалкогольного предшественника каправирина до каправирина:
В одном варианте осуществления в способе использован цианат натрия в присутствии метансульфокислоты для карбамоилирования спиртовой части в молекуле, содержащей также основную группу. Предпочтительно реакцию проводят в безводных условиях. Предпочтительно спирт является частью молекулы, содержащей также либо азотсодержащий гетероцикл, либо сульфенильную группу, либо и то и другое. В предпочтительном варианте осуществления изобретения спирт является частью сульфенилалкогольного предшественника противовирусного агента каправирина.
В другом выполнении в способе использован цианат натрия в присутствии метансульфокислоты для карбамоилирования спиртовой части в молекуле, содержащей также сульфидную или сульфенильную группу. Предпочтительно реакцию проводят в безводных условиях. Предпочтительно спирт является частью молекулы, содержащей также азотсодержащий гетероцикл. В предпочтительном выполнении спирт является частью сульфенилалкогольного предшественника противовирусного агента каправирина.
Условия реакции
Способ данного изобретения может быть проведен в ряде условий, которые детально описаны ниже.
Контролируя стехиометрию реагентов, можно существенно повысить выход желаемого продукта карбамата. Контролируя указанную стехиометрию, можно также существенно уменьшить или свести до минимума выход соответствующей загрязняющей примеси аллофаната. Например, молярное отношение метансульфокислоты к спирту может варьироваться в широких пределах. Предпочтительно молярные отношения метансульфокислоты к спирту составляют от примерно 5 до примерно 20, более предпочтительно от примерно 9 до примерно 10. В представленных ниже примерах показано, что молярное отношение цианата натрия к спирту может варьироваться в некоторых пределах. Предпочтительными молярными отношениями цианата натрия к спирту являются от примерно 1,5 до примерно 2,0, предпочтительно от примерно 1,6 до примерно 1,7, более предпочтительно около 1,65. Предпочтительно реакционная смесь имеет молярные отношения реагентов: метансульфокислоты к спирту от примерно 9 до примерно 10; и цианата натрия к спирту примерно 1,65. Реагенты в указанных соотношениях, в частности, предпочтительны для карбамоилирования сульфенилалкогольного предшественника противовирусного агента каправирина.
Реакционный растворитель может быть выбран для преимущественного повышения выхода желаемого продукта карбамата. Предпочтительными растворителями являются инертные, легко обезвоживаемые, или и то и другое. Предпочтительными растворителями являются этилацетат, тетрагидрофуран и ацетонитрил. Наиболее предпочтительным растворителем является ацетонитрил.
Температура реакции может быть выбрана для преимущественного повышения выхода желаемого продукта карбамата. Температура реакции может быть также выбрана для преимущественного уменьшения или сведения к минимуму выхода соответствующих загрязняющих примесей аллофаната. Температура реакции может варьироваться в широких пределах. Предпочтительными пределами температуры реакции являются от примерно -25°С до примерно +40°С, предпочтительно от примерно -10°С до примерно 0°С.
Согласно данному способу, для карбамоилирования спиртов предпочтительны безводные условия. Безводные условия могут включать присутствие малых количеств воды. Предпочтительно, если вода присутствует, содержание воды менее примерно 1 мас.%, предпочтительно менее примерно 0,7 мас.%, предпочтительно менее примерно 0,5 мас.%.
Согласно данному изобретению, в определенных обстоятельствах реакция может идти с реагентами, отличающимися от цианата натрия и метансульфокислоты. Например, для некоторых спиртов карбамоилирование может идти с такими цианатами, как цианат калия, цианат цезия или их смесь. Для некоторых спиртов карбамоилирование может идти с кислотами, подобными метансульфокислоте, такими как уксусная кислота, серная кислота или их смесь.
Смесь для реакции карбамоилирования может быть составлена и с ней можно манипулировать в ходе реакции различными способами, известными специалистам в области проведения органических реакций. В конечном счете реакционную смесь формируют контактированием спирта с цианатом натрия в присутствии метансульфокислоты, предпочтительно в безводных условиях. В результате контактирования или смешивания реагентов получают реакционную смесь, подходящую для реакции спирта и цианата натрия. Реакционная смесь может быть получена добавлением реагентов в любом порядке. Предпочтительно спирт, цианат натрия и инертный растворитель смешивают и затем добавляют к полученной таким образом смеси метансульфокислоту. Предпочтительно перед добавлением метансульфокислоты указанную смесь охлаждают, например, до примерно -10°С. Предпочтительно метансульфокислоту добавляют медленно, например, по каплям, поддерживая пониженную температуру, предпочтительно ниже примерно 0°С.
После добавления метансульфокислоты реакционную смесь активно перемешивают при пониженной температуре, давая реакции протекать преимущественно до высоких выходов. Активное перемешивание можно осуществлять, например, при помощи мешалки. Предпочтительно пониженная температура для хода реакции равна от примерно -10°С до примерно 0°С. Реакция может протекать в течение от примерно 8 часов до примерно 10 часов или дольше. Длительность реакции может контролироваться или определяться специалистом в области проведения органических реакций.
Через желательное время гашением можно остановить или замедлить реакцию карбамоилирования. Гашение может осуществляться любым из различных способов, известных специалистам в данной области, таким как охлаждение, понижение концентрации одного или более реагентов, потребление одного или более реагентов или подобными. Предпочтительно гашение предусматривает добавление воды к реакционной смеси. С гашением или без него любой карбамат, полученный в результате реакции, может быть выделен и/или очищен из реакционной смеси способами, известными специалистам в области проведения органических реакций.
Данное изобретение может быть лучше понято со ссылкой на следующие примеры. Указанные примеры являются представительными для специфических выполнений, но не ограничивают область изобретения.
ПРИМЕР 1
Способ Loev и Kormendy
Loev и Kormendy (supra., 1963) использовали для карбамоилирования спирта трифторуксусную кислоту и цианат натрия. Указанные реагенты были использованы для начального исследования карбамоилирования спирта, содержащего сульфенильную группу и основную часть.
Материалы и способы
Каправиринсульфениловый спирт
В указанном исследовании спирт был сульфенилалкогольным предшественником противовирусного агента каправирина. Каправиринсульфениловый спирт был получен по следующему способу:
Бензилокси((4-изопропил-1-(4-пиридил)метил)-1Н-имидазол-2-ил)метандиоксалат (171,6 г, 0,342 моля) суспендировали в толуоле (460 мл) и воде (150 мл). Смесь перемешивали и охлаждали до температуры ниже 10°С. К смеси медленно при охлаждении прибавляли 32%-ный водный раствор гидроксида калия (КОН) до конечного рН 11-12. Органический слой отделяли и промывали водой и затем насыщенным раствором хлорида натрия. Толуольный раствор бензилокси((4-изопропил-1-1-(4-пиридил)метил)-1Н-имидазол-2-ил)метана сушили путем азеотропной перегонки толуола.
Бис-(3,5-дихлорфенил)дисульфид (71,6 г, 0,201 моля) растворяли в толуоле (180 мл) и охлаждали до температуры ниже 10°С в колбе под давлением инертного газа. Колбу под давлением помещали в вакуумный сосуд и добавляли хлор (30,8 г, 0,434 моля) при температуре от 0°С до 10°С. Реакционную смесь затем перемешивали при температуре от 0°С до 10°С полчаса. Избыток хлора удаляли из раствора 3,5-дихлорфенилсульфенилхлорида с применением чередующихся вакуума и продувки азотом.
N-Метилморфолин (41,6 г, 0,411 моля) загружали в полученный ранее толуольный раствор бензилокси((4-изопропил-1-(4-пиридил)метил)-1Н-имидазол-2-ил)метана. Образовавшийся раствор медленно добавляли к раствору 3,5-дихлорсульфенилхлорида, поддерживая температуру от 0°С до 10°С. После того как добавление было закончено, реакционную смесь простого сульфенилового эфира перемешивали при температуре от 0°С до 10°С около 12 часов. Затем реакционную смесь промывали водой при рН от 4 до 7. К слою простого сульфенилового эфира добавляли концентрированную соляную кислоту (700 мл) и нагревали примерно 7 часов при температуре от 70°С до 80°С. Реакционную смесь охлаждали и отделяли водный слой с продуктом. К водному раствору прибавляли метанол (92 мл). рН раствора доводили до 2 разбавленным раствором гидроксида натрия при охлаждении. Добавляли этилацетат (460 мл) и рН водного слоя доводили до 9. Слой этилацетата отделяли и добавляли к нему воду (215 мл) и дополнительное количество этилацетата. рН смеси при охлаждении доводили до 1,5, используя концентрированную соляную кислоту. Водный слой с продуктом отделяли. К водному раствору добавляли метанол (428 мл). рН раствора доводили до 4 30%-ным раствором гидроксида натрия. рН полученной суспензии доводили до конечного значения 6, используя раствор бикарбоната натрия. Суспензию перемешивали при температуре от 30°С до 40°С примерно один час и затем охлаждали в течение примерно 5 часов до температуры от 0°С до 10°С. Суспензию фильтровали и промывали холодным водным метанолом. Продукт сушили, получая каправиринсульфениловый спирт (выход 121 г, 86,7%) с чистотой 99,7% при стандартизации ВЭЖХ.
Получение каправирина
Короче говоря, карбамоилирование проводили с применением трифторуксусной кислоты (TFA) и ацетонитрила в качестве растворителя. Каправиринсульфениловый спирт (20,4 г, 0,05 моля), цианат натрия (5,35 г, 0,0825 моля) и ацетонитрил помещали в трехгорлую круглодонную колбу емкостью 500 мл. Суспензию охлаждали до -10°С, затем добавляли по каплям TFA (11,5 мл), поддерживая температуру ниже 0°С. Реакционную смесь перемешивали при -5°С±5°С примерно от 8 до 10 часов до окончания реакции. Затем определяли выход каправирина.
Результаты
Для сульфенилалкогольного предшественника каправирина TFA дает очень малое превращение в желаемый карбамат; конверсия в процессе составила 3,3%.
ПРИМЕР 2
Карбамоилирование спирта цианатом натрия в присутствии серной или уксусной кислоты
Было изучено карбамоилирование спирта, содержащего сульфенильную группу и основную часть, цианатом натрия в присутствии серной или уксусной кислоты.
Материалы и способы
Каправиринсульфениловый спирт был получен как описано выше в примере 1. Так же как и в примере 1 другие реагенты были коммерческой степени чистоты и использовались без дополнительной очистки.
Превращение каправиринсульфенилового спирта в каправирин производили, как описано в примере 1, со следующими изменениями. Вместо TFA использовали серную или уксусную кислоту. Таким образом, суспензию охлаждали до -10°С, затем прибавляли по каплям серную кислоту (18 мл) или уксусную кислоту (30 мл), поддерживая температуру ниже 0°С.
Результаты
Серная кислота и уксусная кислота дают более высокие выходы, чем TFA. Конверсии в процессе карбамоилирования спирта были 17,5% с серной кислотой и 7,8% с уксусной кислотой. Серная кислота содержала примерно 4% воды по весу.
ПРИМЕР 3
Карбамоилирование спирта цианатом натрия в присутствии метансульфокислоты
Карбамоилирование спиртов цианатом натрия изучали в различных условиях реакции в присутствии кислоты, применяя подходящий способ.
Материалы и способы
Материалы
Каправиринсульфениловый спирт был получен, как описано выше в примере 1. Так же как и в примере 1 другие реагенты были коммерческой степени чистоты и использовались без дополнительной очистки.
Получение каправирина
Было изучено карбамоилирование каправиринсульфенилового спирта до каправирина в различных условиях реакции для определения подходящего способа проведения указанной реакции. Каждое из различных условий было испытано протоколом, подобным описанному в параграфе ниже, для определения наиболее эффективных условий.
Каправиринсульфениловый спирт (20,4 г, 0,05 моля), цианат натрия (5,35 г, 0,0825 моля) и ацетонитрил помещали в трехгорлую круглодонную колбу емкостью 500 мл. Суспензию охлаждали до -10°С, затем прибавляли по каплям метансульфокислоту (50 мл, 0,75 моля), поддерживая температуру ниже 0°С. Реакционную смесь перемешивали при -5°С±5°С примерно от 8 до 10 часов до завершения реакции.
Реакцию гасили прибавлением 100 мл воды и ацетонитрил удаляли перегонкой в вакууме. Водный раствор продукта затем нейтрализовали до рН 6-7 приблизительно 60 г 50%-ного раствора гидроксида натрия. Продукт экстрагировали 100 мл этилацетата. Этилацетатный слой отделяли и добавляли 10 мл уксусного ангидрида. Смесь кипятили с обратным холодильником 2 часа, затем охлаждали до комнатной температуры. Реакционную смесь гасили водой и нейтрализовали уксусную кислоту карбонатом натрия.
Этилацетатный слой отделяли и концентрировали до примерно 70 мл. Для кристаллизации продукта добавляли пятьдесят миллилитров гептана. После охлаждения до 5°С на 3 часа суспензию продукта фильтровали и сушили, получая примерно 18 г каправирина, который по данным количественного анализа имел 99% чистоту с 0,45% аллофаната.
1Н ЯМР (200 MГц, CDCl3): 1,3 (6Н, д), 3,2 (1H, м), 5,2 (2H, с), 5,3(1H, с), 6,7 (2H, д), 6,8 (2H, м), 7,0 (1H, м), 8,4 (2H, м).
Результаты
Было обнаружено, что реакция спирта с цианатом натрия с образованием соответствующего карбамата идет в различных условиях.
Регулируя стехиометрию реагентов, преимущественно повышают выход желаемого продукта карбамата. Молярное отношение метансульфокислоты к спирту варьировали в широких пределах. Эффективную конверсию (выход выше 85%) наблюдали при молярных отношениях метансульфокислоты к спирту от 5 до 20, с наибольшей наблюдавшейся конверсией (выход 95%) при отношении от 9 до 10. Молярное отношение цианата натрия к спирту варьировалось в определенных пределах. Эффективную конверсию (выход более 85%) наблюдали при молярных отношениях цианата натрия к спирту от 1,5 до 2,0, с наибольшей наблюдавшейся конверсией (выход 95%) при отношении 1,65.
Растворитель реакции варьировали для повышения выхода желаемого продукта карбамата. Эффективную конверсию (выход более 80%) получали с различными инертными растворителями, этилацетатом, тетрагидрофураном и ацетонитрилом. Наибольшая конверсия (выход 95%) была достигнута с ацетонитрилом в качестве растворителя.
Температуру реакции варьировали для повышения выхода желаемого продукта карбамата. Температуру реакции варьировали в широких пределах. Эффективную конверсию (выход более примерно 80%) наблюдали при температурах между -25°С и +40°С, с наибольшей наблюдавшейся конверсией (выход 95%) при температуре от примерно -10°С до примерно 0°С.
Количество воды в реакционной смеси варьировали для повышения желаемого продукта карбамата. Количество воды варьировали между эффективно безводными условиями (полученными, как описано выше) и до примерно 1% воды. Эффективную конверсию (выход более примерно 75%) наблюдали при содержании воды до 1%, с наибольшей наблюдавшейся конверсией (выход 95%) при использовании безводной реакционной смеси.
Количество загрязняющей примеси аллофаната поддерживали таким низким, как возможно, для повышения выхода желаемого продукта карбамата. Примесь аллофаната поддерживали низкой путем подбора стехиометрии реагентов, температуры реакции, продолжительности реакции и/или степени конверсии в каправирин. Кроме того, количество примеси аллофаната поддерживают на возможно более низком уровне путем мониторинга его уровня во время реакции и гашения реакции, если его уровень начинает расти. Обычно количество примеси аллофаната поддерживают от примерно 0,9% до примерно 1,2%, предпочтительно ниже 0,7%, предпочтительно ниже примерно 0,5%.
Описанные выходы для указанных реакций являются выходами процесса. Обычно после выделения продукта каправирина выход уменьшается примерно на 10% или самое большее на 20% в неблагоприятных случаях.
Обсуждение
Метансульфокислота обеспечивает отличную конверсию спирта в желаемый карбамат в описанных здесь условиях. Это было неожиданно, поскольку Loev и Kormendy (Supra., 1963) утверждали, что метансульфокислота дает только следы карбаматов в их условиях реакции.
Кроме того, тщательное контролирование стехиометрии реакции уменьшает образование аллофаната, хорошо известного продукта реакции спиртов с синильной кислотой. Если обычно для образования карбаматов используют синильную кислоту, вторая молекула синильной кислоты реагирует с продуктом карбаматом, давая аллофанат.
Следует отметить, что в данной спецификации и пунктах формулы изобретения формы единственного числа "а", "an" и "the" включают указания на множественное число, если в контексте ясно не указано иначе. Так, например, ссылка на композицию, содержащую "соединение", включает смесь двух или более соединений. Следует также отметить, что термин "или" обычно используют в смысле включения "и/или", если в контексте ясно не указано иначе.
Все публикации и патентные заявки в данной спецификации ориентированы на уровень специалиста в области, к которой относится данное изобретение.
Изобретение описано со ссылкой на различные специфические и предпочтительные выполнения и технологии. Однако следует понимать, что могут быть сделаны многие вариации и модификации, если они остаются в духе и в рамках изобретения.
1. Способ карбамоилирования спирта, содержащего как спиртовую часть, так и основную часть и/или сульфенильную часть, включающий взаимодействие спирта с цианатом натрия в присутствии метансульфокислоты в безводных условиях.
2. Способ по п.1, где спирт дополнительно содержит сульфенильную часть и азотсодержащую гетероциклическую часть.
3. Способ по п.1, где спиртом является каправиринсульфениловый спирт.
4. Способ карбамоилирования спирта, содержащего как спиртовую часть, так и основную часть и/или сульфенильную часть, включающий смешивание цианата с указанным спиртом в инертном растворителе в безводных условиях; охлаждение образующейся реакционной смеси до температуры от примерно -25 до примерно 40°С;
добавление кислоты к охлажденной реакционной смеси со скоростью, поддерживающей температуру ниже примерно 0°С;
перемешивание реакционной смеси, содержащей кислоту, при температуре от примерно -10°С до примерно 0°С в течение примерно 8 - 10 ч; гашение реакционной смеси водой.
5. Способ по п.4, где спирт содержит сульфенильную часть и азотсодержащую гетероциклическую часть, которая выбрана из имидазолила и пиридила.
6. Способ по п.4, где спиртом является каправиринсульфениловый спирт.
7. Способ по п.4, где цианат представляет цианат натрия, цианат калия, цианат цезия или их смесь, и кислота представляет метансульфокислоту, уксусную кислоту, серную кислоту или их смесь.
8. Способ по п.4, где смешивание предусматривает использование молярного отношения метансульфокислоты и спирта от примерно 5 до примерно 20 и молярного отношения цианата натрия и спирта от примерно 1,5 до примерно 2,0.
9. Способ по п.4, где смешивание предусматривает использование молярного отношения метансульфокислоты и спирта от примерно 9 до примерно 10 и молярного отношения цианата натрия и спирта примерно 1,65.
10. Способ по п.4, где реакционную смесь цианата и спирта охлаждают до температуры от -10 до примерно 0°С.
11. Способ по п.4, дополнительно включающий выделение и очистку карбамоилированного спирта.