Производные бензодиазепина, лекарственное средство, содержащее их, и способ их получения
Иллюстрации
Показать всеОписываются производные бензодиазепина общей формулы (I) и их фармацевтически приемлемые кислотно-аддитивные соли
в которой Х обозначает одинарную связь или этиндиильную группу, когда Х обозначает одинарную связь, R1 обозначает атом галогена; (низш.)алкил; (низш.)алкилкарбонил; (низш.)циклоалкил; бензоил; фенил, необязательно замещенный атомом галогена, гидроксилом, (низш.)алкилом, (низш.)алкокси, гало-(низш.)алкокси или цианогруппой; стирил; фенилэтил; нафтил; дифенил; бензофуранил; или 5- или 6-членное гетероциклическое кольцо, представляющее собой тиофенил; фуранил; пиридинил; дигидропиридинил, тетрагидропиридинил, необязательно замещенные, когда Х обозначает этиндиильную группу, R1 обозначает атом водорода; (низш.)алкил; необязательно замещенный оксогруппой; (низш.)циклоалкил, замещенный гидроксилом; (низш.)циклоалкенил, необязательно замещенный оксогруппой; (низш.)алкенил, фенил, необязательно замещенный; 5- или 6-членное гетероциклическое кольцо, представляющее собой тиофенил, тиазолил, пиридинил, дигидропиридинил, тетрагидропиридинил или дигидропиранил, R3 обозначает фенил; пиридин; тиофенил или тиазолил, которые необязательно замещены. Эти соединения могут быть использованы для лечения или профилактики острых и/или хронических неврологических заболеваний, таких, как психоз, шизофрения, болезнь Альцгеймера, расстройство познавательной способности и нарушение памяти. Описывается лекарственное средство на основе их соединений, а также описывается способ получения соединений формулы (I). 3 н. и 7 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к соединениям общей формулы I
в которой
Х обозначает одинарную связь или этиндиильную группу,
причем в случае, когда Х обозначает одинарную связь,
R1 обозначает атом водорода; галогена; нитрогруппу; низший алкил, соответственно (низш.)алкил; гало-(низш.)алкил; алкоксикарбонил; (низш.)циклоалкил, необязательно замещенный атомом кислорода; бензоил, необязательно замещенный (низш.)алкилом, гало-(низш.)алкилом или атомом галогена; фенил, необязательно замещенный атомом галогена, гидроксилом, (низш.)алкилом, гало-(низш.)алкилом, (низш.)циклоалкилом, (низш.)алкокси, гало-(низш.)алкокси или цианогруппой; стиренил; фенилэтил; нафтил; дифенил; бензофуранил или 5- или 6-членное гетероциклическое кольцо, необязательно замещенное оксогруппой, бензилокси, беизоилом, метансульфонилом, бензолсульфонилом или ацетилом;
в случае, когда Х обозначает этиндиильную группу,
R1 обозначает атом водорода, (низш.)алкил, необязательно замещенный гидроксилом; гало-(низш.)алкил; (низш.)циклоалкил, необязательно замещенный гидроксилом, (низш.)алкилом, гало-(низш.)алкилом, (низш.)алкокси, гало-(низш.)алкокси или атомом галогена; (низш.)циклоалкенил, необязательно замещенный (низш.)алкилом, гало-(низш.)алкилом, (низш.)алкокси, гало-(низш.)алкокси, атомом галогена или оксогруппой; (низш.)алкенил; фенил, необязательно замещенный атомом галогена, (низш.)алкилом, гало-(низш.)алкилом, (низш.)циклоалкилом, (низш.)алкокси или гало; 5- или 6-членное гетероциклическое кольцо, необязательно замещенное (низш.)алкилом, атомом галогена, оксогруппой, бензилокси, бензоилом, метансульфонилом, бензолсульфонилом, ацетилом, пивалоилом, трет-бутоксикарбонилом или трет-бутилкарбонилом; или бензофуранил;
R3 обозначает фенил; пиридин; тиофенил или тиазолил, который необязательно замещен атомом галогена, циано-, нитрогруппой, азидо, гидроксилом, карбокси, морфолин-4-карбонилом, карбамоилом, тиокарбамоилом, N-гидроксикарбамоилом, триметилсилилэтинилом, (низш.)алкилом, (низш.)алкинилом, (низш.)алкокси, гало-(низш.)алкилом, 4-(низш.)алкилпиперазин-1-карбонилом, (низш.)алкиламинокарбонилом, который необязательно замещен амино-, (низш.)алкиламино-, ациламино-, оксогруппой, гидроксилом; (низш.)алкокси, (низш.)алкилтио или карбоксилом, который необязательно этерифицирован или амидирован; или 5-членный ароматический гетероцикл, который необязательно замещен амино-, (низш.)алкиламино-, ациламино-, оксогруппой, гидроксилом, (низш.)алкокси, (низш.)алкилтио, карбоксилом, который необязательно этерифицирован (низш.)алкилом или амидирован (низш.)алкиламиногруппой, которую в конечном счете замещают гидроксилом, или (низш.)алкилом, который необязательно замещен атомом галогена, гидроксилом, амино-, (низш.)алкиламино-, ациламино-, или амидиновой группой, которая необязательно замещена (низш.)алкилом, -C(NRR’)=NR’’ (где каждый из R, R’ и R’’ обозначают водородный атом или (низш.)алкил), гидроксилом. (низш.)алкокси, (низш.)алкилтио, ацилокси, (низш.)алкилсульфинилом, (низш.)алкилсульфонилом, (низш.)алкокси-(низш.)алкилсульфанилом, (низш.)алкилсульфанилом, циклоалкилсульфинилом, циклоалкилсульфонилом, гидроксиимино- или (низш.)алкоксииминогруппой, которая необязательно этерифицирована или амидирована, (низш.)алкенилом, оксо-, цианогруппой, карбамоилокси или сульфамоилом, который необязательно замещен (низш.)алкилом,
при условии, что, если Х обозначает одинарную связь, a R3 обозначает пиридинил, R1 не обозначает водородный атом или метил;
и к их фармацевтически приемлемым кислотно-аддитивным солям.
Было установлено, что соединения формулы I являются метаботропическими антагонистами глутаматного рецептора. Соединения формулы I обладают значительным терапевтическим действием.
В центральной нервной системе (ЦНС) трансмиссия стимула происходит благодаря взаимодействию нейротрансмиттера, который посылается нейроном, с нейрорецептором.
L-глутаминовая кислота - наиболее часто встречающийся в ЦНС нейротрансмиттер, играет ключевую роль в большом числе физиологических процессов. Рецепторы глутамат-зависимого стимула подразделяются на две основные группы. Первая основная группа формирует лиганд-контролируемые ионные каналы. Метаботропические глутаматные рецепторы (mGluR) образуют вторую основную группу и, следовательно, принадлежат к семейству G-белоксопряженных рецепторов.
К настоящему времени известны восемь различных членов этих mGluR и некоторые из них даже подразделяют на подтипы. На основе структурных параметров различного влияния на синтез вторичных метаболитов и разного сродства к низкомолекулярным химическим соединениям эти восемь рецепторов можно подразделить на три группы: mGluR1 и mGluR5, принадлежащих к группе I, mGluR2 и mGluR3, принадлежащих к группе II, и mGluR4, mGluR6, mGluR7 и mGluR8, принадлежащих к группе III.
Лиганды метаботропических глутаматных рецепторов, относящиеся к группе II, могут быть использованы для лечения или профилактики острых и/или хронических неврологических заболеваний, таких, как психоз, шизофрения, болезнь Альцгеймера, расстройство познавательной способности и нарушение памяти.
Другие терапевтические показания связаны с нарушениями функции головного мозга, которые вызваны операциями шунтирования или трансплантации, плохим кровообращением в головном мозгу, повреждениями спинного мозга, травмами головы, гипоксией, вызванной беременностью, угнетением сердечной деятельности и гипогликемией. Более того, показаниями к применению являются также хроническая и острая боли, хорея Хантингтона, боковой амиотрофический склероз (БАС), деменция, вызванная СПИДом, травмы глаз, ретинопатия, идиопатический паркинсонизм и паркинсонизм, вызванный лекарствами, а также условия, которые приводят к глутамат-дефицитным функциям, таким, как, например, миотонический спазм, судороги, мигрень, недержание мочи, никотиновая аддикция, опиомания, страх, рвота, дискинезия и депрессия.
Объектами настоящего изобретения являются соединения формулы I, их фармацевтически приемлемые соли как таковые и в качестве фармацевтически активных веществ, их получение, лекарственные средства на основе одного или нескольких соединений в соответствии с изобретением и их приготовление, а также применение соединений в соответствии с изобретением для лечения или профилактики заболеваний вышеупомянутого типа и, следовательно, для приготовления соответствующих лекарственных средств.
Предпочтительными являются те соединения формулы 1, у которых R3 обозначает фенил, замещенный в мета-положении цианогруппой; атом галогена или имидазолил, который необязательно замещен (низш.)алкилом; или 1,3-тиазолил, который необязательно замещен гидрокси-(низш.)алкилом, карбокси или -CO-NH-(CH2)2OH; 1,3-оксазолил; 1,2,3-триазолил; 1,2,4-триазолил, который необязательно замещен (низш.)алкилом; тетразолил или изоксазолил, который необязательно замещен (низш.)алкилом. Ниже приведены примеры таких соединений:
3-(4-оксо-7-фенилэтинил-4,5-дигидро-3Н-бензо[b][1,4]диазепин-2-ил)бензонитрил;
4-(3-хлорфенил)-8-фенилэтинил-1,3-дигидробензо[b][1,4]диазепин-2-он;
4-(3-имидазол-1-илфенил)-8-фенилэтинил-1,3-дигидробензо[b][1,4]диазепин-2-он;
3-[7-(4-фторфенил)-4-оксо-4,5-дигидро-3Н-бензо[b][1,4]диазепин-2-ил]бензонитрил;
8-(4-фторфенилэтинил)-4-(3-имидазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(4-фторфенилэтинил)-4-(3-[1,2,4]триазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(4-фторфенил)-4-[3-(4-метилимидазол-1-ил)фенил]-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(4-фтор-2-метилфенил)-4-(3-имидазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(4-фтор-2-гидроксифенил)-4-(3-имидазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(4-фторфенилэтинил)-4-(3-тетразол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(2-фторфенил)-4-(3-[1,2,3]триазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(4-фторфенил)-4-[3-(3-метилизоксазол-5-ил)фенил]-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(2,4-дифторфенил)-4-(3-[1,2,3]триазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(2,3-дифторфенил)-4-(3-[1,2,3]триазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(2-фторфенил)-4-[3-(4-гидроксимегилтиазол-2-ил)фенил]-1,3-дигидробензо[b][1,4]диазепин-2-он;
2-{3-[7-(2-фторфенил)-4-оксо-4,5-дигидро-3Н-бензо[b][1,4]диазепин-2-ил]фенил}тиазол-4-карбоновая кислота;
(2-гидроксиэтил)амид 2-{3-[7-(4-фторфенил)-4-оксо-4,5-дигидро-3H-бензо[b][1,4]диазепин-2-ил]фенил}-4-метилтиазол-5-карбоновой кислоты и
4-[3-(4,5-диметил-4Н-[1,2,4]триазол-3-ил)фенил]-8-(4-фторфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он.
Предпочтительны также соединения формулы I, в которой R3 обозначает тиофенил, предпочтительно тиофен-2-ил, необязательно замещенный атомом галогена или цианогруппой; или пиридинил, предпочтительно пиридин-4-ил, необязательно замещенный, предпочтительно во 2-м положении, атомом галогена или цианогруппой.
Ниже приведены примеры таких соединений:
8-(4-фторфенилэтинил)-4-(2-имидазол-1-илпиридин-4-ил)-1,3-дигидробензо[b][1,4]диазепин-2-он;
2-[7-(4-фторфенил)-4-оксо-4,5-дигидро-1Н-бензо[b][1,4]диазепин-2-ил]тиофен-3-карбонитрил;
4-(4-оксо-7-фенилэтинил-4,5-дигидро-3Н-бензо[b][1,4]диазепин-2-ил)пиридин-2-карбонитрил и
4-[7-(2,4-дифторфенил)-4-оксо-4,5-дигидро-3Н-бензо[b][1,4]диазепин-2-ил]пиридин-2-карбонитрил.
Настоящее описание охватывает также все таутомерные формы соединений по изобретению.
Используемое в настоящем описании понятие "(низш.)алкил" служит для обозначения насыщенного прямоцепочечного или разветвленного углеводородного остатка, содержащего от 1 до 7 углеродных атомов, предпочтительно от 1 до 4 углеродных атомов, например такого, как метил, этил, н-пропил, изопропил и т.п.
Используемое в настоящем описании понятие "(низш.)алкинил" служит для обозначения ненасыщенного прямоцепочечного или разветвленного углеводородного остатка, содержащего от 2 до 7 углеродных атомов, предпочтительно от 2 до 4 углеродных атомов, например такого, как этинил, н-пропинил и т.п.
Термин "(низш.)циклоалкил" в настоящем описании обозначает циклический насыщенный углеводородный остаток с 3-5 углеродными атомами, предпочтительно с 3 углеродными атомами, такой, как циклопропил.
Термин "(низш.)алкокси" обозначает (низш.)алкильный остаток в том смысле, в котором он представлен выше, связанный через кислородный атом.
Термин "галоген" охватывает атомы фтора, хлора, брома и иода.
Выражение "5- или 6-членное гетероциклическое кольцо" охватывает тиофен, фуран, тиазол, пиридин, частично гидратированный пиридин, например 2-пиридон, частично гидрированный пиридин, например тетрагидропиридин, пятичленный ароматический гетероцикл, включающий до 4 гетероатомов, выбранных из О, S, N, включая имидазол-1-ил, имидазол-2-ил, имидазол-4-ил; пиразол-1-ил, пиразол-3-ил, пиразол-4-ил; 1,3-тиазол-2-ил, 1,3-тиазол-4-ил, 1,3-тиазол-5-ил; 1,3-оксазол-2-ил, 1,3-оксазол-4-ил, 1,3-оксазол-5-ил, 1,2-оксазол-3-ил, 1,2-оксазол-4-ил, 1,2-оксазол-5-ил; 1,2,3-триазол-1-ил, 1,2,3-триазол-4-ил, 1,2,4-триазол-1-ил, 1,2,4-триазол-3-ил, 1,2,4-триазол-2-ил; 1,2,4-оксадиазол-2-ил, 1,2,4-оксадиазол-3-ил, 1,2,4-оксадиазол-5-ил, 1,2,3-оксадиазол-4-ил, 1,2,3-оксадиазол-5-ил; 1,2,4-тиадиазол-2-ил, 1,2,4-тиадиазол-3-ил, 1,2,4-тиадиазол-5-ил, 1,2,3-тиадиазол-4-ил, 1,2,3-тиадиазол-5-ил; тетразол-1-ил, тетразол-2-ил, тетразол-5-ил;
Предлагаемые соединения общей формулы I и их фармацевтически приемлемые соли могут быть получены в соответствии со следующими способами.
Схема А
Соединения общей формулы I, в которой R1, R3 и Х имеют значения, указанные выше, могут быть получены в соответствии со схемой А, например отщеплением защищающей группы ВОС в соединении общей формулы II и сопутствующей циклизацией освобожденного от защитной группы соединения. Стадию удаления защитной группы/циклизации можно осуществлять обработкой соединения общей формулы II кислотой Бренстеда, подобной, например, трифторуксусной кислоте (ТФК), в инертном растворителе, подобном, например, дихлорметану (ДХМ). В предпочтительном варианте реакцию проводят при температуре в пределах 0 и 50° С. В реакционной смеси может оказаться целесообразным также использование анизола или 1,3-диметоксибензола в качестве акцептора карбокатиона. В другом варианте вместо группы ВОС могут быть использованы любые другие подходящие аминзащищающие группы, такие, как, например, ФМОК (флуоренилметилоксикарбонил) или бензилоксикарбонил.
Схема В
Соединения общей формулы II, в которой R1, R3 и Х имеют такие же значения, как указанные выше, могут быть получены в соответствии со схемой В, например реакцией соединения общей формулы III с диоксиноном (общей формулы IV) в инертном растворителе, подобном, например, толуолу или ксилолу, при повышенных температурах, предпочтительно в пределах 80 и 160° С.
По другому варианту соединения общей формулы II могут быть также получены, например, реакцией соединения общей формулы III с β -кетоэфиром (общей формулы IVa), в которой R3 имеет такие же значения, как указанные выше, с использованием таких же условий, как указанные для реакции с диоксинонами.
Схема С
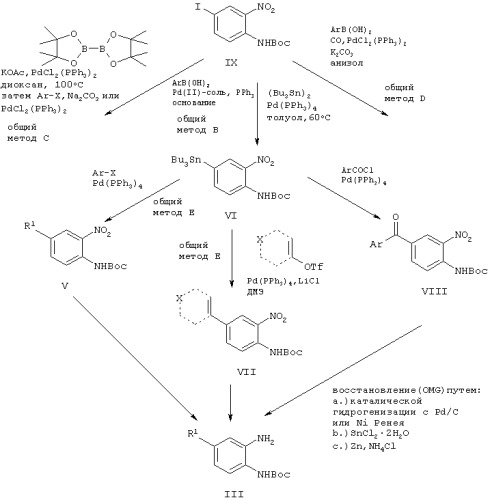
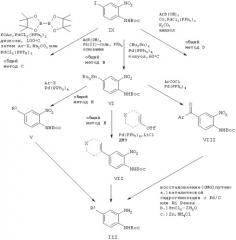
В соответствии со схемой С соединения общей формулы III, в которой R1 имеет такие же значения, как указанные выше для соединения, у которого Х обозначает одинарную связь, могут быть получены по другому пути из соединения йода IX в зависимости от природы R1. Как показано на схеме С, ключевыми стадиями являются реакции сочетания типа реакций по Сузуки и Stille в присутствии или отсутствие монооксида углерода. Точные условия для соответствующих соединений можно найти в экспериментальной части.
Схема D
ОМ (общий метод) А, метод а: дифосген, ЕtOАс, 77° С; затем трет-ВuОН
ОМ А, метод б: Воc2О, Сs2СО3, 2-бутанон, 52° С
ОМ А, метод в: i) Вос2О, ДМАП (N,N-диметиламинопропиламин), ТГФ;
ii) ТФК, ДХМ, 0° С
В соответствии со схемой D ключевой промежуточный йодид IX может быть получен из технически доступного 2-нитроанилина осуществлением стандартной последовательности йодирование/защита.
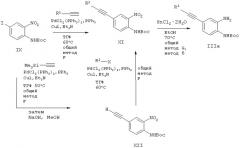
Схема Е
В соответствии со схемой Е соединения общей формулы IIIa, в которой
R1 имеет такие же значения, как указанные выше для соединении, у которых Х обозначает этиндиильную группу, могут быть получены по другому пути из соединения йода IX в зависимости от природы R1. Как показано на схеме Е, превращение, например, можно проводить
а) прямым присоединением R1-алкиндиильного заместителя путем реакции сочетания типа реакции Sonogashira с последующим восстановлением нитрогруппы или
б) двумя постадийными реакциями сочетания типа реакции Sonogashira, где вначале проводят реакцию сочетания триметилсилилацетилена с иодидом IX с получением после удаления защитной группы гидроксидом натрия в метаноле промежуточного продукта XII, который затем можно подвергнуть превращению проведением второй реакции сочетания типа реакции Sonogashira с соответствующим реагентом R1-I, R1-Вr или R1-ОSО2СF3 и восстановлением нитрогруппы с получением целевого соединения.
Точные условия для соответствующих соединений можно найти в экспериментальной части.
Схема F
В соответствии со схемой F диоксиноны и β -кетоэфиры как строительные блоки общих формул IV и IVa могут быть получены по методам, которые некоторым специалистам в данной области техники известны, из соответствующих производных R3-COR карбоновых кислот, т.е. из свободных кислот, метиловых или этиловых эфиров и хлорангидридов кислот. Точные условия для соответствующих соединений можно найти в экспериментальной части.
Другой путь синтетического получения соединений общей формулы Iс, в которой R и Х имеют такие же значения, как указанные выше, a R3 обозначает фенилкарбоксамид общей формулы C(O)NR4R5, в которой R4 и R5 обозначают водородный атом или (низш.)алкил или R4 и R5 совместно образуют морфолиновый остаток или N-метилпиперазин, представлен на схеме G.
Схема G
Точные условия получения соответствующих соединений можно найти в экспериментальной части.
Тем не менее еще один путь получения соединений общей формулы I состоит в проведении реакции 4-арил-8-иод-1,3-дигидробензо[b][1,4]диазепин-2-онов (общей формулы Id, схема синтеза Н) с алкинами общей формулы R1-С≡ С-, в которой R1 имеет такие же значения, как указанные выше, реакции сочетания Sonogashira.
Схема Н
Точные условия получения соответствующих соединений можно найти в экспериментальной части.
Фармацевтически приемлемые соли можно легко получать в соответствии с известными методами и с учетом природы превращаемого в соль соединения. Для получения фармацевтически приемлемых солей основных соединений формулы I приемлемы минеральные и органические кислоты, такие, как, например, соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и лимонная кислота, муравьиная кислота, фумаровая кислота, яблочная кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфокислота, п-толуолсульфокислота и т.п.
Соединения формулы I и их фармацевтически приемлемые соли являются метаботропическими антагонистами глутаматного рецептора и могут быть использованы для лечения или профилактики острых и/или хронических неврологических заболеваний, таких, как психоз, шизофрения, болезнь Альцгеймера, расстройство познавательной способности и нарушение памяти. Другие терапевтичекие показания связаны с нарушениями функции головного мозга, которые вызваны операциями шунтирования или трансплантации, плохим кровообращением в головном мозгу, повреждениями спинного мозга, травмами головы, гипоксией, вызванной беременностью, угнетением сердечной деятельности и гипогликемией. Более того, показаниями к применению являются также хроническая и острая боли, хорея Хантингтона, БАС, деменция, вызванная СПИДом, травмы глаз, ретинопатия, идиопатический паркинсонизм и паркинсонизм, вызванный лекарствами, а также условия, которые приводят к глутамат-дефицитным функциям, таким, как, например, миотонический спазм, судороги, мигрень, недержание мочи, никотиновая аддикция, психоз, опиомания, страх, рвота, дискинезия и депрессия.
Соединения формулы I и их фармацевтически приемлемые соли могут быть использованы в качестве лекарственных средств, например в форме фармацевтических препаратов. Эти фармацевтические препараты можно вводить перорально, например в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение можно также осуществлять ректально, например, в форме суппозиториев, или парентерально, например, в форме растворов для инъекций.
При приготовлении фармацевтических препаратов соединения формулы I и их фармацевтически приемлемые соли можно совмещать с фармацевтически инертными неорганическими или органическими носителями. В качестве таких носителей при изготовлении таблеток, таблеток с покрытием, драже и твердых желатиновых капсул могут быть использованы, например, лактоза, кукурузный крахмал и его производные, тальк, стеариновая кислота и ее соли и т.п. Приемлемыми носителями для изготовления мягких желатиновых капсул являются, например, растительные масла, воски, твердые жиры, полутвердые и жидкие полиолы и т.п. Однако в случае мягких желатиновых капсул в зависимости от природы действующего вещества обычно никакие носители не требуются. При приготовлении растворов и сиропов приемлемыми носителями являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.п. Для приготовления водных растворов для инъекций водорастворимых солей соединений формулы I можно применять адъюванты, такие, как спирты, полиолы, глицерин, растительные масла и т.п., но, как правило, они необязательны. Приемлемыми для изготовления суппозиториев носителями являются, например, натуральные или отвержденные масла, воски, твердые жиры, полужидкие и жидкие полиолы и т.п.
Кроме того, фармацевтические препараты могут включать консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подслащивающие вещества, красители, корригенты, соли для варьирования осмотического давления, буферы, маскирующие добавки и антиоксиданты. Тем не менее, они могут также включать другие терапевтически ценные вещества.
Как сказано выше, лекарственные средства, содержащие по одному или несколько соединений формулы I или их фармацевтически приемлемых солей и терапевтически инертные наполнители, также являются объектом настоящего изобретения, равно как и способ приготовления таких лекарственных средств, который включает придание одному или нескольким соединениям формулы I или их фармацевтически приемлемым солям и, если необходимо, одному или нескольким другим терапевтически ценным веществам формы дозированного галенова препарата совместно с одним или несколькими терапевтически инертными носителями.
Дозу можно варьировать в широких интервалах, и в каждом конкретном случае она, что очевидно, должна соответствовать индивидуальным потребностям. Обычно эффективная доза для перорального или парентерального введения находится в пределах от 0,01 до 20 мг/кг/день, причем для всех описанных показаний предпочтительная доза составляет от 0,1 до 10 мг/кг/день. Следовательно, ежедневная доза для взрослого человека весом 70 кг находится в пределах от 0,7 до 1400 мг, предпочтительно в пределах от 7 до 700 мг.
Объектом настоящего изобретения является также применение соединений формулы I и их фармацевтически приемлемых солей для приготовления лекарственных средств, главным образом для лечения или профилактики острых и/или хронических неврологических заболеваний вышеперечисленного типа.
Соединения по настоящему изобретению относятся к антагонистам mGlu рецептора группы II, как это определяют с помощью теста, описанного Cartmell и др. (Br. J.Pharmacol. 1998, 123(3), 497-504).
Соединения проявляют активность, определяемую так, как описано ниже, и равную 50 мкМ и меньше, более типично 3 мкМ и меньше и идеально 0,5 мкМ и меньше. В таблице, приведенной ниже, представлены некоторые конкретные значения pKi предпочтительных соединений.
| Соединение | KimGlu(MKM) |
| 3-(7-иод-4-оксо-4,5-дигидро-3H-бензо[b][1,4]диазепин-2-ил)бензонитрил | 0,017 |
| 4-(3-хлорфенил)-8-фенилэтинил-1,3-дигидробензо[b][1,4]диазепин-2-он | 0,040 |
| 4-(3-имидазол-1-илфенил)-8-фенилэтинил-1,3-дигидробензо[b][1,4]диазепин-2-он | 0,006 |
| 3-[7-(4-фторфенил)-4-оксо-4,5-дигидро-3H-бензо[b][1,4]диазепин-2-ил)бензонитрил | 0,055 |
| 8-(4-фторфенилэтинил)-4-(3-имидазол-1-илфенил)1,3-дигидробензо[b][1,4]диазепин-2-он | 0,004 |
| 8-(4-фторфенилэтинил)-4-(3-[1,2,4]триазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он | 0,049 |
| 8-(4-фторфенилэтинил)-4-(2-имидазол-1-илпиридин-4-ил)-1,3-дигидробензо[b][1,4]диазепин-2-он | 0,004 |
| 8-(4-фторфенил)-4-[3-(4-метилимидазол-1-ил)фенил]-1,3-дигидробензо[b][1,4]диазепин-2-он | 0,016 |
| 8-(4-фтор-2-метилфенил)-4-(3-имидазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он | 0,050 |
| 8-(4-фтор-2-гидроксифенил)-4-(3-имидазол-1- | 0,170 |
| илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он | |
| 2-[7-(4-фторфенил)-4-оксо-4,5-дигидро-1Н-бензо[b][1,4]диазепин-2-ил]тиофен-3-карбонитрил | 0,250 |
| 8-(4-фторфенилэтинил)-4-(3-тетразол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он | 0,036 |
| 4-(4-оксо-7-фенилэтинил-4,5-дигидро-3H-бензо[b][1,4]диазепин-2-ил]пиридин-2-карбонитрил | 0,039 |
| 4-[7-(2,4-дифторфенил)-4-оксо-4,5-дигидро-3H-бензо[b][1,4]диазепин-2-ил]пиридин-2-карбонитрил | 0,026 |
| 8-(2-фторфенил)-4-(3-[1,2,3]триазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он | 0,008 |
| 8-(4-фторфенил)-4-[3-(3-метилизоксазол-5-ил)-фенил]-1,3-дигидробензо[b][1,4]диазепин-2-он | 0,289 |
| 8-(2,4-дифторфенил)-4-(3-[1,2,3]триазол-1-ил)-фенил]-1,3-дигидробензо[b][1,4]диазепин-2-он | 0,010 |
| 8-(2-фторфенил)-4-(2-имидазол-1-илтиазол-4-ил)-1,3-дигидробензо[b][1,4]диазепин-2-он | 0,298 |
| 8-(2,3-дифторфенил)-4-(3-[1,2,3]триазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он | 0,013 |
| 8-(2-фторфенил)-4-[3-(4-гидроксиметилтиазол-2-ил)фенил]-1,3-дигидробензо[b][1,4]диазепин-2-он | 0,016 |
| 2-{3-[7-(2-фторфенил)-4-оксо-4,5-дигидро-3H-бензо[b][1,4]диазепин-2-ил]фенил}тиазол-4-карбоноваяя кислота | 0,016 |
| (2-гидроксиэтил)амид 2-{3-[7-(4-фторфенил)-4-оксо-4,5-дигидро-3H-бензо[b][1,4]диазепин-2-ил]фенил}-4-метилтиазол-5-карбоновой кислоты | 0,049 |
| 4-[3-(4,5-диметил-4Н-[1,2,4]триазол-3-ил)фенил]-8-(4-фторфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он | 0,108 |
Связывание [3H]-LY354740 на мембранах клеток СНО, трансфектированных mGlu2
Трансфекция и культура клеток
кДНК, кодирующую mGlu2 белковый рецептор крыс, в плазмиде pBluesceipt II получали от проф. S.Nakanishi (Киото, Япония) и субклонировали в эукариотический экспрессирующий вектор pcDNA-I-amp фирмы Invitrogen (NV Leek, Нидерланды). Эта векторная конструкция (pcDlmCR2) и psvNeo плазмида, кодирующая ген устойчивости к неомицину, была встроена в СНО клетки, модифицированные фосфатом кальция по методу, описанному Chen и Okayama (1988). Клетки инкубировали в среде Dulbecco Modified Eagle, содержавшей пониженную концентрацию L-глутамина (конечная концентрация: 2 мМ) и 10%-ную диализованную фетальную телячью сыворотку от фирмы Gibro BRL (Базель, Швейцария). Селекцию проводили в присутствии G-418 (конечная концентрация 1000 мкл/мл). Клоны идентифицировали по методу обратной транскрипции 5 мкг общей РНК с последующей стадией ПНР, используя специфические праймеры рецептора mGluz 5’-atcactgcttgggtttctggcactg-3’ и 5’-agcatcactgtgggtggcataggagc-3’ в 60 мМ Трис HCl (при рН 10), 15 мМ (NH4)2SO4, 2 мМ MgCl2 в присутствии 25 ед/мл Tag полимеразы. Реакцию ПЦР проводили в режиме 30 циклов отжига при 60° С в течение 1 мин, удлинения при 72° С в течение 30 с и денатурации при 95° С в течение 1 мин.
Приготовление мембран
Клетки, культивированные так, как описано выше, собирали и промывали три раза холодным физиологическим раствором с фосфатным буфером и замораживали при -80° С. Осадок ресуспендировали в холодном 20 мМ HEPES-NaOH буфере, содержавшем 10 мМ EDTA (при рН 7,4), и гомогенизировали с политроном (фирма Kinematica, AG, Littau, Швейцария) в течение 10 с при 10000 об/мин. После центрифугирования в течение 30 мин при 4° С, осадок промывали один раз тем же буфером, один раз холодным 20 мМ HEPES-NaOH буфером, включавшем 0,1 мМ EDTA (при рН 7,4). Содержание белков определяли, применяя метод Пирса (фирма Socochim, Лозанна, Швейцария), используя в качестве стандарта бычий сывороточный альбумин.
Связывание [3H]-LY354740
После оттаивания мембраны ресуспендировали в холодном 50 мМ Трис-НСl буфере, содержавшем 2 мМ MgCl2 и 2 мМ СаСl3 (при рН 7) (буфер для связывания). Конечная концентрация мембран в опыте составляла 25 мкг белка/мл. Опыты по ингибированию выполняли с мембранами, инкубированными с 10 нМ [3H]-LY354740 в течение 1 ч при комнатной температуре в присутствии тестируемых соединений различных концентраций. После инкубирования мембраны отфильтровывали на стеклянных волокнистых фильтрах Whatmann GF/C и промывали 5 раз холодным буфером для связывания. Неспецифическое связывание определяли в присутствии 10 мкМ DCG IV (TOCRIS №0975). После переноса фильтров в пластиковые пробирки, содержавшие 10 мл Ultima-gold сцинциллирующей жидкости (Packard, Цюрих, Швейцария), радиоактивность определяли по методу жидкостной сцинцилляции в счетчике Tri-Carb 2500 TR (Packard, Цюрих, Швейцария).
Данные анализа
Кривые ингибирования обрабатывали с использованием четырех параметров логистического уравнения, получая значения ИК50 и коэффициенты Хилла.
ПРИМЕРЫ
Общий метод А (схема синтеза D)
Получение трет-бутиловых эфиров (4-иод-2-нитрофенил)карбаминовой кислоты из 4-иод-2-нитроанилинов.
Метод а
В 4,1 мл раствора дифосгена (34,1 ммоль) в 40 мл EtOAc при 0° С добавляли раствор 4-йод-2-нитроанилина (45,5 ммоль) в 200-500 мл EtOAc и смесь кипятили с обратным холодильником в течение 18 ч. Под вакуумом удаляли растворитель, в результате чего оставалось коричневое твердое вещество, которое растирали в порошок с 200 мл горячего гексана. Этот твердый материал отфильтровывали и фильтрат концентрировали под пониженным давлением, в результате чего в виде желтого твердого вещества оставался чистый 4-иод-2-нитрофенилизоцианат. Этот материал кипятили с обратным холодильником в смеси избытка трет-ВuОН в СН2Сl2 в течение 2,5 ч. В результате удаления растворителя оставалось оранжевое твердое вещество, которое очищали хроматографией в колонке на силикагеле с использованием гексана/ЕtOАс, получая в виде желтого твердого вещества трет-бутиловый эфир (4-иод-2-нитрофенил)карбаминовой кислоты.
Метод б
В смесь 4-иод-2-нитроанилина (142 ммоль) и 55,5 г карбоната цезия (170 ммоль) в 740 мл 2-бутанона по каплям добавляли раствор 37,8 г ВОС2О (173 ммоль) в 170 мл 2-бутанона и образовавшуюся смесь перемешивали при 52° С в течение 26 ч. Под вакуумом удаляли растворитель, остаток обрабатывали смесью 240 мл Н2О и 240 мл МеОН и экстрагировали гексаном (3 порции по 500 мл). Объединенный гексановый слой промывали рассолом (200 мл) и все водные слои повторно экстрагировали гексаном (300 мл). Все объединенные гексановые слои сушили над MgSO4, фильтровали и под вакуумом удаляли растворитель с получением оранжевого твердого вещества, которое очищали хроматографией в колонке на силикагеле с использованием гексана/EtOAc, получая в виде желтого твердого вещества трет-бутиловый эфир (4-иод-2-нитрофенил)карбаминовой кислоты.
Метод в
В раствор 4-иод-2-нитроанилина (550 ммоль) и 1,22 г ДМАП (N,N-диметиламинопропиламин) (10 ммоль) в 1000 мл ТГФ при 23° С в течение 70 мин по каплям добавляли раствор 246 г ВОС2О (1128 ммоль) в 500 мл ТГФ и перемешивание продолжали при 23° С в течение 75 мин. Всю смесь выпаривали досуха и сушили под высоким вакуумом, в результате чего оставалось 253,59 г темно-коричневого твердого вещества. Этот материал растворяли в 1100 мл ДХМ, охлаждали до 0° С и по каплям добавляли 84 мл ТФК (1100 ммоль). Смесь перемешивали при 0° С в течение 2 ч, выливали в охлажденный льдом насыщенный раствор NаНСО3, экстрагировали ДХМ, промывали рассолом и сушили над MgSO4. В результате удаления растворителя под вакуумом оставалось темно-коричневое твердое вещество (199,71 г), которое помещали на силикагель и очищали хроматографией в колонке на силикагеле с использованием гексана/EtOAc, получая в виде желтого твердого вещества трет-бутиловый эфир (4-иод-2-нитрофенил)карбаминовой кислоты.
Пример А1
трет-Бутиловый эфир (4-иод-2-нитрофенил)карбаминовой кислоты.
Изоцианат готовили из 12,0 г 4-иод-2-нитроанилина (45,5 ммоль; получен из 2-нитроаыилина в соответствии с работой Wilson, J. Gerald; Hunt, Frederick C. Aust.J.Chem. 1983, 36, 2317-25; CAS-No. [20691-72-9]) реакцией с 4,1 мл дифосгена (34,1 ммоль) в 250 мл EtOAc с последующей обработкой 12 мл трет-ВuОН в 60 мл СН2Сl2 в соответствии с общим методом А (метод а). Получали в виде 8,23 г желтого твердого вещества (выход: 82%).
MS (EI) 390 (М+); tпл: 92-94° C.
Пример А2
трет-Бутиловый эфир (4-изопропил-2-нитрофенил)карбаминовой кислоты.
Готовили из 4-изопропил-2-нитроанилина (CAS-No. [63649-64-9]) реакцией с ВОС2О и каталитически эффективным количеством ДМАП в ТГФ с последующей обработкой ТФК в CH2Cl2 в соответствии с общим методом А (метод в). Получали в виде желтого масла (14,1 г).
MS (EI) 280 (М+).
Пример A3
трет-Бутиловый эфир (4-циклопропил-2-нитрофенил)карбаминовой кислоты.
Готовили из 4-циклопропил-2-нитрофениламина, полученного нитрованием N-(4-циклопропилфенил)ацетамида 65%-ной НNO3 в Ас2О и последующим омылением 6н. NaOH при кипячении с обратным холодильником в диоксане (CAS-No. [63649-64-9]), реакцией с ВОС2О и каталитически эффективным количеством ДМАП в ТГФ с последующей обработкой ТФК в CH2Cl2 в соответствии с общим методом А (метод в). Получали в виде 2,33 г оранжевой жидкости.
MS (EI) 278 (М+).
Общий метод В (схема синтеза С)
Получение трет-бутиловых эфиров (4-арил-2-нитрофенил)карбаминовой кислоты прямой реакцией сочетания по Сузуки трет-бутиловых эфиров (4-иод-2-нитрофенил)карбаминовой кислоты с арилбороновыми кислотами.
Смесь трет-бутилового эфира (4-иод-2-нитрофенил)карбаминовой кислоты (3,0 ммоль), арилбороновой кислоты (4,5 ммоль) и РdСl2(РРh3)2 (2 мол.%) кипятили с обратным холодильником в 25 мл 1,4-диоксана и 7,5 мл 2 М раствора Nа3СО3 [или, по другому варианту, с 7,5 мл 1 М раствора NaHCO3, LiCl (6,0 ммоль) и (Рh3Р)4Рd (3 мол.%) в 30 мл ДМЭ (диметиловый эфир); также возможно с Еt3N (9,0 ммоль), Pd(OAc)2 (3 мол.%), РРh3 (6 мол.%) в 10 мл ДМФ при 100° С] до тех пор, пока данные тонкослойной хроматографии не указывали на полноту превращения йодида. Смесь переносили в отдельную воронку, добавляли 25 мл Н2О и продукт экстрагировали диэтиловым эфиром или ЕtOАс (3 порции по 30 мл). Объединенные органические слои промывали рассолом (50 мл) и сушили над Na2SO4. В результате удаления растворителя оставался коричневый остаток, который очищали хроматографией в колонке на силикагеле с использованием циклогексана/диэтилового эфира или циклогексана/ЕtOАс, получая указанное в заглавии соединение.
Пример В1
трет-Бутиловый эфир (4’-метокси-3-нитродифенил-4-ил)карбаминовой кислоты.
Готовили из трет-бутилового эфира (4-иод-2-нитрофенил)карбаминовой кислоты (пример А1) и 4-метоксифенилбороновой кислоты в соответствии с общим методом В. Получали в виде желтого твердого вещества (637 мг).
MS (ISN) 343 [(М-Н)-]; tпл: 107-109° С.
Пример В2
трет-Бутиловый эфир (2-нитро-4-тиофен-3-илфенил)карбаминовой кислоты.
Готовили из трет-бутилового эфира (4-иод-2-нитрофенил)карбаминовой кислоты (пример А1) и 3-тиофенбороновой кислоты в соответствии с общим методом В. Получали в виде желтого твердого вещества (326 мг).
MS (ISN) 319 [(М-Н)-].
Пример В3
трет-Бутиловый эфир (4-фуран-2-ил-2-нитрофенил)карбаминовой кислоты.
Готовили из трет-бутилового эфира (4-иод-2-нитрофенил)карбаминовой кислоты (пример А1) и фуран-2-бороновой кислоты в соответствии с общим методом В. Получали в виде оранжевого твердого вещества (282 мг).
MS (EI) 304 (М+); tпл: 169-172° C.
Пример В4
трет-Бутиловый эфир (4’-этил-3-нитродифенил-4-ил)карбаминовой кислоты.
Готовили из трет-бутилового эфира (4-иод-2-нитрофенил)карбаминовой кислоты (пример А1) и 4-этилбензолбороновой кислоты в соответствии с общим методом В. Получали в виде оранжевого твердого вещества (689 мг).
MS (EI) 343 [(M+H)+]; tпл: 94-99° C.
Пример В5
трет-Бутиловый эфир (3-нитродифенил-4-ил)карбаминовой кислоты.
Готовили из 994 мг трет-бутилового эфира (4-иод-2-нитрофенил)карбаминовой кислоты (пример А1) (2,73 ммоль) и 576 мг фенилбороновой кислоты (3,00 ммоль) в соответствии с общим методом В. Получали в виде ярко-желтого твердого вещества (800 мг).
MS(EI)314(M+);tпл: 119-121° С.
Пример В6
трет-Бутиловый эфир (4-фуран-3-ил-2-нитрофенил)карбаминовой кислоты.
Готовили из трет-бутилового эфира (4-иод-2-нитрофенил)карбаминовой кислоты (пример А1) и фуран-3-бороновой кислоты в соответствии с общим методом В. Получали в виде оранжевого твердого вещества (855 мг).
MS (ISP) 322 [(M+NH4)+] и 327 [(M+Na)+]; tпл: 105-110° С.
Пример В7
трет-Бутиловый эфир(4-нафталин-1 -ил-2-нитрофенил)карбаминовой кислоты.
Готовили из трет-бутилового эфира (4-иод-2-нитрофенил)карбаминовой кислоты (пример А1) и 1-нафтилбороновой кислоты в соответствии с общим методом В. Получали в виде желтой пены (1,0 г).
MS (ISN) 363 [(М-Н)-]; tпл: 60-66° C.
Пример В8
трет-Бутиловый эфир (3’-метокси-3-нитродифенил-4-ил)карбаминовой кислоты.
Готовили из трет-бутилового эфира (4-иод-2-нитрофенил)карбаминовой кислоты (пример А1) и 3-метоксифенилбороновой кислоты в соответствии с общим методом В. Получали в виде оранжевого твердого вещества (818 мг).
MS (ISP) 345 [(М+Н)+], 362 [(M+NH4)+] и 367 [(M+Na)+]; tпл:104-107° C.
Пример В9
трет-Бутиловый эфир (3-нитро-4’-трифторметоксидифенил-4-ил)карбаминовой кислоты.
Готовили из трет-бутилового эфира (4-иод-2-нитрофенил)карбаминовой кислоты (пример А1) и 4-(трифторметокси)бензолбороновой кислоты в соответ