Азолы в качестве ингибиторов малонил-соа-декарбоксилазы, полезные в качестве модуляторов метаболизма
Иллюстрации
Показать всеНастоящее изобретение относится к способам лечения заболеваний или синдромов, связанных с метаболизмом жирных кислот и глюкозы, и к новым соединениям и их фармацевтически приемлемым солям. В частности, данное изобретение относится к применению новых соединений и фармацевтических композиций для лечения сердечно-сосудистых заболеваний, диабета, раковых заболеваний, ацидоза и ожирения через ингибирование малонил-СоА-декарбоксилазы (MCD). Указанные соединения имеют формулы (I) и (II), где Y, C, R1, R2, R6 и R7 имеют значения, указанные в формуле изобретения. 5 н. и 22 з.п. ф-лы, 8 табл.
Реферат
Данная заявка испрашивала приоритет на основании предварительной заявки на патент, порядковый №60/270034, поданной 20 февраля 2001, включенной в данное описание в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу лечения некоторых обменных заболеваний (болезней метаболизма) и к новым соединениям и их пролекарствам и/или фармацевтически приемлемым солям, фармацевтическим композициям, содержащим такие соединения, полезные при лечении таких заболеваний. В частности, данное изобретение относится к применению новых соединений и композиций для профилактики, устранения или лечения сердечно-сосудистых заболеваний, диабета, раковых заболеваний и ожирения через ингибирование малонилкофермент-А-декарбоксилазы (малонил-СоА-декарбоксилазы, MCD).
Уровень техники
Малонил-СоА является важным посредником метаболизма, продуцируемым в организме ферментом ацетил-СоА-карбоксилазой (АСС). В печени, адипоцитах и других тканях малонил-СоА является субстратом для синтазы жирных кислот (FAS). АСС и малонил-СоА обнаружены в ткани скелетных мышц и сердечной мышцы, где содержание синтазы жирных кислот низкое. Фермент малонил-СоА-декарбоксилаза (MCD, ЕС 4.1.1.9) катализирует конверсию малонил-СоА в ацетил-СоА и посредством этого регулирует содержание малонил-СоА. Описана MCD активность во многих организмах, в том числе, прокариотах, птицах и млекопитающих. Ее выделили в чистом виде из бактерий Rhizobium trifolii (An et al., J. Biochem. Mol. Biol., 32:414-418 (1999)), надхвостных желез водоплавающих птиц (Buckner et al., Arch. Biochem. Biophys., 177:539 (1976); Kim and Kolattukudy, Arch. Biochem. Biophys., 190:585 (1978)), митохондрий печени крысы (Kim and Kolattukudy, Arch. Biochem. Biophys., 190:234 (1978)), молочных желез крысы (Kim and Kolattukudy, Biochem. Biophys., Acta, 531:187 (1978)), β-клеток поджелудочной железы крысы (Voilley et al., Biochem. J., 340:213 (1999)) и гуся (Anser anser) (Jang et al., J. Biol. Chem., 264:3500 (1989)). Идентификация пациентов с дефицитом MCD привела к клонированию гена человека, гомологичного генам MCD гуся и крысы (Gao et al., J. Lipid. Res., 40:178 (1999); Sacksteder et al., J. Biol. Chem., 274:24461 (1999); FitzPatrick et al., Am. J. Hum. Genet., 65:318 (1999)). Методом Назерн-Блоттинга обнаруживают единственную мРНК MCD человека. Наивысшие уровни экспрессии мРНК обнаруживаются в мышечных и сердечной тканях, далее следуют печень, почки и поджелудочная железа с количествами, поддающимися обнаружению, во всех других исследованных тканях.
Малонил-СоА является сильным эндогенным ингибитором карнитин-пальмитоилтрансферазы-I (СРТ-I) - фермента, существенного для метаболизма длинноцепочечных жирных кислот. СРТ-I является ферментом, который ограничивает скорость окисления жирных кислот и катализирует образование ацилкарнитина, который переносится из цитозоля через митохондриальные мембраны ацилкарнитин-транслоказой. В митохондриях длинноцепочечные жирные кислоты снова переходят в форму СоА под действием комплементарного фермента СРТ-II, и в митохондриях ацил-СоА входит в каскад β-окисления, генерируя ацетил-СоА. В печени высокое содержание ацетил-СоА имеет место, например, после еды, что приводит к повышенному содержанию малонил-СоА, ингибирующего СРТ-I, что предотвращает метаболизм жиров и благоприятствует синтезу жиров. Напротив, низкое содержание малонил-СоА благоприятствует метаболизму жиров за счет переноса длинноцепочечных жирных кислот в митохондрии. Поэтому малонил-СоА является основным метаболитом, играющим ключевую роль в балансе (равновесии) синтеза и окисления жирных кислот (Zammit, Biochem. J., 343:5050-515 (1999)). Последние работы показывают, что MCD способен регулировать цитоплазматические, а также митохондриальные уровни малонил-СоА [Alam and Saggerson, Biochem. J., 334:233-241 (1998); Dyck et al., Am. J. Physiology, 275:H2122-2129 (1998)].
Хотя малонил-СоА присутствует в мышечных и сердечной тканях, в указанных тканях обнаружено только низкое содержание FAS. Полагают, что роль малонил-СоА и MCD в указанных тканях состоит в регулировании метаболизма жирных кислот. Это достигается через ингибирование малонил-СоА мышечной (М) и печеночной (L) изоформ СРТ-I, кодируемых разными генами (McGarry and Brown, Eur. J. Biochem., 244:1-14 (1997)). Мышечная изоформа более чувствительна к ингибированию малонил-СоА (IC50 0,03 мкМ), чем печеночная изоформа (IC50 2,5 мкМ). Описана регуляция СРТ-1 малонил-СоА в печени, сердце, склелетной мышце и β-клетках поджелудочной железы. Кроме того, также описана чувствительная к малонил-СоА ацил-СоА-трансферазная активность, присутствующая в микросомах, возможно, части системы, доставляющей ацильные группы в эндоплазматический ретикулум (Fraser et al., FEBS Lett., 446:69-74 (1999)).
Сердечно-сосудистые заболевания. Здоровое человеческое сердце использует доступные метаболические субстраты. Когда содержание глюкозы в крови высокое, поглощение и метаболизм глюкозы обеспечивают основной источник питания сердца. В состоянии голода липиды обеспечиваются жировыми тканями, и поглощение жирных кислот и метаболизм в сердце регулируются по типу отрицательной обратной связи с метаболизмом глюкозы. Регуляция промежуточного метаболизма сывороточными уровнями жирных кислот и глюкозы включает цикл глюкоза-жирная кислота (Randle et al., Lancet, 1:785-789 (1963)). При ишемических состояниях ограниченное поступление кислорода ослабляет как окисление жирных кислот, так и глюкозы, и снижает количество АТФ (АТР), образующегося за счет окислительного фосфорилирования в тканях сердца. В отсутствие достаточного количества кислорода гликолиз возрастает при попытке сохранить уровни АТФ и накопление лактата, и в результате снижается внутриклеточный рН. Энергия тратится на поддержание ионного гомеостаза, и имеет место гибель миоцитов как результат аномально низких уровней АТФ и нарушенной клеточной осмолярности. Кроме того, АМРК, активизировавшийся при ишемии, фосфорилируется и, таким образом, инактивирует АСС. Общее содержание сердечного малонил-СоА падает, поэтому возрастает активность СРТ-I, и окисление жирных кислот преобладает над окислением глюкозы. Благоприятным эффектом метаболических модуляторов в ткани сердца являются повышенная эффективность АТФ/моль кислорода для глюкозы по сравнению с жирными кислотами и, что более важно, повышенное сопряжение гликолиза с окислением глюкозы, проявляющееся в суммарном снижении протонной нагрузки в ишемической ткани.
Ряд клинических и экспериментальных исследований показывает, что сдвиг энергетического обмена в сердце в сторону окисления глюкозы является эффективным подходом к ослаблению симптомов, связанных с сердечно-сосудистыми заболеваниями, такими как миокардиальная ишемия (Hearse, "Metabolic approaches to ischemic heart disease and its management", Science Press), и другими. Некоторые прошедшие клинические испытания лекарственные средства против стенокардии, в том числе, пергексилен и амиодарон, ингибируют окисление жирных кислот через ингибирование СРТ-I (Kennedy et al., Biochem. Pharmacology, 52:273 (1996)). Показано, что лекарственные средства против стенокардии ранолазин, находящийся в фазе III клинических испытаний, и триметазидин ингибируют β-окисление жирных кислот (McCormack et al., Genet. Pharmac., 30:639 (1998); Pepine et al., Am. J. Cardiology, 84:46 (1999)). Показано, что триметазидин специфически ингибирует длинноцепочечную 3-кетоацил-СоА-тиолазу - существенный этап при оксилении жирных кислот (Kantor et al., Circ. Res., 86:580-588 (2000)). Дихлорацетат усиливает окисление глюкозы, стимулируя комплекс пируватдегидрогеназы и улучшает сердечную функцию у пациентов с белезнями венечной артерии (Wargovich et al., Am. J. Cardiol., 61:65-70 (1996)). Ингибирование активности СРТ-I через повышенное содержание малонил-СоА ингибиторами MCD может привести не только к новому, но также к более безопасному, по сравнению с другими известными ингибиторами СРТ-I с маленькими молекулами, способу профилактики и лечения сердечно-сосудистых заболеваний.
Большинство стадий, включенных в глицеролипидный синтез, происходит в цитозоле мембраны эндоплазматического ретикулума (ER) печени. Синтез триацилглицерина (TAG) для секреции в ER, из диацилглицерина (DAG) и ацил-СоА зависит от транспорта ацил-СоА через ER мембрану. Этот транспорт зависит от активности ацил-СоА трансферазы, чувствительной к малонил-СоА (Zammit, Biochem. J., 343:505 (1999); Abo-Hashema, Biochem., 38:15840 (1999); и Abo-Hashema, J. Biol. Chem., 274:35577 (1999)). Ингибирование биосинтеза TAG ингибитором MCD может улучшить липидный профиль крови и, следовательно, ослабить фактор риска для болезни коронарной артерии у пациента.
Диабет. Двумя метаболическими осложнениями, наиболее часто ассоциированными с диабетом, являются сверхпродуцирование кетонных телец в печени (в NIDDM) и интоксикации органов, связанные с длительным повышенным содержанием глюкозы. Ингибирование окисления жирных кислот может регулировать содержание глюкозы в крови и улучшает некоторые симптомы диабета по типу II. Ингибирование малонил-СоА СРТ-I является наиболее важным регуляторным механизмом, регулирующим скорость окисления жирных кислот при возникновении гипоинсулинемического-гиперглюкагонемического состояния. Некоторые необратимо и обратимо действующие ингибиторы СРТ-I оценивали на их способность регулировать содержание глюкозы в крови, и все они неизменно оказывались гипогликемическими (Anderson, Current Pharmaceutical Design, 4:1 (1998)). Специфический для печени и обратимо действующий ингибитор СРТ SDZ-ZPI-975 существенно снижает уровни глюкозы у здоровых голодавших в течение 18 часов приматов, не относящихся к человеку, и крыс, не вызывая сердечной гипертрофии (Deems et al., Am. J. Physiology, 274:R524 (1998)). Малонил-СоА играет важную роль в качестве сенсора (чувствительного элемента) относительной доступности глюкозы и жирных кислот в панкреатических β-клетках и, таким образом, связывает метаболизм глюкозы с клеточным энергетическим статусом и секрецией инсулина. Показано, что средство, усиливающее секрецию инсулина, повышает концентрацию малонил-СоА в β-клетках (Prenki et al., Diabetes, 45:273 (1996)). Однако, лечение диабета непосредственно ингибиторами СРТ-I приводит к механизму с сопутствующим отравлением печени и миокарда. Ингибиторы MCD, ингибирующие СРТ-I через повышение содержания своего эндогенного ингибитора малонил-СоА, являются, таким образом, более безопасными и превосходными для лечения диабета по сравнению с ингибиторами СРТ-I.
Раковые заболевания. Предполагается, что малонил-СоА является возможным медиатором цитотоксичности, вызванной ингибированием синтазы жирных кислот в клетках рака молочной железы человека и ксенотрансплантатах (Pizer et al., Cancer Res., 60:213 (2000)). Обнаружено, что ингибирование синтазы жирных кислот с использованием противоопухолевого антибиотика церуленина или синтетического аналога С75 заметно повышает содержание малонил-СоА в клетках рака молочной железы. С другой стороны, ингибитор синтазы жирных кислот TOFA (5-(тетрадецилокси)-2-фуранкарбоновая кислота), которая только подавляет уровень ацетил-СоА-карбоксилазы (АСС), не показывает какой-либо противоопухолевой активности, в то время как при этом содержание малонил-СоА снижается на 60% от контроля. Полагают, что повышенное содержание малонил-СоА ответственно за противоопухолевую активность таких ингибиторов синтазы жирных кислот. Таким образом, регулирование содержания малонил-СоА с использованием ингибиторов MCD составляет чрезвычайно важную терапевтическую стратегию в случае лечения раковых заболеваний.
Ожирение. Предполагается, что малонил-СоА может играть ключевую роль в сигнале о потребности в пище в головном мозге через ингибирование каскада реакций нейропептида Y (Loftus et al., Science, 288:2379 (2000)). Системное или интрацеребровентрикулярное введение мышам ингибитора синтазы жирных кислот (FAS) церуленина или С75 приводит к ингибированию потребления корма и значительной потере массы. Обнаружено, что С75 ингибирует экспрессию профагового сигнального нейропептида Y в гипоталамусе и действует в лептиннезависимой форме, что, как оказывается, опосредуется малонил-СоА. Следовательно, регулирование содержания малонил-СоА через ингибирование MCD представляет новый подход к профилактике и лечению ожирения.
О создании ингибиторов MCD для лечения сердечно-сосудистых заболеваний, диабета, рака или ожирения в литературе не сообщается. Авторы нашли новый ряд соединений, содержащих триазолы и оксазолы, члены которого являются сильными ингибиторами MCD. Соединения, испытанные как in vitro, так и in vivo, ингибируют активности малонил-СоА-декарбоксилазы и повышают концентрацию малонил-СоА в организме. Кроме того, в ходе эксперимента выбранные соединения индуцируют значительное усиление окисления глюкозы по сравнению с контролем в анализе с изолированным перфузированным сердцем крысы (McNeill, Measurement of Cardiovascular Function, CRC Press, 1997). Преимущественно, предпочтительные соединения изобретения, такие как в табл.3, № пп 16, и табл.8, № пп 7, обладают более выраженным действием по сдвигу метаболизма, чем известные модуляторы метаболизма, такие как ранолазин или триметазидин. Поэтому соединения изобретения и фармацевтическая композиция, содержащая такие соединения, полезны в медицине, в частности, при профилактике и лечении различных сердечно-сосудистых заболеваний, диабета, раковых заболеваний и ожирения.
Кроме того, такие соединения также полезны в качестве средства диагностики в случае болезней, связанных с дефицитом или нарушением функций MCD.
Краткое изложение сущности изобретения
Настоящее изобретение относится к новым соединениям, изображаемым структурами I и II, новым фармацевтическим композициям, содержащим такие соединения, и способам профилактики, устранения и лечения болезней метаболизма и болезней, модулированных ингибированием MCD. Соединения данного изобретения полезны для профилактики, устранения и лечения болезней, в том числе, метаболизма глюкоза/жирные кислоты, регулируемого малонил-СоА. В частности, такие соединения и фармацевтические композиции, содержащие указанные соединения, показаны при профилактике, устранении и лечении сердечно-сосудистых заболеваний, диабета, рака и ожирения. Кроме того, новые соединения и композиции данного изобретения, промежуточные соединения и способы, полезные для получения соединений изобретения, также входят в объем данного изобретения.
Настоящее изобретение также включает в свой объем способы диагностики для обнаружения болезней, связанных с дефицитом или нарушением функций MCD.
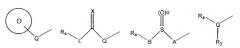
Соединения изобретения представляют приведенные далее структуры
где Y, C, R1, R2, R6 и R7 имеют значения, указанные ниже. В объем данного изобретения также входят соответствующие энантиомеры, диастереоизомеры, пролекарства и фармацевтически приемлемые соли указанных соединений. Другие аспекты данного изобретения станут очевидны из следующего описания данного изобретения. Итак, приведенное выше только суммирует некоторые аспекты изобретения не предназначается, и не должно рассматриваться, как какое-либо ограничение данного изобретения.
Подробное описание изобретения
Следующее далее подробное описание не предназначено быть исчерпывающим или для ограничения изобретения приведенными подробностями. Подробности выбраны и описаны для наилучшего понимания изобретения другими специалистами в данной области техники.
Настоящее изобретение относится к соединениям, представленным следующими формулами
где
Y выбирают из S или О; С представляет собой замещенное моноциклическое 5-7-членное кольцо, содержащее один-три гетероатома, где указанные гетероатомы выбирают из O, N или S, и где указанные заместители выбирают, независимо, из R1 и R2;
R1 и R2 являются разными, и каждый выбран, независимо, из водорода, галогена, гидрокси, нитро, циано, (С1-С12)-алкила, замещенного (С1-С12)-алкила, алкиламино, алкилсульфанила, арила, (С1-С12)-алкокси, замещенного (С1-С12)-алкокси, -С(Х)R3,
-CR11(V)R12, -CH2CR11(V)R12, -S(O)nR3, -NR4P(O)(R5)2, -P(O)(R5)2 или замещенного или незамещенного моноциклического 3-7-членного кольца, содержащего от нуля до трех гетероатомов, где указанные гетероатомы выбирают из O, N или S, и где указанные заместители выбирают, независимо, из R9; либо R1 и R2 могут представлять собой группу одной из приведенных далее формул
где цикл D является замещенным или незамещенным моноциклическим 3-7-членным кольцом, содержащим от нуля до трех гетероатомов, где указанные гетероатомы выбирают из O, N или S, и где указанные заместители выбирают, независимо, из R9, и R3 и R4, взятые вместе, могут образовывать замещенный или незамещенный моноциклическое 3-7-членное кольцо, содержащее от нуля до трех гетероатомов, где указанные гетероатомы выбирают из O, N или S, и где указанные заместители выбирают, независимо, из R9, либо R1 и R2, взятые вместе, могут образовывать замещенное или незамещенное 5-7-членное кольцо, содержащее от нуля до трех гетероатомов, выбранных из N, O или S, и где указанные заместители выбирают, независимо, из R9;
R3 выбирают из водорода, гидрокси, амино, (С1-С12)-алкила, замещенного (С1-С12)-алкила, алкиламино, арила, (С1-С12)-алкокси, замещенного (С1-С12)-алкокси или моноциклического 3-7-членного кольца, содержащего от нуля до трех гетероатомов, где указанные гетероатомы выбирают из O, N или S, и где указанные заместители выбирают, независимо, из R9;
R4 выбирают из водорода, (С1-С12)-алкила, замещенного (С1-С12)-алкила, арила или моноциклического 3-7-членного кольца, содержащего от нуля до трех гетероатомов, где указанные гетероатомы выбирают из O, N или S, и где указанные заместители выбирают, независимо, из R9;
R5 выбирают из водорода, (С1-С12)-алкила, замещенного (С1-С12)-алкила, алкиламино, алкокси, арила или моноциклического 3-7-членного кольца, содержащего от нуля до трех гетероатомов, где указанные гетероатомы выбирают из O, N или S, и где указанные заместители выбирают, независимо, из R9;
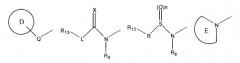
R6, который занимает или 5-ое, или 6-ое положение в структуре II, выбирают из -NR8P(O)(R5)2 или группы одной из следующих формул
где цикл D является замещенным моноциклическим 5-7-членным кольцом, содержащим один-три гетероатома, где указанные гетероатомы выбирают из O, N или S, и где указанные заместители выбирают, независимо, из R9, а цикл Е представляет собой замещенное 5-членное гетероароматическое кольцо или моноциклический 3-, 4-, 6- или 7-членный гетероцикл, содержащий один-три гетероатома, где указанные гетероатомы выбирают из O, N или S, и где указанные заместители выбирают, независимо, из R9, и Q выбирают из -NR8, -C(O)- или -О-;
R7 выбирают из водорода, (С1-С12)-алкила, (С1-С12)-алкокси, галогена, циано, SO2R4, SO2NR4R4,
или R7 и R6, взятые вместе, могут образовывать конденсированное замещенное 5-7-членное кольцо, содержащее от одного до трех гетероатомов, где указанные гетероатомы выбирают из N, O или S, и где указанные заместители выбирают из R9;
R8 выбирают из замещенного (С2-С12)-алкила, разветвленного (С3-С12)-алкила, ((С2-С6)-(алкилен))R14, -CH(CF3)2,
-CH((CF2)nCF3)n, -CH(CF3)R11, -CHR12(арила), -CHR11(гетероарила), -CHR11(гетероциклила), циклоалкила или моноциклического 3-7-членного кольца, содержащего от нуля до трех гетероатомов, где указанные гетероатомы выбирают из O, N или S, и где указанные заместители выбирают, независимо, из R9;
R9 выбирают из водорода, галогена, -CN, -C(O)CF3,
-S(O)nCF3, -C(O)CH2F, -CH(OH)CF3, -N(CN)2, -C(CN)3, -CHR10R11, (С1-С12)-алкила, замещенного (С1-С12)-алкила, -CF3, -(CF2)mCF3,
-CH(CF3)2, -CF(CF3)2, -SO3H, алкиламино, алкилсульфанила, арила, (С1-С12)-алкокси, замещенного (С1-С12)-алкокси, -С(Х)R10,
-CR11(V)R12, -CH2CR11(V)R12, -S(O)nR12, -S(O)2NHMe(OH), -S(O)2NH(2-тиазолила), -(4-оксо-2-тиоксотиазолидин-5-илидена), тетразолила, -СН2(1,1-диоксо-1лямбда*6*-тиоморфолин-4-ила),
-S(O)2CH2NO2, -S(O)2CH2S(O)2R12, -P(O)(OR11)R12, -NR11P(O)OR12,
-P(O)(NR11R12), замещенного или незамещенного моноциклического 3-7-членного кольца, содержащего один-три гетероатома, где указанные гетероатомы выбирают из О, N или S;
R10 выбирают из гидрокси, амино, NHCN, (С1-С12)-алкила, замещенного (С1-С12)-алкила, циклоалкила, алкиламино, (С1-С12)-алкокси, -CF3, гетероциклила, арила;
R11 выбирают из водорода, (С1-С12)-алкила, замещенного (С1-С12)-алкила, гетероциклила или арила;
R12 выбирают из (С1-С12)-алкила, замещенного (С1-С12)-алкила, гетероциклила или арила;
R13 выбирают из замещенного (С2-С12)-алкила, замещенного (С2-С12)-алкенила, замещенного (С2-С12)-алкинила, гетероциклила, простого алкилэфира, алкиламино и незамещенного или замещенного гетероарила или п-R9-замещенного фенила;
R14 выбирают из -COR3, R6;
А представляет собой связь, -NR5- или -CR4R5-;
В представляет собой связь, -NR4-, -CR4H-, -CR4(OH)- или
-CR4R5-;
G представляет собой -CH(CH2)m-, >C=CH-, -N(CH2)m-;
L представляет собой связь, -O-, -C(O)-, -NR5-, -CR4H-,
-CR4(OH)- или -CR4R5-, -NHNR5-;
Q представляет собой связь, -NR5-, -C(O)-, -O- или
-CR4R5-;
X представляет собой O, S, NR4, NOR4, NCN, NNO2, CR11NO2, CR11CN, C(CN)2, CR11R12 или N-NR11R12;
V представляет собой -ОН, -SH, -CN;
m равен нулю, единице, двум или трем;
n равен единице или двум;
их соответствующим энантиомерам, диастереоизомерам или таутомерам,
или фармацевтически приемлемым солям, или их пролекарствам в фармацевтически приемлемом носителе.
Как описано выше, соединения данного изобретения можно предоставить в виде пролекарств, примерами которых могут служить
В структуре III имеется дисульфидная связь, которая in vivo превращается в активную форму, т.е., структуру I. Структура IV описывает этиловый эфир, который in vivo превращается в соответствующую кислоту, т.е., форму -СО2Н.
Специалисту следует иметь в виду, что обозначение
описывает расположение заместителей Ri и Rj в любой доступной позиции в цикле, и любая позиция соотносится с другой, и что относительные позиции Ri и Rj в приведенном выше обозначении не предполагают ничего иного, кроме их положения в цикле. Указанное правило используется во всем данном описании для описания радикалов, которые можно располагать по любой доступной валентности, причем ничто иное не подразумевается.
Кроме того, что касается номенклатуры в данном описании, то соединения, названные точно, как правило, названы с использованием соглашения ИЮПАК, но в соединениях, строение которых описывается, используется следующая нумерация в цикле, независимо от соглашения ИЮПАК или гетероатомов, присутствующих в цикле:
Следовательно, содержат или нет соединения гетероатомы, такие как N, например, в 6-членной части цикла, радикалы, присоединенные к этой части цикла, описываются с помощью нумерации, указанной выше. Так, примерами гетероциклов являются
Правило нумерации, описанное выше, применяется, и, как правило, при описании делается ссылка на "структуру II", за исключением соединений, названных точно.
Существует несколько предпочтительных вариантов воплощения настоящего изобретения. Одним из таких предпочтительных вариантов является вариант, где Y в структурах I и II представляет собой атом серы. Другим таким предпочтительным вариантом является вариант, где цикл С в структуре I представляет собой или пиридин или пиримидин. Другим таким предпочтительным вариантом является вариант, где заместители R1 и R2 в структуре I занимают положение 5 или положение 6, как показывают следующие структуры:
В другом предпочтительном варианте заместитель R2 представляет собой водород или, в другом случае, отсутствует, и R1 присоединяется в положении 6, как показывают следующие структуры:
Другим таким предпочтительным вариантом является вариант, где цикл С представляет собой пиридин, заместитель R2 представляет собой водород или, в другом случае, отсутствует, и R1 присоединяется в положении 6, как показывают следующие структуры:
где заместитель R1 представляет собой группу одной из следующих формул:
Даже более предпочтительным вариантом является вариант, где R1 представляет собой группу, выбранную из групп одной из следующих формул:
Еще более предпочтительным вариантом является вариант, где в перечисленных выше функциональных группах R5' представляет собой водород, и R5 выбирают из разветвленного (С3-С12)-алкила, ((С2-С8)-(алкилен))R14, циклоалкила,
-СН2(гетероциклила), -СН2(арила), гетероциклила, и R4 представляет собой замещенный (С6-С12)-алкил, ((С2-С8)-(алкилен))R14, замещенный гетероарил, замещенный гетероциклил или п-R9-замещенный фенил. Предпочтительнее, R4 представляет собой замещенный 5-6-членный гетероциклил, R9-замещенный гетероарил или п-R9-замещенный фенил. Другим таким предпочтительным вариантом является вариант, где в структуре II заместитель R7 представляет собой водород, и R6 присоединяется в положении 6, как показывает структура
Более предпочтительным вариантом является вариант, где в вышеуказанной структуре R6 представляет собой группу, выбранную из групп одной из следующих формул:
Особенно предпочтительным вариантом является вариант, где R6 выбирают из разветвленного (С3-С12)-алкила, ((С2-С8)-(алкилен))R14, циклоалкила, -СН2(гетероарила),
-СН2(гетероциклила), гетероциклила, и R13 представляет собой замещенный (С6-С12)-алкил, ((С2-С8)-(алкилен))R14, гетероциклил, замещенный гетероарил или п-R9-замещенный фенил. Предпочтительнее, R13 в вышеуказанных функциональных группах представляет собой R9-замещенный гетероарил или п-R9-замещенный фенил.
Еще более предпочтительным вариантом является вариант, где R8 в вышеуказанных формулах представляет собой разветвленный (С3-С7)-алкил, в частности, изопропил или изобутил, (С3-С7)-циклоалкил, в частности, циклопропил, циклобутил, циклопентил и циклогексил, 5-6-членный гетероциклил, в частности, тетрагидропиранил, тетрагидрофуранил, пиперидинил и пирролининил, -СН2(гетероарил), в частности, метилпиридинил, метилтиазолил и метилизоксазолил, -СН2(гетероарил), в частности, метилтетрагидропиранил, метилтетрагидрофуранил, метилпиперидинил и метилпирролининил; и R13 представляет собой ((С2-С8)-(алкилен))R14, предпочтительнее, -(СН2)2-8R14, незамещенный гетероарил или R9-замещенный гетероарил, в частности, 5-6-членный гетероарил, например, пиридил и оксазолинил, тиофенил, и особенно предпочтительный R13 представляет собой п-R9-замещенный фенил.
Весьма предпочтительным вариантом воплощения изобретения является вариант, где в приведенных выше формулах R13 представляет собой п-R9-замещенный фенил, где наиболее предпочтительный R9 выбирают из -CN, -C(O)CF3, -S(O)nCF3,
-C(O)CH2F, -CH(OH)CF3, -N(CN)2, -C(CN)3, -CHR10R11, (С1-С12)-алкила, замещенного (С1-С12)-алкила, -CF3, -(CF2)mCF3, -CH(CF3)2, -CF(CF3)2, -SO3H, (С2-С12)-алкокси, замещенного (С2-С12)-алкокси, -С(Х)R10, -CR11(V)R12, -CH2CR11(V)R12, -S(O)nR12, -S(O)2NHMe(OH),
-S(O)2NH(2-тиазолила), -(4-оксо-2-тиоксотиазолидин-5-илидена), тетразолила, -СН2(1,1-диоксо-1лямбда*6*-тиоморфолин-4-ила),
-S(O)2CH2NO2, -S(O)2CH2S(O)2R12, -P(O)(OR11)R12, -NR11P(O)OR12,
-P(O)(NR11R12) или цикла, выбранного из
| присоединен в положении 1 или 2 | присоединен в положении 2, 4 или 5 | присоединен в положении 2, 4 или 5 | присоединен в положении 2, 4 или 5 |
| присоединен в положении 4 или 5 | присоединен в положении 2 или 4 | присоединен в положении 2 или 4 | присоединен в положении 4 или 5 |
Особенно весьма предпочтительным вариантом является вариант формулы
где R6 выбирают из
наиболее предпочтительный R8 выбирают из разветвленного (С3-С7)-алкила, (С3-С7)-циклоалкила, 5-6-членного гетероциклила, -(СН2)4-8R14, и наиболее предпочтительный R13 выбирают из R9-замещенного 5-6-членного гетероарила или п-R9-замещенного фенила, где наиболее предпочтительный R9 выбирают из F, Cl, Br, I, OH, -CN, -N(CN)2, -C(CN)3, -CF3, -(CF2)mCF3, -CH(CF3)2,
-CF(CF3)2, -SO3H, (С2-С12)-алкилсульфанила, (С2-С12)-алкокси, замещенного (С2-С12)-алкокси, -С(Х)R10, тетразолила, 3-гидроксиизоксазол-4-ила, 3-гидроксиизоксазол-5-ила, и наиболее предпочтительный R14 выбирают из -С(Х)R10, и Х представляет собой O, NH2, NCN, NNO2, где наиболее предпочтительный R10 выбирают из -ОН, амино, алкиламино, CF3, NHCN и 5-6-членного гетероциклила.
Композиции
Композиции настоящего изобретения содержат
(а) безопасное и терапевтически эффективное количество ингибирующего MCD соединения I или II, его соответствующего энантиомера, диастереоизомера или таутомера, или его фармацевтически приемлемой соли или его пролекарства; и
(b) фармацевтически приемлемый носитель.
Как описано выше, на многие заболевания можно действовать лечением, связанным с MCD. Таким образом, соединения данного изобретения полезны при лечении состояний с участием такой MCD-активности.
Соответственно, поэтому соединения данного изобретения можно вводить в фармацевтические композиции для применения в профилактике, устранении и лечении таких состояний. Используют стандартные способы получения фармацевтических композиций, описанные, например, в Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, PA.
"Безопасным и терапевтически эффективным количеством" соединения настоящего изобретения является количество, эффективное для ингибирования MCD в месте(ах) активности в организме субъекта в ткани или клетке, и предпочтительно - в организме животного, предпочтительнее - млекопитающего, без чрезмерного вредного побочного действия (такого как токсичность, раздражение или аллергическая реакция), соразмерное с разумным соотношением польза/риск, при использовании согласно данному изобретению. Конкретное "безопасное и терапевтически эффективное количество" будет, очевидно, изменяться в зависимости от таких факторов, как конкретное состояние, которое лечат, физическое состояние пациента, длительность лечения, характер сопутствующего лечения (если оно есть), конкретной используемой лекарственной формы, используемого носителя, растворимости соединения в нем и схемы приема, желательной для композиции.
Кроме целевого соединения композиции - предмет изобретения содержат фармацевтически приемлемый носитель. Термин "фармацевтически приемлемый носитель", используемый в данном описании, обозначает один или несколько совместимых твердых или жидких носителей, разбавителей или инкапсулирующих веществ, подходящих для введения млекопитающему. Термин "совместимый", используемый в данном описании, означает, что компоненты композиции способны смешиваться с целевым соединением и друг с другом таким образом, что осутствует взаимодействие, которое могло бы существенно снизить фармацевтическую эффективность композиции в обычных условиях применения. Фармацевтически приемлемые носители должны, конечно, быть достаточно чистыми и достаточно малотоксичными, чтобы отнести их к пригодным для введения, предпочтительно, животному, предпочтительно - млекопитающему, которое лечат.
Некоторыми примерами веществ, которые могут служить в качестве фармацевтически приемлемых носителей или их компонентов, являются сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и метилцеллюллоза; измельченный трагакант; солод; желатин; тальк; твердые смазывающие вещества, такие как стеариновая кислота и стеарат магния; сульфат кальция; растительные масла, такие как арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и масло какао; полиолы, такие как пропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль; альгиновая кислота; эмульгаторы, такие как твины; смачивающие вещества, такие как лаурилсульфат натрия; красители; отдушки; вещества, способствующие таблетированию, стабилизаторы; антиоксиданты; консерванты; апирогенная вода; изотонический физиологический раствор и фосфатные буферные растворы.
Выбор фармацевтически приемлемого носителя для применения в сочетании с целевым соединением определяется, в основном, способом, которым соединение следует вводить.
Если целевое соединение следует инъецировать, предпочтительным фармацевтически приемлемым носителем является стерильный физиологический раствор с суспендирующим веществом, совместимым с кровью, рН которого доведен до примерно 7,4. В частности, фармацевтически приемлемые носители для системного введения включают сахара, крахмалы, целлюлозу и ее производные, солод, желатин, тальк, сульфат кальция, растительные масла, синтетические масла, полиолы, альгиновую кислоту, фосфатные буферные растворы, эмульгаторы, изотонический физиологический раствор и апирогенную воду. Предпочтительными носителями для парентерального введения являются пропиленгликоль, этилолеат, пирролидон, этанол и кунжутное масло. Предпочтительно, фармацевтически приемлемый носитель в композициях для парентерального введения составляет по меньшей мере примерно 90 мас.% от всей композиции.
Композиции данного изобретения, предпочтительно, предоставляются в стандартной лекарственной форме. Термин "стандартная лекарственная форма", используемый в данном описании, относится к композиции данного изобретения, содержащей количество соединения, подходящее для введения животному, предпочтительно - млекопитающему, в однократной дозе согласно основательной медицинской практике. (Однако, препарат однократной или стандартной лекарственной формы не означает, что лекарственная форма вводится один раз в сутки или один раз на курс лечения. Предполагается, что такие лекарственные формы вводят один, два, три или более раз в сутки, и ожидается, что в курсе лечения они принимаются более одного раза, хотя конкретно однократное введение не исключается. Специалисту будет понятно, что композиция не предназначается конкретно для полного курса лечения, и такие решения, а не композиция, остаются за специалистами в данной области.) Такие композиции предпочтительно содержат от примерно 5 мг (миллиграмм), предпочтительнее - от примерно 10 мг до примерно 1