Производные бензодиазепина и лекарственное средство, их содержащее
Иллюстрации
Показать всеОписываются производные бензодиазепинов общей формулы (I)
где Х означает одинарную связь или этиндиильную группу, в которой в случае, когда Х означает одинарную связь, R1 означает галоид или фенил, необязательно замещенный галоидом, С1-С7алкилом; в случае, когда Х означает этиндиильную группу, R1 означает фенил, необязательно замещенный галоидом; R2 означает галоид, гидрокси, низший алкил, низший алкокси, гидроксиметил, гидроксиэтокси, низший алкокси(этокси)n (n=1-4), цианометокси, морфолин-4-ил, тиоморфолин-4-ил, 1-оксотиоморфолин-4-ил, 1,1-диоксотиоморфолин-4-ил, 4-оксопиперидин-1-ил, 4-(низш.)алкоксипиперидин-1-ил, 4-гидроксипиперидин-1-ил, 4-гидроксиэтоксипиперидин-1-ил, 4-(низш.)алкилпиперазин-1-ил, низший алкоксикарбонил, 2-ди-(низш.)алкиламиноэтилсульфанил, N,N-бис(низш.)алкиламино(низш.)алкил, (низш.)алкоксикарбонил(низш.)алкил, (низш.)алкилкарбокси(низш.)алкил, низший алкоксикарбонилметилсульфанил, карбоксиметилсульфанил, 1,4-диокса-8-азаспиро[4.5]дец-8-ил, карбокси(низш.)алкокси, циано(низш.)алкил, 2-оксо[1,3]диоксолан-4-ил(низш.)алкокси, (2-гидрокси(низш.)алкил)-(низш.)алкиламино, 2,2-диметилтетрагидро[1,3]диоксоло[4,5-с]пиррол-5-ил, (3R)-гидроксипирролидин-1-ил, 3,4-дигидроксипирролидин-1-ил, 2-оксооксазолидин-3-ил, карбамоилметил, карбокси(низш.)алкил, карбамоилметокси, гидроксикарбамоил(низш.)алкокси, низший алкоксикарбамоил(низш.)алкокси, (низш.)алкилкарбамоилметокси, R3 означает фенил, тиофенил, пиридинил, которые замещены галогеном, цианогруппой, карбамоилом, имидазолилом, 1,2,3-триазолилом, 1,2,4-триазолилом или изоксазолилом, где группы 1,2,3-триазолила, 1,2,4-триазолила или изоксазолила необязательно замещены C1-С7алкилом или C1-С7алкилсульфанилом, и их фармацевтически приемлемые соли. Описывается лекарственное средство, являющееся антагонистом группы II рецепторов mGlu, на основе соединения формулы (I). Технический результат - лекарственное средство может использоваться для лечения или предупреждения острых и/или хронических неврологических нарушений, включая психоз, шизофрению, болезнь Альцгеймера, нарушения познавательной способности и поражения памяти. 2 н. и 5 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к соединениям общей формулы I
где
Х означает одинарную связь или этиндиильную группу, в которой в случае, когда Х означает одинарную связь,
R1 означает галоид или фенил, который необязательно замещен галоидом, С1-С7алкилом;
в случае, когда Х означает этиндиильную группу,
R1 означает фенил, необязательно замещенный галоидом,
R2 означает галоид, гидрокси, низший алкил, низш. алкокси,
гидроксиметил, гидроксиэтокси, низший алкокси(этокси)n (n=1-4), цианометокси, морфолин-4-ил, тиоморфолин-4-ил, 1-оксотиоморфолин-4-ил, 1,1-диоксотиоморфолин-4-ил, 4-оксопиперидин-1-ил, 4-низшийалкоксипиперидин-1-ил, 4-гидроксипиперидин-1-ил, 4-гидроксиэтоксипиперидин-1-ил, 4-(низш.)алкилпиперазин-1-ил, низший алкоксикарбонил, 2-ди(низш.)алкиламиноэтилсульфанил, N,N-бис(низш.)алкиламино(низш.)алкил, (низш.)алкоксикарбонил(низш.)алкил, (низш.)алкилкарбокси(низш.)алкил, низший алкоксикарбонилметилсульфанил, карбоксиметилсульфанил, 1,4-диокса-8-азаспиро[4.5]дец-8-ил, карбокси(низш.)алкокси, циано(низш.)алкил, 2-оксо[1,3]диоксолан-4-ил(низш.)алкокси, (2-гидрокси(низш.)алкил)-(низш.)алкиламино, гидроксикарбамоил(низш.)алкокси, 2,2-диметилтетрагидро [1,3]диоксоло[4,5-с] пиррол-5-ил, низший алкоксикарбамоил(низш.)алкокси, (3R)-гидроксипирролидин-1-ил, 3,4-дигидроксипирролидин-1-ил, 2-оксооксазолидин-3-ил, низший алкилкарбамоилметокси, карбамоилметокси, карбамоилметил, карбокси(низш.)алкил;
R3 означает фенил, тиофенил или пиридинил, которые замещены галогеном, цианогруппой или карбамоилом, имидазолилом, 1,2,3-триазолилом, 1,2,4-триазолилом или изоксазолилом, где группы 1,2,3-триазолила, 1,2,4-триазолила или изаксозолила необязательно замещены С1-С7алкилом или С1-С7алкилсульфанилом
и их фармацевтически приемлемые соли.
Неожиданно оказалось, что соединения общей формулы I являются антагонистами метаботропных рецепторов глутамата. Соединения формулы I отличаются ценными терапевтическими свойствами.
В центральной нервной системе (ЦНС) передача стимула происходит путем взаимодействия нейромедиатора, который посылается нейроном, с нейрорецептором.
L-Глутаминовая кислота, наиболее часто встречающийся нейромедиатор в ЦНС, играет важную роль во многих физиологических процессах. Глутамат-зависимые рецепторы стимулов делятся на две основные группы. Первая основная группа образует контролируемые лигандом ионные каналы. Метаботропные рецепторы глутамата (mGluR) образуют вторую основную группу и, более того, принадлежат к семейству рецепторов, сопряженных с G-белком.
В настоящее время известны восемь различных членов этих mGluR, и некоторые из них даже имеют подтипы. На основании структурных параметров, различного влияния на синтез вторичных метаболитов и разного сродства к низкомолекулярным химическим соединениям эти восемь рецепторов можно подразделить на три подгруппы: к группе I принадлежат mGluR1 и mGluR5, к группе II принадлежат mGluR2 и mGluR3 и к группе III принадлежат mGluR4, mGluR6, mGluR7 и mGluRS.
Лиганды метаботропных рецепторов глутамата, принадлежащие к группе II, могут применяться для лечения или предупреждения острых и/или хронических неврологических нарушений, таких, как психоз, шизофрения, болезнь Альцгеймера, нарушения познавательной способности и поражения памяти.
В этой связи другими показаниями для лечения являются ограниченные функции мозга, вызванные операциями шунтирования или трансплантатами, плохое кровоснабжение мозга, травмы позвоночника, травмы головы, гипоксия, вызванная беременностью, остановка сердца и гипогликемия. Другими показаниями для лечения являются хроническая и острая боль, хорея Гентингтона, боковой амиотрофический склероз (ALS), деменция, вызванная СПИД, глазные травмы, ретинопатия, идиопатический паркинсонизм или паркинсонизм, вызванный лекарственными препаратами, а также состояния, которые приводят к глутамат-дефицитным функциям, как, например, мышечные спазмы, конвульсии, мигрень, недержание мочи, никотиновая зависимость, наркотическая зависимость, чувство тревоги, рвота, дискинезия и депрессия.
Целями по настоящему изобретению являются соединения формулы I и их фармацевтически приемлемые соли как таковые и в качестве фармацевтически активных веществ, их получение, препараты, основанные на соединении по изобретению, и их получение, а также применение соединений по изобретению для контроля или предупреждения заболеваний вышеупомянутого типа и соответственно для получения соответствующих препаратов.
Предпочтительными соединениями формулы I в объеме настоящего изобретения являются те, в которых R3 означает фенил, замещенный в мета-положении циано, галоидом; или имидазолилом, который необязательно замещен (низш.)алкилом или метилсульфанилом; 1,2,3-триазолилом, 1,2,4-триазолилом или изоксазолилом, который необязательно замещен (низш.)алкилом.
Примерами таких соединений являются следующие.
3-(8-Хлор-4-оксо-7-фенилэтинил-4,5-дигидро-3H-бензо[b][1,4]диазепин-2-ил)бензонитрил;
3-[8-(4-Метилпиперазин-1-ил)-4-оксо-7-фенилэтинил-4,5-дигидро-3H-бензо [b][1,4]диазепин-2-ил] бензонитрил;
3-(8-Хлор-4-оксо-7-фенил-4,5-дигидро-3H-бензо[b][1,4]диазепин-2-ил)бензонитрил;
Метиловый эфир [4-(3-цианофенил)-2-оксо-8-фенилэтинил-2,3-дигидро-1H-бензо[b][1,4]диазепин-7-илсульфанил]уксусной кислоты;
2-[4-(3-цианофенил)-2-оксо-8-фенилэтинил-2,3-дигидро-1H-бензо[b][1,4]диазепин-2-ил]диазепин-7-ил]ацетамид;
3-(8-Метокси-4-оксо-7-фенилэтинил-4,5-дигидро-3H-бензо[b][1,4] диазепин-2-ил] бензонитрил;
3-(8-Цианометил-4-оксо-7-фенилэтинил-4,5-дигидро-3H-бензо[b][1,4]диазепин-2-ил)бензонитрил;
4-(3-Йодфенил)-7-(2-метоксиэтокси)-8-фенилэтинил-1,3-дигидробензо[b][1,4]диазепин-2-он;
4-(3-Имидазол-1-илфенил)-7-(2-метоксиэтокси)-8-фенилэтинил-1,3-дигидробензо[b][1,4]диазепин-2-он;
[RS]-3-[4-Оксо-8-(2-оксо[1,3]диоксолан-4-илметокси)-7-фенилэтинил-4,5-дигидро-3H-бензо[b][1,4]диазепин-2-ил]бензонитрил;
7-Гидроксиметил-4-(3-имидазол-1-илфенил)-8-фенилэтинил-1,3-дигидробензо[b][1,4]диазепин-2-он;
[4-(3-Имидазол-1-илфенил)-2-оксо-8-фенилэтинил-2,3-дигидро-1H-бензо[b][1,4]диазепин-7-илокси]ацетонитрил;
8-(4-Фторфенилэтинил)-7-гидроксиметил-4-(3-имидазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он;
7-(2-Гидроксиэтокси)-4-(3-имидазол-1-илфенил)-8-фенилэтинил-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(4-Фторфенил)-7-[4-(2-гидроксиэтокси)пиперидин-1-ил]-4-(3-имидазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(4-Фторфенил)-7-гидрокси-4-(3-имидазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(2-Фторфенил)-7-метокси-4-[3-(2-метилимидазол-1-ил)фенил]-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(2-Фторфенил)-7-гидрокси-4-(3-[1,2,3]триазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(2-Фторфенил)-7-гидрокси-4-[3-(2-метилимидазол-1-ил)фенил]-1,3-дигидробензо [b][1,4]диазепин-2-он;
8-(2-Фторфенил)-7-гидрокси-4-[3-(2-метилсульфанилимидазол-1-ил)фенил]-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(2,5-Дифторфенил)-7-метокси-4-(3-[1,2,3]триазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он;
8-(2-Фторфенил)-7-гидрокси-4-[3-(3-метилизоксазол-5-ил)фенил]-1,3-дигидробензо [b][1,4]диазепин-2-он;
3-[7-(2,5-Дифторфенил)-8-гидрокси-4-оксо-4,5-дигидро-3H-бензо[b][1,4]диазепин-2-ил]бензонитрил;
8-(4-Фторфенилэтинил)-7-гидрокси-4-(3-имидазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он и
8-(4-Фторфенилэтинил)-7-гидрокси-4-(3-[1,2,3]триазол-1-илфенил)-1,3-дигидробензо[b][1,4]диазепин-2-он.
Предпочтительными являются также соединения формулы I, где R3 означает тиофенил, предпочтительно тиофен-2-ил, который необязательно замещен циано или галоидом; или R3 означает пиридинил, предпочтительно пиридин-4-ил, который необязательно замещен по положению 2 циано или галоидом, или где R3 означает тиазолил, который необязательно замещен по положению 2 имидазолилом или 4-метилимидазолилом.
Особенно предпочтительными являются следующие соединения.
5-[7-(2-Фторфенил)-8-метокси-4-оксо-4,5-дигидро-3H-бензо[b][1,4]диазепин-2-ил]тиофен-2-карбонитрил;
2-[7-(2-Фторфенил)-8-гидрокси-4-оксо-4,5-дигидро-1H-бензо[b] [1,4]диазепин-2-ил]тиофен-3-карбонитрил;
4-[7-(2-Фторфенил)-8-метокси-4-оксо-4,5-дигидро-3H-бензо[b][1,4]диазепин-2-ил]пиридин-2-карбонитрил;
4-[7-(4-Фторфенил)-8-гидрокси-4-оксо-4,5-дигидро-3Н-бензо[b][1,4]диазепин-2-ил]пиридин-2-карбонитрил;
4-[7-(2-Фторфенил)-8-гидрокси-4-оксо-4,5-дигидро-3H-бензо[b][1,4]диазепин-2-ил]пиридин-2-карбонитрил;
Все таутомерные формы соединений по изобретению также включены в него.
Термин «(низш.)алкил», использованный в настоящем описании, означает линейные или разветвленные углеводородные остатки с 1-7 атомами углерода, предпочтительно с 1-4 атомами углерода, такие, как метил, этил, н- пропил, изопропил и тому подобное.
Термин «(низш.)циклоалкил», использованный в настоящем описании, означает циклические насыщенные углеводородные остатки с 3-5 атомами углерода, предпочтительно с 3 атомами углерода, такие, как циклопропил.
Термин «(низш.)алкокси» означает (низш.)алкильный остаток в смысле вышеупомянутого определения, связанный через атом кислорода.
Термин «галоид» охватывает фтор, хлор, бром и йод.
Термин «5- или 6-членный арил или гетероарил» включает фенил, тиофенил, пиридин, частично гидратированный пиридин.
Выражение «пятичленный ароматический гетероцикл» включает фуран, тиазол, имидазол, пиразол, 1,3-тиазол, 1,3-оксазол, 1,2-оксазол, 1,2-тиазол, 1,2,3-триазол, 1,2,4-триазол, 1,2,4-оксадиазол, 1,2,3-оксадиазол, 1,2,4-тиадиазол, 1,2,3-тиадиазол и тетразол.
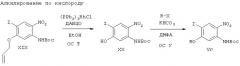
Соединения общей формулы I и их фармацевтически приемлемые соли могут быть получены в соответствии со следующими способами.
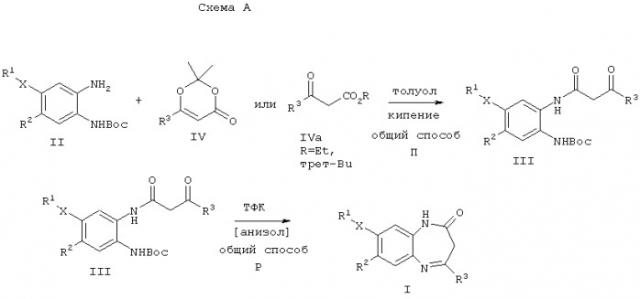
В соответствии со схемой А соединения общей формулы I, в которой X, R1, R2 и R3 имеют значения, описанные выше, могут быть получены из соединений общей формулы II с помощью последовательности реакций ацилирование-удаление защиты-циклизация.
Например, взаимодействие соединений общей формулы II с диоксиноном IV, в котором R3 имеет описанное выше значение, в инертном растворителе, таком, как толуол или ксилол, при повышенной температуре, предпочтительно между 80°С и 160°С приводит к соединениям общей формулы III.
Альтернативно соединения общей формулы III могут быть получены, например, реакцией соединения общей формулы II с β-кетоэфиром (общей формулы IVa), в которой R3 обозначено выше, используя те же самые условия, которые описаны для реакции с диоксинонами.
Впоследствии отщепление Вос(трет-бутилоксикарбонильной)-защитной группы в соединениях общей формулы III и сопутствующая циклизация деблокированного соединения дает требуемые соединения общей формулы I. В качестве альтернативы вместо Вос-группы может быть использована любая соответствующая аминозащитная группа, такая, как Fmoc (флуоренилметоксикарбонильная) или бензилоксикарбонильная (Z).
Этап деблокирование-циклизация может быть осуществлен обработкой соединений общей формулы III, например, кислотой Бренстеда, такой, как трифторуксусная кислота (ТФК), в инертном растворителе, таком, как дихлорметан (ДХМ). Предпочтительно реакцию проводят при температурах 0-50°С. Преимуществом может служить также применение анизола или 1,3-диметоксибензола в качестве ловушки карбокатиона в реакционной смеси.
ОС - общий способ
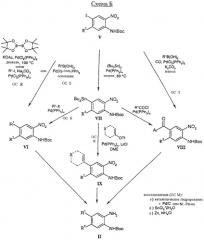
В соответствии со схемой Б соединения общей формулы II, в которой R1 имеет описанные выше значения для соединения, где Х означает одинарную связь, и R2 имеет описанные выше значения, могут быть получены различными путями, зависящими от природы R1 в йодсодержащих соединениях общей формулы V, в которой значения R2 описаны выше. Как показано на схеме Б, ключевыми этапами являются конденсации по типу реакций Сузуки и Штилле в присутствии или в отсутствие оксида углерода.
Точные условия для соответствующих соединений общей формулы II можно найти в экспериментальной части.
Соединения общей формулы V, в которой значения R2 такие, как описанные выше, могут быть получены различными способами, зависящими от индивидуального остатка R2.
Схема В
ОС Б, метод а: дифосген, этилацетат; затем трет.-бутанол
ОС Б, метод б: Вос2O, Cs2CO3, 2-бутанон, 52°С
ОС Б, метод в: i) Вос2О, ДМАП (диметиламинопиридин), ТГФ; ii) ДХМ, 0°C.
Как показано на схеме В, соединения общей формулы Va, в которых R2 означает (низш.)алкил, галоид или алкоксикарбонил, могут быть получены из известных соединений общей формулы XI йодированием и последующей защитой синтезированных промежуточных соединений общей формулы XII.
Этап йодирования может быть осуществлен, например, с использованием хлористого йода в уксусной кислоте в присутствии ацетата натрия. Реакция может быть проведена, например, при температурах 20-80°С.
Защита аминогруппы может быть достигнута, например, взаимодействием соединений общей формулы XII с ди-трет.-бутилкарбонатом в присутствии такого основания, как карбонат цезия. Реакцию можно проводить в полярных растворителях, таких, как ацетон или бутанон и тому подобное, при температурах 20-60°С.
Как показано на схеме Г, соединения общей формулы Vб и Vв, в которых R2 присоединен через атом серы или азота (например, R2 означает морфолин-4-ил, тиоморфолин-4-ил, диалкиламино, карбоксиметилсульфанил и т.д.), соответственно, могут быть получены из промежуточного производного XIII по реакции нуклеофильного замещения с соответствующими аминами или меркаптанами в присутствии подходящего основания.
ДИПЭА - диизопропилэтиламин
Реакцию предпочтительно проводят в полярном апротонном растворителе, таком, как диметилформамид, N-метилпирролидон или диметилсульфоксид и тому подобное. Основание может быть выбрано из стерически затрудненных аминов, таких, как основание Хюнига, алкоксидов, таких, как метилат натрия и трет.-бутилат, или гидридов, таких, как гидрид натрия. Реакцию можно проводить при температурах 20-110°С, в зависимости от индивидуального соединения, которое должно быть синтезировано.
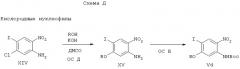
Соединения общей формулы Vг, в которой R2 присоединен через атом кислорода (например, R2 означает (низш.)алкокси, галоид(низш.)алкокси, (низш.)циклоалкокси, (низш.)алкокси(низш.)алкокси и т.д.), могут быть получены, как показано, например на схеме Д, по реакции нуклеофильного ароматического замещения с соответствующим спиртом в присутствии подходящего основания и с последующей защитой аминогруппы.
ОС Б, метод а: дифосген, этилацетат, 77°С, затем трет.-бутанол
ОС Б, метод б: i) Вос2О, ДМАП, ТГФ, ii) ТФК, ДХМ, 0°C
ДАБЦО - диазабицикло[2.2.2]октан
Основание может быть выбрано из класса оснований Бренстеда, таких, как гидроксид калия и тому подобное. Реакцию проводят предпочтительно в полярном апротонном растворителе, таком, как диметилформамид, N-метилпирролидон или диметилсульфоксид и тому подобное, при температурах 20-100°С.
Защита аминогруппы может быть осуществлена, например, взаимодействием соединений общей формулы XV с ди-трет.-бутоксикарбонатом в присутствии основания, такого, как карбонат цезия. Реакцию можно проводить в полярных растворителях, таких, как ацетон или бутанон и тому подобное, при температурах 20-60°С.
Другой способ осуществить этот этап защиты состоит в том, чтобы сначала превратить аминогруппу соединения общей формулы XV в изоцианат по реакции с фосгеном или эквивалентом фосгена в присутствии подходящего основания, который затем обрабатывают трет-бутиловым спиртом, получая требуемые соединения общей формулы Vг.
Другой подходящий способ для осуществления этого этапа защиты состоит в том, чтобы сначала превратить аминогруппу соединения общей формулы XV в соответствующее ди-Вос-производное по реакции с избытком ди-трет.-бутоксикарбоната в присутствии 4-диметиламинопиридина (ДМАП), которое затем обрабатывают 2 экв. ТФК в дихлорметане (ДХМ), получая требуемые соединения общей формулы Vг.
Данный обратный порядок этапов, а именно, осуществление сначала нуклеофильного ароматического замещения в ключевом промежуточном соединении XIV и затем защиты аминогруппы, как показано на схеме синтеза Д, может быть также применен к соединениям общей формулы Vб и Vв (схема синтеза Г).
Еще один способ получения соединений общей формулы Vг состоит в использовании О-аллильного производного XIX и осуществления последовательности реакций дезаллилирование-алкилирование, как показано на схеме Д. Дезаллилирование осуществляют предпочтительно изомеризацией, катализируемой переходным металлом, например, в присутствии солей родия(I), подобных, например, катализатору Вилкинсона [(PPh3)3RhCl], или солей палладия(II), таких, как [(PPh3)2PdCl2), сопровождающейся гидролизом образующегося простого винилового эфира водной кислотой. Пример этого способа можно найти в J. Org. Chem. 1973, 38, 3224. Алкилирование фенола XX в требуемое соединение общей формулы Vг можно осуществить с помощью электрофильных реагентов общей формулы R-X, в которой R имеет значение (низш.)алкила, (низш.)алкенила, алкилацетата или бензила, и Х означает уходящую группу, например, анион йода, брома, метансульфонат или толилсульфонат, в соответствующем растворителе в присутствии основания. Предпочтительно реакцию проводят в полярном апротонном растворителе, например, в хлорированных растворителях, таких, как дихлорметан, хлороформ или дихлорэтан, или в амидах, например, диметилформамиде, диметилацетамиде и N-метилпирролидоне, или в сульфоксидах, например, диметилсульфоксиде. Основание может быть выбрано из стерически затрудненных аминов, таких, как основание Хюнига, алкоксидов, таких, как метилат натрия и трет.-бутилат, гидридов, таких, как гидрид натрия, гидроксидов, таких, как гидроксид калия, карбонатов, таких, как карбонат калия, или кислых карбонатов, таких, как бикарбонат калия. Реакцию можно проводить при температурах -20-80°С, зависящих от отдельных соединений, которые должны быть синтезированы. Для синтеза О-трет.-бутилпроизводных общей формулы Vг фенол XX может быть обработан ди-трет.-бутилацеталем ДМФА в толуоле или бензоле при 80°С, как описано в Synthesis, 1983, 135.
В соответствии со схемой синтеза Е
ОС - общий способ
ОТГП - О-тетрагидропиранил
соединения общей формулы Vд и Ve, в которых R2 присоединен через атом углерода (R2 означает, например, (низш.)алкилоксикарбонилметил, цианометил и т.д.), могут быть получены из соединения XIII или XIV, например, реакцией с эфиром или полуэфиром малоновой кислоты в присутствии основания с последующим удалением одной из алкилкарбоксилатных групп путем декарбоксилирования. Точные условия реакции изменяются в зависимости от природы отдельных соединений и описаны в примерах.
Ключевые промежуточные производные XIII и XIV могут быть получены, как уже описано на схеме В.
Для соединений, содержащих одноуглеродный заместитель, общей формулы Vз-Vм синтез начинают из известного метилового эфира 3-амино-4-нитробензойной кислоты. Стандартное йодирование, как описано на схеме синтеза В, приводит к йодиду XXI, который, в свою очередь, может быть защищен с помощью Вос-группы. Восстановление метилового эфира может, например, быть осуществлено обработкой боргидридом лития, боргидридом натрия или гидридом диизобутилалюминия в апротонном растворителе, например, ТГФ, эфире или толуоле. Присутствие спирта, такого, как метанол, этанол или изопропанол, может быть полезным. Предпочтительно восстановление осуществляют при температурах между -20°С и 0°С. Дальнейшие преобразования функциональных групп, как, например, превращение образующегося производного бензилового спирта Vз в хлорид (Vл), происходят стандартными способами, известными специалистам. Точные условия реакции изменяются в зависимости от природы отдельных соединений и описаны в примерах.
В соответствии со схемой Ж соединения общей формулы II, в которой R1 имеет описанные выше значения для соединений, где Х означает этиндиильную группу, могут быть получены различными способами из йодпроизводного V, зависящими от природы заместителей R1 и R2. Как показано на схеме Ж, превращение может осуществляться, например,
(а) непосредственным присоединением алкиндиильного заместителя R1 к соединению общей формулы V путем конденсации по типу реакции Соногашира с последующим восстановлением нитрогруппы или
(б) двухстадийными конденсациями по типу реакции Соногашира, в которых сначала триметилсилилацетилен конденсируют с соединением общей формулы V с образованием после удаления защиты с гидроксидом натрия в метаноле промежуточного производного XVIII, которое затем может быть превращено с помощью второй конденсации по типу реакции Соногашира с соответствующим реагентом R1-I, R1-Br или R1-OSO2CF3 и восстановления нитрогруппы в требуемое соединение общей формулы II.
Точные условия для соответственных соединений можно найти в экспериментальной части.
ЛДА - диизопропиламид лития
ТФА - трифторуксусный ангидрид
В соответствии со схемой 3 диоксиноновые и β-кетоэфирные строительные блоки общей формулы IV и Va могут быть получены способами, известными специалистам, из соответствующих производных карбоновых кислот R3-COR, т.е., свободных кислот, метиловых или этиловых эфиров и хлорангидридов. Точные условия для соответствующих соединений можно найти в экспериментальной части.
Другой синтетический способ для получения соединений общей формулы I, в которой R1, R2 и Х имеют значения, описанные выше, и R3 означает карбамид общей формулы C(O)NR4R5, в которой R4 и R5 означают водород, (низш.)алкил, или R4 и R5 вместе образуют остаток морфолина или
N-метилпиперазин, приведен на схеме И:
дффп - дифенилфосфинополистирол
Точные условия для соответствующих соединений можно найти в экспериментальной части.
Фармацевтически приемлемые соли также могут быть легко получены в соответствии со способами, по сути известными, принимая во внимание природу соединения, которое должно быть превращено в соль. Пригодными для образования фармацевтически приемлемых солей основных соединений формулы I являются неорганические или органические кислоты, такие, как, например, хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота или лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, n-толуолсульфоновая кислота и тому подобное. Соединения формулы I и их фармацевтически приемлемые соли являются антагонистами метаботропных рецепторов глутамата и могут применяться для лечения или предупреждения острых и/или хронических неврологических нарушений, таких, как психоз, шизофрения, болезнь Альцгеймера, нарушения познавательной способности и поражения памяти. Другими показаниями для лечения являются ограниченная функция мозга, вызванная операциями шунтирования или трансплантатами, плохое кровоснабжение мозга, повреждения спинного мозга, повреждения головы, гипоксия, вызванная беременностью, остановка сердца и гипогликемия. Другие показания для лечения составляют острые и хронические боли, хорея Гентингтона, боковой амиотрофический склероз (ALS), деменция, вызванная СПИД, повреждения глаза, ретинопатия, идиопатический паркинсонизм или паркинсонизм, вызванный лекарственными препаратами, а также состояния, которые приводят к глутамат-дефицитным функциям, таким, как, например, мышечные спазмы, конвульсии, мигрень, недержание мочи, никотиновая зависимость, психозы, наркотическая зависимость, чувство тревоги, рвота, дискинезия и депрессия.
Соединения формулы I и их фармацевтически приемлемые соли могут применяться в качестве лекарственных средств, например в виде фармацевтических препаратов. Фармацевтические препараты могут быть введены перорально, например, в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение может быть также осуществлено ректально, например, в форме суппозиториев, или парентерально, например, в форме инъекционных растворов.
Для получения фармацевтических препаратов соединения формулы I и их фармацевтически приемлемые соли могут быть подвергнуты обработке с фармацевтически инертным неорганическим или органическим носителями. Лактоза, кукурузный крахмал или их производные, тальк, стеариновая кислота или ее соли и тому подобное могут применяться, например, в качестве таких носителей для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. Соответствующими носителями для мягких желатиновых капсул являются, например, растительные масла, воска, жиры, полутвердые и жидкие полиолы и тому подобное; однако в случае мягких желатиновых капсул в зависимости от природы активного вещества обычно не требуются никакие носители. Подходящими носителями для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и тому подобное. Для водных инъекционных растворов водорастворимых солей соединений формулы I могут использоваться вспомогательные вещества, такие, как спирты, полиолы, глицерин, растительные масла и тому подобное, но, как правило, это не является необходимостью. Соответствующими носителями для суппозиториев являются, например, природные или затвердевшие масла, воска, жиры, полужидкие или жидкие полиолы и тому подобное.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, отдушки, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут содержать также и другие терапевтически ценные вещества.
Как упоминалось ранее, лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный наполнитель, также являются целью настоящего изобретения, как и способ получения таких лекарственных средств, который включает объединение одного или нескольких соединений формулы I или их фармацевтически приемлемых солей и, при необходимости, одного или нескольких ценных веществ в лекарственной дозированной форме вместе с одним или несколькими терапевтически инертными носителями.
Дозированная форма может меняться в широких пределах и, безусловно, будет соответствовать индивидуальным требованиям в каждом отдельном случае. В общем, эффективная доза для перорального или парентерального введения находится между 0,01-20 мг/кг/день, причем доза 0,1-10 мг/кг/день предпочтительна для всех описанных показаний. Дневная доза для взрослого человека с массой 70 кг находится между 0,7-1400 мг/день, предпочтительно между 7-700 мг/день.
Настоящее изобретение относится также к применению соединений формулы I и их фармацевтически приемлемых солей для получения лекарственных средств, особенно для контроля или предупреждения острых и/или хронических неврологических нарушений вышеупомянутого типа.
Соединения по настоящему изобретению являются антагонистами группы II рецепторов mGlu. Соединения проявляют активность, измеренную в описанных ниже опытах, при концентрации 50 мкМ или менее, типично 3 мкМ или менее и идеально 0,5 мкМ или менее. Ниже в таблице приведены некоторые специфические значения pKi предпочтительных соединений.
Связывание [3H]-LY354740 на трансфицированных mGlu2 мембранах клеток СНО (яичника китайского хомячка)
Трансфекция и клеточная культура
Получали от профессора S. Nakanishi (Kyoto, Japan) кДНК, кодирующую белок крысиного рецептора mGlu2, в векторе pBluescript II и субклонировали в эукариотический экспрессионный вектор pcDNA I-amp от фирмы Invitrogen (NV Leek, The Netherlands). Эту векторную конструкцию (pcDlmGR2) трансфицировали вместе с плазмидой psvNeo, кодирующей ген устойчивости к неомицину, в клетки СНО с помощью модифицированного кальций-фосфатного метода, описанного Chen и Okayama (1988). Клетки поддерживали в модифицированной по способу Дульбекко среде Игла с восстановленным L-глутамином (конечная концентрация 2 мМ) и 10% диализованной эмбриональной телячьей сывороткой от фирмы Gibco BRL (Base, Switzerland). Селекцию проводили в присутствии G-418 (конечная концентрация 1000 мкг/мл). Клоны идентифицировали обратной транскрипцией 5 мкг общей РНК, сопровождаемой ПЦР (полимеразной цепной реакцией) с использованием специфических праймеров рецептора mGlu2 5'-atcactgcttgggtttctggcactg-3' и 5'-agcatcactgtgggtggcataggagc-3' в 60 мМ трис-HCl (рН 10), 15 мМ (NH4)2SO4, 2 мМ MgCl2, 25 ед./мл полимеразы Taq с 30 циклами отжига при 60°С в течение 1 мин, растяжения при 72°С в течение 30 сек и денатурации в течение 1 мин при 95°С.
Мембранный препарат
Клетки, культивированные, как описано выше, собирали и трижды промывали холодным ЗФР (забуференным фосфатом физиологическим раствором) и замораживали при -80°С. Осадок вновь суспендировали в холодном 20 мМ буфере HEPES-NaOH (N-[2-гидроксиэтил]пиперазин-N'-[4-бутансульфоновая кислота]-NaOH), содержащем 10 мМ EDTA (этилендиаминтетрауксусную кислоту) (рН 7,4), и гомогенизировали с помощью политрона (Kinematica, AG, Littau, Switzerland) в течение 10 сек при 10000 об/мин. После центрифугирования в течение 30 мин при 4°С осадок промывали один раз тем же самым буфером и один раз 20 мМ буфером HEPES-NaOH, содержащим 0,1 мМ EDTA (рН 7,4). Содержание белка измеряли, используя метод Пирса (Socochim, Lausanna, Switzerland) и бычий сывороточный альбумин в качестве стандарта.
Связывание [3H]LY354740
После оттаивания мембраны снова суспендировали в холодном 50 мМ буфере трис-HCl, содержащем 2 мМ MgCl2 и 2 мМ CaCl2 (рН 7) (буфер связывания). Конечная концентрация мембран в анализах составила 25 мкг/мл. Эксперименты по ингибированию проводили с мембранами, инкубированными с 10 нМ [3H]-LY354740 при комнатной температуре в течение 1 ч в присутствии различных концентраций исследуемого соединения. После инкубации мембраны отделяли на стекловолоконных фильтрах Whatmann GF/C и промывали 5 раз холодным буфером связывания. В присутствии 10 мкМ DCG IV не отмечено никакого специфического связывания. После переноса фильтров в пластиковые флаконы, содержащие 10 мл сцинтилляционной жидкости Ultima-gold (Packard, Zürich, Switzerland), радиоактивность измеряли с помощью жидкостной сцинтилляции в счетчике Tri-Carb 2500 TR (Packard, Zürich, Switzerland).
Анализ данных
Кривые ингибирования соответствовали четырехпараметровому логистическому уравнению, дающему значения IC50 и коэффициенты Хилла.
Примеры
Следующие примеры относятся к получению трет.-бутиловых эфиров (4-йод-2-нитрофенил)карбаминовой кислоты (схема синтеза В).
Общий способ А
Получение 4-йод-2-нитроанилинов йодированием 2-нитроанилинов (в соответствии с Wilson J. Gerald. Hunt Frederick C. Austr. J. Chem. 1983, 36, 2317-25).
К перемешиваемому раствору 2-нитроанилина (1,0 моль) в уксусной кислоте (500 мл), содержащему безводный ацетат натрия (93-103 г, 1,125-1,25 моля), прибавляли монохлорид йода (59-66 мл, 1,125-1,25 моля) в уксусной кислоте (300 мл) в течение 60 мин. Реакционную смесь нагревали до определенной температуры, пока тонкослойная хроматография (ТСХ) не показала полного превращения исходного материала, перемешивали еще 30 мин при 23°С, затем медленно разбавляли водой (1000 мл), что вызвало отделение кристаллического продукта. Перемешивание продолжали в течение 1 ч, продукт отфильтровывали, промывали от уксусной кислоты и сушили в вакууме при 60°С.
Пример А1
5-Хлор-4-йод-2-нитрофениламин
Получали из 5-хлор-2-нитроанилина йодированием с монохлоридом йода в смеси уксусная кислота-ацетат натрия в соответствии с общим способом А (80°С). Получали продукт в виде оранжевого твердого вещества.
МС (масс-спектр) (ИЭ) (ионизация с электрораспылением): 298 (М+) и 300 [(М+2)+]; tпл. 202-203°C (разл.).
Пример А2
4-Йод-5-метил-2-нитрофениламин
Получали из 5-метил-2-нитроанилина йодированием с монохлоридом йода в смеси уксусная кислота-ацетат натрия в соответствии с общим способом А (80°С). Получали продукт в виде красного твердого вещества.
МС (ИЭ): 278 (М+); tпл 154°C (разл.).
Пример A3
Метиловый эфир 5-амино-2-йод-4-нитробензойной кислоты
Получали из метилового эфира 3-амино-4-нитробензойной кислоты (22,25 г) {CAS-№ [99512-09-1], полученного в две стадии следующим образом: 3-гидрокси-4-нитробензойную кислоту (30 г, 164 ммоля), хлористого аммония (21,91 г, 410 ммолей) в 25% водном аммиаке (180 мл) нагревали в стальном автоклаве при 160°С в течение 7 ч (внутреннее давление 2,3 МПа). Охлаждали до 23°С и упаривали досуха. Растворяли в воде (200 мл), доводили значение рН до 1 с концентрированной серной кислотой, насыщали хлоридом натрия и экстрагировали этилацетатом (6×750 мл), объединенные органические слои сушили над MgSO4. Фильтрование и удаление растворителя в вакууме дали достаточно чистую З-амино-4-нитробензойную кислоту (22,26 г, 75%) в виде оранжевого твердого вещества. Данный материал суспендировали в метаноле (500 мл), прибавляли концентрированную серную кислоту (3 мл), смесь нагревали до 65°С в течение 2,5 дней. Растворитель удаляли в вакууме, твердый остаток растворяли в этилацетате, промывали насыщенными растворами бикарбоната натрия и соли, затем сушили над MgSO4. Удаление растворителя дало достаточно чистый метиловый эфир З-амино-4-нитробензойной кислоты (22,25 г, 93%) в виде оранжевого твердого вещества йодированием с монохлоридом йода в смеси уксусная кислота-ацетат натрия в соответствии с общим способом А (35°С). Получали продукт в виде оранжевого твердого вещества (29,38 г, 80%).
МС (ИЭ): 322 (М+); tпл. 168°С (разл.).
Общий способ Б
Получение трет.-бутиловых эфиров (2-нитрофенил)карбаминовых кислот из 2-нитроанилинов
Метод а: к раствору дифосгена (4,1 мл, 34,1 ммоля) в этилацетате (40 мл) при 0°С прибавляли раствор 4-йод-2-нитроанилина (45,5 ммоля) в этилацетате (200-500 мл), смесь нагревали при кипении в течение 18 ч. Растворитель удаляли в вакууме, получая коричневое твердое вещество, которое обрабатывали горячим гексаном (200 мл). Твердый материал отделяли фильтрованием, фильтрат концентрировали при пониженном давлении, получая чистый 4-йод-2-нитрофенилизоцианат в виде желтого твердого вещества. Данный материал нагревали при кипении в смеси избытка трет.-бутанола в метиленхлориде в течение 2,5 ч. Удаление растворителя дало оранжевое твердое вещество, которое очищали колоночной хроматографией на силикагеле со смесью гексан/этилацетат, получая трет.-бутиловый эфир (4-йод-2-нитрофенил)карбаминовой кислоты в виде желтого твердого вещества.
Метод б: к смеси 4-йод-2-нитроанилина (142 ммоля) и карбоната цезия (55,5 г, 170 ммолей) в 2-бутаноне (740 мл) прибавляли по каплям раствор Вос2О (37,8 г, 173 ммоля) в 2-бутаноне (170 мл), полученную смесь перемешивали при 52°С в течение 26 ч. Растворитель удаляли в вакууме, остаток обрабатывали смесью воды (240 мл) и метанола (240 мл) и экстрагировали гексаном (3×500 мл). Объединенный гексановый слой промывали насыщенным раствором соли (200 мл), все водные слои вновь экстрагировали гексаном (300 мл). Все объединенные гексановые слои сушили над MgSO4, фильтровали, растворитель упаривали в вакууме, получая оранжевое твердое вещество, которое очищали колоночной хроматографией на силикагеле со смесью гексан/этилацетат, получая трет.-бутиловый эфир (4-йод-2-нитрофенил)карбаминовой кислоты в виде желтого твердого вещества.
Метод в: к раствору 4-йод-2-нитроанилина (550 ммолей) и ДМАП (1,22 г, 10 ммолей) в ТГФ (1000 мл) при 23°С прибавляли по каплям в течение 70 мин раствор Вос2О (246 г, 1128 ммолей) в ТГФ (500 мл) и продолжали перемешивание при 23°С в течение 75 мин. Всю смесь упаривали досуха и сушили в высоком вакууме, получая темно-коричневое твердое вещество (253,59 г). Данный материал растворяли в ДХМ (1100 мл), охлаждали до 0°С и прибавляли по каплям ТФК (84 мл, 1100 ммолей). Смесь перемешивали при 0°С в