Профилактическое или терапевтическое средство и фармацевтическая композиция, содержащая гетероциклическое соединение
Иллюстрации
Показать всеНастоящее изобретение относится к профилактическому или терапевтическому средству против гиперлипидемии, содержащему в качестве активного ингредиента гетероциклическое соединение формулы [1] или его фармацевтически приемлемую соль:
где: R1 представляет арил, необязательно замещенный одинаковыми или различными одной-тремя группами, выбранными из алкила, галогеналкила, тригалогеналкила, алкокси, галогена; Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5]:
где Х представляет кислород, серу или NR6; R6 представляет водород или алкил; R2 представляет водород, алкил или тригалогеналкил; D представляет алкилен, алкенилен; и Е представляет группу формулы [3] или [4]:
где Y представляет кислород или серу; R3 и R4 являются одинаковыми или различными, и каждый представляет водород или алкил; р равно 1; Z представляет карбокси, алкоксикарбонил, циано или 1Н-5-тетразолил, а также к новым соединениям, принадлежащим к группе перечисленных выше гетероциклических соединений формулы [1], которые обладают действием, снижающим уровень триглицеридов в крови; действием, снижающим уровень холестерина липопротеинов низкой плотности (ЛНП-Х) в крови; действием, снижающим уровень глюкозы в крови, и действием, снижающим уровень инсулина в крови, либо действием, повышающим уровень ЛВП-Х в крови, или действием, снижающим атерогенный индекс, и поэтому они могут быть использованы для предупреждения или лечения гиперлипидемии, артериосклероза, ишемической болезни сердца, инфаркта головного мозга, реокклюзии после чрескожной внутрипросветной коронарной ангиопластики (ЧВКА), сахарного диабета и ожирения. 10 н. и 19 з. п. ф-лы, 1 табл.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к новым гетероциклическим соединениям и к их фармацевтически приемлемым солям.
Соединения настоящего изобретения обладают действием, снижающим уровень триглицеридов в крови, действием, снижающим уровень холестерина липопротеинов низкой плотности (называемого далее «ЛНП-Х»), а также действием, снижающим уровень глюкозы в крови, действием, снижающим уровень инсулина в крови, или действием, повышающим уровень холестерина липопротеинов высокой плотности (называемого далее «ЛВП-Х»), и действием, уменьшающим атерогенный индекс, который представляет собой отношение не-ЛНП-Х к ЛВП-Х и который вычисляют по формуле: (общий холестерин - ЛВП-Х)/ (ЛВП-Х). Следовательно, соединения настоящего изобретения могут быть использованы для предупреждения и лечения коронарной болезни сердца, инфаркта головного мозга, гиперлипидемии, артериосклероза или сахарного диабета.
Предпосылки создания изобретения
Синдром резистентности к инсулину, осложненный нарушением углеводного и/или липидного метаболизма и гипертензией, привлекает особое внимание специалистов как фактор очень высокого риска возникновения ишемической болезни сердца. Синдром резистентности к инсулину обнаруживается у большинства пациентов, страдающих ожирением и инсулин-независимым сахарным диабетом (ИНСД). Известно, что нарушение метаболизма липидов приводит к увеличению уровня триглицеридов в крови, которое обусловлено, главным образом, повышением уровней хиломикрона, липопротеинов очень низкой плотности и остаточных липопротеинов, которые являются их промежуточными метаболитами, а также снижением уровней ЛВП-Х (Diabetes, 37, 1595-1607 (1988); Arch. Intern. Med., 149, 1514-1520 (1989); Diabetes Care, 14, 173-194 (1991)).
Хотя часто указывалось, что уровень триглицерида является, вероятно, важным фактором риска заболеваний артериосклерозом, однако, явного соответствия между ними не было установлено. На основании недавно полученных результатов артериографии (Circulation, 90, 2230-2235 (1994)) сообщалось, что указанный уровень триглицеридов является независимым фактором риска возникновения ишемической болезни сердца.
Хорошо известно, что уровень ЛВП-Х обратно пропорционален заболеваемости ишемической болезнью сердца, как было выявлено из результатов серии эпидемиологических исследований (Circulation, 79, 8-15 (1989)). Предполагается, что ЛВП участвует в обратном транспорте холестерина в печень из внепеченочных тканей, и в экспериментах на животных, используемых в качестве моделей, было продемонстрировано, что он обладает действием, направленным против артериосклероза (J. Clin. Invest., 85, 1234-1241 (1990); Nature, 353, 265-267 (1991)).
В результате широкомасштабных испытаний по коррекции уровня холестерина было подтверждено, что уровень общего холестерина в крови, а в частности, уровень ЛНП-Х, положительно коррелирует с заболеваемостью ишемической болезнью сердца, и эта заболеваемость может быть снижена путем уменьшения указанного уровня (Lipid Research Clinics Program: JAMA, 251, 351 (1984); Lipid Research Clinics Program: JAMA, 251, 365 (1984)).
В соответствии с этим, соединения, которые способствуют уменьшению уровня триглицеридов и ЛНП-Х в крови, а также увеличению уровня ЛВП-Х или снижению атерогенного индекса, могут быть использованы в качестве лекарственного средства для лечения артериосклероза, особенно для предупреждения или лечения ишемической болезни сердца. Кроме того, ожидается, что соединения, которые повышают резистентность к инсулину, способствуют снижению уровня глюкозы в крови и уровня инсулина в крови и улучшению патологических состояний при таких осложнениях, как сахарный диабет, гиперинсулинемия, гипертензия и ожирение, которые могут быть факторами риска возникновения артериосклеротических заболеваний, и поэтому обладают эффективной превентивной или терапевтической активностью, направленной против артериосклероза.
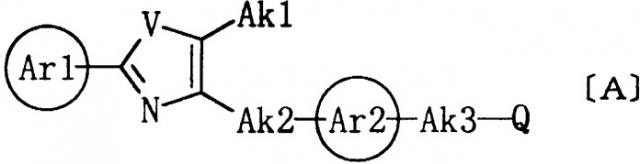
В настоящее время известно, что 2-арил-5-алкилоксазольные производные или 2-арил-5-алкилтиазольные производные общей формулы (А), которые имеют некоторое сходство с соединениями настоящего изобретения, обладают действием, снижающим уровень липидов в крови, или действием, снижающим уровень глюкозы в крови.
где кольцо Ar1 представляет арил; V представляет кислород или серу; Ak1 представляет водород, алкил или галогеналкил; Ak2 представляет алкилен; Ak3 представляет алкилен, алкенилен или алкинилен, необязательно замещенные алкокси, алкоксикарбонилом, ацилтио, ациламино или арилом; Q представляет карбокси, 2,4-оксазолиндион-5-ил, 2,4-тиазолиндион-5-ил или 1,2,4-оксадиазолидин-3,5-дион-2-ил; а кольцо Ar2 представляет группу формулы [B1] или [B2].
Так, например, в USP 5532256, WO96/05186, JP H7-188227, A, JP S61-85372, A и USP 5401761, сообщалось, что соединения общей формулы (А), а именно 2,4-тиазолидиндионовые производные, обладают действием, снижающим уровень липидов в крови, или действием, снижающим уровень глюкозы в крови.
В JP H9-124623, A, WO95/18125, JP H7-165735, A, USP 5468762 и JP Н8-92228, A указывалось, что соединения общей формулы (А), а именно 2,4-оксазолидиндионовые производные, обладают действием, снижающим уровень липидов в крови, или действием, снижающим уровень глюкозы в крови.
В USP 5510360 и USP 5480896 указывалось, что соединения общей формулы (А), а именно 1,2,4-оксадиазолидин-3,5-дионовые производные, обладают действием, снижающим уровень липидов в крови, или действием, снижающим уровень глюкозы в крови.
В WO99/462325, WO98/00137, WO97/31907, WO96/38415, JP H9-323982, A, JP H8-325264, A, JP Н5-507920, А, USP 5510360 и USP 5480896 указывалось, что соединения общей формулы (А), а именно производные карбоновых кислот, обладают действием, снижающим уровень липидов в крови, или действием, снижающим уровень глюкозы в крови.
Соединения общей формулы (А) отличаются тем, что они имеют:
(1) 2-арил-5-алкилоксазольное кольцо или 2-арил-5-алкилтиазольное кольцо на одном конце;
(2) карбокси, 2,4-оксазолиндион-5-ил, 2,4-тиазолиндион-5-ил или 1,2,4-оксадиазолидин-3,5-дион-2-ил на другом конце; и
(3) ароматическое кольцо, такое как бензол, представленное кольцом Ar2 в данной молекуле.
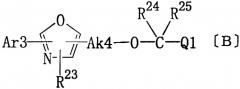
Кроме того, В ЕР-А-220573 показано, что окзазольные производные общей формулы (В) обладают противоартритной активностью.
где Ar3 представляет замещенный фенил или тиенил; R23 представляет водород или алкил; Ak4 представляет алкилен, имеющий 1-2 атома углерода; каждый из R24 и R25 представляет алкил; Q1 представляет карбокси, алкоксикарбонил, карбамоил, N-алкилкарбамоил или N,N-диалкилкарбамоил.
Описание изобретения
Одной из целей настоящего изобретения является получение эффективного профилактического или терапевтического средства против гиперлипидемии, артериосклероза, сахарного диабета, гипертензии, ожирения и т.п., которое обладает действием, снижающим уровень триглицеридов в крови; действием, снижающим уровень ЛНП-Х в крови, а также действием, снижающим уровень глюкозы в крови или уровень инсулина в крови, либо действием, повышающим уровень ЛВП-Х в крови, или действием, снижающим атерогенный индекс.
Для достижения этой цели авторами настоящего изобретения были проведены интенсивные исследования, и было обнаружено, что гетероциклические соединения формулы [1], представленной ниже, удовлетворяют поставленной цели и способствуют осуществлению настоящего изобретения.
Таким образом, настоящее изобретение относится к гетероциклическому соединению приведенной ниже формулы [1] или к его фармацевтически приемлемым солям и к фармацевтической композиции, содержащей это соединение в качестве активного ингредиента.
где R1 представляет арил, ароматическую гетероциклическую группу или циклоалкил, где указанная арильная или ароматическая гетероциклическая группа необязательно замещены одинаковыми или различными одной-тремя группами, выбранными из алкила, галогеналкила, тригалогеналкила, алкокси, галогена и нитро;
Het представляет двухвалентную ароматическую гетероциклическую группу, где указанная ароматическая гетероциклическая группа необязательно замещена алкилом или тригалогеналкилом;
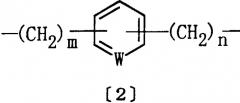
D представляет алкилен, алкенилен, алкинилен или группу формулы [2]:
где W представляет СН или азот, m равно целому числу 1-10, а n равно целому числу 0-9, при условии, что m + n равно целому числу 1-10; и
Е представляет группу формулы [3] или [4]:
где Y представляет кислород или серу; R3 и R4 являются одинаковыми или различными, и каждый из них представляет водород или алкил; р равно целому числу 0-2; Z представляет карбокси, алкоксикарбонил, гидроксиметил, карбамоил, N-гидроксикарбамоил, N-алкилкарбамоил, N,N-диалкилкарбамоил, циано, 1Н-5-тетразолил, 1-алкил-5-тетразолил или 2-алкил-5-тетразолил, при условии, что если D представляет группу формулы [2], то Е не является группой формулы [4].
Из гетероциклических соединений формулы [1] соединения, в которых Het представляет группу формулы [5z]:
где R22 представляет водород, алкил или тригалогеналкил, D представляет алкилен, имеющий 1-2 атома углерода, Е представляет группу формулы [4], а Y представляет кислород, являются известными соединениями. Однако авторами настоящего изобретения было впервые обнаружено, что соединения формулы [1] обладают действием, снижающим уровень триглицеридов в крови; действием, снижающим уровень ЛНП-Х в крови, а также действием, снижающим уровень глюкозы в крови, уровень инсулина в крови, либо действием, повышающим уровень ЛВП-Х в крови, или действием, снижающим атерогенный индекс.
Гетероциклические соединения [1], отличающиеся от соединений формулы [1], где Het представляет группу формулы [5z]; D представляет алкилен, имеющий 1-2 атома углерода, R22 представляет водород, алкил или тригалогеналкил, Е представляет группу формулы [4], а Y представляет кислород, являются новыми соединениями, которые до сих пор не были описаны ни в одной работе.
Из соединений [1] настоящего изобретения предпочтительными являются соединения, где D представляет алкилен, алкенилен или алкинилен, имеющие 3-10 атомов углерода. Другими предпочтительными соединениями являются соединения, где Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5]:
где Х представляет кислород, серу или NR6, R6 представляет водород или алкил, а R2 представляет водород, алкил или тригалогеналкил.
Из соединений [1] настоящего изобретения более предпочтительными являются соединения, где Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5]; Х представляет кислород, серу или NR6, R6 представляет водород или алкил, R2 представляет водород, алкил или тригалогеналкил, а D представляет алкилен, алкенилен или алкинилен, имеющие 3-10 атомов углерода.
Из соединений [1] настоящего изобретения еще более предпочтительными являются соединения, где R1 представляет фенил, необязательно замещенный одной или двумя группами, выбранными из алкила, галогена, тригалогеналкила и алкокси; Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5а]:
где Х определен выше, R15 представляет алкил или тригалогеналкил, а D представляет алкилен или алкенилен, имеющие 3-7 атомов углерода.
Из соединений [1] настоящего изобретения еще более предпочтительными являются, во-первых, соединения, где R1 представляет фенил, необязательно замещенный одной или двумя группами, выбранными из алкила, галогена, тригалогеналкила и алкокси; Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5а], Х представляет кислород, серу или NR6, R6 представляет водород или алкил, R15 представляет алкил или тригалогеналкил, D представляет алкилен или алкенилен, имеющие 3-5 атомов углерода, Е представляет группу формулы [3], р равно 1, Y представляет кислород, R3 представляет водород или алкил, а Z представляет карбокси или алкоксикарбонил; и во-вторых, соединения, где R1 представляет фенил, необязательно замещенный одной или двумя группами, выбранными из алкила, галогена и алкокси; Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5а], Х представляет кислород, серу или NR6, R6 представляет водород или алкил, R15 представляет алкил или тригалогеналкил, D представляет алкилен, алкенилен или алкинилен, имеющие 5-7 атомов углерода, Е представляет группу формулы [4], Y представляет кислород, R3 и R4 являются одинаковыми или различными, и каждый из них представляет водород или алкил, а Z представляет карбокси или алкоксикарбонил.
Из соединений [1] настоящего изобретения особенно предпочтительными являются, во-первых, соединения, где R1 представляет фенил, необязательно замещенный одной или двумя группами, выбранными из алкила и алкокси; Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5а], Х представляет кислород, R15 представляет алкил, D представляет алкилен, имеющий 3-5 атомов углерода, Е представляет группу формулы [3], р равно 1, Y представляет кислород, R3 представляет алкил, а Z представляет карбокси; и во-вторых, соединения, где R1 представляет фенил, необязательно замещенный одной или двумя группами, выбранными из алкила, галогена и алкокси; Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5а], Х представляет кислород, R15 представляет алкил, D представляет алкилен, алкенилен или алкинилен, имеющие 5-7 атомов углерода, Е представляет группу формулы [4], Y представляет кислород, R3 и R4 являются одинаковыми, и каждый из них представляет водород или алкил, а Z представляет карбокси.
Конкретными примерами предпочтительных соединений [1] настоящего изобретения являются нижеследующие гетероциклические соединения (1)-(14) или их фармацевтически приемлемые соли:
(1) 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)-(Е)-4-гексенилокси]пропионовая кислота,
(2) цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота,
(3) 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)-4-гексинилокси]пропионовая кислота,
(4) 2-изобутил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота,
(5) 2-этил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота,
(6) 2-метил-цис-5-{4-[5-метил-2-(4-трифторметилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота,
(7) 2-метил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)-(Е)-3-бутенил]-1,3-диоксан-r-2-карбоновая кислота,
(8) цис-5-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-ил]бутил}-2-метил-1,3-диоксан-r-2-карбоновая кислота,
(9) 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)гексилокси]пропанол,
(10) 2-метил-2-{6-[5-метил-2-(п-толил)оксазол-4-ил]гексилокси}пропионовая кислота,
(11) 2-метил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота,
(12) 2-метил-цис-5-{4-[5-метил-2-(3-фтор-4-метилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота,
(13) 2-метил-цис-5-{4-[5-метил-2-(м-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота и
(14) 2-метил-цис-5-{4-[5-метил-2-(3,4-диметилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота.
Используемый в описании настоящего изобретения термин «алкил» означает алкильную группу с прямой или разветвленной цепью, имеющую 1-7 атомов углерода, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, н-гексил, изогексил, н-гептил и изогептил. Предпочтительными являются алкильные группы с прямой цепью, имеющие 1-3 атомов углерода, например, метил, этил, н-пропил.
Примерами алкильной части групп «галогеналкил», «тригалогеналкил», «алкокси», «алкоксикарбонил», «N-алкилкарбамоил», «N,N-диалкилкарбамоил», «1-алкил-5-тетразолил» и «2-алкил-5-тетразолил» являются алкильные группы, определенные выше.
Термин «циклоалкил» означает циклоалкильную группу, имеющую 4-8 атомов углерода, например, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Предпочтительными являются циклоалкильные группы, имеющие 5-7 атомов углерода.
Термин «алкилен» означает алкиленовую группу с прямой или разветвленной цепью, имеющую 1-10 атомов углерода, например, метилен, этилен, 1-метилэтилен, 2-метилэтилен, триметилен, тетраметилен, пентаметилен, гексаметилен, гептаметилен, октаметилен, нонаметилен и декаметилен. Предпочтительными являются алкиленовые группы, имеющие 3-10 атомов углерода, а более предпочтительными являются алкиленовые группы, имеющие 3-7 атомов углерода.
Термин «алкенилен» означает алкениленовую группу с прямой или разветвленной цепью, имеющую 2-10 атомов углерода, например, этенилен, 1-пропенилен, 2-пропенилен, 1-бутенилен, 2-бутенилен, 3-бутенилен, 1-пентенилен, 2-пентенилен, 3-пентенилен, 4-пентенилен, 4-метил-3-пентенилен, 1-гексенилен, 2-гексенилен, 3-гексенилен, 4-гексенилен, 5-гексенилен, 1-гептенилен, 2-гептенилен, 3-гептенилен, 4-гептенилен, 5-гептенилен, 6-гептенилен, 1-октенилен, 2-октенилен, 3-октенилен, 4-октенилен, 5-октенилен, 6-октенилен, 7-октенилен, 1-ноненилен, 2-ноненилен, 3-ноненилен, 4-ноненилен, 5-ноненилен, 6-ноненилен, 7-ноненилен, 8-ноненилен, 1-деценилен, 2-деценилен, 3-деценилен, 4-деценилен, 5-деценилен, 6-деценилен, 7-деценилен, 8-деценилен и 9-деценилен. Предпочтительными являются алкениленовые группы, имеющие 3-10 атомов углерода, а более предпочтительными являются алкениленовые группы, имеющие 3-7 атомов углерода.
Термин «алкинилен» означает алкиниленовую группу с прямой или разветвленной цепью, имеющую 2-10 атомов углерода, например, этинилен, 1-пропинилен, 2-пропинилен, 1-бутинилен, 2-бутинилен, 3-бутинилен, 1-пентинилен, 2-пентинилен, 3-пентинилен, 4-пентинилен, 2-метил-3-пентинилен, 1-гексинилен, 2-гексинилен, 3-гексинилен, 4-гексинилен, 5-гексинилен, 1-гептинилен, 2-гептинилен, 3-гептинилен, 4-гептинилен, 5-гептинилен, 6-гептинилен, 1-октинилен, 2-октинилен, 3-октинилен, 4-октинилен, 5-октинилен, 6-октинилен, 7-октинилен, 1-нонинилен, 2-нонинилен, 3-нонинилен, 4-нонинилен, 5-нонинилен, 6-нонинилен, 7-нонинилен, 8-нонинилен, 1-децинилен, 2-децинилен, 3-децинилен, 4-децинилен, 5-децинилен, 6-децинилен, 7-децинилен, 8-децинилен и 9-децинилен. Предпочтительными являются алкиниленовые группы, имеющие 3-10 атомов углерода, а более предпочтительными являются алкиниленовые группы, имеющие 3-7 атомов углерода.
Термин «арил» означает арильную группу, имеющую 6-10 атомов углерода, например, фенил, 1-нафтил и 2-нафтил, при этом, предпочтительным является фенил.
Термин «ароматическое гетероциклическое кольцо» означает 5-6-членное ароматическое кольцо, содержащее 1-4 гетероатома, выбранных из азота, кислорода и серы, или указанное ароматическое кольцо, конденсированное с бензольным кольцом. Примерами являются 1-пирролил, 2-пирролил, 3-пирролил, 3-индолил, 2-фурил, 3-фурил, 3-бензофуранил, 2-тиенил, 3-тиенил, 3-бензотиенил, 2-оксазолил, 2-тиазолил, 2-бензотиазолил, 2-имидазолил, 4-имидазолил, 2-бензимидазолил, 1Н-1,2,4-триазол-1-ил, 1Н-тетразол-5-ил, 2-пиридин, 3-пиридил, 4-пиридил, пиридин-1-оксид-2-ил, пиридин-1-оксид-3-ил, пиридин-1-оксид-4-ил, 2-пиримидинил, 4-пиримидинил, 2-пиразинил, 1,3,5-триазин-2-ил.
Термин «двухвалентное ароматическое гетероциклическое кольцо» означает 5-6-членное ароматическое кольцо, содержащее 1-4 гетероатома, выбранных из азота, кислорода и серы, или указанное ароматическое кольцо, конденсированное с бензольным кольцом. Примерами являются пирролилен, индолилен, фуранилен, бензофуранилен, тиенилен, бензотиенилен, оксазолилен, тиазолилен, бензотиазолилен, имидазолилен, бензимидазолилен, 1Н-1,2,4-триазолилен, пиридинилен, пиримидинилен, пиразинилен и 1,3,5-триазинилен.
Примерами «галогена» являются фтор, хлор, бром и иод.
Примерами галогеновой части «галогеналкила» и «тригалогеналкила» является галоген, определенный выше.
Конкретными примерами «тригалогеналкила» являются трифторметил, трихлорметил, 2,2,2-трифторэтил и 2,2,2-трихлорэтил.
Соединения [1] настоящего изобретения могут быть получены способами, проиллюстрированными ниже или в рабочих примерах.
Способ А
Соединение [1а] настоящего изобретения, где Е представляет группу формулы [3], а Z представляет алкоксикарбонил, может быть получено взаимодействием соединения [11] и соединения [22].
где R1, Het, D, Y, р и R3 являются такими, как они определены выше, а R11 представляет алкил.
Обычно, данная реакция может быть проведена в подходящем растворителе (например, в полярном растворителе, таком как ацетонитрил или N,N-диметилформамид (ДМФ), в эфирном растворителе, таком как тетрагидрофуран (ТГФ) или диэтиловый эфир, в галогенированном углеводородном растворителе, таком как хлороформ или дихлорметан, в сложноэфирном растворителе, таком как метилацетат или этилацетат, в углеводородном растворителе, таком как бензол, толуол или н-гексан, или в их смеси) в присутствии кислоты Льюиса (например, эфиратного комплекса трифторида бора) при температуре от -20 до 150°С. Хотя время реакции может варьироваться в зависимости от вида соединения [11] и соединения [22] или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Соединение [22] предпочтительно используется в количестве 1-5 моль на один моль соединения [11].
Способ В
Соединение [1b] настоящего изобретения, где Е представляет группу формулы [4], а Z представляет карбокси, может быть получено по реакции соединения [12] и соединения [13] с последующей обработкой кислотой.
где R1, Het, Y, R3 и R4 являются такими, как они определены выше, L представляет уходящую группу, такую как галоген, метансульфонилокси или толуолсульфонилокси, Т представляет галоген, R13 и R14 являются одинаковыми или различными, и каждый из них представляет алкил, D1 представляет алкилен, алкенилен или алкинилен, имеющий на один атом углерода меньше, чем D (D имеет значения, определенные выше).
Соединение [14] может быть получено, в основном, обработкой соединения [13] металлическим реагентом, таким как бутиллитий или магний, и последующим проведением реакции с соединением [12] в присутствии иодида меди или бромида меди при температуре от -80 до 150°С в апротонном растворителе (например, в полярном растворителе, таком как ацетонитрил или N,N-диметилформамид (ДМФ), в эфирном растворителе, таком как тетрагидрофуран (ТГФ) или диэтиловый эфир, в галогенированном углеводородном растворителе, таком как хлороформ или дихлорметан, в сложноэфирном растворителе, таком как метилацетат или этилацетат, в углеводородном растворителе, таком как бензол, толуол или н-гексан, или в их смеси). Хотя время реакции может варьироваться в зависимости от вида соединения [12], соединения [13] и металлического реагента или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Металлический реагент и соединение [12] предпочтительно используются в количестве 1-1,2 моль на один моль соединения [13].
Соединение [1b] может быть, в основном, получено обработкой соединения [14] кислотой (например, хлористоводородной кислотой) в спиртовом растворителе (например, в метаноле или этаноле) при температуре от -80 до 80°С в течение периода времени от 5 минут до 24 часов.
Способ С
Соединение [1с], где D представляет алкенилен, который присоединен к Het в части с ненасыщенной связью, может быть получено по реакции Виттига с использованием соединения [15] и соединения [16].
где R1, Het, Е и Т являются такими, как они определены выше, Ph представляет фенил, D2 представляет алкенилен, имеющий на два атома углерода меньше, чем D (D имеет значения, определенные выше), или группу формулы [2].
Указанная реакция, обычно, может быть осуществлена в том же растворителе, который был использован в описанном выше способе А, в присутствии основания (например, гидроксида натрия) при температуре от -20 до 150°С. Хотя время реакции может варьироваться в зависимости от вида соединения [15] и соединения [16] или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Соединение [16] предпочтительно используется в количестве 1-1,2 моль на один моль соединения [15].
Способ D
Соединение [1d] настоящего изобретения, где Het представляет группу формулы [5а]:
где Х и R15 являются такими, как они определены выше, Е представляет группу формулы [3] или [4], а Z представляет алкоксикарбонил, может быть также получено по реакции соединения [17] с оксихлоридом фосфора, тионилхлоридом, пентоксидом фосфора, метильным реагентом Дэви (2,4-бис(метилтио)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфидом), реактивом Лавессона (2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфидом), аммиаком или алкиламином. При использовании оксихлорида фосфора, тионилхлорида или пентоксида фосфора могут быть получены оксазольные производные; при использовании метильного реагента Дэви или реагента Лавессона могут быть получены тиазольные производные; а при использовании аммиака или алкиламина могут быть получены имидазольные производные.
где R1, D и R15 являются такими, как они определены выше, а Е представляет группу формулы [31] или [41]:
где R3, R4, R11, Y и р являются такими, как они определены выше.
Обычно данная реакция может быть проведена в подходящем растворителе (например, в углеводородном растворителе, таком как бензол, толуол или ксилол, в галогенированном углеводородном растворителе, таком как хлороформ или дихлорметан, в полярном растворителе, таком как N,N-диметилформамид (ДМФ), в эфирном растворителе, таком как тетрагидрофуран (ТГФ) или диэтиловый эфир, в уксусной кислоте или в их смеси) при температуре от -10 до 200°С. Хотя время реакции зависит от вида реагента (например, оксихлорида фосфора, реагента Лавессона, алкиламина), вида соединения [17] или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Оксихлорид фосфора, тионилхлорид, пентоксид фосфора, метильный реагент Дэви, реагент Лавессона, аммиак или алкиламин предпочтительно используются в количестве 1-10 моль на один моль соединения [17].
Способ Е
Соединение [1е] настоящего изобретения, где Het представляет указанную выше группу формулы [5а], Е представляет группу формулы [4], а Z представляет алкоксикарбонил, может быть получено по реакции соединения [18] и соединения [19].
где R1, R3, R4, R11, R15, Х, Y, L и D1 являются такими, как они определены выше.
Указанная реакция может быть осуществлена, обычно, в таком же растворителе, который был использован в описанном выше способе А, в присутствии основания (например, гидрида натрия или карбоната натрия) при температуре от -20 до 150°С. Хотя время реакции может варьироваться в зависимости от вида соединения [18] и соединения [19] или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Соединение [19] предпочтительно используется в количестве 1-1,2 моль на один моль соединения [18].
Способ F
Соединение [1d] настоящего изобретения, где Het представляет указанную выше группу формулы [5а], может быть получено по реакции соединения [20] и соединения [21].
где R1, R15, D, Е1 и Х являются такими, как они определены выше, а L1 представляет хлор или бром.
Указанная реакция может быть осуществлена, обычно, в отсутствие растворителя или в растворителе, который был использован в описанном выше способе А, в присутствии основания (например, гидрида натрия или карбоната натрия) при температуре от -20 до 150°С. Хотя время реакции может варьироваться в зависимости от вида соединения [20] и соединения [21] или от температуры реакции, однако, обычно, подходящее время реакции составляет от 30 минут до 24 часов. Соединение [21] предпочтительно используется в количестве 1-1,2 моль на один моль соединения [20].
Способ G
Соединение формулы [1h] настоящего изобретения, где Z представляет карбокси, может быть получено гидролизом соединения формулы [1g] настоящего изобретения, где Z представляет алкоксикарбонил.
Соединение [1g] настоящего изобретения может быть получено конденсацией соединения [1h] настоящего изобретения со спиртом [73] или взаимодействием с алкилирующим агентом.
Кроме того, соединение [1i] настоящего изобретения, где Z представляет карбамоил, N-гидроксикарбамоил, N-алкилкарбамоил или N,N-диалкилкарбамоил, может быть получено взаимодействием соединения [1h] настоящего изобретения с соединением [82], то есть, аммиаком, гидроксиламином, алкиламином или диалкиламином.
где R1, R11, Het, D и Е1 определены выше; R7 представляет водород, а R8 представляет водород, гидрокси или алкил, либо R7 представляет алкил, и R8 представляет алкил; Е2 представляет группу формулы [32] или [42]; Е3 представляет группу формулы [33] или [43]:
где R3, R4, R7, R8, Y и р определены выше.
Гидролиз соединения [1g] может быть, обычно, проведен в смешанном спиртовом растворителе, таком как метанол, этанол, изопропанол или трет-бутиловый спирт и вода, в присутствии кислоты (например, хлористоводородной кислоты, серной кислоты или п-толуолсульфоновой кислоты) или основания (например, гидроксида натрия или гидроксида калия) при температуре от -20 до 150°С. Хотя время реакции варьируется в зависимости от вида соединения [1g] или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Кислота или основание предпочтительно используются в количестве 1-20 моль на один моль соединения [1g].
Конденсация соединения [1h] и спирта [73] может быть, обычно, проведена с использованием спирта в качестве растворителя в присутствии кислоты (например, хлористоводородной кислоты, серной кислоты или п-толуолсульфоновой кислоты) при температуре от -20 до 150°С. Хотя время реакции варьируется в зависимости от вида соединения [1h], вида спирта или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Кислота или основание предпочтительно используется в количестве 0,1-1,2 моль на 1 моль соединения [1h].
Указанная реакция конденсации может быть также осуществлена в таком же растворителе, который был использован в описанном выше способе А, в присутствии конденсирующего агента (например, N,N'-дициклогексилкарбодиимида или 1,1'-карбонилдиимидазола) при температуре от -20 до 150°С. Хотя время реакции может варьироваться в зависимости от вида соединения [1h], вида спирта или конденсирующего агента, или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Конденсирующий агент, предпочтительно, используется в количестве 1-1,2 моль на 1 моль соединения [1h].
Реакция между соединением [1h] и алкилирующим агентом (например, триметилсилилдиазометаном/метанолом, метилиодидом) может быть осуществлена в таком же растворителе, который был использован в описанном выше способе А, при (-20)-(150)°С. Хотя время реакции может варьироваться в зависимости от вида соединения [1h], вида алкилирующего агента или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Алкилирующий агент, предпочтительно, используется в количестве 1-2 моль на 1 моль соединения [1h].
Реакция между соединением [1h] и соединением [82] может быть осуществлена способом, аналогичным способу проведения указанной реакции конденсации соединения [1h] и спирта [73]. Кроме того, соединение [1i] настоящего изобретения может быть получено по реакции реакционноспособного производного соединения [1h] и соединения [82], проводимой известным способом. Примерами реакционноспособных производных являются реагенты, в основном, используемые в реакции амидирования, такие как галогенангидриды (хлорангидрид или бромангидрид), смешанный ангидрид кислоты, активированный амид и т.п.
Так, например, если в качестве реакционноспособного производного используется галогенангидрид, то реакция может быть проведена в апротонном растворителе (например, в полярном растворителе, таком как ацетонитрил или N,N-диметилформамид (ДМФ), в эфирном растворителе, таком как тетрагидрофуран (ТГФ) или диэтиловый эфир, в галогенированном углеводородном растворителе, таком как хлороформ или дихлорметан, в углеводородном растворителе, таком как бензол, толуол или н-гексан, или в их смеси) в присутствии основания (например, карбоната калия, карбоната натрия, гидрокарбоната натрия, гидрокарбоната калия, пиридина, 4-диметиламинопиридина, триэтиламина, гидроксида натрия) при температуре от -20 до 100°С. Хотя время реакции варьируется в зависимости от вида галогенангидрида и соединения [82] или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Соединение [82] предпочтительно используется в количестве 1-1,2 моль на один моль галогенангидрида.
Способ Н
Соединение [1k] настоящего изобретения, где D представляет алкенилен, который присоединен к Het в части с ненасыщенной связью, может быть также получено дегидрированием соединения [1j] настоящего изобретения, где D представляет алкилен.
Кроме того, соединение [1k] настоящего изобретения может быть также получено гидрированием соединения [1m] настоящего изобретения, где D представляет алкинилен, который присоединен к Het в части с ненасыщенной связью.
Соединение [1j] настоящего изобретения может быть также получено гидрированием соединения [1k] настоящего изобретения.
где R1, Het, D2 и Е1 определены выше.
Дегидрирование соединения [1j] может быть проведено по реакции указанного соединения с N-бромсукцинимидом (NBS) или с N-хлорсукцинимидом (NCS) в таком же растворителе, который был использован в описанном выше способе А, при температуре от -20 до 150°С, с последующей реакцией с основанием (например, гидроксидом натрия или гидроксидом калия) в спиртовом растворителе, таком как метанол или этанол. Хотя время реакции может варьироваться в зависимости от вида соединения [1j] или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. NBS, NCS или основание, предпочтительно, используются в количестве 1-1,2 моль на 1 моль соединения [1j].
Гидрирование соединения [1m] может быть проведено в спиртовом растворителе (например, в метаноле или этаноле) в присутствии палладиевого катализатора (например, палладия на карбонате кальция или палладия на угле) при (-20)-(150)°С. Хотя время реакции может варьироваться в зависимости от вида соединения [1m], от палладиевого катализатора или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Палладиевый катализатор, предпочтительно, используется в количестве 0,05-0,5 моль на 1 моль соединения [1m].
Гидрирование соединения [1k] может быть проведено в спиртовом растворителе (например, в метаноле или этаноле) в присутствии палладиевого катализатора (например, палладия на угле) при (-20)-(150)°С. Хотя время реакции может варьироваться в зависимости от вида соединения [1k], от палладиевого катализатора или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Палладиевый катализатор, предпочтительно, используется в количестве 0,05-0,2 моль на 1 моль соединения [1k].
Способ I
Соединение [1n] настоящего изобретения, где Z представляет гидроксиметил, может быть получено восстановлением соединения [1g] настоящего изобретения, где Z представл