Производные азаиндола
Иллюстрации
Показать всеИзобретение относится к новым производным азаиндола формулы I или его фармацевтически приемлемым солям:
где
выбирают из группы, состоящей из:
R1, R2, R3, R4 каждый независимо выбран из группы, состоящей из Н, С1-С6алкила, С2-С6алкенила, галогена, CN, фенила, нитро, OC(О)R15, C(О)R15, C(О)OR16, OR19, SR20 и NR21R22;
R15 независимо выбран из группы, включающей Н, C1-С6алкил и С2-С6алкенил;
R16, R19 и R20 каждый независимо выбран из группы, включающей Н, C1-С6алкил, С1-6алкил, замещенный от одного до трех атомов галогена;
R21 и R22 каждый независимо выбран из группы, включающей Н, ОН, C1-С6алкил;
R5 представляет собой (О)m, где m имеет значение 0 или 1;
n имеет значение 1 или 2;
R6 выбирают из группы, включающей Н, C1-C6алкил, C(О)R24, C(О)OR25;
при условии, что атомы углерода, которые содержат углерод-углеродную двойную связь указанного С3-С6алкенила не являются точкой присоединения к азоту, к которому присоединен R6;
R24 выбирают из группы, состоящей из Н, C1-C6алкила;
R25 представляет собой C1-С6алкил;
R7, R8, R9, R10, R11, R12, R13 и R14 каждый независимо выбран из группы, включающей Н, C1-С6алкил;
Ar выбирают из группы, включающей
Соединение I ингибирует вирус, вызываемый ВИЧ-1, что позволяет предположить возможность его использования в медицине. 21 з.п. ф-лы, 5 табл.
Реферат
Область техники
Настоящее изобретение относится к соединениям, обладающим лекарственными и биоактивными свойствами, их фармацевтическим композициям, а также способам их применения. В частности, изобретение касается производных азаиндолпиперазиндиамида, которые обладают уникальной антивирусной активностью. В особенности, настоящее изобретение касается соединений, пригодных для лечения ВИЧ-инфекции и СПИДа.
Уровень техники
ВИЧ-1 (вирус-1 человеческого иммунодефицита) остается главной медицинской проблемой, поскольку по всемирной оценке инфицированы 33.6 миллиона человек. Число случаев ВИЧ-инфекции и СПИДа (приобретенный синдром иммунодефицита) быстро повышается. В 1999 г. было сообщено о новых инфекциях у 5.6 миллионов человек и о 2.6 миллионах умерших от СПИДа. В настоящее время доступные лекарственные препараты для лечения ВИЧ-инфекции включают шесть нуклеозидных ингибиторов обратимости транскриптазы (RT) (зидовудин, диданозин, ставудин, ламивудин, залтитабин и абасавир) (zidovudine, didanosine, stavudine, lamivudine, zalcitabine and abacavir), три ненуклеозидных ингибитора обратимости транскриптазы (невирапин, делавирдин и эфавиренз) (nevirapine, delavirdine and efavirenz), а также пять пептидомиметических ингибиторов протеазы (саквинавир, индинавир, ритонавир, нельфинавир и ампренавир) (saquinavir, indinavir, ritonavir, nelfinavir and amprenavir). Каждый из указанных лекарственных препаратов способен только кратковременно ограничить размножение вирусов, если их используют как таковые. Однако, когда их используют в сочетании (комбинации), эти лекарственные препараты оказывают сильное воздействие на вирусы и прогрессирование болезни. Фактически, было подтверждено документально, что существенные сокращения в показателях смертности среди пациентов, заболевших СПИДом, являются следствием широкого применения комбинационной терапии. Однако, несмотря на эти впечатляющие результаты, от 30 до 50% пациентов в конечном счете не вылечиваются при применении комбинационной терапии лекарственных препаратов. Неэффективность действия лекарственных препаратов, несоответствие, ограниченное действие внутри некоторых типов клеток (например, большинство нуклеозидных аналогов не могут быть профосфорилированы в отдельных клетках) может служить оценкой неполного подавления восприимчивых вирусов. Кроме того, высокая скорость размножения и быстрое преобразование ВИЧ-1 вместе с частым включением мутаций, приводит к появлению устойчивости к лекарственным препаратам и лечение становится невозможным, когда присутствует сверхоптимальная концентрация лекарственных препаратов (Larder и Kemp; Gulick; Kuritzkes; Morris-Jones et al.; Schinazi et al.; Vacca и Condra; Flexner; Berkhout и Ren et al.; (Ref.6-14)). Таким образом, имеется необходимость создания новых анти-ВИЧ агентов, демонстрирующих отличные свойства устойчивости и благоприятную фармакокинетику, также как и безопасность, чтобы обеспечить альтернативное лечение.
В настоящее время в качестве запатентованных лекарственных препаратов против ВИЧ-1 доминируют либо нуклеозидные ингибиторы обратимости транскриптазы, либо ингибиторы пептидомиметической протеазы. Недавно полученные ненуклеозидные ингибиторы обратимости транскриптазы (NNRTIs) играют все более и более важную роль в терапии ВИЧ-инфекций (Pedersen & Pedersen, Ref.15). В литературе описаны по крайней мере 30 различных классов NNRTI (De Clercq, Ref.16) и несколько NNRTIs прошли клинические испытания. Дипиридодиазепинон (невиралин), бензоксазинон (эфавиренз) и производные бис(гетероарил) пиперазина (делавирдин) одобрены для клинического применения. Однако главным недостатком в развитии и применении NNRTIs является их склонность к быстрому появлению штаммов, резистентных к лекарственным препаратам как в культуре клеточной ткани, так и у подвергнутых лечению индивидуумов, в особенности тех, которых прошли монотерапию. Как следствие, возникает значительный интерес для выявления большого количества NNRTIs со сниженной способностью к развитию резистентности (Pedersen & Pedersen, Ref.15).
Имеются сообщения о нескоторых производных индола, включая индол-3-сульфоны, пиперазининдолы, пиразининдолы и производные 5Н-индоло[3,2-b][1,5]бензотиазепина, как об ингибиторах обратимости ВИЧ-1 транскриптазы (Greenlee et al., Ref.1; Williams et al., Ref.2; Romero et al., Ref.3; Font et al., Ref.17; Romero et al., Ref.18; Young et al., Ref.19; Genin et al., Ref.20; Silvestri et al., Ref.21). Индольные 2-карбоксамиды также были описаны как ингибиторы клеточной адгезии и ВИЧ-инфекции (Boschelli et al., US 5,424,329, Ref.4). И, наконец, были описаны как ингибиторы ВИЧ-1 протеазы природные продукты на основе 3-замещенного индола (семикохлиодинол А и В, дидеметиластерихинон и изокохлиодинол (Semicochliodinol А и В, didemethylasterriquinone и isocochliodinol) (Fredenhagen et al., Ref.22).
Ранее были описаны близкие по структуре производные азаиндоламида (Kato et al., Ref.23; Levacher et al., Ref.24; Mantovanini et al., Ref.5(a); Cassidy et al., Ref.5(b); Scherlock et al., Ref.5(с)). Однако эти структуры представляют собой скорее азаиндолмоноамиды, чем несимметричные производные азаиндолпиперазиндиамида и, кроме того, отсутствуют упоминания о применении этих соединений для лечения антивирусных инфекций, в частности ВИЧ-инфекции. Ничто в перечисленных ссылках не может быть определено, как раскрытие или предположение относительно новых соединений по настоящему изобретению и их применения для ингибирования ВИЧ-инфекции.
КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение включает в себя соединения формулы I или их фармацевтически приемлемые соли, которые являются эффективными антивирусными агентами, в частности действуют как ВИЧ ингибиторы.
где:
выбирают из группы, состоящей из
R1, R2, R3, R4 каждый независимо выбран из группы, состоящей из Н, C1-C6алкила,
С2-С6алкенила, галогена, -CN, фенила, нитро, OC(O)R15, C(O)R15, C(O)OR16, OR19, SR20 и NR21R22;
R15 независимо выбран из группы, включающей Н, C1-С6алкил и С2-С6алкенил;
R16, R19 и R20 каждый независимо выбран из группы, включающей Н, C1-С6алкил, C1-C6алкил, замещенный от одного до трех атомами галогена;
R21 и R22 каждый независимо выбран из группы, включающей Н, ОН, C1-С6алкил;
R5 представляет собой (O)m, где m имеет значение 0 или 1;
n имеет значение 1 или 2;
R6 выбирают из группы, включающей Н, С1-С6алкил, С3-С6алкенил, C(O)R24, C(O)OR25; при условии, что атомы углерода, которые содержат углерод-углеродную двойную связь указанного С3-С6алкенила, не являются точкой присоединения к азоту, к которому присоединен R6;
R24 выбирают из группы, состоящей из Н, C1-C6алкила;
R25 представляет собой C1-C6алкил;
R7, R8, R9, R10, R11, R12, R13 и R14 каждый независимо выбран из группы, включающей Н, C1-C6алкил;
Ar выбирают из группы, включающей
A1, А2, А3, А4, A5, B1, B2, В3, В4, C1, C2, С3 каждый независимо выбран из группы, включающей Н, галоген, C1-C6алкил, -CN, нитро, N3.
Предпочтительными являются соединения формулы I или их фармацевтически приемлемые соли, в которых R2-R4 независимо представляет собой Н, -ОСН3, -ОСН2CF3, -OiPr, -OnPr, CN, NO2, C1-С6алкил, NHOH, NH2, SR20 или N(СН3)2.
Также предпочтительны соединения формулы I, в которых один или два R7-R14 независимо представляют собой метил, а другие заместители представляют собой водород.
Также предпочтительны соединения формулы I, в которых один из A1-A5, В1-B4, C1-С3 представляют собой либо водород, галоген, или амино и остальные заместители представляют собой водород.
Также предпочтительны соединения формулы, приведенной ниже
где
R2 представляет собой Н, F, Cl, Br, OMe, CN или ОН;
R4 представляет собой C1-C6алкил, С2-С6алкенил, Cl, OMe, CN, ОН, Ph или -С(O)СН3;
n имеет значение 2;
R8, R9, R10, R11, R12, R13 и R14 каждый независимо является Н или СН3 при условии, что вплоть до двух этих заместителей могут быть метилом;
R1 представляет собой водород;
R5 является незамещенным;
R6 представляет собой водород или метил.
К наиболее предпочтительным относятся соединения или их фармацевтически приемлемые соли следующей формулы
где
R2 представляет собой Н, -ОСН3, -OCH2CF3, -OPr, галоген, CN, NO2 или NHOH;
R4 представляет собой Н, -галоген, -CN или гидрокси;
Один или два члена R7-R14 представляют собой метил и оставшиеся члены представляют собой водород;
n имеет значение 2;
R1 представляет собой водород;
R5 представляет собой (O)m, где m представляют собой О;
R6 представляет собой водород, метил, или аллил.
К другим наиболее предпочтительным относятся соединения формулы
где
R2 выбирают из группы, включающей Н, F, Cl, Br, OMe, CN и ОН;
R4 выбирают из группы, включающей Н, C1-C6алкил, С2-С6алкенил, Cl, OMe, CN, ОН, фенил и -С(O)СН3;
n имеет значение 2;
R8, R9, R10, R11, R12, R13 и R14 каждый независимо является Н или СН3 при условии, что 0-2 членов группы R8, R9, R10, R11, R12, R13 и R14 могут быть СН3, а остальные члены группы R8, R9, R10, R11, R12, R13 и R14 являются Н;
R6 представляет собой Н или СН3.
К другим наиболее предпочтительным аспектам изобретения относятся соединения формулы, приведенной ниже
где
R4 выбирают из группы, включающей Н, C1-C6алкил, С2-С6алкенил, Cl, ОМе, CN, ОН, фенил и -С(O)СН3;
n имеет значение 2;
R8, R9, R10, R11, R12, R13 и R14 каждый независимо является Н или СН3 при условии, что 0-2 членов группы R8, R9, R10, R11, R12, R13 и R14 могут быть СН3, а остальные члены группы R8, R9, R10, R11, R12, R13 и R14 являются Н;
R6 представляет собой Н или СН3.
Поскольку соединения в соответствии с настоящим изобретением могут иметь асимметричные центры и соответственно существовать в виде смесей диастереоизомеров и энантиомеров, настоящее изобретение включает индивидуаьные формы диастереоизомеров и энантиомеров соединений формулы I.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Препаративные процессы и анти-ВИЧ-1 активность новых аналогов азаиндолпиперазиндиамида формулы I приведены ниже. Далее приведены также определения различных терминов.
Термин «С1-C6алкил», как его используют в описании и в формуле изобретения (если контекст не указывает на другое), означает линейные или разветвленные цепи алкильных групп, такие как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, амил, гексил и тому подобное. Аналогично "C1-6алкенил" или "C1-6алкинил" включает линейные или разветвленные цепочечные группы.
"Галоген" имеет отношение к хлору, брому, йоду или фтору.
Физиологически приемлемые соли и пролекарства соединений, описанные здесь, входят в границы настоящего изобретения. Термин ″фармацевтически приемлемые соли″, как его используют в описании и в формуле изобретения, как предполагается, включает нетоксичные основные аддитивные соли. Пригодные соли включают те, которые получают из органических и неорганическх кислот, таких как без ограничения соляная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота, метансульфоновая кислота, уксусная кислота, винная кислота, молочная кислота, сульфиновая кислота, лимонная кислота, малеиновая кислота, фумаровая кислота, сорбиновая кислота, аконитовая кислота, салициловая кислота, фталевая кислота и тому подобное. Термин ″фармацевтически приемлемая соль″, как его здесь используют, как предполагается, включает соли кислотных групп, таких как карбоксилат, с такими притивоионами, как аммоний, соли щелочных металлов, в частности натрия или калия, соли щелочноземельных металлов, в частности кальция или магния, и соли с пригодными органическими основаниями, такие как низшие алкиламины (метиламин, этиламин, циклогексиламин и тому подобное), или замещенные низшие алкиламины (например, гидроксилзамещенные алкиламины, такие как диэтаноламин, триэтаноламин или трис(гидроксиметил)-аминометан), или с основаниями, такими как пиперидин или морфолин.
В способе настоящего изобретения термин "антивирусное эффективное количество" означает общее количество каждого активного компонента способа, которое достаточно, чтобы показать заметное преимущество при лечении больных, то есть достигнуть исцеления острого состояния, характеризуемое ингибированием ВИЧ-инфекции. Когда термин применяют для индивидуальных активных инградиентов, вводимых по единому, он относится к одному ингредиенту. Когда термин применяют к комбинации, он имеет отношение к объединенному количеству активных ингредиентов, как результат терапевтического эффекта, при введении в комбинации, последовательно или одновременно. Термины "обрабатывать, лечение, обработка", как их используют в настоящем изобретении и в формуле изобретения, означает предотвращение или улучшение состояния при заболеваниях, связанных с ВИЧ-инфекцией.
Настоящее изобретение также направлено на комбинации (или сочетании) соединений с одним или более представителями, пригодными для лечения СПИДа. Например, соединения настоящего изобретения могут эффективно вводиться либо в периоды предварительного выявления и/или последующего выявления, в комбинации с эффективным количеством антивирусных препаратов против СПИДа, иммуномодуляторов, противоинфекционных препаратов или вакцин, таких как приведены в таблице 1.
| Таблица 1АНТИВИРУСНЫЕ ПРЕПАРАТЫ | ||
| Лекарственный препарат,Название | Производитель | Показания |
| 097 | Hoechst/Bayer | ВИЧ-инфекция, СПИД, ARC (ингибитор RT) |
| Ампренивир141 W94 GW141 | Glaxo Wellcome | ВИЧ-инфекция, СПИД, ARC (ингибитор протеазы) |
| Абакавир(1592U89) GW1592 | Glaxo Wellcome | ВИЧ-инфекция, СПИД, ARC (ингибитор RT) |
| Ацематан | Carrington Labs (Irving, TX) | ARC |
| Ацикловир | Burroughs Wellcome | ВИЧ-инфекция, СПИД, ARC, в комбинации с AZT |
| AD-439 | Tanox Biosystems | ВИЧ-инфекция, СПИД, ARC |
| AD-519 | Tanox Biosystems | ВИЧ-инфекция, СПИД, ARC |
| Адефовир дипивоксил | Gilead Sciences | ВИЧ-инфекция |
| AL-721 | Ethigen (Los Angeles, CA) | ARC, PGL ВИЧ-инфекция положительная, СПИД |
| Альфа интерферон | Glaxo Wellcome | Саркома Капози, ВИЧ-инфекция в комбинации с w/ретровирусом |
| Анзалицин LM.427 | Adria Laboratories (Dublin, ОН) Erbamont (Stamford, CT) | ARC |
| Антитело, которое нейтрализует рН лабильный альфа абберантный интерферон | Advanced Biotherapy Concepts (Rockville, MD) | СПИД, ARC |
| AR177 | Aronex Pharm | ВИЧ-инфекция, СПИД, ARC |
| бета-фтор-ddA | Nat'l Cancer Institute | Связанные со СПИДом болезни |
| BMS-232623 (CGP-73547) | Bristol-Myers Squibb/ Novartis | ВИЧ-инфекция, СПИД, ARC (ингибитор протеазы) |
| BMS-234475 (CGP-61755) | Bristol-Myers Squibb/Novartis | ВИЧ-инфекция, СПИД, ARC (ингибитор протеазы) |
| Сl-1012 | Wamer-Lambert | ВИЧ-1 инфекция |
| Цидофовир | Gilead Science | CMV ретинит герпес, вирусная папилома |
| Сульфат курдлана | AJI Pharma USA | ВИЧ-инфекция |
| Цитомегаловирус иммуннглобулин | Medlmmune | CMV ретиниты |
| Цитовенодный Ганцикловир | Syntex | Угроза зрению CMV |
| перефирийные CMV ретиниты | ||
| Делавиридин | Pharmacia-Upjohn | ВИЧ-инфекция, СПИД, ARC (RT нгибитор) |
| Сульфат декстрана | Ueno Fine Chem. Inc. Ltd. (Osaka, Japan) | СПИД, ARC, ВИЧ-инфекция Положительная асимптоматика |
| ddC Дидезоксицитрон | Hoffinan-La Roche | ВИЧ-инфекция, СПИД, ARC |
| ddl Дидезоксицитрон | Bristol-Myers Squibb | ВИЧ-инфекция, СПИД, ARC; комбинация с AZT/d4T |
| DMP-450 | AVID(Camden,NJ) | ВИЧ-инфекция, СПИД, ARC (ингибитор протеазы) |
| Эфавиренц (DMP 266) (-)6-хлор-4-(S)-циклопропилэтинил-4(S)-трифтор-метил-1,4-дигидро-2Н-3,1-бензоксазин-2-он, СТОКРИН | DuPont Merck | ВИЧ-инфекция, СПИД. ARC (ненуклеозидный RT ингибитор) |
| EL10 | Elan Corp, PLC (Gainesville, GA) | ВИЧ-инфекция |
| Фамцикловир | Smith Kline | герпес опоясывающий лишай, герпес симплексный |
| FTC | Emory University | ВИЧ-инфекция, СПИД, ARC (ингибитор транскриптазы) |
| GS840 | Hoechst Marion Roussel | ВИЧ-инфекция, СПИД, ARC (ингибитор транскриптазы) |
| HBY097 | Gilead | ВИЧ-инфекция, СПИД, ARC (ненуклеозидныеИнгибиторы транскриптазы) |
| Гиперицин | VIMRx Pharm. | ВИЧ-инфекция, СПИД, ARC |
| Рекомбинаторный интерферон бета человеческий | Triton Biosciences (Almeda, CA) | СПИД, Саркома Капози, ARC |
| Интерферон альфа-n3 | hiterferon Sciences | ARC, СПИД |
| Индинавир | Merck | ВИЧ-инфекция, СПИД, ARC, бессимптомная ВИЧ-инфекция положительная, также в комбинации с AZT/ddl/ddC |
| ISIS 2922 | ISIS Pharmaceuticals | CMV ретиниты |
| KNI-272 | Nat'l Cancer Institute diseases | болезни, ассоциированные с ВИЧ-инфекцией |
| Ламивудин, 3ТС | Glaxo Wellcome | ВИЧ-инфекция, СПИД. ARC (ингибитор транскриптазы); |
| также с AZT | ||
| Лабукавир | Bristol-Myers Squibb | CMV инфекция |
| Нелфинавир | Agouron Pharmaceuticals | ВИЧ-инфекция, СПИД, ARC (ингибитор протеазы) |
| Невирапин | Boeheringer bigleheim | ВИЧ-инфекция, СПИД, ARC (RT ингибитор) |
| Новапрен | Novaferon Labs, Inc. (Akron, OH) | ВИЧ-ингибитор инфекции |
| Пептид Т октановая последовательность | Peninsula Labs (Behnont, CA) | СПИД |
| Фосфоноформиат | Astra Pharm. Products, Inc. | CMV ретиниты, ВИЧ-инфекция, другие CMV инфекции |
| PNU-140690 | Pharmacia Upjohn | ВИЧ-инфекция, СПИД, ARC (ингибитор протеазы) |
| Пробукол | Vyrex Sheffield Med. Tech (Houston, TX) | ВИЧ-инфекция, СПИД |
| Ривонавир | Abbott | ВИЧ-инфекция, |
| СПИД, ARC (ингибитор протеазы) | ||
| Саквинавир | Hoffinann-LaRoche | ВИЧ-инфекция, СПИД, ARC (ингибитор протеазы) |
| Ставудин d4T Дидегидродезокситимидин | Bristol-Myers Squibb | ВИЧ-инфекция, СПИД, ARC |
| Валахщкловир | Glaxo Wellcome | Генитальные HSV & CMV инфекции |
| Виразол Рибавирин | Viratek/ICN (Costa Mesa, CA) | БессимптомнаяВИЧ-инфекция положительная, LAS, ARC |
| VX-478 | Vertex | ВИЧ-инфекция, СПИД, ARC |
| Залцитабин | Hofflnann-LaRoche | ВИЧ-инфекция, СПИД. ARC, с AZT |
| Зидовудин; AZT | Glaxo Wellcome | ВИЧ-инфекция, СПИД. ARC, Саркома Капози, в комбинации с др. терапиями |
| Таблица 2ИММУНОМОДУЛЯТОРЫ | ||
| Лекарст. препарат, название | Производитель | Показания |
| AS-101 | Wyeth-Ayerst | СПИД |
| Бропиримин | Pharmacia Upjohn | Развитый СПИД |
| Ацеман | Carrington Labs, Inc. (Irving, TX) | СПИД, ARC |
| CL246.738 | American Cyanamid Lederle Labs | СПИД, Саркома Капози |
| EL10 | Elan Corp, PLC (Gainesville, GA) | ВИЧ-инфекция |
| FP-21399 | Fuki Immunol Pharm | Блоки ВИЧ-инфекций, объединенные с CD4+клетки |
| Гамма Интерферон | Genentech | ARC, в комбинации с w/TNF (фактор некроза опухоли) |
| Гранулоцитный Макрофаговая колония стимулирующего фактора | Genetics Institute Sandoz | СПИД |
| Гранулоцитный Макрофаговая колония стимулирующего фактора | Hoechst-Roussel Immunex | СПИД |
| Гранулоцитный Макрофаговая колония стимулирующего фактора | Schermg-Plough | СПИД, ВИЧ-инфекция комбинация с w/AZT |
| Hiv Core Particle Иммуностимулянт | Rorer | Серопозитивная ВИЧ-инфекция |
| IL-2 Интерлейкин-2 | Cetus | СПИД, в комбинации w/AZT |
| IL-2 Интерлейкин-2 | Hoffman-LaRoche Immunex | СПИД, ARC, ВИЧ-инфекция в комбинации w/AZT |
| IL-2 Интерлейкин-2 (альдеслукин) | Chiron | СПИД, увеличение CD4 в клеточном отсчете |
| Иммуноглобулин внутривенный (человека) | Cutter Biological (Berkeley, CA) | Педиатрия СПИДа, в комбинацииw/AZT |
| IMREG-1 | Imreg (New Orleans, LA) | СПИД, Саркома Капози, ARC, PGL |
| IMREG-2 | Imreg | СПИД, Саркома Капози, ARC, PGL |
| (New Orleans, LA) | ||
| Имутиол диэтил-дитокарбамат | Merieux Institute | СПИД, ARC |
| Альфа-2 Интерферон | Schering Plough | Саркома Капози w/AZT, СПИД |
| Метионин Энкефалин | TNI Pharmaceutical (Chicago, IL) | СПИД, ARC |
| МТР-РЕ Мирамил-Трипетит | Ciba-Geigy Corp. | Саркома Капози |
| Гранулоционная колония факторастимул. | Amgen | СПИД, в комбинация w/AZT |
| Ремун | Immune Response Corp. | Иммунотерапия |
| rCD4 Рекомбинационный растворимый чел. CD4 | Genentech | СПИД, ARC |
| rCD4-lgG гибриды | СПИД, ARC | |
| Рекомбинационный растворимый чел. CD4 | ||
| Интерферон Альфа 2а | Hoffman-La Roche | Саркома Калози СПИД, ARC в комбинации w/AZT |
| SK&F106528 Растворимый Т4 | Smith Kline | ВИЧ-инфекция |
| Тимопентин | Immunobiology Research Institute (Annandale, NJ) | ВИЧ-инфекция |
| Фактор некроза опухоли; TNF | Genentech | ARC, в комбинации с w/гамма интерфероном |
| Таблица 3ПРОТИВОИНФЕКЦИОННЫЕ | ||
| Лекарственный препарат название | Производитель | Показания |
| Клидамицин с Примахином | Pharmacia Upjohn | PCP |
| Флуконазол | Pfizer | Криптококковый менингит, кандидиоз |
| Pastille Нистагин Pastille | Squibb Corp. | Предотвращение орального кандидамикоза |
| Орнидол Эфлорнитин | Merrell Dow | PCP |
| Пентамидин Изетионат (ТМ & IV) | LyphoMed (Rosemont, IL) | PCP лечение |
| Триметоприн | Антибактериальный | |
| Триметоприн/ сульфа | Антибактериальный | |
| Пиритрексим | Burroughs Wellcome | РСР-лечение |
| Пентамидин изетион для ингаляции | Fisons Corporation | PCP-профилактика |
| Спирамицин | Rhone-Poulenc | Криптоспоридийная Диарея |
| менингит | ||
| Триметотриксат | Warner-Lambert | PCP |
| Даунорубицин | NeXstar, Sequus | Саркома капози |
| Рекомбинационный Человеческий эритропоэтин | Ortho Phaim. Corp | Серьезная ассоц. анемия с AZT терапией |
| Рекомбинационный Человеческий гормон | Serono | СПИД-связан. Изнурение, кахексия |
| Ацетат Мегестрола | Bristol-Myers Squibb | Лечение ассоц. анорексии, W/СПИД |
| Тестостерон | Alza, Smith Kline | СПИД-изнурение |
| Общее энтеральное питание | Norwich Eaton Pharmaceuticals | Диарея и малабсорбция, связанные СПИД |
Кроме того, соединения по настоящему изобретению могут быть применены в комбинациях, которые включают, более чем три анти-ВИЧ лекарственных препарата. Были исследованы комбинации четырех или даже пяти ВИЧ лекарственных препаратов и, как ожидается, соединения настоящего изобретения будут полезным компонентом таких комбинаций.
Кроме того, соединения по настоящему изобретению могут быть применены в комбинации с другим классом веществ для лечения СПИДа, которые называются ВИЧ входящими ингибиторами. Примеры таких ВИЧ входящих ингибиторов рассмотрены в DRUGS OF THE FUTURE 1999. 24(12), pp.1355-1362; CELL, Vol.9, pp.243-246, Oct.29, 1999; and DRUG DISCOVERY TODAY, Vol.5, №5, May 2000, pp.183-194.
Подразумевается, что набор комбинаций соединений по настоящему изобретению с противовирусными препаратами против СПИДа, иммуномодуляторами, противоинфекционными препаратами, ВИЧ входящими ингибиторами или вакцинами, не ограничивается списком в вышеупомянутой таблице, и он может включать в принципе любую комбинацию с любой фармацевтической структурой, полезной для лечения СПИДа.
Предпочтительными являются сочетания для одновременного или альтернативного лечения, содержащие соединения по настоящему изобретению и ингибиторы ВИЧ-протеазы и/или ненуклеозидный ингибитор - обратимости ВИЧ транскриптазы. Необязательным четвертым компонентом в комбинации является нуклеозидный ингибитор обратимости ВИЧ транскриптазы, такой как AZT, ЗТС, ddC или ddl. Предпочтительным ингибитором ВИЧ-протеазы является индинавир, который представляет собой сульфатную соль N-(2(R)-гидрокси-1-(S)-инданил)-2(R)-фенилметил-4-(S)-гидрокси-5-(1-(4-(3-пиридилметил)-2(S)-N'-(трет-бутилкарбоксамидо)-пиперазинил))-пентанамида этанолата, который синтезируют согласно US 5413999. Индинавир обычно вводят в виде дозы 800 мг три раза в день. Другие предпочтительные ингибиторы протеазы представляют собой нелфинавир и ритонавир. Другой предпочтительный ингибитор ВИЧ-протеазы представляет собой саквинавир, который вводят в дозе 600 или 1200 мг в день. И наконец, новый ингибитор протеазы, BMS-232632, который на текущий момент проходит клинические испытания, может стать предпочтительным ингибитором. Предпочтительные ненуклеозидные ингибиторы ВИЧ-обратимости транскриптазы включают эфавиренц. Получение ddC, ddl и AZT также описано в ЕРО 0484071. Указанные комбинации могут оказывать неожиданное воздействие на сокращение распространения и степени инфецирования ВИЧ-инфекцией. Предпочтительные сочетания включают следующие сочетания (1) индинавир с эфавиренцом и, необязательно, AZT, и/или 3ТС, и/или ddl и/или ddC; (2) индинавир и любой из AZT, и/или ddl, и/или ddC, и/или 3ТС, в особенности индинавир и AZT и 3ТС; (3) ставудин и ЗТС и/или зидовудин; (4) зидовудин и ламивудин, и 141W94 и 1592U89; (5) зидовудин и ламивудин.
В таких сочетаниях соединение по настоящему изобретению и другие активные агенты могут быть введены отдельно или все вместе. В дополнение к сказанному, введение одного элемента может быть осуществлено до, во время или последовательно с введением других агентов (а).
Родственные азаиндолы, такие как 4-азаиндол, 5-азаиндол, 6-азаиндол или 7-азаиндол, получают с помощью методик, описанных в литературе (Mahadevan et al., Ref.25(a)) или Hands et. al. Ref.25(b) и они являются коммерчески доступными (7-азаиндол из Aldrich Co.). В указанной ссылке, а также в аналогичных ссылках приведены некоторые примеры замещенных азаиндолов. Специалист в данной области может определить общую методику, которая распространяется на азаиндолы, имеющие различные заместители в исходных продуктах. Азаиндолы могут быть также получены через пути, описанные на схемах 1 и 2.
На схеме 1 синтез индола по Бартоли (Dobson et al., Ref.25(С)) распространен на получение замещенных азаиндолов. Нитропиридин 22 взаимодействует с избытком винилмагнийбромида при -78°С. После нагревания до -20°С получают желаемый азаиндол 1. Как правило, эти температурные интервалы являются оптимальными, но в конкретных примерах могут варьироваться обычно не более, чем на 20°С, однако случается и более, чтобы оптимизировать выход. Винилмагнийбромид является коммерческим продуктом, который получают в виде раствора в тетрагидрофуране или в некоторых случаях более оптимально его можно готовить в свежем виде из винилбромида и магния, используя известные методики. Винилмагнийхлорид также может быть применен в других примерах.
На схеме 2 ацетилен конденсируют с галогенпиридином 23 при использовании Pd(0) катализатора, чтобы получить 24. Последующая обработка основанием приводит к циклизации 24, что дает желаемый азаиндол 1 (Sakamoto et al., Ref.26). Пригодные основания для второй стадии включают метилат натрия, алкоксидные основания натрия, лития или калия.
Общие методики получения азаиндолпиперазиндиамида 5 формулы I описаны на схеме 3 и схеме 4.
Азаиндол 1, реагирует с MeMgl (метилмагнийиодид) и ZnCl2 (хлорид цинка), после чего добавляют ClCOCOOMe (метилхлороксоацетат), что дает глиоксилметиловый эфир 2 азаиндола (Shadrina et al., Ref.27). Альтернативно соединение 2 может быть получено путем взаимодействия азаиндола 1 с избытком ClCOCOOMe в присутствии AICI3 (хлорида алюминия) (Sycheva et al., Ref.28). Гидролиз метилового эфира 2 дает калийную соль 3, которую подвергают конденсации с монобензоилированными производными пиперазина 4 в присутствии DEPBT (3-(диэтоксифосфорилокси)-1,2,3-бензотриазин-4(3Н)-оном) и N,N-диизопропилэтиламином, обычно известных как основание Ханига, чтобы получить азаиндолпиперазиндиамид 5 (Li et al., Ref.29). Монобензоилированные производные пиперазина 4 могут быть получены согласно хорошо разработанной методике, такой как описана у Desai et al., Ref.30(a), Adamczyk et al., Ref.30(b), Rossen et al., Ref.30(c) и Wang et al., 30(д) и 30(е).
Альтернативная методика получения 5 включает обработку азаиндола 1, полученного как описано в литературе или из коммерческих источников с MeMgl и ZnCl2, с последующим добавлением ClCOCOCl (оксалилхлорида) либо в ТГФ (тетрагидрофуране), либо в этиловом эфире, что дает смесь желаемого продукта, глиоксилхлорида 6 и ацилхлорида 1, схема 4. Полученную смесь глиоксилхлорида 6 и ацилхлорида 7 затем конденсируют с монобензоилированными производными пиперазина 4 в основных условиях, что дает продукт 5 в виде смеси двух соединений (n=1 и 2).
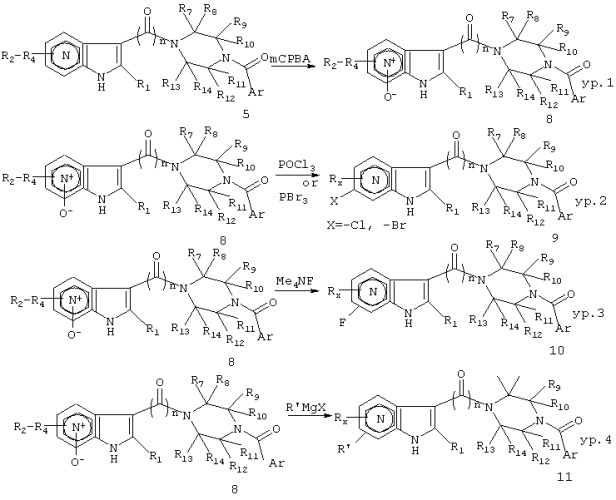
Общие пути дальнейшей фунционализации азаиндольных колец приведены на схеме 5. Должно быть понятно, что символ RX означает, что он представляет собой общее определение остальных заместителей из R4-R2, которые находятся на азаиндольном кольце. Как показано на схеме 5, азаиндол может быть окислен до соответствующего N-оксидного производного 8 при использовании mCPBA (метахлорпербензойной кислотой) в ацетоне или ДМФА (диметилформамиде) (уравнение (ур.) 1, Harada et al., Ref.31 и Antonini et al., Ref.32). N-оксид 8 может быть превращен в различные замещенные производные азаиндола, используя хорошо известные реагенты, такие как оксихлорид фосфора (POCl3) (ур.2, Schneller et al., Ref.33(a)) или трибромид фосфора (ур.2, Wozniak et al., Ref.33(b)), реагенты Гриньяра RMgX (R=алкил, Х=Cl, Br или I) (ур.4, Shiotani et al., Ref.34), триметилсилилциамид (TMSCN) (yp.5, Minakata et al., Ref.35), Ac2O (yp.6, Klemm et al., Ref.36), тиол через тиолат натрия или другие тиолаты (ур.7, Shiotani et al., Ref.37), спирт через алкоксиды металла, как в ссылке 37 или (ур.8, Hayashida et al., Ref.38) и амин (ур.9, используя аммиак или амин в присутствии TsCl в хлорформе/воде как у Miura et al., Ref.39; или в аналогичных условиях, но 10% водным раствором NaOH, также описанным в Solekhova et al., Ref.40). В таких условиях (соответственно) атом хлора или брома, нитрильная группа, алкильная группа, гидроксильная группа, тиольная группа, апкоксигруппа и аминогруппа могут быть включены в пиридиновое кольцо. Аналогично тетраметиламмоний фторид (Me4NF) превращает N-оксиды 8 во фторазаиндолы (ур.3). Дальнейшие стандартные модификации ОН группы также хорошо обеспечивают алкоксифункцию (ур.6).
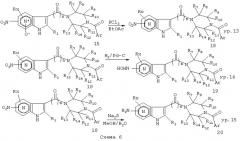
Нитрирование N-оксидов азаиндола приводит к включению нитрогруппы азаиндольное кольцо, как показано на схеме 6 (ур.10, Antonini et al., Ref.32). Нитрогруппа может быть затем замещена с помощью различных нуклефильных агентов, таких как OR, NR1R2 или SR, по хорошо известной химической схеме (ур.11, Regnouf De Vains et al., Ref.41(a), Miura et al., Ref.41(b), Profft et al., Ref.41(с)). Полученные N-оксиды 16 быстро восстанавливают до соответствующих азаиндолов 17, используя трихлорид фосфора (PCl3) (ур.12, Antonini et al., Ref.32 и Nesi et al., Ref.42) или другие восстанавливающие агенты. Аналогично нитрозамещенный N-оксид 15 может быть восстановлен до азаиндола 18, используя трихлорид фосфора (ур.13). Нитрогруппа соединения 18 может быть восстановлена до любого гидроксиламина (NHOH) (ур.14, Walser et al., Ref.43(a) и Barker et al., Ref.43(b)) или амино (NH2) группы (ур.15, Nesi et al., Ref.42 и Ayyangar et al., Ref.44) путем тщательного подбора различных условий восстановления.
Алкилирование атома азота в позиции 1 производных азаиндола может быть достигнуто, используя NaH в качестве основания, ДМФА как растворителя и алоилгалоида или сульфоната в качестве алкилирующего агента, согласно процессу, описанному в литературе (Mahadevan et al., Ref.45) (ур.16, схема 7).
Галоиды могут быть превращены в разнообразные функциональности, такие как нитрил (ур.17), аминогруппа (ур.18) и/или алкоксигруппа (ур.19) (Схема 8), используя хорошо разработанные методики. Примеры указанных типов превращений, раскрытых в равенстве, приведенном в ур.17, раскрыты в Sakamoto et al. (Ref.46(а)), где цианид меди используют для образования нитрила из галоида, у Halley et al. (Ref.46(b)), который получает нитрилы через цианид меди I в ДМФА, Yamaguchi et al. (Ref.46 (c)), Funhoff et al. (Ref.46(д)), а также используют CuCN в NMP, Shiotani et al. (Ref.37). Обычно реакция CuCN для замещения галогена требует нагревания. Температуры, такие как 145°С в течение 18 часов, как было найдено, являются предпочтительными, но эти условия могут варьироваться. Температура может быть повышена или понижена вплоть до 100°С и время реакции может варьироваться от столь небольшого как 30 минут, до столь длинного как 80 часов в зависимости от температуры реакции и субстрата. Как альтернатива уравнению 17, Klimesova et al. используют в качестве исходного первичный амид (который может быть получен из карбоновой кислоты, как широко описано) и оксихлоридфосфор для образования нитрила (Ref.47) и Katputzky et al. (Ref.48). Как показано в уравнении 18, галоиды могут быть замещены аминами или аммиаком. Некоторые примерные условия описаны в Shiotani et. al. ссылка 37 и в Katputzky et.al. ссылка 48. Например, нагревание галоида 9 в избытке первичного или вторичного амина как растворителя при температуре кипения (или между 20°С и 200°С) приводит к замещению галогена, что обеспечивает амины 27. В случае аммиака или летучих аминов может быть использован автоклав, как описано в Katputzky et al. ссылка 48, чтобы осуществлять реакцию без потери летучего амина при нагревании. Реакции могут быть отслежены с помощью ТСХ или жидкостной хроматографии, при этом температуру реакции поднимают пока осуществляется взаимодействие. Поскольку амин дорог, можно применять диоксаны или пиридины в качестве сорастворителей. Альтернативная методика применяет модифицированный метод палладиевого катализа по Hartwig (Yale) или Buchwald (MIT), чтобы вызвать замещения.в мягких условиях. Как показано в ур.19 на схеме 8, алкоксиды могут быть использованы для замещения галогенов в 9, чтобы обеспечить эфиры 26. Обычно указанное превращение лучшие осуществлять при добавлении натрия к раствору родственного спирта, чтобы образовать алканоат. В качестве альтернативы можно использовать сильное основание, такое как NaH, или NaN(SiMe3)2. Соответствующие литиевые или калийные основания, а также металлы также могут быть использованы. Обычно используют избыток основания относительно галогена, который должен быть замещен. Кроме того, обычно используют от двух до двадцати эквивалентов алконоата при десяти предпочтительных. Реакцию осуществляют при кипении с обратным холодильником или при температуре от 30°С до 200°С. Как правило, приблизительно 80°С являются оптимальными. Реакция протекает в течение от четырех до восьми часов до ее полного завершения, обычно от 12 до 48 часов. Как описано выше в ур.18, реакцию можно отслеживать. Обычные условия для замещения с помощью метилата натрия в метаноле раскрыты в Shiotani et al. ссылка 37, в общей методике, используемой для получения продуктов примеров 5а, 5с и 6 ссылки.
Нитрильная группа может быть превращена в карбоновую кислоту 28 (ур.20) при использовании водного раствора гидроксида натрия в этаноле по Miletin et al., Ref.49(а); или, используя КОН в водном растворе этанола по Shiotani et al., Ref.49(b); или, используя 6N HCl как в El Hadri et al., Ref.49(с)). Нитрильная группа может быть превращена в сложный эфир 29 (ур.21), используя метоксид натрия в метаноле по Heirtzler et al., Ref.50(а); или, используя HCl в метаноле по Norrby et al., Ref.50(b)). Нитрильная группа может быть превращена в амид 30 (ур.22), используя серную кислоту по Sitsun'Van et al., Ref.51(а); или, используя уксусную кислоту, трет-бутанол, серную кислоту и ацетонитрил по Reich et al., 51(b); или, используя MeOS(O)2F no Salfetnikova et al., 51(с)).
На схема 10 метильная группа на пиридиновом кольце может быть также окислена до карбоновой кислоты 28 при использовании К2Cr2O7 в 98% серной кислоте как в ур.23, Oki et al., Ref.52(а); или, используя триоксид хрома в конц. серной кислоте по Garelli et al., Ref.52(b); или, используя диоксид селена в пиридине по Koyama et