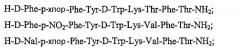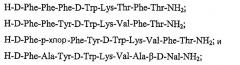Агонисты соматостатина
Иллюстрации
Показать всеПредложены агонисты соматостатина формулы (I), А1-цикло{Cys-A2-D-Trp-A3-A4-Cys}-A5-Y1, где: А1 обозначает D- или L-ароматическую α-аминокислоту, выбранную из группы Phe, D-Phe, Tyr, D-Tyr, β-Nal, D-β-Nal, Cha или D-Cha; А2 обозначает ароматическую α-аминокислоту, выбранную из группы Phe, Tyr, β-Nal или Cha; А3 обозначает Lys или Orn; А4 обозначает β-гидроксивалин, Ser, hSer или Thr; А5 обозначает β-гидроксивалин, Ser, hSer или Thr и Y1 обозначает NH2; где аминный азот каждой пептидной связи и аминогруппа А1 формулы (I) необязательно замещены метильной группой, при условии, что имеется по меньшей мере одна указанная метильная группа, и, при условии, что указанное соединение не является D-Phe-цикло{Cys-Phe-D-Trp-Lys-(N-Me-Thr)-Cys}-Thr-NH2 и его фармацевтически приемлемые соли. 4 н. и 22 з.п. ф-лы, 2 табл.
Реферат
Предпосылки изобретения
Было показано, что соматостатин (SRIF), тетрадекапептид, обнаруженный Brazeau et al., оказывает сильные ингибиторные действия на различные секреторные процессы в тканях, таких как гипофиз, поджелудочная железа и желудочно-кишечный тракт. SRIF действует также в качестве нейромодулятора в центральной нервной системе. Эти биологические действия SRIF, все ингибиторные по природе, индуцируются через серию связанных с G-белком рецепторов, из которых были охарактеризованы пять различных типов (SSTR-1 - SSTR-5). Эти пять подтипов имеют сходные аффинности в отношении эндогенных SRIF-лигандов, но имеют различное распределение в разных тканях. SRIF связывается с пятью различными подтипами рецепторов (SSTR) с относительно высокой и равной аффинностью в отношении каждого подтипа. SRIF обеспечивает различные эффекты, в том числе модуляцию высвобождения гормонов, например, гормона роста, глюкагона, инсулина, амилина, и высвобождение нейротрансмиттеров. Некоторые из этих эффектов ассоциировались с его связыванием со специфическим рецептором SRIF. Например, ингибирование гормона роста было приписано рецептору соматостатина типа 2 (SSTR-2) (Raynor et al., Molecular Pharmacol. 43:838 (1993); Lloyd et al., Am. J. Physiol. 268:G102 (1995)), тогда как ингибирование инсулина было приписано рецептору соматостатина типа-5 (SSTR-5) (Coy, et al., 197:366-371 (1993)). Активация типов 2 и 5 ассоциировалась с супрессией гормона роста и более конкретно GH-секретирующих аденом (акромегалии) и TSH-секретирующих аденом. Активацию типа 2, но не типа 5, связывали с лечением пролактин-секретирующих аденом.
Как хорошо известно специалистам в данной области, SRIF и его аналоги применимы в лечении большого числа разнообразных заболеваний и/или состояний. Примерный, но не исчерпывающий перечень таких заболеваний и/или состояний включает в себя: синдром Кушинга (см. Clark, R.V. et al., Clin. Res. 38, p. 943A, 1990); гонадотропиному (см. Ambrosi B., et al., Acta Endocr. (Copenh.) 122, 569-576, 1990); гиперпаратиреоз (см. Miller, D., et al., Canal. Med. Ass. J., Vol. 145, pp. 227-228, 1991); болезнь Педжета (см. Palmieri, G.M.A., et al., J. of Bone and Mineral Research, 7, (Suppl. 1), p. S240 (Abs. 591), 1992); випому (см. Koberstein, B., et al., Z. Gastroenterology, 28, 295-301, 1990 и Christensen, C., Acta Chir. Scand. 155, 541-543, 1989); незидиобластому и гиперинсулинизм (см. Laron, Z., Israel J. Med. Sci., 26., No. 1, 1-2, 1990, Wilson, D.C., Irish J. Med. Sci., 158, No. 1, 31-32, 1989 и Micic, D., et al., Digestion, 16, Suppl. 1.70. Abs. 193, 1990); гастриному (см. Bauer, F.E., et al., Europ. J. Pharmacol., 183, 55, 1990); синдром Золлингера-Эллисона (см. Mozell, E., et al., Surg. Gynec. Obstet., 170, 476-484, 1990); гиперсекреторную диарею, связанную со СПИДом и другими состояниями (вызванная СПИДом, см. Cello, J.P., et al., Gastroenterology, 98, No. 5, Part 2, Suppl., A163 1990, обусловленную повышенным уровнем гастрин-высвобождающего пептида, см. Alhindawi, R., et al., Can. J. Surg., 33, 139-142, 1990; вторичную реакцию трансплантат против хозяина, см. Bianco J.A., et al., Transplantation, 49, 1194-1195, 1990; диарею, ассоциированную с химиотерапией, см. Petrelli, N., et al., Proc. Amer. Soc. Clin. Oncol., Vol. 10, P 138, Abstr. No. 417 1991); синдром раздражения толстой кишки (см. O'Donnell, L.J.D., et al., Aliment. Pharmacol. Therap., Vol. 4, 177-181, 1990); панкреатит (см. Tulassay, Z., et al., Gastroenterology, 98, No. 5, Part 2, Suppl., A238, 1990); болезнь Крона (см. Fedorak, R.N., et al., Can. J. Gastroenterology, 3, No. 2, 53-57, 1989); системный склероз (см. Soudah, H., et al., Gastroenterology, 98, No. 5, Part 2, Suppl., A129, 1990); рак щитовидной железы (см. Modigliani, E., et al., Ann. Endocr. (Paris), 50, 483-488, 1989); псориаз (см. Camisa, C., et al., Cleveland Clinic J. Med., 57, No. 1, 71-76, 1990); гипотензию (см. Hoeldtke, R.D., et al., Arch. Phys. Med. Rehabil., 69, 895-898, 1988 и Kooner, J.S., et al., Brit. J. Clin. Pharmacol., 28, 735P-736P, 1989); приступы паники (см. Abelson, J.L., et al., Clin. Psychopharmacol., 10, 128-132, 1990); склеродому (см. Soudah, H., Clin. Res., Vol. 39, p. 303A, 1991); обструкцию тонкой кишки (см. Nott, D.M., et al., Brit. J. Surg., Vol. 77, p. A691, 1990); гастроэзофагальный рефлюкс (см. Branch, M.S., et al., Gastroenterology, Vol. 100, No. 5, Part 2, Suppl., p. A425, 1991); дуоденогастральный рефлюкс (см. Hasler, W., et al., Gastroenterology, Vol. 100, No. 5, Part 2, Suppl., p. A448, 1991); болезнь Грейвса (см. Chang, T.C., et al., Brit. Med. J., 304, p. 158, 1992); поликистозную болезнь яичника (см. Prelevic, G.M., et al., Metabolism Clinical and Experimental, 41, Suppl. 2, pp. 76-79, 1992); кровотечение верхней части желудочно-кишечного тракта (см. Jenkins, S.A., et al., Gut, 33, pp. 404-407, 1992 и Arrigoni, A., et al., American Journal of Gastroenterology, 87, p. 1311, (abs. 275), 1992); ложную кисту поджелудочной железы и асцит (см. Hartley, J.E., et al., J. Roy. Soc. Med., 85, pp. 107-108, 1992); лейкемию (см. Santini, et al., 78, (Suppl. 1), p. 429A (Abs. 1708), 1991); менингиому (см. Koper, J.W., et al., J. Clin. Endocr, Metab., 74, pp. 543-547, 1992); и раковую кахексию (см. Bartlett, D.L., et al., Surg. Forum., 42, pp. 14-16, 1991).
Другими показаниями, связанными с активацией подтипов рецепторов SRIF, являются ингибирование инсулина и/или глюкагона и, более конкретно, сахарный диабет, ангиопатия, пролиферативная ретинопатия, феномен Дауна и нефропатия; ингибирование секреции желудочной кислоты и, более конкретно, пептические язвы, энтерокожная и панкреатокожная фистула, синдром раздражения толстой кишки, Дампинг синдром, синдром водянистого стула, связанная со СПИДом диарея, индуцированная химиотерапией диарея, острый или хронический панкреатит и опухоли, секретирующие желудочно-кишечный гормон; лечение рака, такого как гепатома; ингибирование ангиогенеза; лечение воспалительных нарушений, таких как артрит; ретинопатия; хроническое отторжение трансплантата; ангиопластика; предупреждение кровотечения сосудов трансплантата и желудочно-кишечное кровотечение.
Предпочтительно иметь аналог, который является селективным в отношении специфического подтипа или специфических подтипов рецепторов SRIF, ответственных за желательную биологическую реакцию, для уменьшения, таким образом, взаимодействия с другими подтипами рецепторов, которое могло бы приводить к нежелательным побочным действиям. Кроме того, вследствие короткого полупериода существования нативного SRIF были разработаны различные аналоги SRIF, например, для лечения акромегалии (Raynor, et al., Molecular Pharmacol. 43:838 (1993)). Разработка сильнодействующих агонистов SRIF меньшего размера привела к обнаружению различающихся аффинностей различных укороченных лигандов в отношении различных подтипов. По-видимому, остаток Trp8-Lys9 часто присутствует в лигандах, которые узнаются этим рецептором. Остаток Trp8-Lys9 образует часть β-изгиба, который обычно стабилизируется заменой L-Trp на D-Trp, циклизацией скелета, дисульфидным мостиком или всеми ограничениями. Одним непреднамеренным следствием такого структурного упрощения, проведенного до обнаружения множественных подтипов рецепторов, была потеря аффинности связывания широкого спектра. Примером этого является высокая аффинность типа 2, но низкие аффинности типов 1, 3, 4 и 5 пептидов в серии OCTREOTIDE®. Таким образом, многие основные биологические исследования с этим типом аналога не смогли обнаружить эффекты, опосредованные всеми подтипами, но не одним подтипом рецептора SRIF.
Авторы данного изобретения обнаружили, что ограничение пептидного скелета может быть введено N-алкилированием. Эта модификация в значительной степени ограничивает подвергаемый этому действию остаток и предшествующую ему аминокислоту к удлиненной конформации и дополнительно блокирует потенциальные внутримолекулярные сайты образования водородных связей, а также сайты расщепления протеолитическими ферментами, усиливая, таким образом, фармакокинетические свойства пептида. Коммерчески доступными являются только небольшое число N-метиламинокислот, и их синтез является трудоемким. Однако в другом аспекте данного изобретения авторы описали процедуру N-метилирования укороченных аналогов SRIF при любом аминокислотном остатке с использованием твердофазной процедуры, заимствованной из процедуры, сообщенной Miller and Scanlan (J. Am. Chem. Soc. 1997, 119, 2301-2302).
В одном аспекте данное изобретение относится к пептиду в соответствии с формулой (I):
А1-цикло{Cys-A2-D-Trp-A3-A4-Cys]-A5-Y1
(I)
где:
А1 обозначает необязательно замещенную D- или L-ароматическую α-аминокислоту или необязательно замещенный D- или L-цикло(С3-6)алкилаланин;
А2 обозначает необязательно замещенную ароматическую α-аминокислоту или необязательно замещенный цикло(С3-6)алкилаланин;
А3 обозначает Lys или Orn;
А4 обозначает β-гидроксивалин, Ser, hSer или Thr;
А5 обозначает β-гидроксивалин, Ser, hSer или Thr и
Y1 обозначает ОН, NH2 или NHR1, где R1 обозначает (С1-6)алкил;
где каждая указанная необязательно замещенная ароматическая α-аминокислота и каждый указанный необязательно замещенный цикло(С3-6)алкилаланин является необязательно замещенным одним или несколькими заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, NO2, OH, CN, (С1-6)алкила, (С2-6)алкенила, (С2-6)алкинила, (С1-6)алкокси, Bzl, O-Bzl и NR9R10, где R9 и R10, каждый независимо, обозначают Н или (С1-6)алкил; и
где аминный азот каждой пептидной связи и аминогруппа А1 формулы (I) необязательно замещены метильной группой, при условии, что имеется по меньшей мере одна указанная метильная группа;
и, кроме того, при условии, что указанное соединение не является D-Phe-цикло{Cys-Phe-D-Trp-Lys-(N-Me-Thr)-Cys}-Thr-NH2;
или его фармацевтически приемлемой соли.
Предпочтительной группой соединений формулы (I) являются соединения, в которых:
А1 обозначает Phe, D-Phe, Tyr, D-Tyr, β-Nal, D-β-Nal, Cha или D-Cha;
А2 обозначает Phe, Tyr, β-Nal или Cha и
Y1 обозначает ОН или NH2;
или их фармацевтически приемлемая соль.
Предпочтительной группой соединений непосредственно предыдущей группы соединений являются соединения, в которых А1 обозначает D-Phe или Tyr; или в которых А2 обозначает Phe; или в которых А3 обозначает Lys; или в которых А4 обозначает Thr; или в которых А5 обозначает Thr; или их фармацевтически приемлемая соль.
В еще более предпочтительном варианте данное изобретение описывает соединение формулы (I), где указанное соединение имеет формулу:
или его фармацевтически приемлемую соль.
В другом аспекте данное изобретение описывает соединение в соответствии с формулой (II),
где:
А1 обозначает D- или L-изомер Ala, Leu, Ile, Val, Nle, Thr, Ser, β-Nal, β-Pal, Trp, Phe, 2,4-дихлор-Phe, пентафтор-Phe, р-Х-Phe или о-X-Phe, где Х обозначает СН3, Cl, Br, F, OH, OCH3 или NO2;
А2 обозначает Ala, Leu, Ile, Val, Nle, Phe, β-Nal, пиридил-Ala, Trp, 2,4-дихлор-Phe, пентафтор-Phe, о-Х-Phe или р-X-Phe, где Х обозначает СН3, Cl, Br, F, OH, OCH3 или NO2;
А3 обозначает пиридил-Ala, Trp, Phe, β-Nal, 2,4-дихлор-Phe, пентафтор-Phe, о-Х-Phe или р-X-Phe, где Х обозначает СН3, Cl, Br, F, OH, OCH3 или NO2;
А6 обозначает Val, Ala, Leu, Ile, Nle, Thr, Abu или Ser;
А7 обозначает Ala, Leu, Ile, Val, Nle, Phe, β-Nal, пиридил-Ala, Trp, 2,4-дихлор-Phe, пентафтор-Phe, о-Х-Phe или р-X-Phe, где Х обозначает СН3, Cl, Br, F, OH, OCH3 или NO2;
А8 обозначает D- или L-изомер Ala, Leu, Ile, Val, Nle, Thr, Ser, Phe, β-Nal, пиридил-Ala, Trp, 2,4-дихлор-Phe, пентафтор-Phe, p-Х-Phe или о-X-Phe, где Х обозначает СН3, Cl, Br, F, OH, OCH3 или NO2;
каждый R1 и R2, независимо обозначает Н, низший ацил или низший алкил; и R3 обозначает ОН или NH2; где аминный азот каждой из амид-пептидных связей и N-концевая аминогруппа необязательно замещены метильной группой,
при условии, что имеется по меньшей мере одна указанная метильная группа в соединении формулы (II); что по меньшей мере один из А1 и А8 и один из А2 и А7 должен быть ароматической аминокислотой; и что А1, А2, А7 и А8 не могут быть все ароматическими аминокислотами;
или его фармацевтически приемлемую соль.
В одном варианте данное изобретение описывает соединение в соответствии с формулой (II), где указанное соединение выбрано из перечня, состоящего из:
или его фармацевтически приемлемую соль.
В другом варианте данное изобретение описывает пептид, выбранный из перечня пептидов, обозначенных «группой III», состоящего из:
(амидный мостик образован между Lys* и Asp);
или его фармацевтически приемлемую соль, где в соединениях, имеющих два остатка Cys, существует дисульфидная связь и где аминный азот каждой амид-пептидной связи и аминогруппа N-концевой аминокислоты необязательно замещены метильной группой, при условии, что имеется по меньшей мере одна указанная метильная группа в данном соединении.
В следующем аспекте данное изобретение описывает агонисты SRIF, содержащие N-метилированные аналоги агонистов SRIF, охватываемые формулами, или агонисты, описанные в публикациях, приведенных ниже.
Заявка ЕР №P5 164 EU (Inventor: G. Keri);
Van Binst, G. et al. Peptide Research 5:8 (1992);
Horvath, A. et al. Abstract, "Conformations of Somatostatin Analogs Having Antitumor Activity", 22nd European peptide Symposium, September 13-19, 1992, Interlaken, Switzerland;
Патент США №6001801 (1999);
Патент США №4904642 (1990);
Патент США №4871717 (1989);
Патент США №4853371 (1989);
Патент США №4725577 (1988);
Патент США №4684620 (1987);
Патент США №4650787 (1987);
Патент США №4603120 (1986);
Патент США №4585755 (1986);
Заявка ЕР 0203031 А2 (1986);
Патент США №4522813 (1985);
Патент США №4486415 (1984);
Патент США №4485101 (1984);
Патент США №4435385 (1984);
Патент США №4395403 (1983);
Патент США №4369179 (1983);
Патент США №4360516 (1982);
Патент США №4358439 (1982);
Патент США №4328214 (1982);
Патент США №4316890 (1982);
Патент США №4310518 (1982);
Патент США №4291022 (1981);
Патент США №4238481 (1980);
Патент США №4235886 (1980);
Патент США №4224190 (1980);
Патент США №4211693 (1980);
Патент США №4190648 (1980);
Патент США №4146612 (1979);
Патент США №4133782 (1979);
Патент США №5506339 (1996);
Патент США №4261885 (1981);
Патент США №4728638 (1988);
Патент США №4282143 (1981);
Патент США №4215039 (1980);
Патент США №4209426 (1980);
Патент США №4190575 (1980);
Заявка ЕР 0363589 А2 (1990);
EP патент №0389180 (1990);
Заявка ЕР №0505680 (1982);
Заявка ЕР №0083305 (1982);
Заявка ЕР №0030920 (1980);
PCT заявка № WO 97/01579 (1997);
PCT заявка № WO 91/18016 (1991);
PCT заявка № WO 91/09056 (1991);
PCT заявка № WO 90/12811 (1990);
PCT заявка № WO 88/05052 (1988);
Заявка на патент Великобритании № GB 2095261 (1981); и
Заявка на патент Франции № FR 2522655 (1983).
Соединения формулы (I), формулы (II) и группы (III) данной заявки применимы для тех же самых применений, что и SRIF, в зависимости от специфичности связывания или ее отсутствия, как может быть определено описанными здесь анализами связывания.
Таким образом, в другом аспекте данное изобретение описывает способ связывания одного или нескольких рецепторов соматостатина человека подтипов 1, 2, 3, 4 и 5, который предусматривает стадию введения одного или нескольких соединений формулы (I) и/или формулы (II) и/или группы (III) или фармацевтически приемлемой соли (солей) такого соединения или таких соединений реципиенту, нуждающемуся в таком введении.
В предпочтительном варианте способа, непосредственно указанного выше, описан способ индуцирования действия агониста соматостатина, предусматривающий стадию введения одного или нескольких соединений формулы (I) и/или формулы (II) и/или группы (III) или фармацевтически приемлемой соли (солей) такого соединения или таких соединений реципиенту, нуждающемуся в таком введении.
В более предпочтительном варианте способа, непосредственно указанного выше, описан способ лечения заболевания или состояния человека или другого животного, нуждающегося в этом, предусматривающий стадию введения одного или нескольких соединений формулы (I) и/или формулы (II) и/или группы (III) или фармацевтически приемлемой соли (солей) такого соединения или таких соединений указанному человеку или животному, где указанное заболевание или состояние выбрано из группы, состоящей из синдрома Кушинга, гонадотропиномы, гиперпаратиреоза, болезни Педжета, випомы, незидиобластомы и гиперинсулинизма, гастриномы, синдрома Золлингера-Эллисона, гиперсекреторной диареи, связанной со СПИДом и другими состояниями, синдрома раздражения толстой кишки, панкреатита, болезни Крона, системного склероза, рака щитовидной железы, псориаза, гипотензии, приступов паники, склеродомы, обструкции тонкой кишки, гастроэзофагального рефлюкса, дуоденогастрального рефлюкса, болезни Грейвса, поликистозной болезни яичника, кровотечения верхней части желудочно-кишечного тракта, ложной кисты поджелудочной железы, панкреатического асцита, лейкемии, менингиомы, раковой кахексии, акромегалии, рестеноза, гепатомы, рака легких, меланомы, ингибирования ускоренного роста солидной опухоли, уменьшения веса тела, лечения инсулинорезистентности, синдрома Х, пролонгирования выживания панкреатических клеток, фиброза, гиперлипидемии, гиперамилинемии, гиперпролактинемии и пролактиномы.
За исключением N-концевой аминокислоты, все аббревиатуры (например, Phe для А1) аминокислот в этом описании обозначают структуру -NH-CH(R)-CO-, где R в непосредственно предыдущей формуле обозначает боковую цепь аминокислоты (например, СН3 для Ala). Для N-концевой аминокислоты эта аббревиатура обозначает структуру (R1R2)-N-CH(R)-CO-, где R обозначает боковую цепь аминокислоты и R1 и R2 имеют указанные выше значения.
Номенклатура для подтипов рецепторов соматостатина находится в соответствии с рекомендациями IUPHAR, где SSTR-4 относится к рецептору, первоначально клонированному Bruno et al., а SSTR-5 относится к рецептору, клонированному O'Carroll et al. Аббревиатуры обычных аминокислот находятся в соответствии с рекомендациями IUPAC-IUB. Далее приведены аббревиатуры некоторых аминокислот, которые могут встретиться здесь:
Abu = α-аминомасляная кислота;
Aib = α-аминоизомасляная кислота;
β-Ala = β-аланин;
Amp = 4-аминофенилаланин;
Ava = 5-аминовалериановая кислота;
Cha = циклогексилаланин;
Gaba = γ-аминомасляная кислота;
Lys = лизин;
β-Nal = β-(2-нафтил)аланин;
Nle = норлейцин;
Nva = норвалин;
Orn = орнитин;
Pal = β-(3-пиридинил)аланин;
Phe = фенилаланин;
Ser = серин;
hSer = гомосерин;
Thr = треонин и
Tyr = тирозин.
Дополнительные аббревиатуры включают в себя:
DBU, 1,8-диазабицикло[5.4.0]ундец-7-ен;
DCM (ДХМ), дихлорметан;
DIC, дициклогексилкарбодиимид;
DIEA, диизопропилэтиламин;
DMF (ДМФ), диметилформамид;
MTBD, 1,3,4,6,7,8-гексагидро-1-метил-2Н-пиримидо[1,2-a]пиримидин;
NPS, 2-нитрофенилсульфонил;
TBTU, О-бензотриазол-1-ил-N,N,N',N'-тетраметилуроний-тетрафторборат; и
TFA (ТФУ), трифторуксусная кислота.
Соединение данного изобретения или его фармацевтически приемлемая соль может вводиться пероральным, парентеральным (например, внутримышечной, внутрибрюшинной, внутривенной или подкожной инъекцией или введением имплантата), назальным, вагинальным, ректальным, сублингвальным или местным способом введения и может быть приготовлено с фармацевтически приемлемыми носителями для обеспечения дозированных форм, подходящих для каждого способа введения.
Твердые дозированные формы для перорального введения включают в себя капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах активное вещество смешано по меньшей мере с одним инертным фармацевтически приемлемым носителем, таким как сахароза, лактоза или крахмал. Такие дозированные формы могут также содержать, что является обычной практикой, дополнительные вещества, иные, чем такие инертные разбавители, например, смазывающие агенты, такие как стеарат магния. В случае капсул, таблеток и пилюль, дозированные формы могут также содержать буферные средства. Таблетки и пилюли могут быть также приготовлены с энтеросолюбильными покрытиями.
Жидкие дозированные формы для перорального введения включают в себя фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы, эликсиры, содержащие инертные разбавители, обычно используемые в данной области, такие как вода. Кроме таких инертных разбавителей, композиции могут также включать в себя вспомогательные вещества, такие как увлажняющие агенты, эмульгирующие и суспендирующие агенты и подсластители, вкусовые добавки и ароматизирующие агенты.
Препараты данного изобретения для парентерального введения включают в себя стерильные водные и неводные растворы, суспензии или эмульсии. Примерами неводных растворителей или носителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло и кукурузное масло, желатин и пригодные для инъекций органические эфиры, такие как этилолеат. Такие дозированные формы могут также содержать вспомогательные вещества, например, консервирующие, увлажняющие, эмульгирующие и диспергирующие агенты. Они могут быть стерилизованными, например, фильтрованием через удерживающий бактерии фильтр, включением стерилизующих агентов в композиции, облучением композиций или нагреванием композиций. Они могут быть также приготовлены в форме стерильных твердых композиций, которые могут быть растворены в стерильной воде или некоторой другой стерильной среде для инъекций непосредственно перед использованием.
Композиции для ректального или вагинального введения являются предпочтительно суппозиториями, которые могут содержать, наряду с активным веществом, наполнители, такие как масло какао или воск для суппозиториев.
Композиции для назального или сублингвального введения также готовят со стандартными наполнителями, хорошо известными в данной области.
Дозировка активного ингредиента в композициях данного изобретения может варьироваться; однако, необходимо, чтобы количество активного ингредиента было таким, чтобы была получена подходящая дозированная форма. Выбранная дозировка зависит от желаемого терапевтического эффекта, от способа введения и от продолжительности лечения. Обычно уровни доз 25 мкг/кг/день - 100 мг/кг/день (на кг веса тела) вводят ежедневно в виде единственной дозы или в виде разделенных множественных доз людям и другим животным, например, млекопитающим, для получения желаемого терапевтического действия.
Предпочтительным обычным диапазоном доз является 250 мкг/кг/день - 5 мг/кг/день (на кг веса тела ежедневно), которые могут вводиться в виде единственной дозы или в виде разделенных множественных доз.
Далее, соединение данного изобретения или его фармацевтически приемлемая соль могут вводиться в композиции пролонгированного действия, такой как описанные в следующих патентах. Среди этих форм предпочтительными являются формы для замедленного высвобождения в течение 14 дней или 28 дней. Патент США №5672659 описывает композиции пролонгированного высвобождения, содержащие пептид и сложный полиэфир. Патент США №5595760 описывает композиции пролонгированного высвобождения, содержащие пептид в гелеобразующей форме. Патент США №5821221 описывает полимерные композиции пролонгированного высвобождения, содержащие пептид и хитозан. Патент США №5915883 описывает композиции пролонгированного высвобождения, содержащие пептид и циклодекстрин. Международная заявка на патент № РСТ/US99/01180 (публикация № WO 99/38536, 5 августа 1999 года) описывает абсорбируемые композиции пептида пролонгированного действия. Содержание предыдущих патентов и заявок включено здесь в качестве ссылки.
Применение композиций немедленного или пролонгированного высвобождения зависит от типа показаний. Если показанием является острое или сверхострое нарушение, будет предпочтительным лечение формой немедленного высвобождения, а не композицией пролонгированного высвобождения. Напротив, для превентивных или долгосрочных лечений будет предпочтительной композиция пролонгированного высвобождения.
Подробное описание изобретения
На основании приведенного здесь описания специалист с квалификацией в данной области сможет использовать данное изобретение в полной степени. Таким образом, следующие частные варианты должны рассматриваться только как иллюстрации данного изобретения и не должны рассматриваться как ограничивающие полный объем данного изобретения.
Синтез
Смолу гидрохлорида 4-метилбензгидриламина (0,25 или 0,5 мэкв/г) получали от Advanced ChemTech Inc., Louisville, KY. Nα-трет-бутилоксикарбонил (Вос)-защищенные аминокислоты приобретали от Bachem Inc., Torrance, CA, Advanced ChemTech Inc. и Synthetech Inc., Albany, OR. Реакционноспособные боковые цепи аминокислот маскировали одной из следующих групп: Cys, 4-метилбензилоксикарбонил; Lys, 2-хлорбензилоксикарбонил; Thr, О-бензил; Tyr, О-2,6-дихлорбензил. Все реагенты и растворители имели чистоту ACS или более высокую, и их использовали без дополнительной очистки.
Соединения данного изобретения, например, соединения формулы (I), синтезировали на функционализированной 4-метилбензгидриламином, 1% сшитой полистирольной смоле (0,25 или 0,5 мэкв/г), в 0,25 ммоль-масштабе на синтезаторе Advanced ChemTech (модель 200) с использованием следующего протокола: деблокирование, 40% ТФУ (2 мин, 20 мин); цикл промывок DCM (три промывки); нейтрализация, 10% DIEA (1 мин, 5 мин); цикл промывки DMF; цикл промывок DCM (две промывки); двойное связывание; сначала с 1,3-диизопропилкарбодиимидными эфирами (3 экв.), 30 мин в DCM; промывка DCM (три промывки); второе связывание с предварительно полученными эфирами TBTU (3 экв.), 90 мин в DMF, с каталитическим количеством DIEA; промывка DMF (одна промывка); промывка DCM (три промывки). Реакции связывания подвергали качественному мониторингу с использованием нингидринового теста.
Nα-защита. После удаления защитной группы аминогруппы в желательном сайте метилирования эту смолу суспендировали в DCM (20 мл). К этой суспензии добавляли коллидин (3 экв.) и о-нитробензолсульфонилхлорид (3 экв.) и эту смесь встряхивали с использованием синтезатора Advanced ChemTech (модель 200) в течение 2 часов. Затем эту смолу подвергали промывке DCM (2 промывки) и промывке DMF (3 промывки). Защиту подвергали качественному мониторингу с использованием нингидринового теста.
Nα-метилирование. Защищенную о-нитробензолсульфониламидом смолу суспендировали в DMF (20 мл), к которому добавляли MTBD (3 экв.) и 4-нитробензолсульфонат или диметилсульфат (для Cys11). Смесь встряхивали с использованием синтезатора Advanced ChemTech (модель 200) в течение 0,5 ч и эту смолу подвергали промывке DMF (4 промывки).
Удаление защиты Nα-Ме. После метилирования желаемого остатка смолу опять суспендировали в DMF (20 мл). К этой суспензии добавляли DBU (3 экв.) и 2-меркаптоэтанол (3 экв.) и смесь встряхивали в течение 0,5 ч с использованием синтезатора Advanced ChemTech (модель 200). Затем эту смолу тщательно промывали DMF (5 промывок).
Отщепление пептида. Пептиды отщепляли от смолы-носителя с одновременным удалением защитных групп боковых цепей ацидолизом с использованием безводного фтороводорода, содержащего акцепторный анизол (˜30% о./о.), в течение 45 мин при 0°С. Пептиды циклизовали в 90% уксусной кислоте (˜600 мл) с небольшим избытком I2 (15 мин). Затем избыток I2 удаляли добавлением аскорбиновой кислоты.
Очистка. Неочищенные пептиды очищали препаративной ОФ-ВЭЖХ на связанном с С-18 силикагеле с использованием аксиальных компрессионных колонок (Dynamax-300A, 5 или 8 мкм, 21,4 х 250 мм). Использовали систему элюции с линейным градиентом при скорости тока 20 мл/мин: А; 0,1% ТФУ, В; 0,1% ТФУ в 80% MeCN, 20% В - 50% В при 1% в минуту. Разделение контролировали с использованием аналитической ОФ-ВЭЖХ при 215 нм. Фракции, содержащие продукт, объединяли, концентрировали в вакууме и подвергали лиофилизации. Каждый пептид получали в виде пушистого белого порошка постоянного веса посредством лиофилизации из водной уксусной кислоты. Чистоту конечного продукта оценивали аналитической ОФ-ВЭЖХ при 215 нм. Аналитическую ОФ-ВЭЖХ регистрировали с использованием носителя Vydac C-18 (4,6×250 мкм, размер пор 300 Е, Liquid Separation Group). Систему линейного градиента использовали при скорости тока 1,5 мл/мин: ВЭЖХ-1, А, 0,1% ТФУ; В, 0,1% ТФУ в 80% MeCN; 20% В - 50% В при 1% в минуту; ВЭЖХ-2, С, 5% MeCN в TEAP (0,1 М, рН 3); D, 20% С в MeCN, 10% D - 70% D при 1% в минуту. Элюент из колонки подвергали мониторингу при 215 нм. Время удерживания и чистоту каждого пептида оценивали с использованием Rainin Dynamax HPLC Method Manager.
Аминокислотный анализ. Пептиды гидролизовали в вакууме (110°С; 20 ч) в 4 М метансульфоновой кислоте, содержащей 0,2% 3-(2-аминоэтил)индол (Pierce). Аминокислотные анализы выполняли на гидролизатах после дериватизации о-фталидальдегидным реагентом (Sigma Chemicals Co.) с использованием автоматической системы ВЭЖХ (Rainin Instrument Co.), снабженной аксиальной компрессионной колонкой С-18 100×4,6 мм, 3 мкм с интегральной защитной колонкой (Microsorb AAAnalysis™, Type O; Rainin Instrument Co.). Дериватизованные первичные аминокислоты элюировали с использованием двойного градиента буфера А; 0,10 М ацетат натрия, содержащий 4,5% об./об. метанола и 0,5% об./об. тетрагидрофурана, при рН 7,2, и буфера В; метанол. Использовали последовательность градиента; 0% А при 0 мин; 35% А при 16,5 мин; 90% А при 30 мин и 90% А при 33 мин со скоростью тока 1,0 мл в минуту при температуре окружающей среды. Элюент подвергали мониторингу при 340 нм и интегрировали с использованием Dynamax HPLC Method Manager (Rainin). Стандартные времена удерживания были следующими; Asp, 6,6 мин; Arg, 19,9 мин; Trp, 25,4 мин и Lys, 29,5 мин. Каждый пептид таблицы I давал ожидаемые аналитические результаты для первичных аминокислот. Цистеин не определяли количественно.
Масс-спектрометрия. Пептиды анализировали масс-спектрометрией со временем пролета, определяемым в лазерной десорбции/ионизации с использованием матрикса, при помощи масс-спектрометра LaserMat 2000 (Thermal Bioanalysis, San Jose, CA) с использованием α-циано-4-гидроксикоричной кислоты в качестве матрикса с Веществом Р (1348,7 Да) в качестве внутреннего стандарта. В каждом случае спектры состояли из главного пика ионов М-Н для внутреннего стандарта, ожидаемого пика аналита М-Н и небольшого числа пиков, связанных с этим матриксом (<500 Да). Величины массы, полученные таким образом для репрезентативных соединений данного изобретения, подробно показаны в таблице 1.
Ингибирование аналогом SRIF высвобождения GH. Собирали передние доли гипофиза взрослых самцов крыс и диспергировали их ранее описанным способом с использованием трипсина/ДНКазы (Murphy, W.A.; Taylor, J.; Moreau, J.-P. and Coy, D.H., Peptide Res. 1989, 2, 128-132). Диспергированные клетки разбавляли стерильно отфильтрованной средой Игла, модифицированной по способу Дульбекко (МЕМ, Gibco Laboratories, Grand Island, NY), которая была дополнена 2,5% фетальной телячьей сывороткой (Gibco), 3% лошадиной сывороткой (Gibco), 10% свежей крысиной сывороткой (хранящейся на льду не дольше 1 часа) от доноров гипофиза, 1% МЕМ с заменимыми аминокислотами (Gibco), гентамицином (10 нг/мл, Sigma) и нистатином (10000 Е/мл, Gibco). Клетки высевали случайным образом при плотности приблизительно 200000 клеток на лунку (Costar cluster 24; Rochester Scientific Co., Rochester, NY). Посеянные клетки поддерживали в вышеупомянутой среде Дульбекко в увлажненной атмосфере 95% воздуха/5% СО2 при 37°С в течение 4-5 дней. При приготовлении для введения гормона клетки промывали средой 199 (Gibco, 3 х 1 мл). Каждую дозу соединения данного изобретения тестировали в трех повторностях (лунках) в общем объеме 1 мл среды 199, содержащей 1% БСА (фракция V; Sigma Chemical Co.). Все лунки содержали GHRH(1-29)NH2 (1 нМ). После инкубации в атмосфере воздух/диоксид углерода (95/5%, 3 ч при 37°С) среду удаляли и хранили при -20°С до анализа на содержание гормона. Гормон роста в средах измеряли стандартным РИА с двойными антителами с использованием компонентов, предоставленных доктором A.E. Parlow, в рамках Международной программы по гормонам и гипофизу (NHHP) Torrance, CA. IC50 агониста рассчитывали с использованием Sigmaplot (Jandel Scientific, San Rafael, CA). Величины выражали в виде среднего IC50 (нМ) ± SEM (стандартная ошибка среднего) из (n) отдельных кривых доза-ответ.
Функциональная экспрессия клонированных рецепторов соматостатина человека. Геномные клоны, содержащие рецепторы соматостатина человека (hSSTR-1 - hSSTR-5) (Yamada, Y., et al., Proc. Natl. Acad. Sci. USA. 1992, 89, 251-255; Yasuda, K., et al., J. Biol. Chem. 1992, 267, 20422-20428; Yamada, Y., et al., Mol. Pharmacol. 1992, 42, 2136-2142; Rohrer, L., et al., Proc. Natl. Acad. Sci. USA. 1993, 90, 4196-4200), были предоставлены доктором Graeme I. Bell из университета Чикаго. кДНК hSSTR-1, hSSTR-2, hSSTR-3, hSSTR-4 и hSSTR-5 выделяли в виде PstI-XmnI-фрагмента 1,5 т.п.н., BamHI-HindIII-фрагмента 1,7 т.п.н., NcoI-HindIII-фрагмента 2,0 т.п.н., NheI-NdeI-фрагмента 1,4 т.п.н. и HindIII-XbaI-фрагмента 1,2 т.п.н., соответственно, каждый из которых содержит весь кодирующий район полноразмерных рецепторов. Эти фрагменты независимо субклонировали в соответствующие сайты рестриктаз в экспрессирующем векторе pCMV5 млекопитающих, справа от промотора цитомегаловируса (CMV) человека, с получением экспрессионных плазмид pCMV5/hSSTR-1, pCMV5/hSSTR-2, pCMV5/hSSTR-3, pCMV5/hSSTR-4 и pCMV5/hSSTR-5. Для трансфекции в клетки СНО-К1 добавляли плазмиду, pRSV-neo из Американской Коллекции Типовых Культур (Rockville, MD), несущую неомициновый селектируемый маркер клеток млекопитающих.
Экспрессия и трансфекция рецептора. Трансфекции выполняли способом с использованием фосфата кальция. Клетки СНО-К1 поддерживали в α-минимальной необходимой среде (α-МЕМ, Gibco), дополненной 10% фетальной телячьей сывороткой, и трансфицировали каждой из экспрессионных плазмид с использованием осаждения фосфатом кальция. Клоны, которые наследовали экспрессионную плазмиду, отбирали в α-МЕМ, дополненной 500 мкг/мл генетицина (G418; Gibco). Независимые клоны СНО-К1 собирали клонзапирающим стеклянным кольцом и размножали в культуре в селективной среде. Из выделенных клонов получали мембраны, и экспрессию hSSTR первоначально оценивали на связывание с [125I]Tyr11-SRIF и [125I]МК-678 (для SSTR-2).
Анализы связывания радиолиганда. Клеточные мембраны 5 типов клеток получали из гомогенатов (Polytron, установка 6, 15 сек) соответствующих клеток СНО-К1 в охлажденном на льду Трис-HCl (50 мМ) и центрифугировали (39000 g, 10 мин × 2) с промежуточным ресуспендированием в свежем буфере. Конечные осадки ресуспендировали в Трис-HCl (10 мМ) для анализа. Аликвоты мембран инкубировали (30 мин при 37оС) с 0,05 нМ [125I]Tyr11-SRIF (типы 1, 3, 4, 5) или [125I]МК-678 (тип 2) в 50 нМ HEPES (рН 7,4), содержащем БСА (10 мг/мл); MgCl2 (5 мМ), Трасилол (200 кМЕ/мл), бацитрацин (0,02 мг/мл) и фенилметансульфонилфторид (0,02 мг/мл). Конечный объем реакционной смеси для анализа был 0,3 мл, и инкубации останавливали быстрым фильтрованием через фильтры GF/C, предварительно пропитанные 0,3% поли(этиленимином), с использованием модуля для быстрого фильтрования Brandel. Затем каждую пробирку и фильтр промывали аликвотами холодного буфера (3 х 5 мл).
Специфическое связывание определяют в виде общего количества связанного радиолиганда минус количество лиганда, связанного в присутствии 1,0 мкМ SRIF. С использованием этих систем анализа обычно получали следующие величины общего связывания радиолиганда и неспецифического связывания (неспец.): hSSTR-1, 7000 имп/мин (общее) против 3500 имп/мин (неспец.); hSSTR-2, 9000 имп/мин (общее) против 1000 имп/мин (неспец.); hSSTR-3, 8000 имп/мин (общее) против 1000 имп/мин (неспец.); hSSTR-4, 6000 имп/мин (общее) против 3500 имп/мин (неспец.) и hSSTR-5, 7500 имп/мин (общее) против 3500 имп/мин (неспец.). Аффинности связывания выражали в виде величин Ki ± SEM (нМ) для каждого из пяти подтипов рецепторов. Величины Ki, полученные для репрезентативных соединений данного изобретения, подробно показаны в таблице 2.
Молекулярное моделирование. Все молекулярное моделирование выполняли на компьютере Silicon Graphics Indigo2 High Impact 10000 с использованием SYBYL6.6 c силовым полем всех атомов по Kollman. Файлы PDB для трех структур решения ЯМР исходного соединения Sandostatin/OCTREOTIDE®; DPhe5-c[Cys6-Phe7-DTrp8-Lys9-Thr10-Cys11]-Thr12-ола (1SOC и 2SOC) получали из базы данных PDB. Эти структуры были введены в SYBYL6.6 и мутированы для образования N-метилированных соединений на основе примера 9. Парциальные атомные заряды по Kollman загружали из словаря мономеров. Эти структуры оптимизировали отжигом мутированного остатка и затем полной минимизацией энергии с использованием алгоритма градиента конъюгата до конечного градиента среднеквадратичных значений (rms) ≤0,01 ккал моль·А-1. Зависимую от расстояния диэлектрическую функцию использовали вместе с установками по умолчанию для всех других опций минимизации.
Примеры 9 и 18 алкилировали в любом остатке с использованием твердофазной процедуры, собирая на смоле метилбензгидриламина. После удаления трет-бутоксикарбонильной (Вос) группы в желаемом сайте N-метилирования свободный амин связанного на смоле пептида защищали с использованием о-нитробензолсульфонилхлорида и коллидина в дихлорметане. Затем N-H амид о-нитробензолсульфонамида селективно депротонировали сильным, заблокированным неионным основанием MTBD и метилировали