Способ получения инозина и инозин 5'-монофосфата, штамм бактерии, принадлежащей к роду bacillus - продуцент инозина (варианты)
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Способ получения инозина предусматривает выращивание бактерии, принадлежащей к роду Bacillus, в питательной среде с последующим выделением из культуральной жидкости накопленного инозина. При этом в качестве продуцента используют бактерию, обладающую устойчивостью к ингибированию роста полимиксином В и/или колистином. Предложен также способ получения инозин-5'-монофосфата и два новых штамма продуцентов инозина Bacillus subtilis ВКПМ В-8245 и Bacillus amyloliquefaciens ВКПМ-8246. Предложенная группа изобретений позволяет повысить продуктивность инозина. 4 н. и 4 з.п. ф-лы, 4 табл.
Реферат
Область техники.
Настоящее изобретение относится к способу получения пуриновых нуклеозидов, таких как инозин, ксантозин, гуанозин, методом ферментации и к новому микроорганизму, используемому для их продукции. Пуриновые нуклеозиды используются в качестве исходных реагентов для синтеза соответствующих нуклеотидов, таких как инозин-5'-фосфат, ксантозин-5'-фосфат и гуанин-5'-фосфат.
Предшествующий уровень техники
Традиционно нуклеозиды получают в промышленном масштабе методом ферментации с использованием штаммов микроорганизмов, ауксотрофных по аденину, или этих штаммов, которым дополнительно придана устойчивость к различным соединениям, таким как аналоги пуринов, сульфасоединения, аналоги метионина и антифолатные соединения. Примерами таких штаммов являются штаммы, принадлежащие к роду Bacillus (патентные заявки Японии №38-23039 (1963), 54-17033 (1979), 55-2956 (1980), 55-45199 (1980), 56-162998 (1981), 57-14160 (1982) и 57-41915 (1982), 59-42895 (1984), 06-113876 (1992)), к роду Brevibacterium (патентные заявки Японии №51-5075 (1976), 58-17592 (1983), 02-174689 (1988) и Agric. Biol. Chem., 42, 399 (1978)), к роду Escherichia (заявка РСТ WO9903988) и подобные им.
Получение указанных мутантных штаммов обычно состоит из обработки микроорганизмов с целью получения мутаций путем воздействия ионизирующего излучения (УФ-излучение, рентгеновское излучение) или обработки химическими агентами (нитрат натрия, диэтилсульфат, N-метил-N'-нитро-N-нитрозогуанидин) с последующей селекцией нужного штамма на подходящей питательной среде для селекции.
Хорошо известно, что разнообразные воздействия, которые вызывают стресс у микробных клеток (температура, облучение, голод, ингибиторы и антибиотики), могут приводить к разрывам РНК и ДНК с последующей экскрецией производных нуклеиновых кислот (Domain A. (1968). Production of purine nucleotides by fermentation. In: Progress in Inductrial Microbiology, vol.18. Ed. D.J.D.Hockenhell. J.&A.Churchill Ltd., London). В настоящее время общепризнанно, что проникновение метаболитов через цитоплазматическую мембрану обычно происходит с участием более или менее специфических транспортных белков, осуществляющих их выброс (Рао et al, 1998, Microbiol. Mol. Biol. Rev., 62, 1-34; Paulsen et al, 1998, J. Mol. Biol., 277, 573-592; Saier et al, 1999, J. Mol. Microbiol. Biotechnol., 1, 257-279). Много лет назад было показано (Billen, D., 1957, Arch. Biochem. Biophys., 67, 333-340), что облученные УФ и рентгеновскими лучами клетки Escherichia coli экскретируют свободные основания, рибозиды, мононуклеотиды и АТФ. Такое высвобождение не было результатом лизиса клеток, поскольку никакие производные ДНК или пептиды при этом не обнаруживались.
Описание изобретения
Целью настоящего изобретения являются увеличение продуктивности инозина штаммами-продуцентами инозина и предоставление способа получения инозина с использованием указанных штаммов, а также предоставление более эффективного способа получения инозин-5'-фосфата, в котором инозин используется в качестве промежуточного соединения для получения инозин-5'-фосфата.
Авторы настоящего изобретения предположили, что некоторые мутации, оказывающие влияние на структуру и/или функционирование клеточной мембраны, могут имитировать условия стресса и индуцировать усиление активности специфических транспортеров, увеличивая тем самым накопление в культуральной жидкости производных нуклеиновых кислот, таких как пуриновые нуклеозиды, предпочтительно инозин и ксантозин. С этой целью авторы настоящего изобретения установили, что микроорганизм, принадлежащий к роду Bacillus и содержащий новообнаруженные мутации, которые придают микроорганизму устойчивость к пептидным антибиотикам, таким как полимиксин В и колистин, может продуцировать и накапливать в культуральной жидкости значительно большие количества пуриновых нуклеозидов. Ранее не было общепризнанно, что продуктивность пуриновых нуклеозидов может быть улучшена путем наделения указанными чертами микроорганизмов - продуцентов пуриновых нуклеозидов. Поэтому данная работа была продолжена на основе обнаруженных фактов для завершения настоящего изобретения.
Таким образом, настоящее изобретение предоставляет микроорганизм, принадлежащий к роду Bacillus, обладающий способностью к продукции пуриновых нуклеозидов. В частности, настоящее изобретение предоставляет микроорганизм с повышенной способностью к продукции пуриновых нуклеозидов, основанной на мутации, придающей микроорганизму устойчивость к пептидным антибиотикам, таким как полимиксин В и колистин.
Далее настоящее изобретение предоставляет способ получения пуриновых нуклеозидов методом ферментации, включающим стадии выращивания указанного выше микроорганизма в питательной среде с целью продукции и накопления пуриновых нуклеозидов в питательной среде, и выделения пуриновых нуклеозидов из культуральной жидкости.
Далее настоящее изобретение предоставляет способ получения пуриновых нуклеотидов, таких как инозин-5'-фосфат, ксантозин-5'-фосфата и гуанозин-5'-фосфата, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде, фосфорилирования полученного и накопленного пуринового нуклеозида и выделения полученного пуринового нуклеозида.
Также настоящее изобретение предоставляет способ получения гуанозин-5'-фосфата, включающий стадии выращивания указанной выше бактерии в питательной среде, фосфорилирования полученного и накопленного ксантозина, аминирования полученного ксантозин-5'-фосфата и выделения полученного гуанозин-5'-фосфата.
Настоящее изобретение включает в себя следующее:
1. Бактерия, принадлежащая к роду Bacillus, обладающая устойчивостью к ингибированию роста полимиксином В и/или колистином и способностью к продукции пуринового нуклеозида.
2. Бактерия, принадлежащая к роду Bacillus, в соответствии с п.1, которая принадлежит к виду Bacillus subtilis.
3. Бактерия, принадлежащая к роду Bacillus, в соответствии с п.1, которая принадлежит к виду Bacillus amyloliquefaciens.
4. Бактерия в соответствии с пп.1-3, в которой пуриновым нуклеозидом является инозин.
5. Бактерия в соответствии с пп.1-3, в которой пуриновым нуклеозидом является ксантозин.
6. Бактерия в соответствии с пп.1-3, в которой пуриновым нуклеозидом является гуанозин.
7. Способ получения пуринового нуклеозида, включающий стадии выращивания бактерии в соответствии с любым пп.1-6 в питательной среде с целью продукции и накопления в питательной среде пуринового нуклеозида и выделения пуринового нуклеозида из культуральной жидкости.
8. Способ в соответствии с п.7, в котором пуриновым нуклеозидом является инозин.
9. Способ в соответствии с п.7, в котором пуриновым нуклеозидом является ксантозин.
10. Способ в соответствии с п.7, в котором пуриновым нуклеозидом является гуанозин.
11. Способ получения пуринового нуклеотида, включающий стадии выращивания бактерии в соответствии с любым из пп.1-6 в питательной среде, фосфорилирования полученного и накопленного нуклеозида и выделения полученного и накопленного пуринового нуклеотида.
12. Способ в соответствии с п.11, в котором пуриновым нуклеотидом является инозин-5'-фосфат.
13. Способ в соответствии с п.11, в котором пуриновым нуклеотидом является ксантозин-5'-фосфат.
14. Способ в соответствии с п.11, в котором пуриновым нуклеотидом является гуанозин-5'-фосфат.
15. Способ получения гуанозин-5'-фосфата, включающий стадии выращивания бактерии в соответствии с п.5 в питательной среде, фосфорилирования полученного и накопленного ксантозина, аминирования полученного ксантозин-5'-фосфата и выделения полученного и накопленного гуанозин-5'-фосфата.
Настоящее изобретение более детально будет описано ниже.
1. Бактерия согласно настоящему изобретению.
Вышеуказанная бактерия согласно настоящему изобретению может быть получена, исходя из бактерии, уже обладающей способностью к продукции пуриновых нуклеозидов, путем придания ему заданной устойчивости. С другой стороны, бактерия согласно настоящему изобретению также может быть получена путем придания способности к продукции пуриновых нуклеозидов бактерии, обладающей заданной устойчивостью.
Термин "бактерия, обладающая устойчивостью к ингибированию роста полимиксином В и/или колистином" означает бактерию, полученную из родительского штамма и обладающую генетическими свойствами, модифицированными таким образом, что она может расти в питательной среде, содержащей пептидные антибиотики, такие как полимиксин В и/или колистин.
Например, бактерия, которая способна образовывать колонии в течение 3-5 дней в ходе выращивания при 34°С на чашках с агаром, содержащим 5 мг/л или более, предпочтительно 10 мг/л или более полимиксина В, или 5 мг/л или более, предпочтительно 10 мг/л или более колистина, является устойчивой к указанным пептидным антибиотикам.
В дополнение к уже упомянутым выше свойствам указанная бактерия может обладать другими специфическими свойствами, такими как потребность в различных питательных добавках, устойчивость или чувствительность к химическим реагентам, зависимость от химических соединений, не выходя при этом за границы настоящего изобретения.
Полимиксин В и колистин (полимиксин F) вместе с грамицидином, нигерицином и подобными соединениями принадлежит к классу химических соединений, называемых "пептидными антибиотиками". Указанные соединения оказывают влияние на структуру и функционирование клеточной мембраны и имитируют условия стресса. Пептидые антибиотики являются соединениями, эффективными против грамотрицательных бактерий (Vaara, Microbiol. Rev., 56, 395-411, 1992). Авторы настоящего изобретения обнаружили, что полимиксины также могут ингибировать рост грамположительных бактерий, принадлежащих к роду Bacillus. Мутации в бактериях, принадлежащих к роду Bacillus, придающие устойчивость полимиксинам, могут оказывать влияние на цитоплазматическую мембрану и имитировать условия стресса, индуцируя транспортеры для выброса из клетки пуриновых нуклеозидов.
Бактерия согласно настоящему изобретению может обладать так называемой "перекрестной устойчивостью" к пептидным антибиотикам. Это означает, что бактерия, которой придана устойчивость к одному из пептидных антибиотиков, может проявлять устойчивость к другому пептидному антибиотику (смотри раздел "Примеры"). Предполагается, что пептидные антибиотики могут обладать сходным механизмом действия. Например, показано, что как полимиксин В, так и грамицидин S индуцируют накопление гуанозинтетрафосфата - регуляторного нуклеотида строгого ответа - в условиях ингибирования указанными антибиотиками макромолекулярного синтеза (Cortay J.C. and Cozzone A.J., Bochim. Biophys. Acta, 1983, 755(3), 467-473).
Термин "бактерия, обладающая способностью к продукции пуринового нуклеозида" означает способность бактерии к продукции и накоплению значительного количества пуринового нуклеозида в питательной среде в ходе выращивания указанной бактерии в этой питательной среде. Обычно это означает способность к накоплению в питательной среде не менее чем 50 мг/л, предпочтительно не менее чем 0,5 мг/л пуринового нуклеозида в условиях, описанных в Примерах (смотри ниже).
Использованный здесь термин "пуриновый нуклеозид" включает в себя инозин, ксантозин и гуанозин.
Мутантный микроорганизм, полезный для осуществления настоящего изобретения, может быть получен путем генерации мутаций с использованием традиционных методов мутагенеза, таких как облучение УФ-излучением, рентгеновским излучением, радиоактивным излучением, или обработка химическими мутагенами с последующей селекцией методом реплики. Предпочтительным мутагеном является N-метил-N'-нитро-N-нитрозогуанидин (здесь и далее упоминаемый как NTG).
Таким образом, возможно подвергнуть любой известный штамм, принадлежащий к роду Bacillus и уже обладающий способностью к продукции пуринового нуклеозида, одной из указанных выше процедур для получения мутантного штамма, а затем проверить полученный мутантный штамм, чтобы определить, удовлетворяет ли он упомянутым выше условиям настоящего изобретения относительно устойчивости к пептидным антибиотикам и, следовательно, подходящим для использования в настоящем изобретении. Полученные штаммы проверяются путем выращивания в питательной среде, отбираются штаммы, обладающие способностью к продукции пуринового нуклеозида с выходом, большим чем у родительского штамма, и отобранные штаммы используются в настоящем изобретении.
Штаммы, удовлетворяющие требованиям настоящего изобретения, также могут быть получены с помощью методов генной рекомбинации, хорошо известных специалисту в данной области техники.
Вышеуказанные особенности устойчивости могут комбинироваться в одном штамме методами последовательной селекции или генной рекомбинации.
В качестве примеров микроорганизма, принадлежащего к роду Bacillus, использованного в настоящем изобретении, могут быть приведены Bacillus subtilis (В. subtilis), Bacillus amyloliquefaciens (B. amyloliquefaciens) и подобные им. Репрезентативными примерами штаммов согласно настоящему изобретению, которые могут быть использованы на практике, являются Bacillus subtilis KMBS16 polR 1-1 (ВКПМ В-8245), Bacillus amyloliquefaciens ColR 7-105 (ВКПМ В-8246). Указанные бактерии, которые могут быть использованы для продукции пуриновых нуклеозидов в соответствии с настоящим изобретением, обладают такими же бактериологическими свойствами, как и родительские штаммы, за исключением устойчивости к пептидным антибиотикам и способности к продукции пуринового нуклеозида с большим выходом. Штаммы Bacillus subtilis KMBS16 polR 1-1 и Bacillus amyloliquefaciens ColR 7-105 депонированы во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) (Россия, 113545 Москва, 1-й Дорожный поезд, 1) 29 января 2002 под инвентарными номерами ВКПМ В-8245 и ВКПМ В-8246 соответственно.
В качестве родительского штамма, который может быть улучшен с целью получения бактерии согласно настоящему изобретению, могут быть использованы штаммы, принадлежащие к роду Bacillus, такие как штамм Bacillus subtilis AJ12707 (FERM Р-12951) (патентная заявка Японии JP6113876), штамм Bacillus subtilis AJ3772 (FERM-P 2555) (патентная заявка Японии JP62014794), Bacillus pumilus NA-1102 (FERM BP-289), Bacillus subtilis NA-6011 (FERM BP-291) и Bacillus subtilis NA-6012 (FERM BP-292) (патент США 4701413), В. pumilis Gottheil No. 3218 (ATCC No. 21005) (патент США 3616206), штамм В. amyloliquefaciens AS115-7 (VKPM B-6134) (патент РФ №2003678) или подобные им. Также может быть использован штамм В. subtilis KMBS16. Этот штамм является производным от известного штамма В. subtilis 168 trpC2, содержащим мутации, введенные в ген purR, кодирующий пуриновый репрессор (purR::spc), ген ригА, кодирующий сукцинил-АМФ синтазу (purA::erm), и ген deoD, кодирующий фосфорилазу пуриновых нуклеозидов (deoD::kan).
1. Способ получения пуриновых нуклеозидов.
К способам согласно настоящему изобретению относится способ получения пуринового нуклеозида, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления указанного пуринового нуклеозида в питательной среде, и выделения пуринового нуклеозида из культуральной жидкости.
В способе согласно настоящему изобретению выращивание бактерии, принадлежащей к роду Bacillus, выделение и очистка пуринового нуклеозида из культуральной жидкости могут быть осуществлены способом, подобным традиционным способам ферментации, в которых пуриновый нуклеозид продуцируется с использованием микроорганизма.
Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, неорганические ионы и другие необходимые органические компоненты. К источникам углерода относятся различные углеводы, такие как глюкоза, лактоза, галактоза, фруктоза, арабиноза, мальтоза, ксилоза, трехалоза, рибоза и гидролизат крахмала; спирты, такие как глицерин, маннитол и сорбитол; различные органические кислоты, такие как глюконовая кислота, фумаровая кислота, лимонная кислота и янтарная кислота и подобные им. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как сульфат аммония, хлорид аммония и фосфат аммония, органические источники азота, такие как гидролизат соевых бобов; газообразный аммиак и подобные соединения. Желательно, чтобы подходящие небольшие количества витаминов, таких как витамин B1, и других необходимых веществ, например нуклеиновых кислот, таких как аденин и РНК, или дрожжевой экстракт и подобные соединения присутствовали в питательной среде в качестве органических питательных компонент. Кроме того, небольшие количества фосфата кальция, сульфата магния, ионов железа, ионов марганца и подобных соединений могут быть добавлены, если необходимо.
Выращивание осуществляется предпочтительно в аэробных условиях в течение 16-72 часов, температура при выращивании поддерживается в пределах от 30 до 45°С и рН в пределах от 5 до 8. рН среды может регулироваться неорганическими или органическими кислотными или щелочными веществами, а также газообразным аммиаком.
Целевой пуриновый нуклеозид может быть выделен из культуральной жидкости любым из традиционных методов или любой комбинацией этих методов, такими как ионообменная хроматография и осаждение.
3. Способ получения пуриновых нуклеотидов.
К способам согласно настоящему изобретению также относится способ получения пуринового нуклеотида, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде, фосфорилирования полученного и накопленного пуринового нуклеозида и выделения полученного и накопленного пуринового нуклеотида. Более конкретно, к способам согласно настоящему изобретению также относится способ получения инозин-5'-фосфата, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде, фосфорилирования полученного и накопленного инозина и выделения полученного и накопленного инозин-5'-фосфата. Также к способам согласно настоящему изобретению относится способ получения ксантозин-5'-фосфата, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде, фосфорилирования полученного и накопленного ксантозина и выделения полученного и накопленного ксантозин-5'-фосфата. Также к способам согласно настоящему изобретению также относится способ получения гуанозин-5'-фосфата, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде, фосфорилирования полученного и накопленного гуанозина и выделения полученного и накопленного гуанозин-5'-фосфата.
Согласно настоящему изобретению выращивание, выделение и очистка пуринового нуклеозида из культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам ферментации, в которых пуриновый нуклеозид продуцируется с использованием микроорганизма. Далее согласно настоящему изобретению фосфорилирование полученного и накопленного пуринового нуклеозида, а также выделение полученного и накопленного пуринового нуклеотида может быть осуществлено методом, подобным традиционным методам, в которых пуриновый нуклеотид получается из пуринового нуклеозида.
Фосфорилирование пуринового нуклеозида может быть осуществлено ферментативно с использованием различных фосфатаз, нуклеозидкиназ и нуклеозидфосфотрансфераз, или химически с использованием фосфорилирующих агентов, таких как POCl3 или подобным им. Могут быть использованы фосфатаза, способная к катализу селективного переноса фосфорильной группы пирофосфата в 5'-положение нуклеозида (Mihara et. al, Phosphorylation of nucleosides by the mutated acid phosphatase from Morganella morganii. Appl. Environ. Microbiol. 2000, 66:2811-2816), или кислая фосфатаза, использующая полифосфорные кислоты (их соли), фенилфосфорную кислоту (ее соли) или карбамилфосфорную кислоту (ее соли) в качестве донора фосфорной кислоты (WO9637603 A1), или подобные им. Также, в качестве примера фосфатазы может быть приведена фосфатаза, способная к каталитическому переносу фосфорильной группы в 2', 3', 5'-положение нуклеозида с использованием в качестве субстрата п-нитрофенилфосфата (Mitsugi, К., et al, Agric. Biol. Chem. 1964,28, 586-600), неорганического фосфата (JP42-1186), или ацетил фосфата (JP61-41555), или подобная ей. В качестве примера нуклеозидкиназы может быть приведена гуанозин-инозинкиназа из Е. coli (Mori et. al. Cloning of a guanosine-inosine kinase gene of Escherichia coli and characterization of the purified gene product. J. Bacteriol. 1995. 177:4921-4926; WO9108286), или подобная ей. В качестве примера нуклеозидфосфотрансферазы может быть приведена нуклеозидфосфотрансфераза, описанная Hammer-Jespersen, К. (Nucleoside catabolism, p.203-258. In A Munch-Petesen (ed.). Metabolism of nucleotides, nucleosides, and nucleobases in microorganism. 1980, Academic Press, New York), или подобная ей. Химическое фосфорилирование нуклеозидов может быть осуществлено с использованием фосфорилирующего агента, такого как POCl3 (Yoshikawa et. al. Studies of phosphorylation. III. Selective phosphorylation of unprotected nucleosides. Bull. Chem. Soc. Jpn. 1969, 42:3505-3508), или подобного ему.
Также к способам согласно настоящему изобретению относится способ получения гуанозин-5'-фосфата, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде, фосфорилирования полученного и накопленного ксантозина, аминирования полученного и накопленного ксантозин-5'-фосфата и выделения полученного и накопленного гуанозин-5'-фосфата. Согласно настоящему изобретению выращивание бактерии согласно настоящему изобретению в питательной среде, фосфорилирование полученного и накопленного ксантозина, аминирование полученного и накопленного ксантозин-5'-фосфата, а также выделение полученного и накопленного гуанозин-5'-фосфата может быть осуществлено методом, подобным традиционным методам, в которых гуанозин-5'-фосфат получается из ксантозин-5'-фосфата.
Аминирование ксантозин-5'-фосфата может быть осуществлено ферментативно с использованием, например, GMP синтетазы из Е. coli (Fujio et. al. High level of expression of XMP aminase in Escherichia coli and its application for the industrial production of 5'-guanylic acid. Biosci. Biotech. Biochem. 1997, 61:840-845; EP0251489 B1).
В способе согласно настоящему изобретению бактерия согласно настоящему изобретению может быть модифицирована с целью увеличения экспрессии генов биосинтеза пуриновых нуклеозидов.
Наилучший способ осуществления изобретения
Пример - ссылка 1. Конструирование штамма В. subtilis KMBS16 - продуцента инозина.
Штамм В. subtilis KMBS16 - продуцент инозина, являющийся мутантом, содержащим инсерционно-делеционные мутации в генах purR,purA и deoD, был получен из штамма Bacillus subtilis 168 Marburg.
1) Конструирование мутанта В. subtilis, дефицитного по purR.
ПЦР осуществлялась при 94°С, 30 секунд; 55°С, 1 мин; 72°С, 1 мин; 30 циклов; (Gene Amp PCR System Model 9600, Perkin Elmer), с использованием хромосомной ДНК штамма В. subtilis 168 Marburg в качестве матрицы, и следующих олигонуклеотидных затравок, №1 (SEQ ID NO:1) и №2 (SEQ ID NO:2), синтезированных в соответствии с последовательностью ДНК в геномном банке данных. Затравка №1 (28 звеньев) включает в себя последовательность с 246 по 228 нуклеотид перед старт-кодоном гена purR из В. subtilis (M. Weng, P. L. Nagy, and H. Zalkin. Identification of the Bacillus subtilis pur operon repressor. Proc. Natl. Acad, Sci. USA. 1995,92:7455-7459), а также 9 дополнительных нуклеотидов, содержащих сайт Hindlll, присоединенных к 5'-концу. Затравка №2 (28 звеньев) включает в себя последовательность с 57 по 75 нуклеотид после стоп-кодоном гена purR, а также 9 дополнительных нуклеотидов, содержащих сайт PstI, присоединенных к 5'-концу. Фрагмент, полученный в ходе ПЦР, (0.9 т.п.о.) и обработанный HindIII и PstI, был вставлен по тем же сайтам рестрикции вектора pHSG398 (TaKaRa, Япония) с образованием плазмиды pHSG398BSPR. EcoRV - HincII фрагмент (0.3 т.п.о.) во внутренней части амплифицированного гена ригR был удален из плазмиды pHSG398BSPR, и замещен геном устойчивости к спектиномицину (1.2 т.п.о.) из Enterococcu faecalis, вырезанным из pDG1726 (Bacillus Genetic Stock Center, Ohio).
Полученная плазмида pHSG398purR::spc была использована для трансформации компетентных клеток В. subtilis 168 Marburg, полученных методом Dubunau и Davidoff-Abelson (Dubnau, D., and R. Davidoff-Abelson. Fate of transforming DNA following uptake by competent Bacillus subtilis. J. Mol. Biol. 1971, 56:209-221). Двойные перекрестные мутанты были протестированы путем приготовления хромосомной ДНК из каждой колонии, устойчивой к спектиномицину, с последующей ПЦР, как описано выше. Одна из колоний, которая, как было подтверждено, является мутантом, дефицитным по гену purR, была названа KMBS4.
2) Конструирование мутанта В. subtilis, дефицитного по purA.
ПЦР осуществлялась при 94°С, 30 секунд; 55°С, 1 мин; 72°С, 2 мин; 30 циклов (Gene Amp PCR System Model 9600, Perkin Elmer), с использованием хромосомной ДНК штамма В. subtilis 168 Marburg в качестве матрицы, и следующих олигонуклеотидных затравок, №3 (SEQ ID NO:3) и №4 (SEQ ID NO:4), синтезированных в соответствии с последовательностью ДНК в геномном банке данных. Затравка №3 (29 звеньев) включает в себя последовательность с 137 по 118 нуклеотид перед старт-кодоном гена purA из В. subtilis (P. Mäntsälä and H. Zalikin. Cloning and sequence of Bacillus subtilis purA and guaA, involved in the conversion of IMP to AMP and GMP. J. Bacteriol. 1992, 174:1883-1890), а также 9 дополнительных нуклеотидов, содержащих сайт SalI, присоединенных к 5'-концу. Затравка №4 (29 звеньев) включает в себя последовательность с 51 по 70 нуклеотид после стоп-кодоном гена purA, а также 9 дополнительных нуклеотидов, содержащих сайт SphI, присоединенных к 5'-концу. Фрагмент, полученный в ходе ПЦР, (1.5 т.п.о.) и обработанный SalI и SphI, был вставлен по тем же сайтам рестрикции вектора pSTV28 (TaKaRa, Япония). Полученная плазмида pSTV28BSPA была расщеплена с помощью MluI и BglII, что привело к удалению внутреннего фрагмента длиной 0.4 т.п.о. из амплифицированного гена purA, концы были затуплены с помощью фрагмента Кленова, затем в нее лигирован фрагмент гена устойчивости к эритромицину с затупленными концами (1.6 т.п.о.) из Staphylococcus aureus, вырезанным из pDG646 (Bacillus Genetic Stock Center, Ohio).
Полученная плазмида pSTV28BSPA::erm была использована для трансформации компетентных клеток KMBS4, полученных методом Dubunau и Davidoff-Abelson, как описано выше. Двойные перекрестные мутанты были протестированы путем приготовления хромосомной ДНК из каждой колонии, устойчивой к эритромицину, с последующей ПЦР, как описано выше. Одна из колоний, которая, как было подтверждено, является мутантом, дефицитным по гену ригА, была названа KMBS13. Как и ожидалось, клетки KMBS13 были ауксотрофными по аденину.
3) Конструирование мутанта В. subtilis, дефицитного по deoD.
Для получения 5'-концевой части гена deoD и предшествующего ей участка из В. subtilis, ПЦР осуществлялась при 94°С, 30 секунд; 55°С, 1 мин; 72°С, 1 мин; 30 циклов (Gene Amp PCR System Model 9600, Perkin Elmer), с использованием следующих олигонуклеотидных затравок, №5 (SEQ ID NO:5) и №6 (SEQ ID NO:6), синтезированных в соответствии с последовательностью ДНК в геномном банке данных. Затравка №5 (29 звеньев) включает в себя последовательность с 310 по 291 нуклеотид перед старт-кодоном гена deoD, а также 9 дополнительных нуклеотидов, содержащих сайт EcoRI, присоединенных к 5'-концу. Затравка №6 (28 звеньев) включает в себя последовательность с 39 по 57 нуклеотид после старт-кодона гена deoD, а также 9 дополнительных нуклеотидов, содержащих сайт BamHI, присоединенных к 5'-концу. Фрагмент, полученный в ходе ПЦР, (0.4 т.п.о.) и обработанный EcoRI и BamHI, был вставлен по тем же сайтам рестрикции вектора pSTV28 (TaKaRa, Япония), что привело к получению плазмиды pSTV28DON.
Для получения 3'-концевой части гена deoD и последующего участка, ПЦР осуществлялась при 94°С, 30 секунд; 55°С, 1 мин; 72°С, 1 мин; 30 циклов (Gene Amp PCR System Model 9600, Perkin Elmer), с использованием следующих олигонуклеотидных затравок, №7 (SEQ ID NO:7) и №8 (SEQ ID NO:8), синтезированных в соответствии с последовательностью ДНК в геномном банке данных. Затравка №7 (29 звеньев) включает в себя последовательность с 321 по 302 нуклеотид после стоп-кодона гена deoD, а также 9 дополнительных нуклеотидов, содержащих сайт HindIII, присоединенных к 5'-концу. Затравка №8 (28 звеньев) включает в себя последовательность с 24 по 42 нуклеотид перед стоп-кодоном гена deoD, а также 9 дополнительных нуклеотидов, содержащих сайт BamHI, присоединенных к 5'-концу. Фрагмент, полученный в ходе ПЦР, (0.4 т.п.о.) и обработанный HindIII и BamHI, был вставлен по тем же сайтам рестрикции вектора pSTV28DON, что привело к получению плазмиды pSTV28DONC.
Для того, чтобы амплифицировать ген устойчивости у канамицину из Streptococcus faecalis, ПЦР осуществлялась при 94°С, 30 секунд; 55°С, 1 мин; 72°С, 2 мин; 30 циклов (Gene Amp PCR System Model 9600, Perkin Elmer), с использованием ДНК-плазмиды pDG783 (Bacillus Genetic Stock Center, Ohio) в качестве матрицы и следующих олигонуклеотидных затравок, №9 (SEQ ID NO:9) и №10 (SEQ ID NO:10), синтезированных в соответствии с последовательностью ДНК в геномном банке данных. Затравка №10 (33 звена) включает в себя последовательность с 513 по 490 нуклеотид перед старт-кодоном гена устойчивости к канамицину, а также 9 дополнительных нуклеотидов, содержащих сайт BamHI, присоединенных к 5'-концу. Затравка №11 (33 звеньев) включает в себя последовательность со 117 по 140 нуклеотид после стоп-кодона указанного гена, а также 9 дополнительных нуклеотидов, содержащих сайт BamHI, присоединенных к 5'-концу. Фрагмент, полученный в ходе ПЦР (1.5 т.п.о.) и обработанный BamHI, был вставлен по уникальному сайту рестрикции BamHI вектора pSTV28DONC. Полученная плазмида pSTV28deoD::kan была использована для трансформации компетентных клеток KMBS13, полученных методом Dubunau и Davidoff-Abelson, как описано выше. Двойные перекрестные мутанты были протестированы путем приготовления хромосомной ДНК из каждой колонии, устойчивой к канамицину, с последующей ПЦР с использованием затравок №5 и №7, как описано выше. Одна из колоний, которая, как было подтверждено, является мутантом, дефицитным по гену deoD, (purR::spc purA::erm deoD::kan) была названа KMBS16.
Пример 1. Селекция и проверка мутантного штамма Bacillus subtilis - продуцента инозина, устойчивого к полимиксинам.
Клетки штамма В. subtilis KMBS16 (108 клеток) были помещены на чашки с агаризованным (20 г/л) L-бульоном (триптон - 10 г/л, дрожжевой экстракт - 5 г/л, NaCl -0.5 г/л, глюкоза 2 г/л, рН 7.0), содержащим 15, 20, 30 или 40 мг/л сульфата полимиксина В (Sigma, США). Инокулированные чашки инкубировались при 34°С в течение 5 дней. Среди появившихся колоний (порядка 100 колоний) 21 мутант обладал повышенной по сравнению с исходным штаммом способностью к продукции инозина. Среди них был выбран спонтанный мутант Bacillus subtilis KMBS16 polR 1-1 (ВКПМ В-8245), обладавший наивысшей продуктивностью инозина.
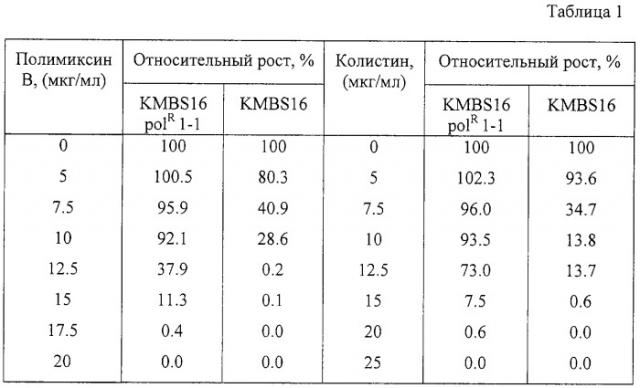
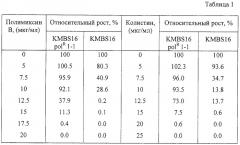
Устойчивость к полимиксину В и колистину (относительная степень роста) мутантного и родительского штаммов была оценена следующим способом. Пробирки, содержащие 5 мл L-бульона с различными ступенчатыми концентрациями полимиксина или колистина, были инокулированы 106 клеток/мл тестируемого штамма, предварительно выращенного в течение 18 часов в L-бульоне, и культивировались на роторной качалке при 37°С в течение 24 часов. Полученная культуральная жидкость была соответствующим образом разбавлена водой, и ее оптическая плотность при 540 нм была определена для того, чтобы измерить степень роста: POD540 в случае полимиксина В и COD540 в случае колистина. Степень роста (OD540) такого же штамма в среде, не содержащей антибиотик, принималась за 100%. Относительная степень роста на среде, содержащей полимиксин или колистин, может быть рассчитана по формулам (POD540)/(OD540)×100 или (COD540)/(OD540)×100 соответственно. Результаты приведены в Таблице 1.
Как видно из Таблицы 1, штамм В. subtilis KMBS16 polR 1-1, полученный отбором на устойчивость к полимиксину В, также обладал устойчивостью к колистину.
Каждый из штаммов В. subtilis KMBS16 polR 1-1 и В. subtilis KMBS16 выращивался при 34°С при аэрации в течение 18 часов в L-бульоне. Затем 0.3 мл полученной культуры было перенесено в 3 мл питательной среды для ферментации в пробирке 20×200 мм и инкубировалось при 34°С в течение 72 часов на роторной качалке.
Состав питательной среды для ферментации, г/л:
| Глюкоза | 80.0 |
| KH2PO4 | 1.0 |
| MgSO4 | 0.4 |
| FeSO4×7H2O | 0.01 |
| MnSO4×5H2O | 0.01 |
| Mameno-TN | 1.35 |
| DL-метионин | 0.3 |
| NH4Cl | 32.0 |
| Аденин | 0.1 |
| Триптофан | 0.02 |
| СаСО3 | 50.0 |
Глюкоза и сульфат марганца стерилизовались раздельно. СаСО3 стерилизовали нагреванием при 180°С в течение 2 часов. рН поддерживали в районе 7.0.
После выращивания количество инозина, накопленное в среде, определялось методом ВЭЖХ. Образец культуральной жидкости (500 мкл) был отцентрифугирован при 1500 об/мин в течение 5 мин, супернатант был разбавлен водой в 100 раз и проанализирован с помощью ВЭЖХ.
Условия для анализа с помощью ВЭЖХ:
Колонка: Luna С18(2) 250×3 мм, 5 u (Phenomenex, USA). Буфер: 2% v/v C2H5OH; 0.8% v/v триэтиламин, 0.5% v/v уксусная кислота (ледяная), рН 4.5. Температура: 30°С. Скорость потока: 0.3 мл/мин. Объем пробы: 5 мкл. УФ-детектор: 250 нм.
Время удерживания, мин:
| Ксантозин | 13.7 |
| Инозин | 9.6 |
| Гипоксантин | 5.2 |
| Гуанозин | 11.4 |
| Аденозин | 28.2 |
Полученные результаты представлены в Таблице 2.
.
| Таблица 2 | ||
| Штамм В. subtilis | OD540 | Инозин, г/л |
| KMBS16 | 8.1 | 1-4 |
| KMBS16 polR 1-1 | 7.8 | 1.9 |
Как видно из таблицы 2, штамм В. subtilis KMBS16 polR 1-1 продуцировал больше инозина, чем родительский штамм.
Пример 2. Селекция и проверка мутантного штамма Bacillus amyloliquefaciens - продуцента инозина, устойчивого к колистину.
Клетки штамма Bacillus amyloliquefaciens AS115-7 (ВКПМ В-6134) (108 клеток) были помещены на чашки с агаризованным L-бульоном, как описано в Примере 1, содержащим 10, 15, 20, 30 или 40 мг/л сульфата колистина (Sigma, США). Инокулированные чашки инкубировались при 34°С в течение 5 дней. Среди появившихся колоний (порядка 100 колоний) 18 мутантов обладали повышенной по сравнению с исходным штаммом способностью к продукции инозина. Среди них был выбран спонтанный мутант Bacillus amyloliquefaciens ColR 7-105 (ВКПМ В-8246), обладавший наивысшей продуктивностью инозина.
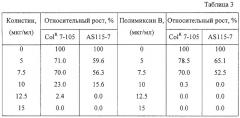
Устойчивость к полимиксину В и колистину (относительная степень роста) мутантного и родительского штаммов была оценена способом, описанным в Примере 1. Результаты приведены в Таблице 3.
Как видно из Таблицы 3, штамм Bacillus amyloliquefaciens ColR 7-105, полученный отбором на устойчивость к колистину, был более устойчив к полимиксину В.
Каждый из штаммов Bacillus amyloliquefaciens ColR 7-105 и Bacillus amyloliquefaciens AS115-7 выращивался при 34°С при аэрации в течение 18 часов в L-бульоне. Затем 0.3 мл полученной культуры было перенесено в 3 мл питательной среды для ферментации, описанной в Примере 1, содержащей 40 мкг/мл L-гистидина и 40 мкг/мл L-тирозина вместо L-триптофана, в пробирке 20×200 мм и инкубировалось при 34°С в течение 72 часов на роторной качалке. После выращивания количество инозина, накопленное в среде, определялось методом ВЭЖХ, как описано выше. Результаты приведены в Таблице 4.
| Таблица 4 | ||
| Штамм В. amyloliquefaciens | OD540 | Инозин, г/л |
| AS115-7 | 4.2 | 8.8 |
| ColR 7-105 | 5.0 | 9.5 |
Как видно из Таблицы 4, штамм B. amyloliquefaciens strain ColR 7-105, устойчивый к колистину, накапливал больше инозина, чем родительский штамм.
Пример 3. Продукция инозин-5'-фосфата из инозина с использованием штамма, содержащего ген, кодирующий кислую фосфатазу со сниженной активностью фосфомоноэстеразы.
Инозин, полученный в соответствии с Примерами 1 или 2, очищенный путем ионообменной хроматографии с последующим осаждением, фосфорилируют с использованием кислой фосфатазы со сниженной активностью фосфомоноэстеразы и пирофосфата натрия в качестве донора фосфорной группы. Источником кислой фосфатазы со сниженной активностью фосфомоноэстеразы является штамм Escherichia coli JM109/pEPI330, содержащий индуцируемую плазмиду с мутантным геном, кодирующим указанную кислую фосфатазу (патент США 6010851).
Штамм Escherichia coli JM109/pEPI330, содержащий плазмиду с мутантным геном, кодирующим кислую фосфатазу, инокулируют в 50 мл L-среды, содержащей 100 мкг/мл ампициллина и 1 мМ ИПТГ, и выращивают при 37°С в течение 16 часов. Затем готовят раствор пирофосфата натрия (120 г/л) и инозина (60 г/л) в 100 мМ натрий-ацетатном буфере (рН 4.0), в который добавляют бактериальные клетки, полученные, как описано выше, до достижения концентрации 2 г/л в пересчете на сухой клеточный вес. Полученную смесь инкубируют при 35°С в течение 32 часов с поддержанием рН в районе 4.0. В результате получают до 74 г/л инозин-5'-фосфата. Побочная продукция инозин-2'-фосфата и инозин-3'-фосфата не наблюдается.
Использование штаммов бактерий, принадлежащих к роду Bacillus и обладающих устойчивостью к ингибированию роста полимиксином В и/или колистином, - продуцентов инозина позволяет повысить эффективность получения конечного инозин-5'-фосфата на 8-15% в пересчете на и