Способ модифицирования трансглутаминаз микроорганизмов
Иллюстрации
Показать всеНастоящее изобретение относится к биотехнологии, а именно к способу конструирования и получения мутантных трансглутаминаз на основе пространственной структуры трансглутаминазы, полученной из Streptoverticillium mobaraense (MTG), и полученной таким образом мутантной MTG. Настоящее изобретение относится также к способу модификации MTG на основе пространственной структуры и трансглутаминазе, обладающей усиленной этим способом реакционной способностью по отношению к субстрату. Данное изобретение позволяет предсказать сайт связывания MTG с субстратом на основе пространственной структуры, определенной с помощью рентгеноструктурного анализа кристаллов MTG, и сконструировать мутантные трансглутаминазы путем замены, вставки или делеции аминокислотных остатков, расположенных в субстратсвязывающем сайте трансглутаминазы. 5 з. п.ф-лы, 60 ил.
Реферат
Настоящее изобретение относится к способу конструирования и получения мутантной трансглутаминазы на основе пространственной структуры трансглутаминазы, полученной из Streptoverticillium mobaraense (здесь и далее обозначаемой как "MTG"), определенной с помощью методики рентгеноструктурного анализа, и полученным таким образом мутантным MTG. MTG широко применяется для переработки продуктов питания или тому подобное, так как она формирует гелеобразное вещество путем образования поперечных сшивок между белками. Мутантная MTG с усиленной трансглутаминазной активностью и термостабильностью, призвана снизить ее требуемое количество, а также мутантная MTG с модифицированными субстратной специфичностью и оптимальным значением pH позволит применять фермент в новой области.
Трансглутаминаза представляет собой фермент, катализирующий реакцию переацетилирования γ-карбоксамидной группы, содержащейся в пептидной последовательности белка. При взаимодействии белка с указанным ферментом может происходить реакция образования поперечных сшивок типа ε-(γ-Glu)-Lys и реакция замещения Gln на Glu путем дезамидирования.
Пока известными являются трансглутаминазы животных и микроорганизмов. Первые являются Ca2+-зависимыми ферментами и широко представлены в 20 внутренних органах, коже и крови животных. Они включают, например, трансглутаминазу печени морских свинок [K. Ikura et al., Biochemistry, Vol.27, p.2898 (1988)], трансглутаминазу эпидермальных кератиноцитов человека [M. A. Phillips et al., Proc. Natl. Acad. Sci. USA, Vol.87, p.9333 (1990)] и фактор XIII системы свертывания крови человека [A. Ichinose et al., Biochemistry, Vol.25, p.6900 (1990)]. Что касается последних, то Ca2+-независимые ферменты были обнаружены у бактерий класса Streptoverticillium, таких как Streptoverticillium griseocarneum IFO 12776, Streptoverticillium cinnamoneum подвида cinnamoneum IFO 12852 и Streptoverticillium mobaraense IFO 13819. Среди указанных ферментов трансглутаминаза, обнаруженная в культуральном супернатанте варианта Streptoverticillium mobaraense, обозначается как MTG (Микробная Трансглутаминаза). Ca2+-независимая трансглутаминаза была также обнаружена у Streptomyces lydicus NRRL B-3446 (JP-Kokai No.10-504721).
MTG представляет собой состоящий из 331 аминокислоты мономерный белок с молекулярной массой, равной приблизительно 38000 [Journal of Biological Chemistry, vol.268, p.11565 (1993)]. Ранее сообщалось о способе получения активной MTG путем экспрессии секреции с применением E.coli или дрожжей (JP-Kokai No.Hei 5-199883). Также сообщалось о способе получения активной MTG, в котором MTG экспрессируется в E.coli в виде белкового тельца включения, затем тельце включения солюбилизируется с денатурирующим белки агентом, а затем регенерируется путем удаления денатурирующего агента с получением активной MTG (JP-Kokai No.6-30771).
В отличие от трансглутаминаз животных трансглутаминазы микроорганизмов, такие как MTG, являются Ca2+-независимыми. Поэтому они применяются для производства гелеобразных продуктов питания, таких как желе, йогуртов, сыров или косметических средств в гелевой форме, а также для улучшения качества мясных продуктов (JP-Kokai No.64-27471). Они широко применяются в промышленности в качестве материалов для производства термостабильных микрокапсул или в качестве носителей для иммобилизированных ферментов.
Что касается условий протекания ферментативной реакции, то, например, студнеобразные продукты питания не могут быть превращены в гелевую форму, если время протекания ферментативной реакции является коротким, и наоборот, применение в качестве коммерческих продуктов затруднено, если время протекания ферментативной реакции является слишком большим. Поэтому, если MTG применяется для производства гелеобразных продуктов питания, таких как желе, йогуртов, сыров или косметических средств в гелевой форме, или для улучшения качества мясных продуктов, для получения предполагаемого продукта должны соответствующим образом регулироваться концентрации субстрата и фермента, температура реакции и время протекания реакции. Однако в связи с различием получаемых с применением MTG продуктов питания и реагентов случается, что для получения предполагаемых продуктов в некоторых случаях бывает недостаточно регулировать только концентрацию, температуру, время и тому подобное. Поэтому появляется необходимость в модификации ферментативной активности MTG.
Для модификации ферментативной активности MTG необходимо получить мутантную MTG и для выбора хорошего мутанта определить его активность, субстратную специфичность и тому подобное. Для получения мутантов необходимо воздействовать на гены дикого типа, и, соответственно, это является предпосылкой возможного получения рекомбинантного белка. Для MTG была установлена высокопродуктивная экспрессирующая система с применением E.coli (JP-Kokai No.6-30771). Однако MTG, экспрессированная подобным образом в большом количестве в E.coli, накапливается в микробных клетках в виде нерастворимых белковых телец включения. После их солюбилизации денатурированная MTG в белковых тельцах включения должна быть активирована путем ее повторной укладки. Таким образом, для получения одной мутантной MTG требуется от 2 до 3 недель. Поэтому требовалось разработать способ приемлемой модификации MTG с применением некой методики, отличной от методик случайно индуцированных мутаций в целой молекуле.
Краткое описание изобретения
Целью настоящего изобретения являлся способ усовершенствования MTG.
Другой целью настоящего изобретения являлась трансглутаминаза, обладающая усиленной реакционной способностью по отношению к субстратам.
В результате интенсивных исследований, выполненных с целью решения описанных выше задач, авторы изобретения обнаружили, что трансглутаминаза, обладающая усиленной реакционной способностью по отношению к субстрату, может быть получена на основе пространственной структуры. Настоящее изобретение было совершено на основе этого открытия.
А именно, краткое содержание настоящего изобретения представляет собой следующее:
(1) Способ конструирования и получения мутантной трансглутаминазы путем предсказания сайта связывания MTG с субстратом на основе пространственной структуры трансглутаминазы, определенной с помощью рентгеноструктурного анализа, и замены, вставки или делеции аминокислотных остатков, расположенных в предсказанном субстратсвязывающем сайте трансглутаминазы.
(2) Обладающая модифицированной субстратной специфичностью мутантная MTG, в которой, по крайней мере, одна из следующих позиций (остатки, расположенные в пределах 20 Å от активного остатка Cys64 и находящиеся на поверхности предположительного сайта связывания с акцептором ацильной группы) в аминокислотных последовательностях MTG, обозначенных как SEQ ID NO: 2, является модифицированной: 1-5, 26, 28, 58-59, 62, 69, 74-75, 77, 79, 235-236, 238-244, 248-250, 252-254, 277-278, 282-287, 289, 291, 296-297 и 300-304.
(3) Обладающая трансглутаминазной активностью и модифицированной субстратной специфичностью мутантная трансглутаминаза, в которой при сравнении аминокислотной последовательности указанной трансглутаминазы с аминокислотной последовательностью MTG по SEQ ID NO: 2, по крайней мере, одна из позиций, соответствующая следующим позициям (остатки, расположенные в пределах 20 Å от активного остатка Cys64 и находящиеся на поверхности предположительного сайта связывания с акцептором ацильной группы) в аминокислотных последовательностях MTG по SEQ ID NO: 2, является модифицированной: 1-5, 26, 28, 58-59, 62, 69, 74-75, 77, 79, 235-236, 238-244, 248-250, 252-254, 277-278, 282-287, 289, 291, 296-297 и 300-304.
(4) Обладающая трансглутаминазной активностью и модифицированной субстратной специфичностью мутантная трансглутаминаза, в которой при сравнении методом тридинга аминокислотной последовательности указанной трансглутаминазы с аминокислотной последовательностью MTG по SEQ ID NO: 2, по крайней мере, одна из позиций, соответствующая следующим позициям (остатки, расположенные в пределах 20 Å от активного остатка Cys64 и находящиеся на поверхности предположительного сайта связывания с акцептором ацильной группы) в аминокислотных последовательностях MTG по SEQ ID NO: 2, является модифицированной: 1-5, 26, 28, 58-59, 62, 69, 74-75, 77, 79. 235-236, 238-244, 248-250, 252-254, 277-278, 282-287, 289, 291, 296-297 и 300-304.
(5) Мутантная MTG или мутантная трансглутаминаза, обладающая модифицированной субстратной специфичностью вследствие снижения отрицательной заряженности путем модификации кислых аминокислотных остатков, расположенных в позициях, определенных любым из описанных выше пп.(2)-(4), или аминокислотных остатков, прилегающих к упомянутым кислым аминокислотным остаткам.
(6) Ген, кодирующий мутантную MTG или мутантную трансглутаминазу, определенную любым из описанных выше пп.(2)-(5).
(7) Рекомбинантная ДНК, содержащая ген, определенный в описанном выше п.(6).
(8) Микроорганизм, несущий рекомбинантную ДНК, определенную в описанном выше п.(7).
(9) Способ получения мутантной MTG или мутантной трансглутаминазы, включающий культивирование описанных в п.(8) микроорганизмов и сбор мутантной MTG или мутантной трансглутаминазы.
(10) Моноклинный кристалл MTG, принадлежащий к спейсерной группе P21.
А именно, настоящее изобретение относится к способу рационального конструирования и получения мутантной MTG на основе пространственной структуры MTG и полученной таким образом мутантной MTG.
Краткое описание фигур
Фигура 1 представляет собой ленточную модель, отображающую кристаллическую структуру MTG.
Фигура 2 отображает поверхностную неровность кристаллической структуры MTG, наблюдаемую в том же направлении, что и на Фигуре 1.
Фигура 3 отображает сравнения аминокислотных последовательностей MTG и трансглутаминазы из Streptoverticillium cinnamoneum.
Фигура 4 отображает сравнения аминокислотных последовательностей MTG и трансглутаминазы из Streptoverticillium lydicus.
Фигура 5 отображает наборы праймеров, применяемые для сайтспецифического мутагенеза S2Y·S2R·S2D мутантов.
Фигура 6 отображает наборы праймеров, применяемые для сайтспецифического мутагенеза del 1-2 и del 1-3 мутантов.
Фигура 7 отображает 1H-15N HSQC спектр овальбумина, вступившего во взаимодействие с диким типом в присутствии 15NH4Cl.
Фигура 8 отображает величину интенсивности пика сигнала "a" на Фигуре 7 в глутаминовых остатках овальбумина, вступившего во взаимодействие с диким типом, Ser-типом, S2R, del 1-2 или del 1-3 мутантами в присутствии 15NH4Cl, расположенную относительно времени реакции.
Фигура 9 отображает величину интенсивности пика сигнала "a" на Фигуре 7 в глутаминовых остатках овальбумина, вступившего во взаимодействие с диким типом, S2Y, S2R или S2D мутантами в присутствии 15NH4Cl, расположенную относительно времени реакции.
Фигура 10 отображает 1H-15N HSQC спектр овальбумина, вступившего во взаимодействие с диким типом, Sg4 или Sg7 мутантами в присутствии 15NH4Cl.
Фигура 11 отображает атомные координаты (1) MTG.
Фигура 12 отображает атомные координаты (2) MTG.
Фигура 13 отображает атомные координаты (3) MTG.
Фигура 14 отображает атомные координаты (4) MTG.
Фигура 15 отображает атомные координаты (5) MTG.
Фигура 16 отображает атомные координаты (6) MTG.
Фигура 17 отображает атомные координаты (7) MTG.
Фигура 18 отображает атомные координаты (8) MTG.
Фигура 19 отображает атомные координаты (9) MTG.
Фигура 20 отображает атомные координаты (10) MTG.
Фигура 21 отображает атомные координаты (11) MTG.
Фигура 22 отображает атомные координаты (12) MTG.
Фигура 23 отображает атомные координаты (13) MTG.
Фигура 24 отображает атомные координаты (14) MTG.
Фигура 25 отображает атомные координаты (15) MTG.
Фигура 26 отображает атомные координаты (16) MTG.
Фигура 27 отображает атомные координаты (17) MTG.
Фигура 28 отображает атомные координаты (18) MTG.
Фигура 29 отображает атомные координаты (19) MTG.
Фигура 30 отображает атомные координаты (20) MTG.
Фигура 31 отображает атомные координаты (21) MTG.
Фигура 32 отображает атомные координаты (22) MTG.
Фигура 33 отображает атомные координаты (23) MTG.
Фигура 34 отображает атомные координаты (24) MTG.
Фигура 35 отображает атомные координаты (25) MTG.
Фигура 36 отображает атомные координаты (26) MTG.
Фигура 37 отображает атомные координаты (27) MTG.
Фигура 38 отображает атомные координаты (28) MTG.
Фигура 39 отображает атомные координаты (29) MTG.
Фигура 40 отображает атомные координаты (30) MTG.
Фигура 41 отображает атомные координаты (31) MTG.
Фигура 42 отображает атомные координаты (32) MTG.
Фигура 43 отображает атомные координаты (33) MTG.
Фигура 44 отображает атомные координаты (34) MTG.
Фигура 45 отображает атомные координаты (35) MTG.
Фигура 46 отображает атомные координаты (36) MTG.
Фигура 47 отображает атомные координаты (37) MTG.
Фигура 48 отображает атомные координаты (38) MTG.
Фигура 49 отображает атомные координаты (39) MTG.
Фигура 50 отображает атомные координаты (40) MTG.
Фигура 51 отображает атомные координаты (41) MTG.
Фигура 52 отображает атомные координаты (42) MTG.
Фигура 53 отображает атомные координаты (43) MTG.
Фигура 54 отображает атомные координаты (44) MTG.
Фигура 55 отображает атомные координаты (45) MTG.
Фигура 56 отображает атомные координаты (46) MTG.
Фигура 57 отображает атомные координаты (47) MTG.
Фигура 58 отображает атомные координаты (48) MTG.
Фигура 59 отображает атомные координаты (49) MTG.
Фигура 60 отображает атомные координаты (50) MTG.
Описание предпочтительных воплощений
Настоящее изобретение будет подробно описано далее.
Трансглутаминаза широко применяется при производстве продуктов питания, таких как желатинов, сыров, йогуртов, тофу, вареных рыбных паштетов, ветчин, колбас и лапши, а также для улучшения качества мясных продуктов (JP-Kokai No.64-27471). Трансглутаминаза также применяется для различных промышленных целей, например, в производстве материалов для термостабильных микрокапсул и в производстве носителей для иммобилизированных ферментов. Трансглутаминаза катализирует реакцию переацетилирования γ-карбоксамидной группы глутаминового остатка, содержащегося в пептидной последовательности молекулы белка. Если в молекуле белка ε-аминогруппа остатка лизина действует в качестве акцептора ацильной группы, в молекуле белка и между молекулами образуется связь типа ε-(γ-Glu)-Lys.
Авторы изобретения обнаружили, что трансглутаминаза не взаимодействует со всеми глутаминовыми остатками, а именно возможность реакции, то есть реакционная способность трансглутаминазы, варьирует в зависимости от типов и расположения остатков, окружающих глутаминовые остатки. Поэтому, модификация реакционной способности трансглутаминазы по отношению к глутаминовым остаткам в определенных условиях окружающей среды приводит к изменению скорости гелеобразования и, как результат, к расширению диапазона дальнейшего применения трансглутаминазы.
В настоящем изобретении для модификации субстратной специфичности MTG с помощью метода рентгеноструктурного анализа определяли ее пространственную структуру, предсказывали способ связывания ее с субстратом и конструировали и осуществляли приемлемые для этой цели мутации. Применяемый здесь термин "субстратная специфичность" обозначает реакционную способность по отношению к каждому глутаминовому остатку в акцепторе ацильной группы.
Определение пространственной структуры белка методом рентгеноструктурного анализа может быть осуществлено в соответствие со следующей процедурой:
(1) Белок кристаллизуют. Кристаллизация является необходимой для определения пространственной структуры. В дополнение кристаллизацию применяют в промышленности для высококачественной очистки белка, а также в качестве способа стабильного хранения белка в высокой концентрации, причем данный способ обладает высокой устойчивостью к действию протеолитических ферментов.
(2) Полученные таким образом кристаллы подвергают воздействию рентгеновского излучения с регистрацией результатов дифракции. Во многих случаях кристаллы белка повреждаются воздействием рентгеновского излучения, что снижает их способность к дифракции. В подобных случаях в последнее время широко распространена методика измерения при низких температурах, когда кристаллы быстро охлаждают до приблизительно -173°C, и измеряют дифракцию в данных условиях. В заключение, для получения данных с высоким разрешением, применяемых для установления пространственной структуры, используется высокоинтенсивное синхротронное излучение.
(3) Для анализа кристаллической структуры в дополнение к данным дифракции требуется фазовая информация. Структура MTG не может быть определена методом молекулярного замещения, так как кристаллические структуры аналогичных белков до сих пор неизвестны. Поэтому фазовая проблема может быть решена с помощью метода изоморфного замещения тяжелым атомом. Данный метод включает введение в состав кристалла атома металла с большой атомной массой, такого как ртуть или платина, и получение фазовой информации благодаря вкладу атома металла, обладающего высокой способностью рассеивать рентгеновское излучение, в данные дифракции рентгеновского излучения. Определенное таким образом значение фазы может быть улучшено за счет сглаживания электронной плотности в контактирующей с раствором области кристалла. В связи с тем, что электронная плотность молекул воды в контактирующей с раствором области кристалла едва уловима вследствие их высоких флуктуаций, значение электронной плотности, близко совпадающее с истинным значением электронной плотности, может быть получено при приравнивании значения электронной плотности в данной области к 0, что улучшает фазу. В том случае когда множество молекул собраны в асимметричный элемент, значение фазы может быть дополнительно значительно улучшено за счет усреднения электронной плотности данных молекул. Модель белка пригодна для расчета карты электронной плотности с помощью улучшенной фазы. Данный расчет выполняют в виде компьютерной графики с помощью программы, такой как QUANTA (MSI Co., U.S.A.). Затем структуру уточняют с применением программы, такой как X-PLOR (MSI Co., U.S.A.), для завершения анализа структуры.
Авторы изобретения кристаллизовали очищенную обычную MTG из Streptoverticillium mobaraense и рекомбинантную MTG (Met-типа) с дополнительным Met остатком от инициирующего кодона N-конца, но не смогли получить пригодный для анализа кристалл. Тем не менее, исходя из того, что полученные кристаллы обычной MTG были лучше, чем кристаллы MTG Met-типа, авторы изобретения получили MTG Asp-типа (Пример 1) после сделанного предположения о том, что начинающаяся с Asp1 рекомбинантная MTG (MTG Asp-типа) подобно обычной, полученной путем удаления Met остатка в N-конце, может обладать способностью к образованию кристаллов, пригодных для анализа. В результате из MTG Asp-типа был получен хороший кристалл (Пример 2) и успешно была получена пространственная структура (Пример 3). Атомные координаты пространственной структуры MTG представлены на Фигурах 11-60.
Считается, что механизм реакции трансглутаминазы является следующим.
Содержащий Gln донор ацильной группы взаимодействует с трансглутаминазой с образованием промежуточного продукта реакции. Затем содержащий Lys акцептор ацильной группы атакует промежуточный продукт с образованием связи типа ε-(γ-Glu)-Lys между донором ацильной группы и акцептором ацильной группы. Для применения белка в качестве донора ацильной группы факт содержания им Gln не является значимым, но при этом необходимо, чтобы участок вокруг Gln мог соответствующим образом связываться с субстратсвязывающим сайтом MTG. Наоборот, в большинстве случаев бывает достаточно, чтобы белок содержал первичный амин в качестве акцептора ацильной группы. Поэтому модификация субстратной специфичности MTG означает модификацию строения сайтов связывания с донором ацильной группы. Если MTG может быть модифицирована таким образом, чтобы уменьшить ее субстратную специфичность или, другими словами, чтобы связываться с большим количеством доноров ацильной группы, увеличивается частота случаев, когда объединение белков становится возможным с применением меньшего количества MTG, а потому ожидается снижение ее применяемого количества. Дополнительно, если становится возможным объединение белков, в которых образование поперечных сшивок изначально было невозможно, то становится возможным применение MTG в новой области. Пространственная структура MTG необходима для предсказания способа связывания между MTG и донором ацильной группы.
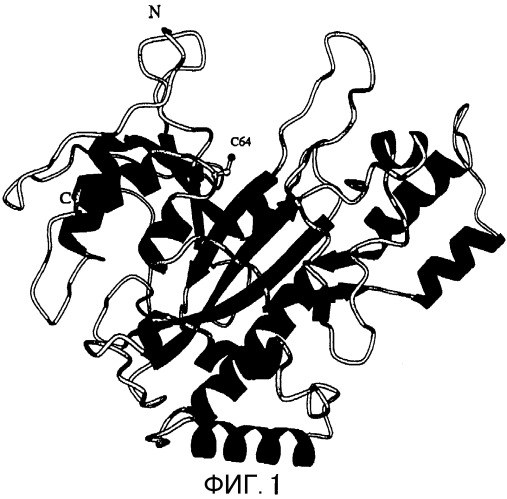
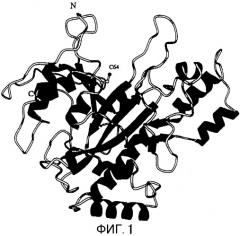
Установленная в настоящем изобретении молекула MTG имеет форму диска с размерами 65×59×41 Å (смотри Фиг.1 и 2). А именно, на Фигуре 1 показана ленточная модель кристаллической структуры MTG. α-Спирали и β-пластины показаны с помощью спиралей и стрелок соответственно. Активный остаток, Cys64, показан с помощью шарово-палочной модели (верхне-центральная часть).
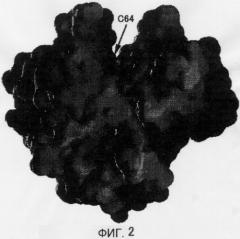
Фигура 2 отражает вогнуто-выпуклую поверхность кристаллической структуры MTG в том же направлении, что на Фигуре 1. Обладающие электрическим зарядом участки обозначены темным светом, а не несущие электрического заряда участки обозначены светлым цветом. При рассмотрении диска сверху обнаруживается клиновидная щель. Во внутренней части щели расположен активный остаток Cys64. Тот факт, что остаток Asp255 расположен по соседству с активным остатком Cys64, наводит на мысль о том, что реакцию обуславливает SH-группа остатка Cys64, которая может дегидрироваться остатком Asp255. Боковая цепь Cys64 обращена к растворителю, и она может достигать донора ацильной группы и акцептора ацильной группы. В Ca2+-зависимом факторе XIII системы свертывания крови человека активный остаток Cys не обращен к растворителю. Поэтому для связывания с донором ацильной группы фактор XIII системы свертывания крови человека должен претерпевать значительные структурные изменения для связывания активного остатка с донором ацильной группы. С другой стороны, считается, что MTG способна связываться с донором ацильной группы без изменения своей структуры. Поэтому высказано предположение, что MTG может использовать больше остатков Gln в качестве субстрата по сравнению с фактором XIII системы свертывания крови человека. Кроме того, MTG обладает тем достоинством, что легко может быть сконструирован ее мутант, обладающий сниженной субстратной специфичностью, так как структурное изменение, необходимое для связывания с донором ацильной группы, может не приниматься во внимание. Более того, молекулярная масса MTG составляет менее 38000, в то время как для фактора XIII системы свертывания крови человека она равна 166000, что делает определение сайта связывания MTG с донором ацильной группы более простым. При рассмотрении структуры MTG становится понятным, что субстрат, скорее всего, связывается в клиновидной щели, направленной от раствора к Cys64.
В щели расположено множество гидрофобных аминокислотных остатков и ароматических аминокислотных остатков, направленных к активному остатку Cys64, и поэтому считается, что их совместное действие с гидрофобными остатками или ароматическими остатками донора ацильной группы является одним из ключей для определения субстратной специфичности. Полярные остатки, включая Asp, также разбросаны на поверхности щели, что наводит на мысль о том, что они играют важную роль в распознавании донора ацильной группы. Обладающая модифицированной субстратной специфичностью мутантная трансглутаминаза может быть получена путем замены, вставки или делеции расположенных в щели аминокислотных остатков, которые предположительно являются участком связывания донора ацильной группы, предпочтительно замещением полярных остатков (Asp, Glu, Lys и Arg) или ароматических остатков (Phe, Tyr и Trp) другими аминокислотами, замещением их полярными остатками или ароматическими остатками, делецией полярных остатков или ароматических остатков или вставкой полярных остатков или ароматических остатков. Необходимо, тем не менее, отметить, что в связи с предположительной утратой активности вследствие модификации остатков Cys64 и Asp255, играющих важную роль в активности, при получении мутантов указанные остатки должны быть исключены.
Как показано в представленных ниже Примерах, в субстратных белках к реакционному сайту прилегают кислые аминокислоты. Во многих случаях взаимодействующие с MTG остатки глутамина расположены на поверхности субстратного белка и считается, что легко контактирующие с растворителем кислые аминокислоты, скорее всего, расположены вокруг них. Если кислые аминокислотные остатки содержатся в реакционном сайте субстратного белка MTG, то отрицательные заряды в MTG и субстратном белке взаимоотталкиваются со снижением скорости ферментативной реакции. Отрицательный заряд может быть устранен путем модификации кислых аминокислотных остатков, представленных на поверхности щели MTG, содержащей остаток Cys64,который предположительно связывается с донором ацильной группы, или, альтернативно, отрицательный заряд может быть уменьшен путем превращения аминокислотных остатков, последовательно или пространственно прилегающих к кислым аминокислотным остаткам, в основные аминокислоты с получением обладающей модифицированной субстратной специфичностью трансглутаминазы. Подобные кислые аминокислоты включают остатки MTG с №№1, 3, 4, 28, 58, 249, 300 и 304, описанные в SEQ ID NO: 2.
Аминокислоты, прилегающие к кислым аминокислотам, представляют собой аминокислотные остатки, располагающиеся в пределах 5 A от карбоксильных групп кислых аминокислот, таких как аспарагиновая кислота или глутаминовая кислота, и предпочтительно представляют собой аминокислотные остатки со степенью взаимодействия с растворителем, по меньшей мере, равной 10%. Они включают остатки MTG с №№2, 5, 59, 248-250, 252, 278, 283-285, 289, 291, 296-297 и 302-303, описанные в SEQ ID NO: 2.
Аминокислотная последовательность MTG представлена на SEQ ID NO: 2, а нуклеотидная последовательность кодирующего MTG гена представлена на SEQ ID NO. 1.
Как показано в Примере 5, было подтверждено, что в молекуле белка скорость реакции на конкретном глутаминовом остатке может быть повышена путем удаления остатков Asp1 или Asp3 или путем замещения остатка Ser2. В связи с тем, что расстояние между активным остатком Cys64 и остатком Asp1 в N-конце составляет 20 Å, предполагается существование возможности модификации субстратной специфичности путем модификации аминокислотных остатков, расположенных в пределах 20 Å от остатка Cys64. В дополнение, в связи с подтверждением субстратной специфичности, по крайней мере, для петлевых участков (233-253 и 276-288), сделано предположение о возможности модификации субстратной специфичности при помощи модификации данных участков. Возможность модификации субстратной специфичности дополнительно возрастает при помощи модификации остатков, расположенных на поверхности расщелины, содержащей остаток Cys64, предположительно связывающийся с донором ацильной группы. Для определения того, обращены ли аминокислотные остатки в сторону растворителя или нет, с применением программы, такой как QUANTA, может быть рассчитана доступность растворителя. Доступность растворителя является выражаемой в процентах величиной, равной частному доступной для растворителя площади остатка белка и доступной для растворителя площади аминокислоты в своей свободной форме. Возможность модификации субстратной специфичности MTG может быть высока в случае модификации остатков, располагающихся в пределах 20 Å от остатка Cys64 и имеющих значение доступности растворителя, равное, по меньшей мере, 10%. Данные остатки соответствуют остаткам MTG с №№1-5, 26, 28, 58-59, 62, 69, 74-75, 77, 79, 235-236, 238-244, 248-250, 252-254, 277-278, 282-287, 289, 291, 296-297 и 300-304, описанным в SEQ ID NO. 2.
При конструировании и получении мутантной трансглутаминазы кодон в кодирующем трансглутаминазу гене, соответствующий аминокислотным остаткам в описанном выше субстратсвязывающем сайте, может быть модифицирован путем сайтспецифического мутагенеза, полученный ген может быть вставлен в подходящий вектор и перенесен реципиенту с последующим культивированием трансформанта. Требуемая мутантная трансглутаминаза может быть выделена из трансформированных культивируемых микробных клеток и оценена.
Методы сайт-специфического мутагенеза для проведения требуемой мутации в требуемых сайтах ДНК включают, например, описанный в Примерах метод PCR [Higuchi, R., 61, in PCR technology; Stockton Press, edited by Eriich, H. A. (1989); Carter P., Meth. In Enzymol., Vol.154, p.3382 (1987)]; и метод с применением фага [Kramer W. and Frits H.J., Methods in Enzymology, Vol.54, p.350 (1987), Kunkel, T A. et al. Methods in Enzymology, Vol.154, p.367 (1987)]. Векторы для введения кодирующих трансглутаминазу генов конкретно не ограничиваются настолько, насколько они могут реплицироваться в реципиенте. В случае применения Escherichia coli в качестве реципиента могут применяться плазмиды, способные автономно реплицироваться в данной бактерии. Например, могут применяться плазмиды pUC19, pET или pGEMEX.
Предпочтительными реципиентами являются, например, линии Escherichia coli, однако любая бактерия может быть использована в качестве реципиента настолько, насколько репликатор сконструированной рекомбинантной ДНК и мутантной трансглутаминазы может функционировать, мутантная ДНК может реплицироваться, а гены мутантной трансглутаминазы могут экспрессироваться в бактерии. Примером предпочтительного реципиента является Escherichia coli BL21(DE3)pLysS при использовании промотора T7 или Escherichia coli JM109 в других случаях.
Для введения реципиенту рекомбинантной ДНК, полученной путем сшивания вектора с фрагментом ДНК, содержащим кодирующий мутантную трансглутаминазу ген, может применяться обычный метод, без какого-либо конкретного ограничения. В случае использования в качестве реципиента Escherichia coli может быть применен метод хлорида кальция [J. Mol. Biol., Vol.53, p.159 (1970)], метод Hanahan [J. Mol. Biol, Vol.166, p.557 (1983)], метод SEM [Gene, Vol.96, p.23 (1990)] и метод по Chung et al. [Proceedings of the National Academy of Sciences of the USA, Vol.86, p.2172 (1989)].
MTG может быть экспрессирована в бактериальной клетке в большой степени путем культивирования трансформанта, несущего рекомбинантную ДНК, содержащую кодирующий мутантную трансглутаминазу ген, в подходящей среде, содержащей источник углерода, источник азота, неорганическое железо и, если это необходимо, дополнительно содержащей источник питания органической природы. Для экстракции мутантной трансглутаминазы из культивируемых клеток после культивации клетки собирают, суспендируют в буферном растворе, подвергают воздействию лизоцима, замораживания-оттаивания, разрушению ультразвуком и тому подобное, а затем разрушают и центрифугируют для разделения суспензии на супернатант и осадок.
В связи с тем, что мутантная трансглутаминаза продуцируется в виде белкового тельца включения и выделяется в виде осадка, она может быть солюбилизирована денатурирующим агентом или тому подобное, а затем денатурирующий агент может быть удален для выделения и очистки белка. Денатурирующими агентами для солюбилизации продуцируемого белкового тельца включения могут быть, например, мочевина (например, 8 M) и гуанидинхлорид (например, 6 M). Обладающий трансглутаминазной активностью белок регенерируют путем снижения концентрации денатурирующего агента при помощи разбавления или тому подобное. Применяемые для разбавления растворы могут включать фосфатные буферы и Трис-буферы.
После регенерации активности действующий белок может быть выделен и очищен при помощи подходящей комбинации известного способа выделения и способа очистки. Примерами таких способов являются высаливание, диализ, ультрафильтрация, гель-фильтрация, ионообменная хроматография, аффинная хроматография и высокоэффективная жидкостная хроматография с обращенной фазой.
Термин "субстратная специфичность" в контексте настоящего изобретения обозначает реакционную способность каждого остатка глутамина в молекуле субстратного белка по отношению к трансглутаминазе. Изменение субстратной специфичности трансглутаминазы означает изменение реакционной способности, по крайней мере, одного остатка глутамина. В том случае когда обладающая измененной субстратной специфичностью трансглутаминаза взаимодействует с белком, степень поперечного сшивания белка, а именно степень гелеобразования, также изменяется по сравнению с результатами, полученными при взаимодействии с обычной трансглутаминазой.
Способы сравнения субстратной специфичности трансглутаминаз включают, например, способ, при котором определяется скорость гелеобразования казеина, способ, при котором полученный в результате трансглутаминазной реакции поперечно-сшитый полимер анализируют при помощи электрофореза, и способ, при котором продукт реакции разделяют на фрагменты и анализируют. Также возможно, что с применением трансглутаминазы проводят взаимодействие субстратного белка с 15N-меченным ионом аммония, а затем определяют меченые остатки глутамина методом ЯМР (заявка на выдачу патента Японии №2000-141152).
Анализ субстратной специфичности при помощи последнего способа представляет собой способ сравнения реакционной способности индивидуального остатка глутамина в белке, основываясь на том выгодном факте, что азот карбоксамидной группы в действующем в качестве субстрата остатке глутамина является 15N-меченным при помощи трансглутаминазы. Субстратные специфичности трансглутаминаз могут сравниваться между собой, основываясь на том выгодном факте, что действующий в качестве субстрата для трансглутаминазы остаток глутамина является специфически 15N-меченным, и что скорость мечения варьирует в зависимости от реакционной способности трансглутаминазы по отношению к остатку глутамина.
Единицу активности трансглутаминазы определяют и обозначают следующим образом.
Проводят взаимодействие бензилоксикарбонил-L-глутаминилглицина и гидроксиламина в качестве субстратов, полученную гидроксамовую кислоту преобразовывают в ее комплекс с железом в присутствии трихлоруксусной кислоты и затем определяют ее количество по поглощению при 525 нм. Таким образом, получают калибровочную кривую, основанную на количестве гидроксамовой кислоты. Количество фермента, продуцирующего 1 мкМ гидроксамата за 1 минуту, обозначают как единицу трансглутаминазной активности, одна единица. Детали данного способа определения сообщались ранее (например, JP-Kokai No.64-27471).
Кроме трансглутаминазы из Streptoverticillium mobaraence (MTG), на основе пространственной структуры MTG также возможно модифицировать фермент, обладающий трансглутаминазной активностью и гомологичной MTG аминокислотной последовательностью, или фермент, обладающий трансглутаминазной активностью и предположительно обладающий сходной с MTG пространственной структурой. Замена аминокислот, эффективная для модификации субстратной специфичности MTG или тому подобное, также эффективна для аналогичных ферментов, таких как ферменты из Streptoverticillium cinnamoneum и Streptoverticillium lydicus (JP-Kokai No.10-504721). Аминокислотная последовательность трансглутаминазы из Streptoverticillium cinnamoneum представлена на SEQ ID NO: 6, нуклеотидная последовательность кодирующего аминокислотную последовательность гена представлена на SEQ ID NO: 5, аминокислотная последовательность трансглутаминазы из Streptomyces lydicus представлена на SEQ ID NO: 8, и нуклеотидная последовательность кодирующего аминокислотную последовательность гена представлена на SEQ ID NO: 7. В этой связи гомологичность аминокислотной последовательности MTG и трансглутаминазы из Streptoverticillium cinnamoneum составляет 78% (Фигура 3), а гомологичность аминокислотной последовательности MTG и трансглутаминазы из Streptomyces lydicus составляет 79% (Фигура 4). А именно, на Фигуре 3 представлено сравнение аминокислотной последовательности MTG и трансглутаминазы из Streptoverticillium cinnamoneum. Сохраненные остатки аминокислот обозначены "*". На Фигуре 4 представлено сравнение аминокислотной последовательности MTG и трансглутаминазы из Streptoverticillium lydicus. Сохраненные остатки аминокислот обозначены "*".
Задание координат остатков аминокислот двух разных белков может быть сделано на основе сравнения аминокислотных последовательностей (Сравнение Сиквенса), если гомологичность их аминокислотных последовательностей превышает приблизительно 20%, и оно может быть сделано на основе пространственных структур и сравнения аминокислотных последовательностей (Тридинг), если гомологичность не превышает приблизительно 20%. Первый может быть выполнен с применением программы, такой как BLA