Составы моксифлоксацина, содержащие поваренную соль
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к водному составу моксифлоксацин-гидрохлорида и хлорида натрия, содержащему от 0,04 до 0,4% (м/о) (считая на количество моксифлоксацина) моксифлоксацин-гидрохлорида и от 0,4 до 0,9% (м/о) хлорида натрия, и использованию состава с целью получения лекарственного средства для профилактики или лечения бактериальных инфекций у людей или животных. Достигается стабильность полученного раствора моксифлоксацина в виде моксифлоксацин-гидрохлорида в присутствии ионов железа. 5 з.п. ф-лы.
Реферат
Данное изобретение относится к водному составу, содержащему моксифлоксацин-гидрохлорид и хлорид натрия, составу для применения в качестве лекарственного средства и использованию состава с целью получения лекарственного средства для профилактики или лечения бактериальных инфекций у людей или животных.
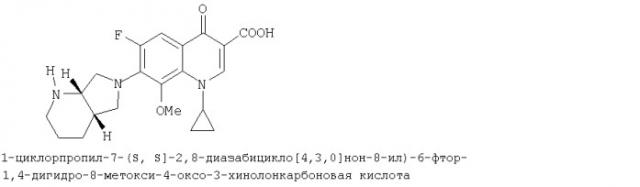
Моксифлоксацин (INN - международное незарегистрированное название) является антибиотиком из класса хинолонкарбоновых кислот следующей формулы:
Он является высокоэффективным противоинфекционным средством и впервые описан в заявке на европейский патент ЕР-А-0350733. Однако в этой заявке не описываются фармацевтические препараты, пригодные для парентерального введения. Потребность же в таком парентерально вводимом инфузионном растворе существует, в частности, в отделениях интенсивной терапии для лечения пациентов, которые не способны к оральному приему лекарств.
Для состава совместимых инфузионных растворов требуется приведение осмотичности в соответствие с физиологическими показателями организма (Suker/Fuchs/Speiser, Фармацевтическая технология). Значительное гипо- или гиперосмотическое отклонение может привести к разрушению эритроцитов или раздражению тканей. При повышенной внутривенной дозе гипоосмотического раствора наступает гемолиз, введение больших количеств гиперосмотического раствора приводит к плазмолизу. Гипоосмотические растворы содержат меньше растворенных молекул или ионов по сравнению с присутствующими в крови или тканевой жидкости. В этом случае должно быть проведено изотонизирование путем добавления изотонического средства. (Bayer/Frömming/Führer; Фармацевтическая технология). При этом в качестве изотонической целесообразно считается область от 270 до 350 мОсмол/кг.
Стандартным изотоническим раствором является, например, 5%-ный раствор глюкозы или 0,9%-ный раствор поваренной соли.
В заявке на европейский патент ЕР-А-0534860 описываются составы хинолонкарбоновой кислоты - антибиотика спарфлоксацина с монокарбоксил-полигидроксикислотами или их лактонами, как, например, с аскорбиновой кислотой и с глюкозой или глицерином в качестве изотонизирующей добавки. Изобретение основывается на улучшении растворимости спарфлоксацина с помощью монокарбоксил-полигидроксикислот для получения совместимого изотонического или гипертонического состава нужной концентрации.
В заявке на патент США А-5563149 описан состав, содержащий водные растворы пиридонкарбоновых кислот и их эфиров и солей в качестве антибиотиков, применяемых в качестве инъекционных или инфузионных растворов или концентратов. Данные о изотонизирующих добавках или составах для тонизирования не приводятся. Целью данного изобретения является улучшение растворимости описанных пиридонкарбоновых кислот.
В заявке на европейский патент А-0507851 описаны составы, содержащие комплексы хинолонкарбоновая кислота - ион металла - кислота. Посредством введения многовалентных металлических ионов магния, кальция, марганца, цинка, кадмия, алюминия, церия или железа в результате комплексообразования при нейтральной величине рН обнаружена повышенная растворимость активного вещества. Отмечается, что такие составы химически и физически стабильны также в присутствии глюкозы для изотонизирования и обладают улучшенной совместимостью благодаря нейтральной величине рН.
В патенте США 5811130 описан комплекс иона металла с данофлоксацином, в котором для комплексообразования используются, в частности, ионы магния и цинка, что способствует отчетливо повышенной растворимости данофлоксацина. Описаны составы с более высокой концентрацией активного вещества для подкожных инъекций, которая может быть достигнута, прежде всего, благодаря улучшенной растворимости комплекса ион металла - активное вещество.
Далее, в патенте США 5084276 указывается на применение комплексов хинолонкарбоновая кислота - ион металла, например, с ионами магния, кальция, марганца, цинка, кадмия, железа (II), железа (III) или церия (IV) для комплексообразования с активными веществами темафлоксацином, токсифлоксацином или пефлоксацином, причем комплекс активного вещества вместе с вспомогательными веществами используется для восстановления поврежденных вен. Описанные составы для парентерального введения изотонизируются глюкозой.
В рамках развития работ с моксифлоксацином неожиданно было найдено, что изотонизирование путем добавления 5% стандартной глюкозы или другого сахара или многоатомных спиртов, дающих при окислении моносахарид, например, 2,5% глицерина, в случае моксифлоксацина приводит к нестабильным растворам. Эта нестабильность проявляется в появлении в растворе субвизуальных частиц, число которых лежит выше пределов, допускаемых фармакопеей (USP XXIII, ВР93). При этом в процессе хранения образуются окрашенные коричневые аморфные частицы, которые часто появляются лишь после 4-8 недель хранения при 40°С, и далее в процессе хранения их количество увеличивается. При комнатной температуре или хранении в холодильнике образование этих частиц замедляется. Изобретатель нашел, что образование частиц вызывается тройным взаимодействием между моксифлоксацином или его солями, железом и сахаром или многоатомными спиртами, образующими при окислении моносахарид, например, глицерином. Это обстоятельство стало неожиданным, т.к. подобный феномен при получении парентеральных составов хинолонкарбоновых кислот прежде не был известен и, в частности, из европейского патента ЕР 0507851, патента США 5811130, патента США 5084276, в которых для стабилизации и повышения растворимости использовалось взаимодействие поливалентных ионов металлов с хинолонкарбоновыми кислотами. Антибиотик ципрофлоксацин допускает более высокие концентрации железа.
Так как железо встречается повсеместно и, в частности, как примесное вещество к глюкозе, с которой может образовывать комплекс, очевидно, что такой состав может быть получен лишь с большими издержками, связанными с его анализом и установлением гарантированного качества. Вдобавок применение стали для изготовления установки проблематично, т.к. контактировать с раствором могут лишь специальные марки стали и проверенные материалы. Далее, такой состав требует наличия, как правило, максимально свободного от железа активного вещества, которое может быть получено только путем больших затрат. В растворах, содержание железа в которых выше 20·10-9, в случае моксифлоксацина содержание частиц сильно возрастает со временем, так что нужное фармацевтическое качество состава после получения не может быть гарантировано в течение необходимого срока годности. Кроме того, тонизируемые глюкозой составы в различных областях клинического применения классифицируются как очень вредные, поскольку могут создавать добавочную нагрузку на энергетический баланс организма пациента, что, в частности, необходимо принимать во внимание особенно при лечении больных диабетом.
В случае парентеральных водных составов гидрохлоридов хинолонкарбоновых кислот из-за их плохой растворимости в присутствии хлорида натрия в общем существует проблема введения предназначенных для вливания объемов. Наряду с описанной выше возможностью повышения растворимости посредством получения комплексов с металлами описаны также различные возможности солеобразования.
Так, в заявке на европейский патент ЕР-А-0219784 описаны инфузионные растворы ципрофлоксацина с физиологически совместимыми кислотами. Описаны также составы, содержащие 75 мг/500 мл ципрофлоксацина, что соответствует 0,015% (масса/объем), 0,203 мг/500 мл 1М соляной кислоты (соответствует мольному соотношению ципрофлоксацин/соляная кислота от 1,0 до 0,9), и 4,5 г/500 мл (0,9%) хлорида натрия в качестве изотонизирующей добавки. Эта концентрация активного вещества соответствует приблизительно концентрации насыщенного раствора в данном составе при комнатной температуре. Более высокая концентрация ципрофлоксацина в присутствии соляной кислоты и изотонических количеств хлорида натрия не может быть достигнута вследствие плохой растворимости ципрофлоксацина или его гидрохлорида. При обычной дозировке ципрофлоксацина от 2 до 3 раз ежедневно в количестве 100-400 мг на дозу инфузионные объемы являются таким образом неприемлемыми, т.к. составляют от 1,3 до 8 л ежедневно. Из-за очень больших количеств инфузионной жидкости при данной дозировке применяют вследствие этого предпочтительно водные составы лучше растворимых ципрофлоксацин-лактамов.
В настоящий момент изобретателем неожиданно было найдено, что лекарственный состав моксифлоксацин-хлорида, который изотонизируют хлоридом натрия, не обладает чувствительностью к ионам железа. Растворимость активного вещества моксифлоксацина в форме его гидрохлорида в присутствии хлорида натрия правда чрезвычайно плохая, так что первоначально проведенные испытания таких составов после образования осадка были признаны неудачными. Однако неожиданно было найдено, что приемлемые составы моксифлоксацин-хлорида при изотонизировании поваренной солью могут быть получены, если придерживаться определенных узких областей концентраций для активного вещества и изотонизирующего агента.
Объектом изобретения в связи с этим являются водные составы, которые содержат от 0,04 до 0,4% моксифлоксацин-гидрохлорида (считая на моксифлоксацин) и от 0,4 до 0,9% (м/о) хлорида натрия.
Водный состав означает, что компоненты состава находятся в воде.
Обозначение "% (м/о)" означает массу в г на 100 мл объема, т.е. г/100 мл.
Водный состав по изобретению содержит предпочтительно от 0,08 до 0,32% (м/о) моксифлоксацин-гидрохлорида (считая на моксифлоксацин) и особенно предпочтительно от 0,1 до 0,2% (м/о) моксифлоксацин-гидрохлорида (считая на моксифлоксацин). Совсем предпочтительным является состав с приблизительно 0,16% (м/о) моксифлоксацин-гидрохлорида (считая на моксифлоксацин), соответствующий содержанию 400 мг/250 мл.
Водный состав по изобретению содержит от 0,4 до 0,9% (м/о) хлорида натрия, предпочтительно от 0,5 до 0,9% (м/о) хлорида натрия, предпочтительнее от 0,7 до 0,9% (м/о) хлорида натрия и совсем предпочтительной является добавка хлорида натрия около 0,8% (м/о).
В области дозирования от 100 до 1000 мг при концентрациях активного вещества от 0,04 до 0,4% (м/о) моксифлоксацин-гидрохлорида приведение осмотического давления в соответствие с физиологическими параметрами может быть достигнуто посредством добавления от 0,4 до 0,9% (м/о) хлорида натрия. Кроме того, необходимо принимать во внимание концентрацию насыщенного раствора активного вещества в присутствии различных концентраций хлорида натрия при температуре 5°С и доводить концентрацию активного вещества, а также концентрацию хлорида натрия до оптимальных значений в соответствии с данным изобретением. Концентрация насыщенного раствора активного вещества в присутствии необходимого для изотонизирования количества хлорида натрия, измеренная при 5°С, не должна быть превышена. Этим гарантируется, что при кратковременном охлаждении в холодильнике не произойдет осаждения активного вещества из-за превышения концентрации насыщенного раствора.
Для растворов с концентрацией активного вещества приблизительно 0,2% (м/о) моксифлоксацин-гидрохлорида не могут быть получены с хлоридом натрия идеальные изотонические растворы из-за слишком малой растворимости вещества. Однако, поскольку при внутривенном введении происходит быстрое разбавление инфузионного раствора током крови, протекающее безболезненно, то приведение тоничности в соответствие с физиологическими параметрами является вполне удовлетворительным. Оптимальная совместимости таких растворов может достигаться путем соответствующего подбора скорости инфузии. (Литер-ра: Sucker/Fuchs/Speiser, "Фармацевтическая технология", Издательство "Tieme", 1991, стр.460 и далее).
Изотоническим раствором называют раствор, обладающий осмотическим давлением приблизительно от 270 до 330 мОсмол. Это соответствует раствору хлорида натрия с концентрацией приблизительно от 0,8 до 0,9% (м/о). По сравнению с этим моксифлоксацин-гидрохлорид почти не способствует изотонизированию. Неожиданно обнаружилось, что при наличии такой концентрации хлорида натрия моксифлоксацин-гидрохлорид удовлетворительно и стабильно растворяется, благодаря чему подобный состав пригоден в качестве состава для парентерального введения.
| Таблица 1.Растворимость моксифлоксацин-гидрохлорида и присутствии хлорида натрия при 5°С. | ||||||||||
| Хлорид натрия, % (м/о) | 0 | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 |
| Растворимость моксифлоксацин-гидрохлорида, % (м/о) | 1,8 | 1,1 | 0,7 | 0,5 | 0,4 | 0,3 | 0,2 | 0,2 | 0,2 | 0,1 |
Особенно предпочтительной является доза моксифлоксацина от 200 до 800 мг, соответствующая концентрации от 0,08 до 0,32% (м/о) моксифлоксацина. Регулировка осмотического давления достигается 0,9-0,4% (м/о) хлорида натрия. Исключительно предпочтительным является дозирование 400 мг моксифлоксацина в виде приблизительно 0,16%-ного (м/о) раствора моксифлоксацина, который изотонизируется 0,8% (м/о) раствором хлорида натрия.
Далее было найдено, что приготовление таких растворов моксифлоксацина с хлоридом натрия требует значительного времени, если обычным путем вносить активное вещество моксифлоксацин-гидрохлорид в растворенный в воде хлорид натрия и доводить до раствора. При этом требуется перемешивание в течение нескольких часов, чтобы раствор стал прозрачным и чтобы избежать затем потери активного вещества при отделении его на стадии фильтрации. При использовании способа, при котором сначала активное вещество растворяется в воде и лишь затем добавляется хлорид натрия, удается получить раствор в течение нескольких минут и осуществить производство в промышленном масштабе.
Объектом изобретения вследствие этого является также способ получения водного состава согласно изобретению, по которому сначала готовят раствор моксифлоксацин-гидрохлорида в воде, а затем прибавляют хлорид натрия и растворяют.
Целесообразно вследствие этого осуществлять приготовление водного состава моксифлоксацин-гидрохлорида так, чтобы раствор моксифлоксацин-гидрохлорида в воде с концентрацией моксифлоксацин-гидрохлорида (считая на количество моксифлоксацина) более, чем от 0,4 до 2,4% (м/о), являющийся таким образом концентратом моксифлоксацин-гидрохлорида в воде, разбавлялся водным раствором, содержащим хлорид натрия, до концентрации моксифлоксацин-гидрохлорида, соотвествующей данному изобретению.
Далее объектом изобретения является, следовательно, применение водного раствора моксифлоксацин-гидрохлорида с концентрацией моксифлоксацин-гидрохлорида (считая на количество моксифлоксацина) более чем от 0,4 до 2,4% (м/о) (в последующем обозначенной как концентрация активного вещества) для получения лекарственного средства для парентерального введения, а также комбинированного препарата, состоящего из изолированных друг от друга водного раствора моксифлоксацин-гидрохлорида с концентрацией моксифлоксацин-гидрохлорида (считая на количество моксифлоксацина) более чем от 0,4 до 2,4% (м/о) и водного раствора хлорида натрия, при этом концентрированный водный раствор моксифлоксацин-гидрохлорида целесообразно смешивать с предоставляемым водным раствором хлорида натрия непосредственно перед введением самим врачом или медперсоналом.
Концентрированный водный раствор моксифлоксацин-гидрохлорида содержит от 0,4 до 2,4% (м/о) моксифлоксацин-гидрохлорида (считая на количество моксифлоксацина). Максимальная концентрация водного раствора ограничивается концентрацией насыщенного раствора приблизительно 2,4% (м/о). Преимущественно концентрат активного вещества содержит от 1,0 до 2,0% (м/о) моксифлоксацин-гидрохлорида (считая на количество моксифлоксацина), особенно предпочтительно 2,0% (м/о) моксифлоксацин-гидрохлорида (считая на количество моксифлоксацина). Концентрат активного вещества разливают в подходящие контейнеры и надлежащим образом стерилизуют. Контейнеры могут быть как стеклянными, так и пластмассовыми. При этом материал для контейнеров может содержать вещества, особо защищающие содержимое, например от света или кислорода.
Посредством смешивания с растворами, содержащими хлорид натрия, производят разбавление концентрата активного вещества до применяемых концентраций моксифлоксацина, соответствующих заднему составу в соответствии с данным изобретением. При необходимости растворы для разбавления, кроме хлорида натрия, могут содержать другие соли натрия, калия, кальция, магния и пр., как например, хлориды, карбонаты, сульфаты, ацетаты, глюконаты, лактаты, малаты, а также другие обычно используемые для парентерального применения вспомогательные вещества, если только гарантируется образование гомогенного диффузионного раствора. Для разбавления концентрата активного вещества могут быть также использованы распространенные и имеющиеся в торговой сети растворы для вливания.
Водный состав по изобретению служит в качестве лекарственного средства для парентерального применения, в частности, в качестве лекарственного средства для предотвращения или лечения бактериальных инфекций. Парентеральное введение включает, например, внутривенное, внутриартериальное, подкожное, внутримышечное, а также внутрибрюшное введение, причем внутривенному введению придается наибольшее значение. Целесообразной считается доза в 400 мг активного вещества, считая на бетаиновую форму, для одноразовой ежедневной внутривенной инъекции. Ежедневно вводимый инъекционный объем не должен превышать 200-250 мл. Из этого следует, что при количестве активного вещества 400 мг концентрация активного вещества около 0,16% (м/о) соответствует 400 мг/250 мл.
Водный лекарственный состав по изобретению может содержать дополнительно к применяемым согласно данному изобретению компонентам другие обычные вещества, используемые при парентеральном введении как, например, кислоты и основания для регулирования величины рН, а также обычные консерванты и антиоксиданты.
Крайне неожиданным оказалось, что состав моксифлоксацина, соответствующий данному изобретению, даже при многонедельном хранении при низких температурах, которое приводит к выпадению активного вещества, снова превращается в прозрачный свободный от частиц раствор с помощью простого нагревания при комнатной температуре. Образование осадка в виде формирования стабильных крупных кристаллических структур не наблюдается, так что состав, соответствующий данному изобретению, может быть классифицирован, как стабильный и надежный для продажи.
Далее, для производства установок достаточно использовать сорт стали, распространенной обычно в фармацевтическом производстве. Составы согласно данному изобретению неожиданным образом в противоположность составам моксифлоксацина, которые содержат сахар и многоатомные спирты, образующие при окислении моносахарид, стабильны в присутствии железа. Описанные ниже опыты с целенаправленной добавкой ионов железа к раствору показали, что даже при количестве железа 1·10-6, т.е. при 50-кратном превышении количества по сравнению с допустимой предельной величиной для глюкозного состава, никакого образования частиц в растворе не происходит. Составы согласно данному изобретению, следовательно, благодаря их стабильности и легкости получения являются исключительно подходящими для парентерального введения.
Изобретение более подробно комментируется следующими примерами.
Примеры
Пример 1 (сравнительный)
Изотонический состав моксифлоксацина, 0,2% (м/о) (400 мг/200 мл), изотонизируемый глюкозой 5%.
| Моксифлоксацин-гидрохлорид | 0,2% (м/о)* |
| Глюкоза-моногидрат | 5,0% (м/о) |
| Вода для инъекций | 94,8% (м/о) |
*Количество, считая на моксифлоксацин в бетаиновой форме
В насадочную емкость из нержавеющей стали фармацевтического назначения помещают воду и растворяют в ней при перемешивании моксифлоксацин-гидрохлорид. В раствор активного вещества добавляют глюкозу (стандартного качества, около 380·10-6 железа) и растворяют. После фильтрации через стерильный фильтр (0,2 мкм) заполняют инфузионную емкость до 200 мл, закупоривают и стерилизуют в автоклаве при 121°С в течение 20 мин. Готовый раствор содержит приблизительно 25·10-9 железа.
В полученном продукте после хранения при 40°С содержание частиц составляло:
| Условия хранения | Частицы >/=25 мкм/ мл | ||
| (Предельная величина макс.2 / мл; USP XXIII) | |||
| Партия А | Партия Б | Партия В | |
| Исходный контроль | 0,6 / мл | 0,6 / мл | 0,7 / мл |
| 4 недели, 40°С | 5,6 / мл | 4,2 / мл | 4,3 / мл |
Продукт нестабилен и уже после 4 недель хранения при 40°С обнаружен недопустимый рост количества частиц, не соответствующий требованиям фармакопеи.
Пример 2 (сравнительный)
Моксифлоксацин-состав 0,4% (м/о) (400 мг/100 мл), тонизирование хлоридом натрия 0,3%
| Моксифлоксацин-гидрохлорид | 0,4% (м/о)* |
| Хлорид натрия | 0,3% (м/о) |
| Вода для инъекций | 99,3% (м/о) |
*Количество, считая на моксифлоксацин в бетаиновой форме
В емкость из высококачественной стали помещают воду и растворяют в ней при перемешивании моксифлоксацин-гидрохлорид. В раствор активного вещества добавляют хлорид натрия и растворяют. После фильтрации через стерильный фильтр (0,2 мкм) заполняют инфузионную емкость до 100 мл, закупоривают и стерилизуют в автоклаве при 121°С в течение 20 мин.
Раствор обладает осмотичностью около 100 мОсмол/кг и является поэтому гипотоническим, вследствие чего введение его с обычной для парентеральных растворов скоростью протекает болезненно и приводит к гемолизу.
Пример 1
Моксифлоксацин-состав 0,16% (м/о) (400 мг/250 мл)
| Моксифлоксацин-гидрохлорид | 0,16% (м/о)* |
| Хлорид натрия | 0,8% (м/о) |
| Вода для инъекций | 99,04% (м/о) |
Осмотичность: 281 мОсмол/кг
*Количество, считая на моксифлоксацин в бетаиновой форме
В емкость из стекла помещают воду и растворяют в ней при перемешивании моксиф-локсацин-гидрохлорид. В раствор активного вещества добавляют и растворяют хлорид натрия. К исходной смеси прибавляют раствор хлорного железа. После фильтрации через стерильный фильтр (0,2 мкм) заполняют инфузионную емкость до 250 мл, закупоривают и стерилизуют в автоклаве при 121°С в течение 20 мин.
В полученном продукте после хранения при 40°С содержание частиц составляло:
Раствор с содержанием железа 540·10-9
| Условия хранения | Частицы >/=25 мкм / мл |
| (Предельная величина макс.2 / мл; USP XXIII) | |
| Исходный контроль | 0,00 |
| 4 недели, 40°С | 0,13 |
| 8 недель, 40°С | 0,17 |
| 8 недель, 25°С | 0,00 |
Раствор стабилен при хранении и не чувствителен к ионам железа.
Раствор с содержанием железа менее 10·10-9
| Условия хранения | Частицы >/=25 мкм / мл |
| (Предельная величина макс.2 / мл; USP XXIII) | |
| Исходный контроль | 0,07 |
| 12 недель, 40°С | 0,19 |
| 78 недель, 25°С | 0,07 |
| 78 недель, 30°С | 0,15 |
Раствор стабилен при хранении и не чувствителен к ионам железа.
Пример 2
Моксифлоксацин-состав 0,1% (м/о) (100 мг/100 мл)
| Моксифлоксацин-гидрохлорид | 0,1% (м/о)* |
| Хлорид натрия | 0,9% (м/о) |
| Вода для инъекций | 99,0% (м/о) |
Осмотичность: 313 мОсмол/кг
*Количество, считая на моксифлоксацин в бетаиновой форме
В емкость из нержавеющей стали фармацевтического качества помещают воду и растворяют в ней при перемешивании моксифлоксацин-гидрохлорид. В раствор активного вещества добавляют хлорид натрия и растворяют. После фильтрации через стерильный фильтр (0,2 мкм) заполняют инфузионную емкость до 100 мл, закрывают и стерилизуют в автоклаве при 121°С в течение 20 мин.
В полученном продукте после хранения при 40°С содержание частиц составляло:
| Условия хранения | Частицы > /=25 мкм / мл |
| (Предельная величина макс.2 / мл; USP XXIII) | |
| Исходный контроль | 0,03 |
| 4 недели, 40°С | 0,05 |
| 95 недель, 25°С | 0,16 |
| 156 недель, 25°С | 0,43 |
Раствор стабилен при хранении и не чувствителен к получению в емкостях из стали фармацевтического назначения в нормальных производственных установках.
Пример 3
Моксифлоксацин-состав 0,04% (м/о) (40 мг/100 мл)
| Моксифлоксацин-гидрохлорид | 0,04% (м/о)* |
| Хлорид натрия | 0,9% (м/о) |
| Вода для инъекций | до 100 мл |
Осмотичность: 310 мОсмол/кг
*Количество, считая на моксифлоксацин в бетаиновой форме
Пример 4
Моксифлоксацин-состав 0,08% (м/о) (80 мг/100 мл)
| Моксифлоксацин-гидрохлорид | 0,08% (м/о)* |
| Хлорид натрия | 0,9% (м/о) |
| Вода для инъекций | до 100 мл |
Осмотичность: 312 мОсмол / кг
*Количество, считая на моксифлоксацин в бетаиновой форме
Пример 5
Моксифлоксацин-состав 0,2% (м/о) (200 мг/100 мл)
| Моксифлоксацин-гидрохлорид | 0,2% (м/о)* |
| Хлорид натрия | 0,8% (м/о) |
| Вода для инъекций | до 100 мл |
Осмотичность: 283 мОсмол/кг
*Количество, считая на моксифлоксацин в бетаиновой форме
Пример 6
Моксифлоксацин-состав 0,3% (м/о) (300 мг/100 мл)
| Моксифлоксацин-гидрохлорид | 0,3% (м/о)* |
| Хлорид натрия | 05% (м/о) |
| Вода для инъекций | до 100 мл |
Осмотичность: 186 мОсмол / кг
*Количество, считая на моксифлоксацин в бетаиновой форме
Пример 7
Моксифлоксацин-состав 0,4% (м/о) (400 мг/100 мл)
| Моксифлоксацин-гидрохлорид | 0,4% (м/о)* |
| Хлорид натрия | 0,4% (м/о) |
| Вода для инъекций | до 100 мл |
Осмотичность: 155 мОсмол / кг
*Количество, считая на моксифлоксацин в бетаиновой форме
Пример 8
Инфузионный концентрат 2% (м/о) (400 мг/20 мл)
| Моксифлоксацин-гидрохлорид | 400 мг (в расчете в виде бетаина) |
| Вода для инъекций | до 20 мл |
В смеситель из нержавеющей стали фармацевтического качества помещают воду и растворяют в ней при перемешивании моксифлоксацин-гидрохлорид. Раствор фильтруют через 0,2 мкм фильтр, наполняют инъекционные емкости до 20 мл, закупоривают и стерилизуют.
Для использования содержимое инъекционной емкости (400 мг моксифлоксацина в 20 мл) отбирают с помощью шприца и в антисептических условиях вносят и смешивают с 230 мл стандартного 0,9% раствора поваренной соли. Концентрация изотонического инфузионного раствора, составляющая 400 мг/250 мл, соответствует 0,16% (м/о). Осмотичность составляет 315 мОсмол/кг.
Примеры 9-14
Составы моксифлоксацина, тонизированные хлоридом натрия, готовят аналогично примеру 1. Концентрация компонентов, данные по стабильности этих составов при температуре 25 и 40°С и результаты определения числа частиц размером ≥25 мкм/мл методом мембранного фильтрования приведены в нижеследующей таблице.
Таблица
| Концентрация | Частицы ≥25 мкм/мл(предельная величина ≤2 частицы/мл | ||||||
| Пример№ | NaCl | Moxifloxacin | FeCl3 | После приготовления | Через6 недель | Через12 недель | |
| [%] | [%] | ч/млн | 40°С | 25°С | 40°С | ||
| 9 | 0,9 | 0,04 | 1 | 0,17 | 0,14 | 0,24 | 0,19 |
| 10 | 0,9 | 0,08 | 1 | 0,11 | 0,15 | 0,18 | 0,18 |
| 11 | 0,8 | 0,16 | 1 | 0,11 | 0,26 | 0,24 | 0,17 |
| 12 | 0,8 | 0,20 | 1 | 0,16 | 0,23 | 0,14 | 0,18 |
| 13 | 0,5 | 0,30 | 1 | 0,17 | 0,23 | 0,12 | 0,16 |
| 14 | 0,4 | 0,40 | 1 | 0,25 | 0,42 | 0,19 | 0,12 |
Из представленных в таблице результатов следует, что состав согласно изобретению стабилен при хранении даже при сравнительно высокой концентрации ионов железа.
1. Водный состав для парентерального введения, содержащий от 0,04 до 0,4 (м/о) (считая на количество моксифлоксацина) моксифлоксацин-гидрохлорида и от 0,4 до 0,9 (м/о) хлорида натрия и воду остальное.
2. Водный состав согласно п.1, содержащий от 0,008 до 0,32% (м/о) (считая на количество моксифлоксацина) моксифлоксацин-гидрохлорида.
3. Водный состав согласно п.1, содержащий от 0,1 до 0,2% (м/о) (считая на количество моксифлоксацина) моксифлоксацин-гидрохлорида.
4. Водный состав согласно п.1, содержащий от 0,5 до 0,9% (м/о) (считая на количество моксифлоксацина) хлорида натрия.
5. Водный состав согласно п.1, содержащий от 0,7 до 0,9% (м/о) (считая на количество моксифлоксацина) хлорида натрия.
6. Водный состав согласно одному из пп.1-5 для применения в качестве лекарственного средства для профилактики или лечения бактериальных инфекций у людей и животных.