Новые аминопропилфосфиновые кислоты
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы (1), имеющим сродство к одному или более чем одному GABAB рецептору, их фармацевтически приемлемые соли, сольваты и стереоизомеры, за исключением рацемата (3-амино-2-гидроксипропил)фосфиновой кислоты. Технический результат: увеличение терапевтического индекса. 3 н. и 11 з.п. ф-лы, 1 табл.
Реферат
Область изобретения
Настоящее изобретение относится к новым соединениям, имеющим сродство к одному или более чем одному GABAВ (γ-аминомасляная кислота) рецептору, а также их фармацевтически приемлемым солям, сольватам и стереоизомерам. Изобретение также относится к способам их получения, фармацевтическим композициям, содержащие указанные терапевтически активные соединения, и к применению указанных активных соединений в терапии.
Предшествующий уровень техники
Рефлюкс
Гастроэзофагеальная рефлюксная болезнь (GORD) является наиболее распространенным заболеванием верхнего отдела желудочно-кишечного тракта. Современная терапия стремится к уменьшению секреции желудочной кислоты или к уменьшению экспозиции кислоты в пищеводе путем повышения пищеводного клиренса, тонуса нижнего пищеводного сфинктера и опорожнения желудка. Ранее считалось, что главный механизм, лежащий в основе рефлюкса, зависит от гипотонического состояния нижнего пищеводного сфинктера. Однако недавнее исследование (например, Holloway & Dent (1990) GastRoenteRol.Clin. N. Amer. 19, 517-535) показало, что большинство приступов рефлюкса происходит во время преходящих расслаблений нижнего пищеводного сфинктера, ниже упоминаемых как TLOSR, то есть расслаблении, не инициируемых глотаниями. Также было показано, что у пациентов с GORD секреция желудочной кислоты обычно является нормальной.
Следовательно, существует потребность в соединениях, которые снижают число случаев TLOSR и таким образом предотвращают рефлюкс.
Фармацевтические композиции, содержащие местный анестетик, применяемые для ингибирования расслабления нижнего пищеводного сфинктера, раскрыты в WO 87/04077 и в US 5036057. Недавно было показано, что агонисты ОАВАв-рецепторов ингибируют TLOSR, что раскрыто в WO 98/11885.
Агонисты GABAB рецепторов
GABA (4-аминомасляная кислота) является эндогенным нейромедиатором в центральной и периферической нервной системах. Рецепторы к GABA традиционно разделяют на подтипы GABAA и GABAB рецепторы. GABAB рецепторы относятся к надсемейству рецепторов, связанных с G-белками. Агонисты GABAB рецепторов описаны как полезные при лечении нарушений ЦНС (центральной нервной системы), таких как мышечное расслабление при спинальной спастичности, сердечно-сосудистых нарушений, астмы, нарушений кишечной моторики, таких как синдром раздраженной толстой кишки (IBS), и в качестве прокинетических и противокашлевых агентов. Агонисты GABAB рецепторов также были описаны как пригодные для лечения рвоты (WO 96/11680) и недавно, как указано выше, для ингибирования TLOSR (WO 98/11885).
Наиболее изученным агонистом GABAB рецепторов является баклофен (4-амино-3-(хлорфенил)масляная кислота), раскрытый в швейцарском патенте №СН 449046. Баклофен в течение нескольких лет применяли в качестве антиспазматического агента. ЕР 0356128 описывает применение отдельного соединения (3-аминопропил)метилфосфиновой кислоты, в качестве сильного агониста GABAB рецепторов, в терапии. ЕР 0181833 раскрывает замещенные 3-аминопропилфосфиновые кислоты, которые, как обнаружено, имеют очень высокое сродство к местам связывания GABAB рецепторов. По аналогии с баклофеном, эти соединения можно применять в качестве, например, мышечных релаксантов. ЕР 0399949 раскрывает производные (3-аминопропил)метилфосфиновой кислоты, которые описаны как сильные агонисты GABAB рецепторов. Установлено, что эти соединения пригодны в качестве мышечных релаксантов. Обе заявки, ЕР 0463969 и FR 2722192, относятся к производным 4-аминомасляной кислоты, имеющим разные гетероциклические заместители на 3-углероде бутиловой цепи. Взаимосвязи структура-активность некоторых аналогов фосфиновой кислоты по отношению к их сродству к GABAB рецептору, а также их действие на мышечное расслабление, обсуждаются в J. Med. Chem. (1995), 38, 3297-3312. Заключением в данной статье является то, что, по сравнению с баклофеном, значительно более сильного мышечного расслабления можно достичь сприменением (S)-энантиомера 3-амино-2-гидроксипропилметилфосфиновой кислоты, и без нежелательных влияний на ЦНС.
В литературе фосфиновые кислоты, имеющие атом водорода, присоединенный к фосфору, также называются фосфонистые кислоты. Это два названия для одних и тех же соединений, и оба названия можно использовать. Однако для соединений по настоящему изобретению авторы выбрали для использования название фосфиновые кислоты.
Краткое изложение сущности изобретения
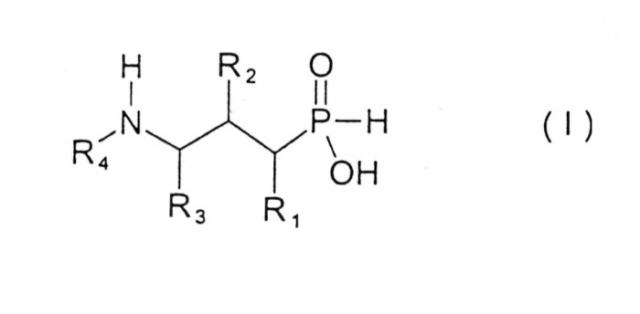
В настоящем изобретении предложены новые соединения формулы I
где
R1 представляет собой водород, гидрокси, низший алкил, низший алкокси или галоген;
R2 представляет собой гидрокси, меркапто, галоген или оксогруппу;
R3 представляет собой водород или низший алкил (возможно замещенный гидрокси, меркапто, низшим алкокси, низшим тиоалкокси или арилом);
R4 представляет собой водород, низший алкил (возможно замещенный арилом), или арил;
и их фармацевтически приемлемые соли, сольваты и стереоизомеры, за исключением:
1) рацемата (3-амино-2-гидроксипропил)фосфиновой кислоты, и
2) (2R/S, 3R)-(3-амино-2-гидроксибутил)фосфиновой кислоты.
В предпочтительном воплощении
R1 представляет собой водород, низший алкил или галоген;
R2 представляет собой галоген, гидрокси или оксогруппу;
R3 представляет собой водород; и
R4 представляет собой водород;
за исключением рацемата (3-амино-2-гидроксипропил)фосфиновой кислоты.
Еще более предпочтительными соединениями являются (3-амино-2-фторпропил)фосфиновая кислота, (2R)-(3-амино-2-фторпропил)фосфиновая кислота, (2S)-(3-амино-2-фторпропил)фосфиновая кислота, (3-амино-2-фтор-1-метилпропил)фосфиновая кислота, (3-амино-2-оксопропил)фосфиновая кислота, (2S)-(3-амино-2-гидроксипропил)фосфиновая кислота, (2R)-(3-амино-2-гидроксипропил)фосфиновая кислота и (3-амино-1-фтор-2-гидроксипропил)фосфиновая кислота.
В рамках объема данного изобретения следует понимать, что когда R1 является оксогруппой, связь между R2 и углеродом является двойной связью.
В рамках объема данного изобретения под "низшими" радикалами и соединениями следует понимать, например, соединения, имеющие до и включая 7, особенно до и включая 4 углеродных атома. Также основные выражения имеют следующие значения:
Низший алкил представляет собой, например, С1-С4алкил, такой как метил, этил, н-пропил или н-бутил, а также изопропил, изобутил, вторичный бутил или третичный бутил, но также может быть С5-С7алкильной группой, такой как пентильная, гексильная или гептильная группа.
Низший алкокси представляет собой, например, С1-С4алкокси, такой как метокси, этокси, н-пропокси или н-бутокси, также изопропокси, изобутокси, вторичный бутокси или третичный бутокси, но также может быть С5-С7 алкоксигруппой, такой как пентокси, гексокси или гептоксигруппа.
Низший тиоалкокси представляет собой, например, С1-С4тиоалкокси, такой как тиометокси, тиоэтокси, н-тиопропокси или н-тиобутокси, также тиоизопропокси, тиоизобутокси, вторичный тиобутокси или третичный тиобутокси, но также может быть С5-С7 тиоалкоксигруппой, такой как тиопентокси, тиогексокси или тиогептоксигруппа.
Галоген представляет собой галоген с атомным номером до и включая 35, такой как фтор или хлор, и менее предпочтительно бром.
Соединения формулы I по изобретению имеют амфотерный характер и могут существовать в форме внутренних солей. Они также могут образовывать соли присоединения кислот и соли с основаниями. Такие соли представляют собой в частности фармацевтически приемлемые соли присоединения кислот, а также фармацевтически приемлемые соли, образованные с основаниями. Подходящие кислоты для образования таких солей включают в себя, например, минеральные кислоты, такие как соляная, бромистоводородная, серная или фосфорная кислота, или органические кислоты, такие как сульфоновые кислоты и карбоновые кислоты. Соли с основаниями представляют собой, например, соли щелочных металлов, например соли натрия или калия, или соли щелочноземельных металлов, например соли кальция или магния, а также соли аммония, такие как соли аммония или органических аминов. Эти соли можно получить традиционными способами.
Когда в молекуле имеется один или более чем один стереоцентр, соединения формулы I могут находиться в форме смеси стереоизомеров, то есть смеси диастереомеров и/или рацематов, или в форме отдельных стереоизомеров, то есть отдельного энантиомера и/или диастереомера. Эти соединения также могут находиться в форме сольватов, например гидратов.
Все соединения формулы I можно применять для ингибирования TLOSR, и таким образом для лечения гастроэзофагеальной рефлюксной болезни. Указанное ингибирование TLOSR также предполагает, что указанные соединения формулы I можно применять для лечения срыгивания у младенцев. Эффективная терапия срыгивания у младенцев была бы важным путем лечения, недостаточно успешной из-за чрезмерной потери проглоченого питательного вещества. Кроме того, новые соединения можно применять для лечения связанных с GORD или не связанных с GORD астмы, отрыжки, кашля, боли, привыкания к кокаину, икоты, IBS, диспепсии, рвоты и ноцицепции.
В противоположность тому, что установлено в уровне техники (J. Med. Chem. (1995) 3297-3312 и The GABA Receptors: Second Edition. Edited by S. J. Enna and Norman Bowery, Humana PRess (1997) особенно стр.281-282), соединения по изобретению обладают неожиданно высокой метаболической стабильностью, несмотря на присутствие Р-Н связи. Данные соединения также обладают неожиданно высоким терапевтическим индексом.
Получение
Соединения формулы I по настоящему изобретению можно получать одним из следующих способов.
А) Соединение формулы II,
где R1 и R3 такие, как определено выше в формуле I, X представляет собой водород или защитную группу, такую как -ССН3(ОСН2СН3)2, Z представляет собой защитную группу, такую как трет-бутилоксикарбонил, и Y представляет собой водород или защитную группу, такую как низший алкил, соединение формулы II, причем данное соединение возможно синтезировали реакцией конденсации согласно Схеме I с использованием подходящего N-защищенного аминокислотного сложного эфира, в котором R3 такой, как определено выше, W является защитной группой, такой как низший алкил, и Z такой, как определено в формуле II, и подходящего защищенного производного фосфиновой кислоты, в котором R1 такой, как определено выше в формуле I, X и Y такие, как определено в формуле II, и основания, такого как диизопропиламид лития,
а) возможно превращают путем реакции N-алкилирования для введения R4, если желательно, чтобы R4 не представлял собой водород, и затем гидролитической реакции с получением соединения формулы III
где R1, R3 и R4 такие, как определено выше в формуле I, и возможно превращают полученное выше соединение III в другое химическое соединение формулы III, и/или разделяют полученную смесь изомеров на отдельные изомеры, и/или превращают полученную соль в свободное соединение формулы III и/или в другую соль, и/или превращают полученное свободное соединение формулы III в соль в соответствии с вышеуказанным определением, или б) превращают путем восстановительной реакции, возможно реакции N-алкилирования, если желательно, чтобы R4 не представлял собой водород, и, наконец, гидролитической реакции с получением соединения формулы IV
где R1, R3 и R4 такие, как определено выше в формуле I, и возможно превращают полученное выше соединение IV в другое химическое соединение формулы IV, и/или разделяют полученную смесь изомеров на отдельные изомеры, и/или превращают полученную соль в свободное соединение формулы IV и/или в другую соль, и/или превращают полученное свободное соединение формулы IV в соль в соответствии с вышеуказанным определением, или
в) превращают путем восстановительной реакции с последующей реакцией дезоксигалогенирования, возможно реакции N-алкилирования для введения R4, если желательно, чтобы R4 не представлял собой водород, и, наконец, гидролитической реакции с получением соединения формулы V
где R1, R3 и R4 такие, как определено выше в формуле I, и Halo представляет собой атом галогена, и возможно превращают полученное выше соединение V в другое химическое соединение формулы V, и/или разделяют полученную смесь изомеров на отдельные изомеры, и/или превращают полученную соль в свободное соединение формулы IV и/или в другую соль, и/или превращают полученное свободное соединение формулы V в соль в соответствии с вышеуказанным определением, или
Б) соединение формулы VI
где R1 и R3 такие, как определено выше в формуле I, X представляет собой водород или защитную группу, такую как - ССН3(ОСН-СН3)2, Т представляет собой группу, которую можно превратить в - NH2 группу, и Y представляет собой водород или защитную группу, такую как низший алкил, причем соединение формулы VI возможно синтезировали реакцией конденсации согласно Схеме 2 с использованием 2,3-эпоксипропильного производного, такого как подходящее N-защищенное производное 2,3-эпоксипропиламина или эпихлоригидриновое производное, в котором R1 и R3 такие, как определено выше в формуле I, и подходящего защищенного производного фосфиновой кислоты, активированного O-силилированием, в котором Х и Y такие, как определено в формуле VI, и кислоты Льюиса, такой как безводный ZnCl2,
а) превращают путем реакции, при которой триметилсилильную группу замещают атомом водорода, реакции, при которой Т группу, как она определена в формуле VI, превращают в -NHR4, где R4 такой, как определено выше в формуле I, и, наконец, гидролитической реакции с получением соединения формулы IV
где R1, R3 и R4 такие, как определено выше в формуле I, и возможно превращают полученное выше соединение IV в другое химическое соединение формулы IV, и/или разделяют полученную смесь изомеров на отдельные изомеры, и/или превращают полученную соль в свободное соединение формулы IV и/или другую соль, и/или превращают полученное свободное соединение формулы IV в соль в соответствии с вышеуказанным определением,
или
б) превращают путем реакции, при которой триметилсилильную группу замещают водородом, окислительной реакции, реакции, при которой Т группу, как она определена в формуле IV, превращают в - NHR4, где R4 такой, как определено выше в формуле I, и, наконец, гидролитической реакции с получением соединения формулы III
где R1, R3 и R4 такие, как определено выше в формуле I, и, возможно, превращают полученное выше соединение III в другое химическое соединение формулы III, и/или разделяют полученную смесь изомеров на отдельные изомеры, и/или превращают полученную соль в свободное соединение формулы III и/или в другую соль, и/или превращают полученное свободное соединение формулы III в соль в соответствии с вышеуказанным определением, или
в) превращают путем реакции, при которой триметилсилильную группу замещают водородом, реакции дезоксигалогенирования, реакции, при которой Т группу, как она определена в формуле VI, превращают в -NHR4, где R4 такой, как определено выше в формуле I, и, наконец, гидролитической реакции с получением формулы V,
где R1, R3 и R4 такие, как определено выше в формуле I, и Halo представляет собой атом галогена, и возможно превращают полученное выше соединение V в другое химическое соединение формулы V, и/или разделяют полученную смесь изомеров на отдельные изомеры, и/или превращают полученную соль в свободное соединение формулы V и/или в другую соль, и/или превращают полученное свободное соединение формулы V в соль в соответствии с вышеуказанным определением, или В) соединение формулы VII,
где R1 такой, как определено выше в формуле I, X представляет собой водород или защитную группу, такую как - ССН3(ОСН2СН3)2, U представляет собой электрон-акцепторную группу, такую как, например, -CN или - CO2Et, которую можно превратить в -CH2NH2 группу, и Y представляет собой водород или защитную группу, такую как низший алкил, и Halo представляет собой атом галогена, причем соединение формулы VII возможно синтезировали реакцией присоединения согласно Схеме 3 с использованием ненасыщенного соединения, в котором R1 такой, как определено выше в формуле I, U и Halo такие, как определено в формуле VII, и подходящего защищенного производного фосфиновой кислоты, активированного O-силилированием, где Х и Y такие, как определено в формуле VII,
превращают путем реакции, при которой U группу превращают в -NHR4, где R4 такой, как определено выше в формуле I, и гидролитической реакцией с получением соединения формулы VIII,
где R1 и R4 такие, как определено выше в формуле I, и Halo представляет собой атом галогена, и возможно превращают полученное выше соединение VIII в другое химическое соединение формулы VIII, и/или разделяют полученную смесь изомеров на отдельные изомеры, и/или превращают полученную соль в свободное соединение формулы VIII и/или в другую соль, и/или превращают полученное свободное соединение формулы VIII в соль в соответствии с вышеуказанным определением; или
Г) соединение формулы IX, возможно в виде отдельного стереоизомера,
где R1, R3 и R4 такие, как определено выше в формуле I, Z представляет собой защитную группу, такую как трет-бутилоксикарбонил, и Halo представляет собой атом галогена, причем соединение формулы IX возможно синтезировали реакцией замещения согласно Схеме 4 с использованием электрофильного соединения, в котором R1, R3 и R4 такие, как определено выше, L является уходящей группой, такой как йодо, Z и Halo такие, как определено выше, и фосфиновой кислоты, активированной O-силилированием,
превращают путем гидролитической реакции в соединение формулы V
где R1, R3 и R4 такие, как определено выше в формуле I, и возможно превращают полученное выше соединение V в другое химическое соединение формулы V, и/или разделяют полученную смесь изомеров на отдельные изомеры, и/или превращают полученную соль в свободное соединение формулы V и/или другую соль, и/или превращают полученное свободное соединение формулы V в соль в соответствии с вышеуказанным определением; или
Д) соединение формулы XI,
где R1, R3 и R4 такие, как определено выше в формуле I, X представляет собой водород или защитную группу, такую как - ССН3(ОСН2СН3)2, и Y представляет собой водород или защитную группу, такую как низший алкил, причем соединение формулы XI возможно синтезировали при помощи реакции присоединения согласно Схеме 4, обрабатывая ненасыщенное производное фосфиновой кислоты, в котором R1, R3 и R4 такие, как определено выше в формуле I, H2S, меркаптидионом (HS-) или защищенным меркаптосоединением, таким как бензилтиол, в случае чего защитную группу после этого удаляют,
превращают путем гидролитической реакции с получением соединения формулы XII,
где R1, R3 и R4 такие, как определено выше в формуле I, и возможно превращают полученное выше соединение XII в другое химическое соединение формулы XII, и/или разделяют полученную смесь изомеров на отдельные изомеры, и/или превращают полученную соль в свободное соединение формулы XII и/или в другую соль, и/или превращают полученное свободное соединение формулы XII в соль в соответствии с вышеуказанным определением.
Подробное описание изобретения.
Изобретение описано более детально следующими неограничивающими примерами.
Пример 1. (3-Амино-2-Фторпропил)фосфиновая кислота
К охлажденному на ледяной бане раствору этил-(3-амино-2-фтор-3-оксопропил)(диэтоксиметил)фосфината в THF (тетрагидрофуране) добавляли 1 М ВН3-THF в атмосфере аргона. Через 10 минут раствор нагревали с обратным холодильником в течение 2,5 часов. Раствор охлаждали до комнатной температуры, и добавляли 6 н. HCl (200 мл). THF удаляли выпариванием на роторном испарителе, и водный слой кипятили с обратным холодильником в течение 2,5 часов. Раствор охлаждали и упаривали. Остаток очищали ионообменной колоночной хроматографией (DOWEX® 50WX-8-200, Н+ форма, 3,5×4,0 см). Ионообменную смолу предварительно промывали смесью 2:1 метанол/вода (400 мл). Неочищенный продукт, растворенный в смеси 1:1 метанол/вода, наносили на колонку и промывали смесью 1:1 метанол/вода (400 мл). Элюент заменяли на смесь 3:1 метанол/концентрированный гидроксид аммония. Объединяли две фракции (всего 150 мл) и упаривали с получением 645 мг (34%) (3-амино-2-фторпропил)фосфиновой кислоты в виде белого твердого вещества. Данные: точка плавления 203-207°С, Rf=0,35 (60:40:1 метанол, метиленхлорид, концентрированный гидроксид аммония); 1H ЯМР (300 МГц, D2O) δ 7.11 (d, J=528 Гц, 1Н), 5.18 (dm, J=54 Гц, 1Н), 3.28-3.45 (m, 2H). 1.65-2.23 (m, 2H); 13С ЯМР (125 МГц, D2O + Диоксан) δ 87.8 (d, J=170 Гц), 44.3 (dd, J=12.6, 21,6 Гц), 35.6 (dd. J=20,2, 86,5 Гц); APIMS (масс-спектрометрия с ионизацией при атмосферном давлении): m/z=142 (М+Н)+.
Пример 2.
(2S)-(3-Амино-2-гидроксипропил)фосфиновая кислота
Смесь этил-(2S)-(3-амино-2-гидроксипропил)(1,1-диэтоксиэтил)фосфината (1,0 г, 3,5 ммоль) и концентрированной HCl (50 мл) нагревали с обратным холодильником в течение 2 часов. Раствор охлаждали до комнатной температуры и упаривали. Остаток растворяли в метаноле (100 мл) и обрабатывали пропиленоксидом (2 мл) при комнатной температуре. После перемешивания смеси в течение 5 часов, осевшее твердое вещество собирали, декантируя растворитель. Твердое вещество сушили струей аргона с получением 220 мг (45%) (2S)-(3-амино-2-гидроксипропил)фосфиновой кислоты в виде белого твердого вещества. Данные: 1H ЯМР (300 МГц, D2O) δ 7.1 (d, J=540 Гц, 1Н), 4.2 (m, 1H), 2.9-3.2 (m, 2H), 1.7-2.0 (m, 2H); 31P ЯМР (121 МГц, D2O) δ 24.2 (d, J=522 Гц); FABMS (масс-спектрометрия с бомбардировкой быстрами атомами): m/z=140 (М+Н)+;[α]D при 20°С=+8° (0,5% в 0,1 M HCl).
Пример 3.
(2R)-(3-Амино-2-гидроксипропил)фосфиновая кислота
Смесь этил-(2R)-(3-амино-2-гидроксипропил)(1,1-диэтоксиэтил)фосфината (0,9 г, 3,2 ммоль) и концентрированной HCl (50 мл) нагревали с обратным холодильником в течение 2 часов. Раствор охлаждали до комнатной температуры и упаривали. Остаток растворяли в метаноле (50 мл) и обрабатывали пропиленоксидом (3 мл) при комнатной температуре. После перемешивания смеси в течение 5 минут осажденное твердое вещество собирали декантацией растворителя. Твердое вещество сушили потоком аргона с получением 260 мг (59%) (2R)-(3-амино-2-гидроксипропил)фосфиновой кислоты в виде белого твердого вещества. Данные: 1H ЯМР (300 МГц, D2O) δ 7.1 (d. J=540 Гц, 1H). 4.2 (m, 1H), 2.9-3.2 (m, 2H), 1.7-2.0 (m, 2H); 31P ЯМР (121 МГц, D2O) δ 23.9 (d, J=525 Гц); FABMS: m/z=140 (М+Н)+; [α]D при 20°С=-8° (0,5% в 0.1 М HCl).
Пример 4.
(3-Амино-2-оксопропил)фосфиновая кислота
Образец этил-[3-[N-(трет-бутоксикарбонил)амино]-2-оксопропил](1,1-диэтоксиэтил)фосфината (8,11 г, 21,0 ммоль) растворяли в 3 н. HCl (400 мл), которую предварительно обескислороживали барботированием N2 через раствор. Смесь перемешивали в течение 14 часов при комнатной температуре и затем концентрировали. Остаток упаривали совместно с метанолом. Остаток затем растворяли в метаноле (10 мл), и добавляли пропиленоксид (10 мл). Смесь перемешивали в течение 6 часов, и полученный в результате осадок выделяли фильтрованием. Твердое вещество промывали холодным метанолом и сушили под вакуумом при 50°С с получением 2,1 г (73%) (3-амино-2-оксопропил)фосфиновой кислоты в виде желтоватого твердого вещества.
Данные: Точка плавления 126-127°С; Rf=0,64 (85:15 метанол, вода); 1H ЯМР(300 МГц, D2O) δ 7.13 (d, J=551 Гц, 1Н), 4.14 (s, 2H), 3.14 (d, J=18 Гц, 2Н); 13С ЯМР (75 МГц, D2O+Диоксан) (199.5, 49.2, 47.3 (d, J=69 Гц); FABMS: т/г=138 (М+Н)+.
Пример 5.
(2R)-(3-Амино-2-фторпропил)фосфиновая кислота
Гипофосфит аммония (73,8 г, 0,89 моль) добавляли в 3-горлую 2-литровую колбу, снабженную механической мешалкой, термометром, воронкой для добавления и барботером аргона. Колбу помещали в водяную баню при комнатной температуре, и добавляли N,O-бис-(триметилсилил)ацетамид (215 мл, 0,87 мол - BSA) с такой скоростью, чтобы поддерживать температуру внутри ниже 38°С (приблизительно 30 минут), используя охлаждение льдом. По окончании добавления BSA реакционную смесь нагревали до 45-48°С и поддерживали при этой температуре в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, и к реакционной смеси добавляли раствор трет-бутил-(2R)-2-фтор-3-йодпропилкарбамата (27,3 г, 0,09 моль) в метиленхлориде (300 мл). Реакционную смесь затем оставляли перемешиваться при комнатной температуре в течение 18 часов. Реакционную смесь охлаждали до 0°С и осторожно гасили метанолом (275 мл) и затем водой (32 мл). Реакционную смесь перемешивали в течение 30 минут, после чего ее фильтровали, и твердые вещества промывали метанолом. Фильтрат концентрировали, и остаток помещали в глубокий вакуум (0,1 мм рт. ст. (13,33 Па)) на ночь. Неочищенный остаток растирали со смесью метиленхлорида, метанола, концентрированного раствора аммиака (80:20:1) и фильтровали. Фильтрат концентрировали при пониженном давлении, и растирание повторяли. Неочищенный концентрат переносили в 2-литровую колбу, растворяли в метаноле (375 мл) и помещали на водяную баню при комнатной температуре. Добавляли насыщенный раствор газообразного хлористого водорода в этилацетате (500 мл), и смесь перемешивали в течение 3 часов. Реакционную смесь фильтровали, и твердые вещества промывали смесью метанола и этилацетата (90:10). Фильтрат концентрировали при пониженном давлении, и неочищенный продукт пропускали через колонку с Dowex® 50WX8-200 меш в Н+ форме (500 г, 8×15 см), элюируя смесью 1:1 метанол/вода, до тех пор, пока вещество более не обнаруживалось посредством ТСХ (тонкослойная хроматография) анализа. Требуемый неочищенный продукт затем элюировали смесью 1:3 концентрированный раствор гидроксида аммония/метанол. Продукт затем очищали колоночной хроматографией, элюируя смесью хлороформа, метанола, концентрированного раствора гидроксида аммония (6:3:1) с получением (2R)-(3-амино-2-фторпропил)фосфиновой кислоты в виде белого твердого вещества (3,12 г, 24%). 1H ЯМР (300 МГц, D2O) δ 7.90 (s. 0,5 Н), 6.15 (s, 0.5 Н), 5.12-5.29 (m, 0,5 Н). 4.92-5.10 (m, 0,5 Н), 3.12-3.42 (m. 2H), 1.74-2.26 (m. 2Н).
Пример 6.
(2S)-(3-Амино-2-фторпропил)фосфиновая кислота
Гипофосфит аммония (58,1 г, 0,70 моль) добавляли в 3-горлую 2-литровую колбу, снабженную механической мешалкой, термометром, воронкой для добавления и барботером аргона. Добавляли N,O-бис-(триметилсилил)ацетамид (175,9 мл, 0,71 моль - BSA) с такой скоростью, чтобы поддерживать температуру внутри между 35-40°С. По окончании добавления BSA реакционную смесь поддерживали при 35-40°С в течение 45 минут. Добавляли метиленхлорид (150 мл), и смесь перемешивали при 35-40°С в течение еще 45 минут. Реакционную смесь охлаждали до комнатной температуры, и к реакционной смеси добавляли раствор трет-бутил-(2S)-2-фтор-3-йодпропилкарбамата (42,5 г, 0,14 моль) в метиленхлориде (300 мл). Реакционную смесь затем оставляли перемешиваться при комнатной температуре в течение ночи. Реакционную смесь охлаждали до 0°С и осторожно гасили метанолом (150 мл) и затем водой (60 мл). Реакционную смесь концентрировали, и остаток помещали в глубокий вакуум (0,1 мм рт. ст. (13,33 Па)). Остаток доводили до приблизительно рН 8 добавлением концентрированного гидроксида аммония (50 мл), затем добавляли метиленхлорид (400 мл) и метанол (250 мл). Полученные твердые вещества отфильтровывали, и фильтрат концентрировали. Остаток растирали со смесью метиленхлорида, метанола, концентрированного раствора аммиака (80:20:1, 400 мл) и фильтровали. Фильтрат концентрировали при пониженном давлении, и неочищенный концентрат растворяли в метаноле (400 мл). Добавляли насыщенный раствор газообразного хлористого водорода в этилацетате (600 мл), и смесь перемешивали в течение 3 часов. Реакционную смесь фильтровали, и фильтрат концентрировали при пониженном давлении.
Неочищенный продукт пропускали через колонку с Dowex® 50WX8-200 меш в Н+ форме (450 г), элюируя смесью 1:1 метанол/вода, до тех пор пока вещество более не обнаруживалось посредством ТСХ анализа. Требуемый неочищенный продукт затем элюировали смесью 1:3 концентрированный раствор гидроксида аммония/метанол. Продукт затем очищали колоночной хроматографией, элюируя смесью метиленхлорида, метанола, концентрированного раствора гидроксида аммония (6:3:1) с получением (2S)-(3-амино-2-фторпропил)фосфиновой кислоты в виде белого твердого вещества (3,46 г, 17%). 1H ЯМР (300 МГц, D2O) δ 7.90 (s. 0,5 Н), 6.15 (s, 0,5 Н), 5.12-5.29 (m. 0,5 Н), 4.92-5.10 (m. 0.5 Н), 3.12-3.42 (m. 2H), 1.74-2.
Пример 7.
(3-Амино-1-фтор-2-гидроксипропил)фосфиновая кислота
Этил-(3-(N-(трет-бутоксикарбонил)амино)-1-фтор-2-гидроксипропил)(1,1-диэтоксиэтил)фосфинат (180 мг, 4,5 ммоль) растворяли в метаноле (2 мл), обрабатывали 3 н. соляной кислотой (20 мл, 60,0 ммоль, пробарботированной аргоном непосредственно перед использованием). Эту смесь перемешивали при комнатной температуре в течение 6 часов в атмосфере аргона. Реакционную смесь концентрировали при пониженном давлении, неочищенный продукт повторно растворяли в метаноле (5 мл);
остаточную воду удаляли совместным выпариванием при пониженном давлении с метанолом. Неочищенный продукт (70 мг) очищали колоночной хроматографией (1×10 см колонка), элюируя смесью метиленхлорида, метанола, концентрированного раствора гидроксида аммония (6:3:1). Фракции, содержащие продукт, концентрировали при пониженном давлении, упаривали совместно с ацетонитрилом (2×10 мл), затем с метанолом (1×10 мл), и сушили в течение ночи в глубоком вакууме (0,1 мм рт. ст. (13,33 Па). В результате этой процедуры получили (3-амино-1-фтор-2-гидроксипропил)фосфиновую кислоту в виде белого твердого вещества (40 мг, 56%). 1H ЯМР (300 МГц, D2O) δ 7.93 (s, 0.5 Н), 6.11 (s, 0.5 Н), 4.60-4.20 (m. 2 Н), 3.42-3.08 (m, 2H).
Пример 8.
(3-Амино-2-фтор-1-метилпропил)фосфиновая кислота
К охлажденному в ледяной бане раствору этил-3-амино-2-фтор-1-метил-3-оксопропил(диэтоксиметил)фосфината (1,6 г, 5,3 ммоль) в THF (15 мл) добавляли 1 М ВН3-THF (12,3 мл, 12,3 ммоль) в атмосфере аргона. Через 10 минут раствор нагревали с обратным холодильником в течение 3 часов. Раствор охлаждали до комнатной температуры и по каплям добавляли 6 н. HCl (100 мл). THF удаляли выпариванием на роторном испарителе и добавляли еще одну порцию 6 н. HCl (100 мл). Смесь кипятили с обратным холодильником в течение 3 часов. Раствор охлаждали, упаривали и выпаривали совместно с водой и затем с этанолом. Остаток очищали ионообменной колоночной хроматографией (DOWEX® 50WX-8-200, H+ форма. 3,5×4,0 см). Ионообменную смолу предварительно промывали смесью 2:1 метанол/вода. Неочищенный продукт, растворенный в смеси 1:1 метанол/вода, наносили на колонку и промывали смесью 1:1 метанол: вода. Элюент заменяли на смесь 3:1 метанол/концентрированный гидроксид аммония. Соответствующие фракции объединяли и упаривали с получением 150 мг (15%) смеси диастереоизомеров (3-амино-2-фтор-1-метилпропил)фосфиновой кислоты в виде масла. Данные: 1H ЯМР (400 МГц, D2O) (6.2-7.8 (m, 1Н), 4.8-5.2 (m, 1H), 3.2-3.5 (m, 2H), 1.8-2.2 (m, 1H); 1.0-1.2 (m, 3 H); m/z=156 (М+Н)+.
Следующие промежуточные соединения использовали при получении соединений по изобретению.
Промежуточные соединения
Пример 11.
Этил-3-[(диэтоксиметил)(этокси)фосфорил]-2-фторпропаноат (промежуточное соединение для соединения по Примеру 1)
Смесь этил-(диэтоксиметил)фосфината (26,0 г, 133 ммоль) и 1,1,1,3,3,3-гексаметилдисилазана (28 мл, 133 ммоль) нагревали с обратным холодильником в течение 2 часов в атмосфере аргона. Смесь охлаждали до комнатной температуры и добавляли фторакрилат (10,5 г, 89,0 ммоль). Реагенты нагревали до 60°С в течение трех суток в атмосфере аргона. Смесь охлаждали до комнатной температуры, разбавляли этилацетатом (300 мл), промывали 1 н. HCl (2×150 мл) и насыщенным хлоридом натрия (100 мл). Органический слой сушили над MgSO4, фильтровали и упаривали с получением 32,0 г желтого масла. Остаток очищали колоночной хроматографией на колонке с мокрой набивкой силикагеля (6×30 см), элюируя смесью 97:3 метиленхлорид/метанол. Соответствующие фракции объединяли и упаривали с получением 16,0 г (57%) этил-3-[(диэтоксиметил)(этокси)фосфорил]-2-фторпропаноата в виде прозрачного масла. Данные: 1H ЯМР (300 МГц, CDCl3) δ 5.32 (dm, 1H), 4.67-4.77 (m. 1H), 4.18-4.32 (m, 2H), 3.58-3.91 (m, 4H), 2.30-2.62 (m. 2Н); 1.20-1.41 (m. 9H).
Пример 12.
Этил-(3-амино-2-фтор-3-оксопропил)(диэтоксиметил)фосфинат (промежуточное соединение для соединения по Примеру 1)
К раствору этил-3-[(диэтоксиметил)(этокси)фосфорил]-2-фторпропаноата (16,0 г, 51,1 ммоль) в этаноле (22 мл) добавляли концентрированный гидроксид аммония (14,8 н, 3,5 мл, 51,1 ммоль). Раствор перемешивали в течение 16 часов и упаривали. Остаток очищали хроматографией на колонке с мокрой набивкой силикагеля (7×37 см), элюируя смесью 96,5:3,5 метиленхлорид/метанол. Соответствующие фракции объединяли и упаривали с получением 3,43 г (27%) этил-(3-амино-2-фтор-3-оксопропил)(диэтоксиметил)фосфината в виде прозрачного масла. Данные: 1H ЯМР (300 МГц, CDCl3) δ 6.43 (s, 1H), 5.70 (s, 1H), 5.21-5.49 (dm. 1H), 4.7 (dd, 1H), 4.18-4.31 (m, 2H), 3.65-3.91 (m, 4H), 2.21-2.81 (m, 2H); 1.30-1.40 (m, 3Н), 1.20-1.28 (m, 6H).
Пример 13.
Этил-(2R)-(3-хлор-2-гидроксипропил)(1,1-диэтоксиэтил)фосфинат (промежуточное соединение для соединения по Примеру 2)
После того как смесь этил-(диэтоксиэтил)фосфината (15,0 г, 71 ммоль) и толуола упарили досуха, остаток и 1,1,1,3,3,3-гексаметилдисилазан (13,2 г, 82 ммоль) нагревали с обратным холодильником в течение 3 часов в атмосфере аргона. Смесь охлаждали до комнатной температуры и упаривали. Добавляли (R)-эпихлоргидрин (6,6 г, 71 ммоль) и безводный хлорид цинка (2,5 г, 18 ммоль), и реагенты нагревали до 60°С в течение ночи в атмосфере аргона. Смесь охлаждали до комнатной температуры, разбавляли метиленхлоридом и водой. Органический слой промывали водой, сушили над MgSO4, фильтровали и упаривали с получением 20,7 г желтого масла. Остаток растворяли в метаноле (150 мл), содержащем 1% уксусной кислоты, и раствор перемешивали в течение ночи. Растворитель удаляли с получением 17,7 г (82%) этил-(2R)-(3-хлор-2-гидроксипропил)(1,1-диэтоксиэтил)фосфината в виде прозрачного масла. Данные: 1H ЯМР (500 МГц, CDCl3) δ 4.3-4.4 (m, 1H), 4.1-4.3 (m, 2H), 3.5-3.8 (m, 4H), 1.9-2.4 (m, 2H); 1.5 (dd, J=2.3, 11,4 Гц, ЗН), 1.32-1.37 (m, 3H), 1.18-1.24(m, 6H).
Пример 14.
Этил-(2S)-(3-амино-2-гидроксипропил)(1,1-диэтоксиэтил)фосфинат (промежуточное соединение для соединения по Примеру 2)
Раствор этил-(2R)-(3-хлор-2-гидроксипропил)(1,1 -диэтоксиэтил)фосфината (5,0 г, 17 ммоль) в этаноле, содержащий 9% аммиака, перемешивали в автоклаве при комнатной температуре в течение 4 суток и при 60°С в течение еще одного дня. Раствор упаривали, и остаток очищали хроматографией на колонке с мокрой набивкой силикагеля, элюируя смесью метиленхлорид/метанол (5-8% МеОН), содержащей 5% триэтиламина. Соответствующие фракции объединяли, упаривали и разбавляли метиленхлоридом и водой. В водном слое рН подводили добавлением нескольких миллилитров 10%-ного водного Na2СО3 и повторно экстрагировали метиленхлоридом. Объединенные органические слои сушили над Na2SO4 и упаривали с получением 1,2 г (26%) этил-(2S)-(3-амино-2-гидроксипропил)(1,1-диэтоксиэтил)фосфината в виде прозрачного масла. Данные: 1H ЯМР (300 МГц, CDCl3) δ 4.40-4.55 (b, 1H), 4.10-4.30 (m, 2Н), 3.55-3.80 (m, 4H), 3.20-3.30 (m, 1H), 3.00-3.10 (m, 1H), 2.00-2.40 (m, 2H); 1.45-1.53 (dd. J=3,4. 11,7 Гц, 3Н). 1.30-1.40 (m, 3