Замещенные пирролы
Иллюстрации
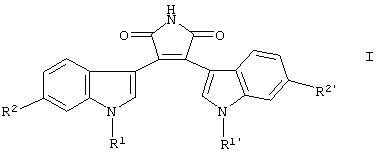
Показать всеИзобретение относится к новым замещенным пирролам формулы I
где R1 и R1' независимо означают Н или (низш.)алкил, незамещенный или замещенный (низш.)алкокси; R2 означает Н, NO2, CN, галоген, (низш.)алкил, незамещенный или замещенный галогеном, или (низш.)алкокси; R2' означает тиазолил, тиофенил, изотиазолил, фуранил, пиразолил, который незамещен или замещен (низш.)алкилом, пиримидинил, незамещенный морфолинил, незамещенный пирролидинил, имидазолил, который незамещен или замещен (низш.)алкилом, незамещенный пиперидинил или пиперазинил, который незамещен или замещен (низш.)алкилом, или этокси, замещенный имидазолилом, или его фармацевтически приемлемая соль. Соединения I ингибируют клеточную пролиферацию в фазе G2/M, что позволяет использовать их в фармацевтической композиции. 2 н. и 34 з.п. ф-лы, 3 табл.
Реферат
Изобретение относится к замещенным пирролам. Прежде всего, изобретение относится к замещенным пирролам формулы
где R1 и R1' независимо означают водород, (низш.)алкил, (низш.)алкенил или (низш.)алкинил,
R2 означает водород, нитро, циано, галоген, (низш.)алкил, (низш.)алкенил, (низш.) алкинил или (низш.)алкокси, а
R2' означает гетероарил, гетероцикл, этил, замещенный гетероарилом, или этокси, замещенный гетероарилом или гетероциклом,
или их фармацевтически приемлемой соли.
Соединения по изобретению используются при терапии или контроле нарушений клеточной пролиферации, прежде всего, рака, в частности, при терапии или контроле солидных опухолей. Прежде всего, соединения по изобретению обладают антипролиферативной активностью, конкретно они ингибируют клеточное деление в фазе G2/M клеточного цикла.
Описание изобретения
Изобретение относится к замещенным пирролам. Прежде всего, изобретение относится к замещенным пирролам формулы
где R1 и R1' независимо означают водород, (низш.)алкил, (низш.)алкенил или (низш.)алкинил;
R2 означает водород, нитро, циано, галоген, (низш.)алкил, (низш.)алкенил, (низш.)алкинил или (низш.)алкокси, а
R2' означает гетероарил, гетероцикл, этил, замещенный гетероарилом, или этокси, замещенный гетероарилом или гетероциклом,
или их фармацевтически приемлемой соли.
Термин "(низш.)алкил", используемый в тексте заявки индивидуально или в различных сочетаниях, означает алкильную группу с прямой или разветвленной цепью, содержащую максимум 3 углеродных атома, такую, как метил, этил, пропил и изопропил, которая является незамещенной или замещенной одной или более следующими группами: гидрокси, (низш.)алкокси, амино, галоген, тио(низш.)алкил или (низш.)алкилсульфинил. Примеры (низш.)алкила, замещенного одним или более галогенами, включают хлорметил и трифторметил.
Термин "(низш.)алкокси", используемый индивидуально или в различных сочетаниях, означает группу, где остаток (низш.)алкил имеет значения, указанные выше, например метокси, этокси, пропокси, изопропокси и т.п.
Термин "гетероарил", используемый индивидуально или в различных сочетаниях, означает 5- или 6-членный ароматический цикл, содержащий от 1 до 4 гетероатомов, которые могут быть идентичными или различными, и где кольцо является незамещенным или замещенным одной или более следующими группами: галоген, (низш.)алкил, гидрокси, карбокси, (низш.)алкокси, нитро, амино или циано. Гетероатом(ы) выбирают из группы, включающей азот, серу и кислород. Примеры гетероарила включают фуран, тиофен, пиррол, оксазол, тиазол, имидазол, пиразол, изоксазол, изотиазол, оксадиазол, триазол, тетразол, тиадиазол, пиридин, пиридазин, пиримидин, пиразин и триазин.
Термин "гетероцикл", используемый индивидуально или в различных сочетаниях, означает 4-7-членный неароматический цикл, содержащий один или более гетероатомов, которые могут быть идентичными или различными, и где кольцо является частично или полностью насыщенным, и где кольцо является незамещенным или замещенным одной или более следующими группами: галоген, (низш.)алкил, гидрокси, карбокси, (низш.)алкокси, нитро, амино или циано. Гетероатом(ы) выбирают из группы, включающей азот, серу и кислород. Примеры незамещенного гетероцикла включают пирролин, пирролидин, имидазолин, имидазолидин, пиразолин, пиразолидин, пиран, пиперидин, диоксан, морфолин, дитиан, тиоморфолин, пиперазин и тритиан.
Термин "галоген" означает фтор, хлор, бром или иод.
Термин "амино" означает незмещенную аминогруппу или амин, замещенный одним или более заместителями, выбранными из группы, включающей алкил, арил, ацил, алкилсульфонил или арилсульфонил.
Термин "алкенил" означает углеводородную группу из 2-5 атомов углерода с прямой или разветвленной цепью, имеющую по меньшей мере одну двойную связь.
Термин "алкинил" означает углеводородную группу из 2-5 атомов углерода с прямой или разветвленной цепью, имеющую по меньшей мере одну тройную связь.
В указанной выше формуле I предпочтительно, если R1 и R1' независимо означают водород, метил или этил, незамещенные или замещенные (низш.)алкокси, предпочтительно метокси или этокси. Наиболее предпочтительно, если по меньшей мере один из R1 и R1' означает (низш.)алкил, наиболее предпочтителен незамещенный метил.
Предпочтительно, если R2 означает (низш.)алкокси, то этот остаток означает метокси и этокси, наиболее предпочтителен метокси. Предпочтительно, если R2 означает (низш.)алкил, то этот остаток означает метил или этил, который является незамещенным или замещенным одной или более группой (низш.)алкокси или галоген. Наиболее предпочтительно, если R2 означает (низш.)алкил, то этот остаток означает метил, который является незамещенным или замещенным группой метокси. Кроме того, R2 предпочтительно может означать галогеналкил, такой, как трифторметил.
Если R2' является гетероарилом, то этот остаток предпочтительно означает тиофенил, фуранил, имидазолил (незамещенный или замещенный (низш.)алкилом), тиазолил, пиразолил, который является незамещенным или замещенным (низш.)алкилом, пиримидинил или изотиазолил.
Если R2' является гетероциклом, то этот остаток предпочтительно означает незамещенный морфолин, незамещенный пирролидин, незамещенный пиперидин или пиперазин, незамещенный или замещенный (низш.)алкилом, (низш.)алкокси или карбокси.
Если R2' означает этил, замещенный гетероарилом, то гетероарил предпочтительно означает имидазол. Кроме того, R2' может означать метил или пропил, замещенные гетероарилом.
Кроме группы этокси, замещенной гетероарилом или гетероциклом, R2' может также означать метокси или пропокси, замещенные гетероарилом или гетероциклом.
В предпочтительном варианте воплощения изобретения, где R2' означает тиофенил, R1 и R1' оба предпочтительно означают метил, а R2 означает водород или нитро.
В другом предпочтительном варианте воплощения изобретения, где R2' означает фуранил, R1 предпочтительно означает водород, метил, R1' означает метил, а R2 означает водород или нитро.
В еще одном предпочтительном варианте воплощения изобретения, где R2' означает имидазолил, незамещенный или замещенный (низш.)алкилом, предпочтительно метилом, R1 предпочтительно означает метил, R1' означает метил, а R2 означает водород, нитро, циано, галоген или метокси.
В еще одном предпочтительном варианте воплощения изобретения, где R2' означает тиазолил, предпочтительно R1 и R1' оба означают метил, а R2 означает водород или нитро.
В еще одном предпочтительном варианте воплощения изобретения, где R2' означает пиразолил, незамещенный или замещенный (низш.)алкилом, предпочтительно метилом, R1 и R1' оба предпочтительно означают метил, а R2 означает водород, нитро или галоген.
В еще одном предпочтительном варианте воплощения изобретения, где R2' означает пиримидинил, R1 и R1' предпочтительно означают метил, а R2 означает водород или нитро.
В еще одном предпочтительном варианте воплощения изобретения, где R2' означает изотиазол, R1 и R1' предпочтительно означают метил, а R2 означает водород или нитро.
В еще одном предпочтительном варианте воплощения изобретения, где R2' означает пирролидинил, предпочтительно, если R1 означает водород или метил, R1' означает водород, метил или метоксиметил, а R2 означает водород, нитро, циано, галоген, трифторметил или метокси.
В еще одном предпочтительном варианте воплощения изобретения, где R2' означает пиперидинил, R1 и R1' оба предпочтительно означают метил, а R2 означает водород.
В еще одном предпочтительном варианте воплощения изобретения, где R2' означает морфолинил, R1 предпочтительно означает водород, метил, R1' предпочтительно означает метил, водород или метоксиметил, a R2 означает водород, нитро, циано, галоген, метил, трифторметил или метокси.
В еще одном предпочтительном варианте воплощения изобретения, где R2' означает этокси, замещенный гетероарилом или гетероциклом, предпочтительно гетероарилом, и более предпочтительно имидазолилом, R1 и R1' оба предпочтительно означают метил, а R2 означает нитро.
Соединения формулы I получают, как описано ниже.
Исходный материал, соединение формулы 4, может быть получен по следующей схеме:
Если R2' означает гетероцикл или гетероарил, а R1 означает (низш.)алкил, соединение 4 может быть получено по схеме 1.
Соединение формулы 2, где Х означает Br или I, получали известными методами (см. статью Moyer M.P., Shiurba J.F., Rapoport H., J. Org. Chem., 57, 5106 (1986)), и алкилировали известными методами (NaH и алкилиодид в N,N-диметилформамиде (ДМФ) или тетрагидрофуране при температуре от 0°С до приблизительно 25°С) с получением соответствующего соединения формулы 3. В другом варианте алкилирование может проводиться с использованием диметилкарбоната и основания (такого, как К2СО3) или катализатора (такого, как ТВАВ) в ДМФ, при кипячении реакционной смеси с обратным холодильником (при температуре выше 90°С).
Соединение формулы 3 взаимодействует с гетероарилом, замещенным триалкилстаннаном, в растворителе, таком, как толуол или ТГФ, в присутствии основания, такого, как триэтиламин, по реакции, катализируемой палладиевым катализатором, таким, как тетракис(трифенилфосфин)палладий (0), при температуре от 50°С до температуры дефлегмации, с получением соответствующего соединения формулы 4, где R2' означает гетероарил.
В другом варианте соединение формулы 3 вводят в реакцию с имидазолом или замещенным имидазолом в присутствии карбоната цезия, 1,10-фенантролина и дибензилиденацетона, катализируемую комплексом трифторметансульфонат меди(I):бензол, в растворителе, таком, как ксилол, при температуре 110-125°С, с получением соответствующего соединения формулы 4, где R2' означает имидазолил, присоединенный к индольному циклу через атом азота, как описано в статье Kiyoori A., Marcoux J-F., Buchwald S.L., Tetrahedron letters, 40, 2657 (1999).
Если R2' означает гетероциклический амин, такой, как пирролинидил или морфолинил, соединение формулы 4 может быть получено из соединения формулы 3 по реакции Бухвальда (Wolfe J.P., Buchwald S.L., J. Org. Chem., 62, 6066 (1997)). Соединение формулы З вводят в реакцию с гетероциклическим амином, таким, как пирролидин, в присутствии трет-бутоксида натрия, 2,2'-бис(дифенилфосфино)-1,1'-бинафтила и 18-краун-6, катализируемую трис(дибензилиденацетон)дипалладием (0) в растворителе, таком, как тетрагидрофуран, при температуре от 25 до 65°С, с получением соединения формулы 4.
Если R2' означает пиримидинил, соединение формулы 4 получают по следующей последовательности реакций. Соединение формулы 3 вводят в реакцию с н-бутиллитием при -78°С в тетрагидрофуране, а затем с триалкилбором. Полученный продукт обрабатывают водным метанолом с получением соединения формулы 5. Соединение формулы 5 вводят в реакцию с бромпиримидином, тетракис(трифенилфосфин)палладием (0) в присутствии основания, такого, как карбонат натрия, в диоксане при температуре 100-110°С, с получением соединения формулы 4, где R2' означает пиримидинил.
Если R2' означает этокси, замещенный гетероциклом или гетероарилом, такой, как 2-имидазол-1-илэтокси, соединение формулы 4 может быть получено по следующей последовательности реакций. Соединение формулы 5 вводят в реакцию с пероксидом водорода и гидроксидом натрия с получением соединения 6. Обработка соединения 6 1-(2-гидроксиэтил)имидазолом, трифенилфосфином и диэтилазодикарбоксилатом приводит к получению соединения формулы 4, где R2' означает 2-имидазол-1-илэтокси.
Соединение формулы 1 может быть получено по схеме 2 при условии, что, если R2 и R1 означают заместители, взаимодействующие с хлорангидридами кислот, такие, например, как алкиламин, их защищают соответствующей защитной группой.
Соединение формулы 4 вводят в реакцию с оксалилхлоридом в растворителе, таком, как диэтиловый эфир или дихлометан, при температуре от 0 до 25°С, с получением соответствующего соединения формулы 7.
Соединение формулы 7 вводят в реакцию с соединением формулы 8, известным соединением (см. патент US №5057614) или соединением, полученным по известным методам, в присутствии основания, такого, как триэтиламин, в дихлорметане при температуре от 0 до 25°С. Затем полученный продукт обрабатывают кислотой, такой, как пара-толуолсульфоновая кислота или хлористоводородная кислота, в растворителе, таком, как хлористый метилен, метанол или ТГФ, при температуре от 25 до 65°С, с получением соответствующего соединения формулы 1. Если в реакциях 7 или 8 используется защитная группа, ее удаляют на этой стадии методами, известными в данной области техники.
Как показано на схеме 3, соединение формулы 4 вводят в реакцию с метилоксалилхлоридом в растворителе, таком, как диэтиловый эфир или дихлорметан, или в отсутствие растворителя, при температуре от 0 до 25°С, с получением соединения формулы 9. Соединение формулы 9 вводят в реакцию с гидратом гипофосфита натрия, катализируемую палладием на угле, в растворителе, таком, как диоксан, при температуре от 100 до 110°С, с получением соединения формулы 10. Соединение формулы 10 вводят в реакцию с гидроксидом аммония с получением соответствующего соединения формулы 11.
Соединение формулы 12 вводят в реакцию с метилоксалилхлоридом в растворителе, таком, как диэтиловый эфир или дихлорметан, или в отсутствие растворителя, при температуре от 0 до 25°С, с получением соединения формулы 13.
Соединение формулы 11 вводят в реакцию с соединением формулы 13 в присутствии основания, такого, как трет-бутоксид калия, в растворителе, таком, как тетрагидрофуран, при температуре от 0 до 25°С. Полученный продукт обрабатывают кислотой, такой, как хлористоводородная кислота, с получением соединения формулы 1.
Как показано на схеме 4, соединение формулы 3 вводят в реакцию с оксалилхлоридом в растворителе, таком, как диэтиловый эфир или хлористый метилен, при температуре от 0 до 25°С, с получением соединения формулы 14. Соединение формулы 14 вводят в реакцию с соединением формулы 8 в присутствии основания, такого, как триэтиламин, в хлористом метилене при температуре от 0°С до 25°С. Затем полученный продукт обрабатывают кислотой, такой, как пара-толуолсульфоновая кислота или хлористоводородная кислота, в растворителе, таком, как хлористый метилен, метанол или ТГФ, при температуре от 25 до 65°С, с получением соответствующего соединения формулы 15.
Соединение формулы 15 вводят в реакцию с гетероарилом, замещенным триалкилстаннаном или бороновой кислотой, таким, как 2-(трибутилстаннил)тиофен или 2-(трибутилстаннил)тиазол, тиофен-3-бороновая кислота, в присутствии основания, такого, как триэтиламин или карбонат натрия, катализируемую палладиевым катализатором, таким, как тетракис(трифенилфосфин)палладий (0) или три(дибензилиденацетон)дипалладий (0), в растворителе, таком, как толуол, ацетонитрил, тетрагидрофуран или диоксан, при температуре от 80 до 110°С, с получением соединения формулы 1.
Превращение кислотного соединения формулы I в фармацевтически приемлемую соль можно проводить взаимодействием с приемлемым основанием по известному способу. Приемлемыми солями являются не только соли неорганических оснований, например соли натрия, калия или кальция, но и соли органических оснований, таких, как этилендиамин, моноэтаноламин или диэтаноламин. Превращение основных соединений формулы I в фармацевтически приемлемые соли можно проводить взаимодействием с приемлемой кислотой по известному способу. Приемлемыми солями являются не только соли неорганических кислот, например гидрохлориды, гидробромиды, фосфаты или сульфаты, но и соли органических кислот, например ацетаты, цитраты, фумараты, тартраты, малеаты, метансульфонаты или пара-толуолсульфонаты.
Антипролиферативная активность соединений по изобретению приводится ниже. Эти результаты показывают, что соединения по настоящему изобретению могут применяться в терапии рака, прежде всего солидных опухолей, таких, как опухоли молочной железы и толстой кишки. Клетки линии эпителиальной карциномы молочной железы (MDAMB-435) получали из АТСС (American Type Cell Culture Collection) и культивировали на среде, рекомендованной АТСС. Для анализа действия различных соединений формулы I на рост этих клеток клетки вносили в лунки 96-луночного культурального планшета ("test plate") в концентрации 1500 клеток на лунку. Через день после внесения клеток анализируемые соединения растворяли в 100% ДМСО (диметилсульфоксид), получая исходный 10 мМ раствор. Раствор каждого соединения разбавляли водой до конечной концентрации 1 мМ и добавляли в первый ряд контрольного планшета ("master plate"), содержащего среду, по три повтора для каждого соединения, при этом конечная концентрация составляла 40 мкМ. Затем проводили серийное разведение соединений в среде контрольного планшета. Разведенные растворы переносили в культуральные планшеты, содержащие клетки. В ряд, содержащий "контрольные клетки", вносили ДМСО. Конечная концентрация ДМСО в каждой лунке составляла 0,1%. Через 5 дней после добавления соединений планшеты анализировали, как описано ниже.
В каждую лунку добавляли МТТ (бромид 3-(4,5-метилтиазол-2-ил)-2,5-дифенилтетразолия, тиазолил синий) до конечной концентрации 1 мг/мл. Затем планшеты инкубировали при 37°С в течение 2,5-3 ч. Среду, содержащую МТТ, удаляли и в каждую лунку добавляли по 50 мкл 100% этанола для растворения формазана. Поглощение измеряли на автоматическом ридере планшетов (фирмы Biotek microplate reader). Величину IC50 рассчитывали по уравнению Рида и Мюнша (см. статью Reed, Munsch, Am. J. Hygiene, 27, 493-497 (1938)).
Результаты экспериментов in vitro приведены ниже в таблице 1.
| Таблица 1 | |||||
| Пример | R1 | R2 | IC50 (мкМ) | ||
| 12г | СН3 | СН3 | NO2 | 0,002 | |
| 12з | СН3 | Н | NO2 | 0,002 | |
| 12д | СН3 | Н | F | 0,003 | |
| 12е | СН3 | Н | Cl | <0,003 | |
| 12ж | СН3 | СН2OCH3 | NO2 | 0,02 | |
| 14е | СН3 | СН3 | Br | 0,005 | |
| 14ж | СН3 | СН3 | ОСН3 | 0,04 | |
| 14з | СН3 | СН3 | CF3 | 0,08 | |
| 12к | СН3 | СН3 | Н | 0,06 | |
| 15 | СН3 | СН3 | CN | <0,01 | |
| 12м | СН3 | СН3 | Н | 0,23 | |
| 12а | СН3 | СН3 | NO2 | <0,01 | |
| 11 | СН3 | СН3 | Н | 0,02 | |
| 13 | СН3 | СН3 | CN | 0,004 | |
| 14а | СН3 | СН3 | ОСН3 | 0,02 | |
| 14б | СН3 | СН3 | F | 0,03 | |
| ]4в | СН3 | СН3 | Cl | 0,002 | |
| 14г | СН3 | СН3 | Br | 0,003 | |
| 14д | СН3 | СН3 | CF3 | 0,05 | |
| 12б | СН3 | СН3 | СН3 | <0,01 | |
| 12в | Н | СН3 | Н | 0,07 | |
| 3 | СН3 | СН3 | Н | 0,04 | |
| 5 | СН3 | СН3 | Н | 0,04 | |
| 2ж | СН3 | СН3 | Н | 0,02 | |
| 2и | Н | СН3 | Н | 0,03 | |
| 2з | СН3 | СН3 | NO2 | 0,01 | |
| 4а | СН3 | СН3 | Н | 0,024 | |
| 2в | СН3 | СН3 | NO2 | 0,03 | |
| 4б | СН3 | СН3 | Н | 0,06 | |
| 4в | СН3 | СН3 | NO2 | 0,02 | |
| 4г | СН3 | СН3 | NO2 | 0,02 | |
| 6 | СН3 | СН3 | NO2 | 0,04 | |
| 1 | СН3 | СН3 | NO2 | 0,005 | |
| 2а | СН3 | СН3 | Н | 0,05 | |
| 2б | СН3 | СН3 | ОСН3 | 0,06 | |
| 2г | СН3 | СН3 | NO2 | 0,12 | |
| 2д | СН3 | СН3 | Н | 0,08 | |
| 2п | СН3 | СН3 | NO2 | 0,04 | |
| 2е | СН3 | СН3 | NO2 | 0,02 | |
| 7 | СН3 | СН3 | Н | 0,06 | |
| 8а | СН3 | СН3 | NO2 | 0,03 | |
| 9 | СН3 | СН3 | ОСН3з | 0,06 | |
| 10а | СН3 | СН3 | Br | 0,025 | |
| 10б | СН3 | СН3 | CN | 0,03 | |
| 8б | СН3 | СН3 | NO2 | 0,25 | |
| 8в | СН3 | СН3 | NO2 | 0.02 | |
| 8г | СН3 | СН3 | Н | 0,03 | |
| 8д | СН3 | СН3 | Br | 0,025 | |
| 2к | СН3 | СН3 | NO2 | 0,2 | |
| 2л | СН3 | СН3 | Н | 0,25 | |
| 2м | СН3 | СН3 | Br | 0,07 | |
| 17 | СН3 | СН3 | NO2 | 0,07 | |
| 2н | CH3 | CH3 | NO2 | 0,01 | |
| 2о | CH3 | CH3 | Н | 0,04 | |
| 18 | CH3 | CH3 | NO2 | 0,05 | |
| 19 | CH3 | CH3 | Н | 0,08 | |
| 12и | Н | CH3 | Н | 0,08 | |
| 14и | CH3 | CH3 | Cl | 0,01 | |
| 12н | CH3 | CH3ОСН2 | F | 0.17 | |
| 12о | CH3 | Н | F | 0,012 | |
| 12п | CH3 | Н | Н | 0,037 | |
| 16 | CH3 | CH3 | CH3ОСН2 | 1,18 | |
| 12л | CH3 | CH3 | Н | 3,41 |
Другой вариант воплощения изобретения относится к фармацевтическим композициям, включающим по меньшей мере одно соединение формулы I или его фармацевтически приемлемую соль.
Эти фармацевтические композиции могут быть введены перорально, например, в форме таблеток, таблеток с покрытием, драже, твердых или мягких желатиновых капсул, растворов, эмульсии или суспензий. Кроме того, они могут быть введены ректально, например, в форме суппозиториев. Однако, прежде всего, соединения по настоящему изобретению пригодны для парентерального введения, например, в форме инъекционных растворов.
Фармацевтические композиции по настоящему изобретению, включающие соединения формулы I, пролекарства таких соединений или их соли, могут быть приготовлены по известному в данной области способу, например, с использованием обычных способов смешивания, инкапсулирования, растворения, гранулирования, эмульгирования, включения в полимер или гель, дражирования или лиофилизации. Эти фармацевтические препараты могут быть переработаны с терапевтически инертными, неорганическими или органическими носителями. В качестве таких носителей при изготовлении таблеток, таблеток с покрытием, драже и твердых желатиновых капсул могут быть использованы лактоза, крахмал зерновых и его производные, тальк, стеариновая кислота или ее соли. Приемлемые носители для мягких желатиновых капсул включают растительные масла, воски и жиры. В зависимости от природы активного соединения в случае мягких желатиновых капсул обычно не требуется никакого носителя. Пригодными носителями для приготовления растворов и сиропов являются вода, полиолы, сахароза, инвертированный сахар и глюкоза. Пригодными носителями для инъекций являются вода, спирты, полиолы, глицерин, растительные масла, фосфолипиды и ПАВ. Пригодными носителями для суппозиториев являются природные или отвержденные масла, воски, жиры и полужидкие полиолы.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизирующие агенты, стабилизирующие агенты, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для регуляции осмотического давления, буферные растворы, агенты для покрытия оболочкой и антиоксиданты. Кроме того, они могут содержать другие терапевтически ценные соединения, включая дополнительные активные ингредиенты, иные, чем соединения формулы I.
Как указывалось выше, настоящее изобретение относится также к способу получения соединения формулы I, включающему
а) взаимодействие соединения формулы 7 (схема 2)
с соединением формулы 8 (схема 2)
где R1 и R1' независимо означают водород или (низш.)алкил, (низш.)алкенил или (низш.)алкинил;
R2 означает водород, нитро, циано, галоген, (низш.)алкил, (низш.)алкенил, (низш.)алкинил или (низш.)алкокси;
а R2' означает гетероарил, гетероцикл, этил, замещенный гетероарилом, или этокси, замещенный гетероарилом или гетероциклом,
или его фармацевтически приемлемой солью,
б) взаимодействие соединения формулы 11 (схема 3)
с соединением формулы 13 (схема 3)
где R1 и R1' независимо означают водород или (низш.)алкил, (низш.)алкенил или (низш.)алкинил;
R2 означает водород, нитро, циано, галоген, (низш.)алкил, (низш.)алкенил, (низш.)алкинил или (низш.)алкокси, а
R2' означает гетероарил, гетероцикл, этил, замещенный гетероарилом, или этокси, замещенный гетероарилом или гетероциклом;
или его фармацевтически приемлемой солью, или
в) взаимодействие соединения формулы 15 (схема 4)
где R1 и R1' независимо означают водород или (низш.)алкил, (низш.)алкенил или (низш.)алкинил;
R2 означает водород, нитро, циано, галоген, (низш.)алкил, (низш.)алкенил, (низш.)алкинил или (низш.)алкокси, а
R2' означает гетероарил, гетероцикл, этил, замещенный гетероарилом, или этокси, замещенный гетероарилом или гетероциклом;
или его фармацевтически приемлемой соли, а
Х означает Br или I,
с гетероарилом, замещенным триалкилстаннаном или бороновой кислотой, в присутствии основания по реакции, катализируемой палладиевым катализатором.
Как указывалось выше, соединения по настоящему изобретению используются при терапии или контроле нарушений клеточной пролиферации, прежде всего онкологической патологии. Эти соединения и композиции, содержащие вышеупомянутые соединения, прежде всего, могут применяться при терапии или контроле солидных опухолей, например, таких, как опухоли молочной железы и толстой кишки.
Таким образом, настоящее изобретение включает применение вышеупомянутых соединений для получения лекарственных средств, прежде всего, для терапии или контроля нарушений клеточной пролиферации, конкретно онкологической патологии, например для лечения или контроля солидных опухолей, например, таких, как опухоли молочной железы и толстой кишки. Терапевтически эффективное количество соединения по настоящему изобретению означает количество соединения, которое эффективно предупреждает, смягчает или уменьшает интенсивность симптомов заболевания или пролонгирует выживание пациента, подлежащего лечению. Терапевтически эффективное количество определяется специалистом.
Терапевтически эффективное количество или дозировка соединения по изобретению может варьировать в широком диапазоне и зависит от индивидуальных требований в каждом конкретном случае. Обычно при пероральном или парентеральном введении взрослым массой приблизительно 70 кг достаточной является суточная доза от приблизительно 10 мг до приблизительно 10000 мг, предпочтительно от приблизительно 200 мг до приблизительно 1000 мг, хотя при соответствующих показаниях верхний предел может быть превышен. Суточную дозировку можно вводить в виде одной дозы или отдельных доз, или при парентеральном введении непрерывным вливанием.
Соединения по настоящему изобретению могут быть синтезированы известными методами, например, такими, какие приведены выше на основных схемах. Предпочтительные методы синтеза соединений и способы по настоящему изобретению иллюстрируются следующими примерами.
Пример 1
3-[1-Метил-6-(3-метил-3Н-имидазол-4-ил)-1Н-индол-3-ил]-4-(1-метил-6-нитро-1Н-индол-3-ил)пиррол-2.5-дион
а) 6-Броминдол (10,4 г, 53,1 ммоля) (полученный, как описано в статье Moyer M.P., Shiurba J.F., Rapoport H., J. Org. Chem., 51, 5106 (1986)) добавляли небольшими порциями в течение 30 мин к перемешиваемой суспензии гидрида натрия (2,96 г, 61,7 ммоля, 50%-ная суспензия в минеральном масле) в сухом ТГФ (120 мл) при 0°С. Перемешивание продолжали в течение еще 30 мин, а затем по каплям добавляли иодметан (4,5 мл, 71,6 ммоля). Через 1 ч смесь выливали в ледяную воду и экстрагировали эфиром (3×200 мл). Объединенные органические экстракты промывали солевым раствором и сушили (MgSO4). После выпаривания растворителя и хроматографии полученного остатка на силикагеле с использованием гексана получали 6-бром-1-метил-1H-индол (10,8 г, 97%).
б) Раствор 6-бром-1-метил-1Н-индола (6,2 г, 29,5 ммоля) в толуоле дегазировали в течение 10-20 мин, пропуская через раствор ток аргона. Затем добавляли Et3N (8,2 мл, 59 ммолей), тетракис(трифенилфосфин)палладий (0) (681 мг, 0,59 ммоля) и 1-метил-5-(трибутилстаннил)имидазол (11,6 г, 31,2 ммоля) (см. статью Gaare К., Repstad Т., Benneche Т., Undheim К., Acta Chem. Scan.,47, 57 (1993)) в толуоле (30 мл) и смесь нагревали при 120°С в течение 18 ч до появления черной окраски Pd. Затем смесь охлаждали и фильтровали через слой силикагеля, который промывали EtOAc. Фильтрат упаривали, остаток хроматографировали на силикагеле с использованием 0,5-1% метанола в EtOAc, при этом получали 1-метил-6-(3-метил-3Н-имидазол-4-ил)-1Н-индол (5,21 г, 84%) в виде твердого кристаллического вещества белого цвета.
в) 1-Метил-6-(3-метил-3Н-имидазол-4-ил)-1Н-индол (5,0 г, 23,7 ммоля) растворяли в CH2Cl2 (25 мл) (высушенном над молекулярными ситами 3Å) при 0°С. Затем по каплям в течение 10 мин добавляли раствор оксалилхлорида в CH2Cl2 (2 М, 23,7 мл, 47,4 ммоля). Полученную смесь перемешивали при 0°С в течение 2,5 ч и упаривали. К остатку в виде твердого вещества добавляли эфир (25 мл) и смесь перемешивали в течение 30 мин. Полученное твердое вещество желтого цвета отделяли фильтрованием, промывали эфиром и высушивали в вакууме в течение 30 мин. К твердому веществу желтого цвета при 0°С добавляли гидрохлорид изопропилового эфира 2-(1-метил-6-нитро-1Н-индол-3-ил)имидиноуксусной кислоты (7,02 г, 22,5 ммоля) и CH2Cl2 (200 мл). Затем по каплям в течение 10 мин добавляли Et3N (16,5 мл, 118,6 ммоля) (высушенный над молекулярными ситами 3Å) и смесь оранжево-красного цвета перемешивали при комнатной температуре в течение ночи. Смесь разбавляли CHCl3 и промывали водным раствором Na2CO3. Водный слой подвергали обратной экстракции CHCl3. Объединенные органические экстракты промывали солевым раствором, сушили (К2СО3) и упаривали. Затем добавляли МеОН (150 мл) и конц.HCl (37%, 10 мл). Полученную смесь кипятили с обратным холодильником в течение 2 ч, охлаждали, разбавляли CHCl3 и промывали водным раствором Na2CO3. Водный слой подвергали обратной экстракции CHCl3. Объединенные органические экстракты промывали солевым раствором и сушили (К2СО3). Смесь пропускали через слой силикагеля (10×10 см), который промывали 10% метанолом/EtOAc. После упаривания объединенных фильтратов получали неочищенный продукт в виде твердого вещества оранжевого цвета. При кристаллизации продукта из EtOH/CHCl3 получали 3-[1-метил-6-(3-метил-3Н-имидазол-4-ил)-1Н-индол-3-ил]-4-(1-метил-6-нитро-1Н-индол-3-ил)пиррол-2,5-дион (5,65 г, 49%) в виде твердого вещества оранжевого цвета.
Пример 2
Следующие соединения были получены аналогично тому, как описано в примере 1. Исходные материалы получали аналогично тому, как описано в примерах 1а) и 1б).
а) 3-(1-Метил-1Н-индол-3-ил)-4-[1-метил-6-(3-метил-3Н-имидазол-4-ил)-1Н-индол-3-ил]пиррол-2,5-дион (391 мг, 45%) получали в виде твердого вещества оранжевого цвета с использованием 1-метил-6-(3-метил-ЗН-имидазол-4-ил)-1Н-индола (422 мг, 2 ммоля) и гидрохлорида изопропилового эфира 1-метил-3-индолимидиноуксусной кислоты (530 мг, 2 ммоля).
б) 3-(6-Метокси-1-метил-1Н-индол-3-ил)-4-[1-метил-6-(3-метил-3Н-имидазол-4-ил)-1Н-индол-3-ил]пиррол-2,5-дион (78 мг, 11%) получали в виде твердого вещества темно-коричневого цвета с использованием 1-метил-6-(3-метил-3Н-имидазол-4-ил)-1Н-индола (316 мг, 1,5 ммоля) и гидрохлорида изопропилового эфира 2-(1-метил-6-метокси-1Н-индол-3-ил)имидиноуксусной кислоты (445 мг, 1,5 ммоля).
в) 3-[1-Метил-6-(1-метил-1Н-имидазол-2-ил)-1Н-индол-3-ил]-4-(1-метил-6-нитро-1Н-индол-3-ил)пиррол-2,5-дион (1,08 г, 34%) получали в виде твердого вещества оран