Штамм penicillium funiculosum, продуцирующиий комплекс ферментов - целлюлазу, эндо-1,4--ксиланазу, целлобиогидролазу, -глюкозидазу, эндо-1,3(4)- -глюканазу, ферулоил-эстеразу, жидкая кормовая добавка и сухой корм для сельскохозяйственных животных
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано в кормопроизводстве для приготовления кормовой добавки и корма для сельскохозяйственных животных. Штамм Penicillium funiculosum IMI378536 продуцирует комплекс ферментов - целлюлозу, эндо-1,4-β-ксиланазу, целлобиогидролазу, β-глюкозидазу, эндо-1,3(4)-β-глюканазу, ферулоил-эстеразу. Жидкая кормовая добавка для сельскохозяйственных животных, таких как домашняя птица, свиньи и жвачные, содержит микробный продукт, полученный из штамма Penicillium funiculosum IМI378536 по п.1, дополненный, в случае необходимости, ферментом (ферментами) определенным (определенными) в п.1, противомикробный агент, сорбит, антифриз, концентрированный отфильтрованный ферментационный бульон при заданном содержании компонентов. Сухой корм для сельскохозяйственных животных, таких как домашняя птица, свиньи и жвачные, содержит микробный продукт, полученный из штамма Penicillium funiculosum IМI378536 по п.1, дополненный, в случае необходимости, ферментом (ферментами) определенным (определенными) в п.1, носитель, компоненты сухого ферментационного бульона при заданном содержании компонентов. Изобретение обеспечивает повышение усвояемости аминокислот и кормов для животных, уменьшение выделения фосфора и аммиака из помещений, где кормят животных. 3 н. и 22 з.п. ф-лы, 4 ил., 32 табл.
Реферат
Область изобретения
Настоящее изобретение относится к новому микроорганизму, новым ферментам и новой смеси ферментов. Кроме того, настоящее изобретение относится к композиции смеси ферментов, к ее получению и использованию в пищевой промышленности, в производстве кормов и в других отраслях промышленности, включая (но не ограничиваясь ими) бумажную и текстильную промышленность.
Предпосылки изобретения
В течение длительного времени ферменты использовали для широкого круга различных промышленных применений. Известны примеры из хлебопекарной промышленности, виноделия и производства фруктовых соков (где ферменты используют для разрушения пектинов и β-глюканов), текстильной промышленности (где целлюлазы используют для получения мягких и гладких целлюлозных тканей) и также, что является отнюдь не последним применением, для приготовления кормов животным. В этом случае ферменты улучшают переваривание кормов из растительных источников.
Последнее применение обеспечивает более эффективное переваривание животными корма. Ценность корма можно определить по FCR (Feed Conversation Ratio = затраты корма на единицу продукции), питательной ценности, количеству расходуемого корма по отношению к увеличению массы животного. Снижение величины FCR для корма указывает на пропорциональное увеличение массы животного, т.е. на то, что животное способно использовать корм более эффективно.
Плохая усвояемость компонентов корма (крахмал, жир, протеин/аминокислоты) является отличительной особенностью кормов на основе злаковых и, например, особенно тех, в которых высоко содержание ячменя или пшеницы. В этих случаях может оказаться необходимым подготавливать корма так, чтобы они содержали более высокие уровни энергии из других источников и других добавок, таких как аминокислоты. Эти ферменты повышают величину очевидной обменной энергии (Apparent Metabolizabie Energy), включенных в корм злаковых.
Другим подходом к решению этой проблемы было введение ферментных добавок, целлюлаз, эндо-1,3(4)-β-глюканаз (β-глюканазы), эндо-1,4-β-ксиланаз (ксиланазы) и т.д. или смесей ферментных активностей к таким кормам на основе злаковых. Ферментные добавки могут иметь специфическое применение для гидролиза β-глюканов или для гидролиза арабиноксиланов, находящихся в злаковых (обычно в ячмене и пшенице). Добавление ферментов имеет различные цели. Одним из преимуществ, которое, безусловно, обеспечивает эффективность ферментных добавок к кормам, является снижение вязкости материалов в пищеварительном тракте животных, которые получают корм на основе злаковых, содержащий соответствующую ферментную добавку. Более высокая вязкость обусловлена, частично, присутствием β-глюканов и арабиноксиланов в ячмене и пшенице. Более низкая вязкость, являющаяся результатом действия ферментов, обеспечивает более легкую абсорбцию питательных компонентов в пищеварительном тракте животных. Другим преимуществом является выделение питательных веществ, заключенных в стенках клеток злаковых, что снижает необходимость в других дорогостоящих кормовых добавках. Общим результатом является значительное снижение стоимости кормов с аналогичным или более высоким эффектом по измерениям FCR.
Было раскрыто, что ферментные препараты, полученные из широкого круга различных микроорганизмов, повышают усвояемость кормов.
С учетом известного уровня, связанного с использованием ферментов в кормах для животных, авторы указывают Европейскую патентную заявку №0699762, в которой раскрыто использование фитазы, выделенной из Schwanniomyces occidentalis. Эта фитаза представляет собой фитазу, полученную из генетически модифицированного организма, полученного путем встраивания клонированного гена, чего авторы хотели бы избежать в настоящем изобретении.
Что касается патентной заявки WO 95/26398, там также модифицированную целлюлазу получают путем встраивания чужеродной ДНК последовательности в клетку-хозяина, которая модифицирует природу исходного штамма, который выбран из следующего перечня микроорганизмов: Bacillus, Streptomyces, Saccharomyces, Schizosacch aromyces, Aspergillus. Основной целью авторов настоящего изобретения было избежать встраивания чужеродного гена в микроорганизм, который продуцирует фермент.
В патентной заявке WO 96/05739 смесь ферментов (ксиланазу, протеазу и, необязательно β-глюканазу) получают из различных микроорганизмов. Авторы приводят пример (стр.5) смеси ферментов с отношением ксилазной активности к β-глюканазной активности порядка 1:5. Было обнаружено, что когда ксилаза включена в рацион на основе злаковых в оптимальной дозе или около этого, совместное присутствие ферментов, процессирующих β-глюканазную активность, повышает FCR корма, что, естественно, невыгодно. Соответственно, авторы выступают против присутствия β-глюканазы, они рекомендуют максимальное отношение ксиланазной активности к β-глюканазной активности как 1:0-0,25.
В некоторых случаях, для того, чтобы обеспечить присутствие всех ферментных активностей, связанных с применением кормов, приходится получать препараты из препаратов, полученных более чем из одного микроорганизма. В ряде случаев ферментные препараты были получены из микроорганизмов, подвергшихся генетическим модификациям с использованием рекомбинантных ДНК методик.
Авторы обнаружили новый микроорганизм, принадлежащий к классу Penicillum funiculosum, который содержит новые ферменты, и разработали смесь ферментных активностей, которую с успехом можно использовать для повышения, главным образом, усвояемости кормов для животных на основе злаковых.
Краткое содержание изобретения
Соответственно, настоящее изобретение относится к новому микроорганизму, полученному из Penicillum funiculosum, и к способу культивирования этого микроорганизма и выделения ферментов, продуцируемых этим микроорганизмом.
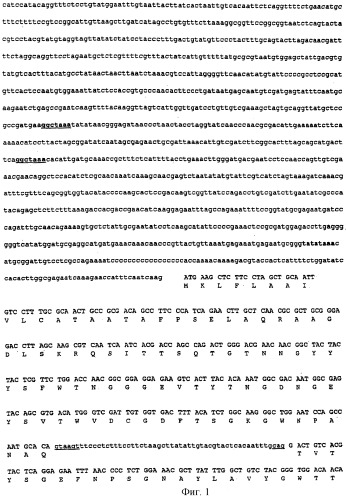
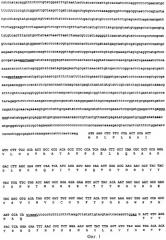
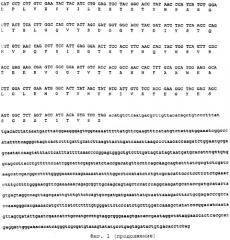
Кроме того, в соответствии с настоящим изобретением предложены новые ферменты, выделенные из этого микроорганизма, их последовательности нуклеиновых кислот и новые композиции, содержащие эти ферменты.
Далее, в соответствии с настоящим изобретением, предложен способ повышения усвояемости аминокислот и кормов для животных на основе аминокислот и злаковых.
Другой целью настоящего изобретения является уменьшение выделения фосфора и выделения аммиака из клеточной батареи, где кормят животных.
Подробное описание изобретения
А. Новый штамм Penicillum funiculosum
Этот новый штамм грибков Penicillum funiculosum депонирован под регистрационным номером IМI378536 в измассатном Международном Депозитарии в соответствии с Будапештским Соглашением (1977), Международным Институтом Микологии (International Mycological Institute (IMI), Bakeham Lane, Englefield Green, Egham, Surrey, TW209TY, UK).
Происхождение
Новый штамм получен из Penicillum funiculosum IMI 134756 после успешного УФ облучения и β-облучения спор, включая скринирование на селективной среде. Никаких генетических модификаций не было получено с помощью рекомбинантных ДНК методик с использованием встраивания чужеродных ДНК или РНК.
Идентификация и типирование
Penicillum funiculosum IMI 134756 был охарактеризован путем выращивания на Czapek Dox агаре при 25°С. Характеристики колонии и микроморфология типичны для Penicillum funiculosum. Идентификация микроорганизма как Penicillum funiculosum была подтверждена в Международном Институте Микологии (International Mycological Institute (IMI), Bakeham Lane, Englefield Green, Egham, Surrey, TW209TY, UK). Рост похож на плотный базальный войлок с аэральным ростом в виде нитей или узелков гифов (funiculose), мицелий белого цвета с подложкой красного цвета в субстрате, поля наоборот бледные, но окрашены красным по направлению к центрам, могут становиться темно-красными. Это типичный пенициллин, он демонстрирует короткий кондиофорез, возникающий, главным образом, из funicles, biverticillate, игольчатых конидиогенных клеток, конидии эллиптичные и гладкие.
Микроорганизм, использованный для получения препарата ферментов настоящего изобретения, выращивают в аэробных условиях в среде, которая содержит целлюлозу, сироп от замачивания кукурузы, карбонат кальция и сульфат аммония.
В. Процесс ферментации
скринирование на селективной среде. Никаких генетических модификаций не было получено с помощью рекомбинантных ДНК методик с использованием встраивания чужеродных ДНК или РНК.
Идентификация и типирование
Penicillum funiculosum IMI 378536 был охарактеризован путем выращивания на Czapek Dox агаре при 25°С. Характеристики колонии и микроморфология типичны для Penicillum funiculosum. Идентификация микроорганизма как Penicillum funiculosum была подтверждена в Международном Институте Микологии (International Mycological Institute (IMI), Bakeham Lane, Engiefield Green, Egham, Surrey, TW209TY, UK). Рост похож на плотный базальный войлок, с аэральным ростом, в виде нитей или узелков гифов (funiculose), мицелий белого цвета с подложкой красного цвета в субстрате, поля наоборот бледные, но окрашены красным по направлению к центрам, могут становиться темно-красными. Это типичный пенициллин, он демонстрирует короткий кондиофорез, возникающий, главным образом, из funicles, biverticillate, игольчатых конидиогенных клеток, конидии эллиптичные и гладкие.
Микроорганизм, использованный для получения препарата ферментов настоящего изобретения, выращивают в аэробных условиях в среде, которая содержит целлюлозу, сироп от замачивания кукурузы, карбонат кальция и сульфат аммония.
В. Процесс ферментации
Эти новые грибки получают путем ферментации депонированного штамма вначале на засеваемой среде, предпочтительно состоящей из (по массе):
| - раствора от замачивания | |
| кукурузы | 1%-4% |
| - агента, препятствующего | |
| пенообразованию | только, чтобы |
| избежать образования пены | |
| - воды | до 100% |
| - NaOH | достаточно для |
| доведения рН до около | |
| рН 3,0-6,0 перед | |
| стерилизацией среды |
Температура инкубирования 27°С-36°С
Ферментационная среда предпочтительно имеет следующий состав (по массе):
| - раствор от замачивания | |
| кукурузы | 0-4,0% |
| - загружаемая и подаваемая | |
| целлюлоза | 0,8-14% |
| - Са соль | 0-0,8% |
| - Сульфат аммония | 0-1,0% |
| - агент, препятствующий | |
| пенообразованию | только, чтобы |
| избежать образования пены | |
| - вода | достаточно для |
| достижения 100% | |
| - NaOH | достаточно для |
| доведения рН до | |
| около рН 3,0-6,0 | |
| перед стерилизацией среды | |
| - H2SO4 | достаточно для |
| поддержания рН | |
| около 3,0-6,0 | |
| - Аммиак (газообразный или | |
| жидкий) | достаточно для |
| поддержания рН | |
| около 3,0-6,0 |
Температура инкубирования 27°С-36°С.
Для ферментации загружают ферментер достаточным количеством воды, добавляют ингредиенты к воде в подходящем контейнере с приспособлением для перемешивания, перемешивают до тех пор, пока ингредиенты не растворятся. Стерилизуют, герметизируя ферментер и повышая температуру содержимого обычно до 121°С. Содержимое ферментера инокулируют затравочной ферментационной средой.
Основным источником углерода, который добавляют в процессе ферментации, является целлюлоза; из различных источников целлюлозы авторы предпочитают использовать ARBOCEL, SOLKAFLOC CLAROCEL, ALPHACEL, FIBRACEL различных степеней чистоты.
Величину рН в процессе ферментации предпочтительно контролируют, добавляя серную кислоту или другую кислоту и аммиак в газообразном или жидком виде, или другое основание.
В конце времени ферментации твердые вещества удаляют фильтрованием или центрифугированием, собирают жидкую фазу и концентрируют, например, ультрафильтрацией или на органических или минеральных мембранах.
Эти ферменты можно также получить с помощью рекомбинантных ДНК методик, и таким образом они будут продуцироваться рекомбинантными гомологичными или гетерологичными видами. Хозяина для переноса гена, кодирующего фермент, можно выбрать из видов грибков, бактериальных клеток или растительных клеток. Для встраивания гена, кодирующего представляющий интерес фермент, в такие клетки-хозяева как плазмиды (интегративно или нет), векторы фагов и векторы вирусов, можно использовать любые удобные способы. Penicillum funiculosum, включающий вставку гетерологичных генов или модификацию генома гомологичными генами за счет вставок, делений или модификаций указанного гомологичного гена, также являются частью настоящего изобретения.
В соответствии с настоящим изобретением можно получить фермент в виде выделенного чистого препарата фермента или в виде неочищенного препарата, такого, как культуральная среда, в которой выращивали Penicillum funiculosum.
Можно также включить этот фермент или эти ферменты в композиции, содержащие еще один фермент, тип которого зависит от предполагаемого использования композиции. Добавляемые ферменты можно выбрать, например, из карбогидраз, липаз и протеаз.
С. Композиции, состоящие из "смеси ферментных активностей"
1. Жидкая композиция
Для жидкой композиции после добавления противомикробных агентов осуществляют измерение концентрации ферментов и разбавление до нужной концентрации. Предпочтительным составом жидкого раствора (по массе) является следующий:
| - Микробные продукты, в виде всех | |
| органических твердых веществ | 4%-10% |
| - Противомикробный агент | 0,005%-0,35% |
| предпочтительно | 0,01%-0,25% |
| - Сорбит | 20%-50% |
| - Необязательно антифриз | 0-40% |
| более предпочтительно | 15%-40% |
| - Концентрированный отфильтрованный | |
| ферментационный бульон | 0,3 до 76% |
Забуференный с доведением рН до 3-5
Противомикробный агент выбирают из таких продуктов, как сорбиновая кислота и ее соли, бензойная кислота и ее соли, метил-4-гидроксибензоат и н-пропил-4-гидроксибензоат, фумаровая кислота, соли и сложные эфиры. Можно также использовать такие соли, как хлорид натрия или хлорид калия.
Наиболее предпочтительными антифризами являются 1,2-пропандиол, этиленгликоль, глицерин.
2. Порошковая композиция
Для получения порошковых препаратов полученный концентрированный раствор сушат необязательно в присутствии носителя. Порошок, полученный в результате сушки концентрированного раствора без присутствия носителя, можно впоследствии смешать с подходящим носителем.
Предпочтительным составом порошковой формы композиции является следующий:
| - Микробный продукт в виде всех | |
| органических твердых веществ | 16%-40% |
| - Носитель | 59%-83% |
| - Другие высушенные компоненты | |
| ферментационного бульона | 1% |
Предпочтительные носители выбирают из пшеничной муки, крахмала, гипса, мальтодекстрина, твердых продуктов кукурузы, побочных продуктов, полученных при обработке злаковых культур, такие, как кукурузная крупа, второсортная пшеница, пшеничные отруби, отходы при обработке риса, смесь минералов.
D. Характеристики ферментов
Получена новая смесь ферментов, продуцируемых Penicillum funiculosum. Эта смесь ферментов содержит новые ферменты, такие, как целлюлазы, β-глюканазы, ксиланазы, такие сопутствующие ксиланазные ферменты, как арабинофуранозидаза и ферулоил-эстеразы.
1. Процедура
Ферментный препарат охарактеризован в различных анализах, которые включают анализы активностей целлюлазы, целлобиогидролазы, β-глюкозидазы, эндо-1,3(4)-β-глюканазы, ламинариназо-эндо-1,4-β-ксиланазы (с использованием различных субстратов), β-ксилозидазы, арабинофуранозидазы и ферулоилэстеразы (с использованием различных субстратов).
1.1. DNS CMC способ анализа целлюлазы
Анализ активности целлюлазы основан на ферментном гидролизе гликозидных связей в карбоксиметилцеллюлозе (CMC), β-1,4-глюкане. Продукты реакции, олигосахариды β-1,4-глюкана, определяют по увеличению уровня восстановления (как глюкозу).
Раствор, содержащий 1 мл 1% (масса/объем) раствора CMC в 0,1 М натрийацетатном буфере, рН 5,0 (или другие значения рН); 1 мл соответствующим образом разбавленного ферментного раствора инкубируют при 50°С в течение 10 минут. Ферментную реакцию останавливают, добавляя 2 мл DNS раствора (1% (масса/ объем)) 3,5-динитросалициловой кислоты, 16% (масса/объем) гидроксида натрия, 30% (масса/объем) калий натрий (+)-тартрата в дистиллированной воде). Этот раствор перемешивают и помещают в баню с кипящей водой (минимум 95°С) на 5 минут, затем охлаждают до 25°С. К раствору добавляют 10 мл дистиллированной воды, и поглощение измеряют при 540 нм, используя стеклянную кювету толщиной 2 см.
Полученный результат превращают в мкмоли восстановленного сахара (как глюкоза), сравнивая со стандартной кривой для 2 мл 0,00-0,04% (масса/объем) растворов глюкозы, обработанных аналогичным образом раствором DNS.
В наблюдаемое поглощение для растворов ферментных реакций вносят поправку на неспецифическое поглощение, осуществляя реакцию, в которой DNS раствор добавляют к смеси перед добавлением ферментного раствора. Одну единицу активности целлюлазы определяют как количество фермента, которое продуцирует 1 мкмоль глюкозного эквивалента в минуту в условиях анализа (50°С и рН 5,0 или при других значениях рН).
1.2 Анализ целлобиогидролазы с использованием р-нитрофенил β-D-целлобиопиранозида
Анализ целлобиогидролазы основан на ферментном гидролизе р-нитрофенил β-D-целлобиопиранозида. Продукт реакции, р-нитрофенол, определяют колориметрически.
Раствор, содержащий 1 мл 0,1% (масса/объем) р-нитрофенил β-D-целлобиопиранозида в дистиллированной воде; 1 мл дистиллированной воды; 1 мл 0,2 М натрийацетатного буфера, рН 5,0; 1 мл соответствующим образом разбавленного ферментного раствора инкубируют при 50°С в течение 30 минут. Ферментную реакцию останавливают, добавляя 4 мл 0,4 М раствора глицина. Этот раствор перемешивают и охлаждают до 20°С. Поглощение измеряют на 400 нм, используя стеклянную кювету толщиной 1 см.
Полученный результат превращают в мкмоли р-нитрофенола, сравнивая с коэффициентом молярной экстинкции р-нитрофенола в этих же условиях.
В наблюдаемое поглощение для растворов ферментных реакций вносят поправку на неспецифическое поглощение, осуществляя реакцию, в которой раствор глицина добавляют к смеси перед добавлением ферментного раствора. Одну единицу активности целлобиогидролазы определяют как количество фермента, которое продуцирует 1 мкмоль р-нитрофенола из р-нитрофенил β-D-целлобиопиранозида в минуту в условиях анализа (50°С и рН 5,0).
1.3. Анализ β-глюкозидазы с использованием р-нитрофенил β-D-глюкопиранозида
Анализ β-глюкозидазы основан на ферментном гидролизе р-нитрофенил β-D-глюкопиранозида. Продукт реакции, р-нитрофенол, определяют колориметрически.
Раствор, содержащий 1 мл 0,1% (масса/объем) р-нитрофенил β-D-глюкопиранозида в дистиллированной воде; 1 мл дистиллированной воды; 1 мл 0,2 М натрийацетатного буфера, рН 5,0; 1 мл соответствующим образом разбавленного ферментного раствора инкубируют при 50°С в течение 30 минут. Ферментную реакцию останавливают, добавляя 4 мл 0,4 М раствора глицина. Этот раствор перемешивают и охлаждают до 20°С. Поглощение измеряют на 400 нм, используя стеклянную кювету толщиной 1 см.
Полученный результат превращают в мкмоли р-нитрофенола, сравнивая с коэффициентом молярной экстинкции р-нитрофенола в этих же условиях.
В наблюдаемое поглощение для растворов ферментных реакций вносят поправку на неспецифическое поглощение, осуществляя реакцию, в которой раствор глицина добавляют к смеси перед добавлением ферментного раствора. Одну единицу активности β-глюкозидазы определяют как количество фермента, которое продуцирует 1 мкмоль р-нитрофенола из р-нитрофенил β-D-глюкопиранозида в минуту в условиях анализа (50°С и рН 5,0).
1.4. Анализ эндо-1,3(4)-β-глюканазы с использованием DNS и β-глюкана ячменя
Анализ активности эндо-1,3(4)-β-глюканазы основан на ферментном гидролизе гликозидных связей в β-глюкане ячменя, β-1,3(4)-глюкане. Продукты реакции, олигосахариды β-1,3(4)-глюкана, определяют по конечному увеличению уровня восстановления (как глюкозы).
Раствор, содержащий 1 мл 1% (масса/объем) раствора β-глюкана ячменя в 0,1 М натрийацетатном буфере, рН 5,0 (или при других значениях рН); 1 мл соответствующим образом разбавленного ферментного раствора инкубируют при 50°С в течение 10 минут. Ферментную реакцию останавливают, добавляя 2 мл DNS раствора (1% (масса/объем)) 3,5-динитросалициловой кислоты, 1,6% (масса/объем) гидроксида натрия, 30% (масса/объем) калий натрий (+)-тартрата в дистиллированной воде). Этот раствор перемешивают и помещают в баню с кипящей водой (минимум 95°С) на 5 минут, затем охлаждают до 25°С. К раствору добавляют 10 мл дистиллированной воды, и поглощение измеряют при 540 нм, используя стеклянную кювету толщиной 2 см.
Полученный результат превращают в мкмоли восстановленного сахара (как глюкозы), сравнивая со стандартной кривой для 2 мл 0,00-0,04% (масса/объем) растворов глюкозы, обработанных аналогичным образом раствором DNS.
В наблюдаемое поглощение для растворов ферментных реакций вносят поправку на неспецифическое поглощение, осуществляя реакцию, в которой DNS раствор добавляют к смеси перед добавлением ферментного раствора. Одну единицу активности эндо-1,3(4)-β-глюканазы определяют как количество фермента, которое продуцирует 1 мкмоль глюкозного эквивалента в минуту в условиях анализа (50°С и рН 5,0 или при других значениях рН).
1.5. Анализ эндо-1,3(4)-β-глюканазы с использованием β-глюкана азо-ячменя
Анализ активности эндо-1,3(4)-β-глюканазы основан на ферментном гидролизе β-глюкана ячменя, у которого имеется связанный хромофор (β-глюкан азо-ячменя). Продукты реакции, олигомеры, которые растворимы после осаждения этанолом, определяют по наблюдаемому увеличению поглощения при 590 нм.
Раствор, содержащий 0,5 мл субстрата β-глюкана азо-ячменя (в форме, готовой для использования) и 0,2 мл разбавления фермента (содержащего от 0,15 до 0,60 ед/мл в CMC в 0,01 М натрийацетатном буфере, рН 4,6), инкубируют при 30°С точно в течение 20 минут. Ферментную реакцию останавливают, добавляя 2,5 мл осаждающего раствора (содержащего 18,1 г ацетата натрия и 3,0 г цинковой смеси, перемешанных в 300 мл стакане с дистиллированной водой, рН доводят до 5,0 соляной кислотой, переносят содержимое в 1 л мерную колбу и доводят до нужного объема 96% (объем/объем) этанолом). Раствор перемешивают и оставляют при комнатной температуре на 10 минут. Раствор переносят в центрифужную ампулу и центрифугируют при 1000 д в течение 10 минут в лабораторной центрифуге. Поглощение надосадочной жидкости измеряют при 590 нм, используя стеклянную кювету толщиной 1 см.
В наблюдаемое поглощение для растворов ферментных реакций вносят поправку на неспецифическое поглощение, осуществляя реакцию, в которой осаждающий раствор добавляют к смеси перед добавлением ферментного раствора. Одну единицу активности эндо-1,3(4)-β-глюканазы определяют как количество фермента, которое гидролизует субстрат, обеспечивая величину поглощения 0,820 ед при 590 нм, используя стандартный субстрат в условиях анализа (30°С и рН 4,6).
1.6. Анализ ламинариназы (эндо-1,3-β-глюканазы) с использованием DNS и ламинарина
Анализ активности ламинариназы (эндо-1,3-β-глюканазы) основан на ферментном гидролизе гликозидных связей в ламинарине, β-1,3-глюкане. Продукты реакции, олигосахариды β-1,3-глюкана, определяют по конечному увеличению уровня восстановления (как глюкозы).
Раствор, содержащий 1 мл 1% (масса/объем) раствора ламинарина в 0,1 М натрийацетатном буфере, рН 5,0; 1 мл соответствующим образом разбавленного ферментного раствора инкубируют при 50°С в течение 10 минут. Ферментную реакцию останавливают, добавляя 2 мл DNS раствора (1% (масса/объем)) 3,5-динитро-салициловой кислоты, 1,6% (масса/объем) гидроксида натрия, 30% (масса/объем) калий натрий (+)-тартрата в дистиллированной воде). Этот раствор перемешивают и помещают в баню с кипящей водой (минимум 95°С) на 5 минут, затем охлаждают до 25°С. К раствору добавляют 10 мл дистиллированной воды, и поглощение измеряют при 540 нм, используя стеклянную кювету толщиной 2 см.
Полученный результат превращают в мкмоли восстановленного сахара (как глюкозы), сравнивая со стандартной кривой для 2 мл 0,00-0,04% (масса/объем) растворов глюкозы, обработанных аналогичным образом раствором DNS.
В наблюдаемое поглощение для растворов ферментных реакций вносят поправку на неспецифическое поглощение, осуществляя реакцию, в которой DNS раствор добавляют к смеси перед добавлением ферментного раствора. Одну единицу активности ламинариназы определяют как количество фермента, которое продуцирует 1 мкмоль глюкозного эквивалента в минуту в условиях анализа (50°С и рН 5,0).
1.7. Анализ эндо-1,4-β-ксиланазы с использованием DNA и ксилана древесины березы
Анализ активности эндо-1,4-β-ксиланазы основан на ферментном гидролизе ксилозидных связей в ксилане древесины березы, β-1,4 ксилане. Продукты реакции, олигосахариды β-1,4-ксилана, определяют по конечному увеличению уровня восстановления (как ксилозы).
Раствор, содержащий 1 мл 1% (масса/объем) раствора ксилана древесины березы в 0,1 М натрийацетатном буфере, рН 5,0 (или при других значениях рН); 1 мл соответствующим образом разбавленного ферментного раствора инкубируют при 50°С в течение 10 минут. Ферментную реакцию останавливают, добавляя 2 мл DNS раствора (1% (масса/объем)) 3,5-динитросалициловой кислоты, 1,6% (масса/объем) гидроксида натрия, 30% (масса/объем) калий натрий (+)-тартрата в дистиллированной воде). Этот раствор перемешивают и помещают в баню с кипящей водой (минимум 95°С) на 5 минут, затем охлаждают до 25°С. К раствору добавляют 10 мл дистиллированной воды, и поглощение измеряют при 540 нм, используя стеклянную кювету толщиной 2 см.
Полученный результат превращают в мкмоли восстановленного сахара (как ксилозы), сравнивая со стандартной кривой для 2 мл 0,00-0,03% (масса/объем) растворов ксилозы, обработанных аналогичным образом раствором DNS.
В наблюдаемое поглощение для растворов ферментных реакций вносят поправку на неспецифическое поглощение, осуществляя реакцию, в которой DNS раствор добавляют к смеси перед добавлением ферментного раствора. Одну единицу активности эндо-1,4-β-ксиланазы определяют как количество фермента, которое продуцирует 1 мкмоль ксилозного эквивалента в минуту в условиях анализа (50°С и рН 5,0 или при других значениях рН).
1.8. Анализ эндо-1,4-β-ксиланазы с использованием DNS и арабиноксилана пшеницы
Анализ активности эндо-1,4-β-ксиланазы основан на ферментном гидролизе ксилозидных связей в арабиноксилане пшеницы, арабинозой замещенном β-1,4-ксилане. Продукты реакции, олигосахариды арабино-β-1,4-ксилана, определяют по конечному увеличению уровня восстановления (как ксилозы).
Раствор, содержащий 1 мл 1% (масса/объем) раствора арабиноксилана в 0,1 М натрийацетатном буфере, рН 5,0 (или при других значениях рН); 1 мл соответствующим образом разбавленного ферментного раствора инкубируют при 50°С в течение 10 минут. Ферментную реакцию останавливают, добавляя 2 мл DNS раствора (1% (масса/объем)) 3,5-динитросалициловой кислоты, 1,6% (масса/объем) гидроксида натрия, 30% (масса/объем) калий натрий (+)-тартрата в дистиллированной воде). Этот раствор перемешивают и помещают в баню с кипящей водой (минимум 95°С) на 5 минут, затем охлаждают до 25°С. К раствору добавляют 10 мл дистиллированной воды, и поглощение измеряют при 540 нм, используя стеклянную кювету толщиной 2 см.
Полученный результат превращают в мкмоли восстановленного сахара (как ксилоза), сравнивая со стандартной кривой для 2 мл 0,00-0,03% (масса/объем) растворов ксилозы, обработанных аналогичным образом раствором DNS.
В наблюдаемое поглощение для растворов ферментных реакций вносят поправку на неспецифическое поглощение, осуществляя реакцию, в которой DNS раствор добавляют к смеси перед добавлением ферментного раствора. Одну единицу активности эндо-1,4-β-ксиланазы определяют как количество фермента, которое продуцирует 1 мкмоль ксилозного эквивалента в минуту в условиях анализа (50°С и рН 5,0 или при других значениях рН).
1.9. Анализ эндо-1,4-β-ксиланазы вискозиметрическим способом с использованием арабиноксилана пшеницы
Анализ активности эндо-1,4-β-ксиланазы основан на ферментном гидролизе стандартного раствора арабиноксилана пшеницы, причем активность определяют по уменьшению относительной вязкости в зависимости от времени.
Раствор, содержащий 1 мл 1% (масса/объем) раствора арабиноксилана пшеницы в 0,1 М натрийацетатном буфере, рН 5,5 (или при других значениях рН); 3 мл дистиллированной воды и 1 мл соответствующим образом разбавленного ферментного раствора вводят в микровискозиметр Haake (используя золотой шарик, калиброванный до 0,1-2,0 мПа·сек), и измеряют время падения шарика (Ттест) (в мсек относительно определенной высоты падения) каждые 30 сек на протяжении 15-20 минут при 30°С. Средние времена падения шарика измеряют для воды (5 мл дистиллированной воды) и субстратного (1 мл 1% (масса/объем) раствора арабиноксилана пшеницы в 0,1 М натрийацетатном буфере, рН 5,5 и 4 мл дистиллированной воды) как Твода и Тсубстрат, соответственно. Проводят контрольные измерения аналогичным образом. Относительную текучесть (Fr) рассчитывают для каждого значения Ттест следующим образом:
Наклон кривой Fr в зависимости от времени (прошедшее время, при котором проведено каждое измерение Ттест), рассчитывают как изменение относительной вязкости в минуту (ΔFr/мин), и оно пропорционально концентрации фермента.
Одну единицу активности эндо-1,4-β-ксиланазы определяют как количество фермента, которое гидролизует субстрат, уменьшая вязкость раствора, обеспечивая изменение относительной текучести в 1 (безразмерная единица) в минуту в условиях анализа (30°С и рН 5,5 или при других значениях рН).
1.10. Анализ β-ксилозидазы с использованием р-нитрофенил-β-ксилопиранозида
Анализ β-ксилозидазы основан на ферментном гидролизе р-нитрофенил β-D-ксилопиранозида. Продукт реакции, р-нитрофенол, определяют колориметрически.
Раствор, содержащий 1 мл 0,1% (масса/объем) р-нитрофенил-β-D-ксилопиранозида в дистиллированной воде; 1 мл дистиллированной воды; 1 мл 0,2 М натрийацетатного буфера, рН 5,0; 1 мл соответствующим образом разбавленного ферментного раствора инкубируют при 50°С в течение 30 минут. Ферментную реакцию останавливают, добавляя 4 мл 0,4 М раствора глицина. Этот раствор перемешивают и охлаждают до 20°С. Поглощение измеряют при 400 нм, используя стеклянную кювету толщиной 1 см.
Полученный результат превращают в мкмоли р-нитрофенола, сравнивая с коэффициентом молярной экстинкции р-нитрофенола в этих же условиях.
В наблюдаемое поглощение для растворов ферментных реакций вносят поправку на неспецифическое поглощение, осуществляя реакцию, в которой раствор глицина добавляют к смеси перед добавлением ферментного раствора. Одну единицу активности ксилозидазы определяют как количество фермента, которое продуцирует 1 мкмоль р-нитрофенола из р-нитрофенил-β-D-ксилопиранозида в минуту в условиях анализа (50°С и рН 5,0).
1.11. Анализ α-N-арабинофуранозидазы с использованием р-нитрофенил α-L-арабинофуранозида
Анализ α-N-арабинофуранозида (арабинофуранозида) основан на ферментном гидролизе р-нитрофенил α-L-арабинофуранозида. Продукт реакции, р-нитрофенол, определяют колориметрически.
Раствор, содержащий 1 мл 0,1% (масса/объем) р-нитрофенил α-L-арабинофуранозида в дистиллированной воде; 1 мл дистиллированной воды; 1 мл 0,2 М натрийацетатного буфера, рН 5,0; 1 мл соответствующим образом разбавленного ферментного раствора инкубируют при 50°С в течение 30 минут. Ферментную реакцию останавливают, добавляя 4 мл 0,4 М раствора глицина. Этот раствор перемешивают и охлаждают до 20°С. Поглощение измеряют на 400 нм, используя стеклянную кювету толщиной 1 см.
Полученный результат превращают в мкмоли р-нитрофенола, сравнивая с коэффициентом молярной экстинкции р-нитрофенола в этих же условиях.
В наблюдаемое поглощение для растворов ферментных реакций вносят поправку на неспецифическое поглощение, осуществляя реакцию, в которой раствор глицина добавляют к смеси перед добавлением ферментного раствора. Одну единицу активности арабинофуранозидазы определяют как количество фермента, которое продуцирует 1 мкмоль р-нитрофенола из р-нитрофенил α-L-арабинофуранозида в минуту в условиях анализа (50°С и рН 5,0).
1.12. Аналиа ферулоил-эстеразы FAXX методом
Анализ ферулоил-эстеразы (эстеразы феруловой кислоты) основан на ферментном гидролизе O-[5-O-(транс-ферулоил)-α-L-арабинофуранозил]-(1→3)-O-β-D-ксилопиранозил-(1→4)-D-ксилопиранозы (FAXX). FAXX получают из ферментативно гидролизованных пшеничных отрубей, очищают и характеризуют с помощью ЯМР. FAXX гидролиз определяют спектрофотометрически.
Ферментативную реакцию соблюдают при длине волны 325 нм, используя кювету толщиной 1 см, в растворе, содержащем 0,050 мМ FAXX в 0,1 М MOPS буфере, рН 6,0 при 37°С.
Одну единицу активности ферулоил-эстеразы на FAXX определяют как количество фермента, которое превращает 1 мкмоль субстрата в продукт в минуту в условиях анализа (37°С и рН 6,0).
1.13. Анализ ферулоил-эстеразы с помощью Ara2F
Анализ ферулоил-эстеразы (эстеразы феруловой кислоты) основан на ферментативном гидролизе Ara2F (феруловая кислота, связанная по 1,2 с арабинозой). Ara2F получают из ферментативно гидролизованной пульпы сахарной свеклы, очищают и характеризуют с помощью ЯМР. Ara2F гидролиз определяют спектрофотометрически.
Ферментативную реакцию наблюдают при длине волны 325 нм, используя кювету толщиной 1 см, в растворе, содержащем 0,050 мМ Ara2F в 0,1 М MOPS буфере, рН 6,0 при 37°С.
Одну единицу активности ферулоил-эстеразы на Ara2F определяют как количество фермента, которое превращает 1 мкмоль субстрата в продукт в минуту в условиях анализа (37°С и рН 6,0).
1.14. Анализ ферулоил-эстеразы с использованием гидролиза метиловых сложных эфиров: метилферуловой кислоты (MFA); метилкофеиновой кислоты (МСА); метилсинаповой кислоты (MSA); метил-р-кумаровой кислоты (MpCA)
Анализ ферулоил-эстеразы (эстеразы феруловой кислоты) основан на ферментативном гидролизе метиловых сложных эфиров феруловой кислоты (MFA); кофеиновой кислоты (МСА); синаповой кислоты (MSA); и р-кумаровой кислоты (МрСА). Гидролиз метиловых сложных эфиров определяют в 0,1 М MOPS буфере, рН 6,0 при 37°С. Анализ основан на двух различных методиках.
В спектрофотометрическом способе концентрация субстрата метиловых сложных эфиров составляет 0,10 мМ, и за гидролизом сложных эфиров наблюдают при длине волны 325 нм, используя кювету толщиной 1 см. В этом способе начальная концентрация субстрата ограничена.
В способе с использованием ВЭЖХ концентрация субстрата метиловых сложных эфиров составляет 1,0 мМ, и за гидролизом сложных эфиров следят, измеряя выделение свободной кислоты с помощью ВЭЖХ с 10-30 минутными интервалами. В этом способе нет ограничения по концентрации субстрата, и измеряемые активности значительно выше, нежели концентрации, определяемые спектрофотометрически.
Одну единицу активности ферулоил-эстеразы определяют как количество фермента, которое превращает 1 мкмоль субстрата в продукт в минуту в условиях анализа (37°С и рН 6,0).
1.15. Определение концентрации протеина с помощью модифицированного анализа Bradford связывания протеина с Coomassie blue
Анализ концентрации протеина основан на модифицированном анализе Bradford связывания протеина с Coomassie blue с использованием Brilliant Blue G (кумасси брильянтовый голубой), измеряемом спектрофотометрически при длине волны 595 нм, используя кювету толщиной 1 см. Этот способ (Sigma В 6916) стандартизован с использованием альбумина быч