Производные индолил-3-глиоксиловой кислоты - соединения, обладающие противоопухолевой активностью, фармацевтическая композиция, противоопухолевое средство (варианты)
Иллюстрации
Показать всеИзобретение относится к применению N-замещенных индол-3-глиоксиламидов в качестве противоопухолевых средств. Соединения могут быть использованы в форме физиологически приемлемых кислотно-аддитивных солей или N-оксидов. В качестве подходящих лекарственных форм для введения используют таблетки, драже, капсулы, растворы для вливания или ампулы, суппозитории, пластыри, композиции для ингаляции, суспензии, кремы и мази. Технический результат заключается в расширении ассортимента противоопухолевых лекарственных средств. 4 н. и 6 з.п. ф-лы, 3 ил., 6 табл.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области фармацевтической химии, в частности к индолил-3-глиоксиламидам, которые широко применяются в качестве фармакодинамических активных соединений и исходных синтетических производных.
Уровень техники
В заявке на выдачу патента Нидерландов 6502481 описаны соединения, которые характеризуются противовоспалительным, жаропонижающим действием и аналгезирующей активностью.
В заявке на выдачу патента Великобритании GB-PS 1028812 упоминаются производные индолил-3-глиоксиловой кислоты и ее амид в качестве соединений, обладающих аналгезирующим, противосудорожным и β-адренергическим действием.
В статье G. Domschke и соавт. (Ber. (1961), т.94, стр.2353) описан 3-индолилглиоксиламид без фармакологических характеристик.
В статье Е. Walton (J. Med. Chem. (1968) т.11, стр.1252) описаны производные индолил-3-глиоксиловой кислоты, являющиеся ингибиторами глицерофосфатдегидрогеназы и лактатдегидрогеназы.
В Европейском патенте ЕР 675110 описаны 1H-индол-3-глиоксиламиды, которые используются в качестве ингибиторов sPLA2 (фосфолипазы А2) для лечения септического шока, панкреатита, аллергического ринита и ревматического артрита.
Сущность изобретения
Целью настоящего изобретения является получение N-замещенных индол-3-глиоксиламидов, обладающих противоопухолевым действием, и расширение спектра имеющихся лекарственных средств.
Упомянутые соединения уже известны в качестве лекарственных средств, которые согласно патенту DE-OS 19636150 А1 обладают противоастматическим, противоаллергическим и иммунодепрессантным/иммуномодулирующим действием.
В связи с этим объектами изобретения являются применение N-замещенных индол-3-глиоксиламидов общей формулы 1 для производства противоопухолевых средств, противоопухолевые средства, содержащие активное соединение формулы 1, и их использование при лечении опухолевых заболеваний
где остатки R, R1, R2, R3, R4 и Z имеют следующие значения:
R означает водород, (С1-С6)алкил, причем алкильная группа может быть одно- или многократно замещенной фенильным кольцом и упомянутое фенильное кольцо, в свою очередь, одно- или многократно замещено следующими группами: галоген, (С1-C6)алкил, (С3-С7)циклоалкил, карбоксильные группы, карбоксильные группы, этерифицированные (C1-С6)алканолами, трифторметильные группы, гидроксильные группы, метоксигруппы, этоксигруппы, бензилоксигруппы, а также бензильной группой, фенильный фрагмент которой может быть одно- или многократно замещен (С1-C6)алкильными группами, атомами галогена или трифторметильными группами;
R кроме того, означает бензилоксикарбонильную группу (Z-группу) и трет-бутоксикарбонильный остаток (ВОС-остаток), кроме того, означает ацетильную группу;
R1 может означать фенильное кольцо, одно- и многократно замещенное следующими группами: (С1-С6)алкил, (С1-С6)алкокси, циано, галоген, трифторметил, гидрокси, бензилокси, нитро, амино, (С1-С6)алкиламино, (С1-С6)алкоксикарбониламино и карбоксильная группа, или карбоксильная группа, этерифицированная (С1-С6)алканолом; или R1 может означать остаток пиридина формулы 2 и его N-оксид
причем остаток пиридина по выбору присоединен через циклический атом углерода в положении 2, 3 и 4 и может быть замещен заместителями R5 и R6. Остатки R5 и R6 могут быть одинаковыми или различными и могут означать (С1-С6)алкил, а также (С3-C7)циклоалкил, (С1-C6)алкокси, нитро, амино, гидрокси, галоген и трифторметил и, кроме того, означают остаток этоксикарбониламина, а также карбоксиалкилокси группу, в которой алкильная группа содержит 1-4 атома углерода;
R1 кроме того, может означать 2- или, соответственно, 4-пиримидинильный гетероцикл, в котором 2-пиримидинильное кольцо может быть одно- или многократно замещено метильной группой; и, кроме того, может означать 2-, 3-, 4- и 8-хинолильный остаток, замещенный следующими группами: (С1-C6)алкил, галоген, нитро, амино и (С1-С6)алкиламино; и 2-, 3- и 4-хинолилметильную группу, причем циклические атомы углерода в пиридилметильном фрагменте хинолильного остатка и хинолилметильного остатка могут быть замещены следующими группами: (С1-С6)алкил, (С1-С6)алкокси, нитро, амино и (С1-С6)алкоксикарбониламино;
R1 кроме того, в случае, если R означает водород, метильную или бензильную группу, а также бензилоксикарбонильный остаток (Z-группу), трет-бутоксикарбонильный остаток (ВОС-группу) и ацетильную группу, может означать следующие группы: -CH2COOH, -СН(СН3)-СООН, -(СН3)2-СН-(СН2)2-СН-СОО-, Н3С-Н2С-СН(СН3)-СН(СООН)-, НО-Н2С-СН(СООН)-, фенил-СН3-СН(СООН)-, (4-имидазолил)-СН2-СН-(СООН)-, HN=С(NH2)-NH-(CH2)3-CH(COOH)-, H2N-(CH2)4-CH(COOH)-, H2N-CO-CH2-CH-(COOH)-, НООС-(СН2)2-СН(СООН)-;
R1 кроме того, в случае, если R означает водород, Z-группу, ВОС-группу, ацетильную или бензильную группу, может означать кислотный остаток природной или неприродной аминокислоты, например, такой как α-глицил, α-саркозил, α-аланил, α-лейцил, α-изолейцил, α-серил, α-фенилаланил, α-гистидил, α-пролил, α-аргинил, α-лизил, α-аспарагил и α-глутамил остатки, причем аминогруппы в упомянутых аминокислотных остатках могут быть свободными или защищенными. В, качестве защитных групп для блокирования аминогрупп могут быть использованы описанные выше Z-группа и ВОС-группа, а также ацетильная группа. Если R1 означает остатки аспарагил или глутамил, то вторая несвязанная карбоксильная группа может быть свободной или в виде сложного эфира с (С1-С6)алканолами, например, в виде метилового, этилового или, соответственно, трет-бутилового эфира.
Кроме того, R1 может означать аллиламинокарбонил-2-метилпроп-1-ил. R и R1, кроме того, могут быть объединены с атомом азота, к которому они присоединены, с образованием пиперазинового цикла формулы 3 или гомопиперазинового цикла, если R1 означает аминоалкиленовую группу, то упомянутые остатки образуют
R7 означает алкил, фенильное кольцо, которое может быть одно- или многократно замещено следующими группами:
(С1-C6)алкил, (С1-С6)алкокси, галоген, нитро, амино и (С1-С6)алкиламино. R7, кроме того, означает бензгидрильную группу и бис-п-фторбензилгидрильную группу, либо 4-пиридинил.
R2 может означать водород и (С1-С6)алкил, причем алкильная группа может быть одно- или многократно замещена галогеном или фенильной группой, которая, в свою очередь, может быть одно- или многократно замещена следующими группами: галоген, (С1-C6)алкил, (С3-С7)циклоалкил; карбоксильные группы, этерифицированные (С1- С6)алканолами; трифторметильные группы, гидроксильные группы, метоксигруппы, этоксигруппы или бензилоксигруппы. Кроме того, если R2 означает (С1-С6)алкил, то данная группа может быть замещена остатками 2-хинолил или 2-, 3- и 4-пиридил, которые, в свою очередь, могут быть одно- или многократно замещены галогеном, (С1-С4)алкильной группой или (С1-С4)алкокси-группой. R2, кроме того, означает ароил, причем арильный фрагмент в данном остатке представлен фенильным кольцом, которое может быть одно- или многократно замещено следующими группами: галоген, (С1-С6)алкил, (С3-С7)циклоалкил, карбоксильные группы, этерифицированные (С1-C6)алканолами, трифторметильные группы, гидроксильные группы, метоксигруппы, этоксигруппы или бензилоксигруппы;
R3 и R4 могут быть одинаковыми или различными и означают водород, (С1-С6)алкил, (С3-C7)циклоалкил, (С1-C6)алканоил, (С1-С6)алкокси, галоген и бензилокси. Кроме того, R3 и R4 могут означать нитрогруппу, аминогруппу, (С1-С4)моно- или диалкилзамещенную аминогруппу и (С1-С6)алкоксикарбонил-аминогруппу или (С1-C6)алкоксикарбониламино(C1-C6)алкильную группу;
Z означает О и S.
Термины "алкил-, алканол-, алкокси- или алкиламиногруппы", использованные для обозначения остатков R, R1, R2, R3, R4, R5, R6, R7, как правило, означают как линейные, так и разветвленные алкильные группы, причем линейные алкильные группы означают, например, метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, а разветвленные алкильные группы означают, например, изопропил или трет-бутил. Термин "циклоалкил" означает, например, циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.
Термин "галоген" означает фтор, хлор, бром или иод. Термин "алкоксигруппа" означает остатки, такие как метокси, этокси, пропокси, бутокси, изопропокси, изобутокси или пентокси.
Соединения могут быть использованы в форме кислотно-аддитивных солей, например в форме солей неорганических кислот, таких как соляная кислота, серная кислота, фосфорная кислота, в форме солей органических кислот, таких как уксусная кислота, молочная кислота, малоновая кислота, малеиновая кислота, фумаровая кислота, глюконовая кислота, глюкуроновая кислота, лимонная кислота, эмбоновая кислота, метансульфоновая кислота, трифторуксусная кислота, янтарная кислота и 2-гидроксиэтансульфоновая кислота.
Соединения формулы 1, а также их соли проявляют биологическую активность. Соединения формулы 1 можно вводить в свободной форме или в форме их солей физиологически переносимых кислот.
Введение можно осуществлять пероральным, парентеральным, внутривенным, чрескожным или ингаляционным методом.
Изобретение, кроме того, относится к фармацевтическим композициям, содержащим по крайней мере одно соединение формулы 1 или его соль физиологически переносимой неорганической или органической кислоты и при необходимости фармацевтически приемлемые носитель и/или разбавитель или вспомогательное вещество.
В качестве подходящих форм для введения используют, например, таблетки, драже, капсулы, растворы для вливания или ампулы, суппозитории, пластыри, композиции для ингаляции, суспензии, кремы и мази.
Фармацевтические композиции по настоящему изобретению могут быть получены способами, известными в данной области техники, например, путем обычного смешивания, растворения, гранулирования, дражирования, растирания в порошок, эмульгирования, инкапсулирования, включения в полимерные материалы и лиофилизации. Фармацевтические композиции для применения по настоящему изобретению можно получить с помощью общепринятых способов с использованием по меньшей мере одного физиологически приемлемого носителя, включая наполнители и вспомогательные средства. Состав композиции зависит от требуемого способа введения. Для инъекций соединения по изобретению получают в виде водных растворов, предпочтительно в физиологически совместимых буферных растворах, таких как раствор Хенкса, раствор Рингера или физиологический раствор. Для чресслизистого введения в композицию вводят смачивающие агенты, способствующие проникновению через биологический барьер. Для перорального введения в состав композиции могут быть включены активные соединения в смеси с фармацевтически приемлемыми носителями, хорошо известными специалистам. Такие носители позволяют получать соединения по изобретению, в частности, в виде следующих лекарственных форм, предназначенных для приема внутрь: таблетки, пилюли, лепешки, драже, капсулы, растворы, гели, взвеси, суспензии и т.п. Композиции для перорального применения получают с использованием твердого наполнителя, необязательно с измельчением полученной смеси, и обработкой смеси гранул после добавления при необходимости других вспомогательных материалов, для получения таблеток или ядер драже. Подходящими наполнителями являются, прежде всего, сахара, включая лактозу, сахарозу, маннит или сорбит, производные целлюлозы, такие как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, и прочие материалы, такие как желатин, трагакант, метилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, и/или поливинилпирролидон (ПВП). При необходимости могут быть добавлены дезинтегрирующие агенты, такие как сшитый поливинилпирролидон или агар. Для покрытия ядер используют концентрированные растворы сахаров, которые могут содержать аравийскую камедь, тальк, поливинилпирролидон, полиэтиленгликоль, и/или диоксид титана, и пригодные органические растворители или смеси растворителей. С целью идентификации или маркировки различных комбинаций доз активного компонента в покрытие таблеток или драже могут быть добавлены красители или пигменты. Лекарственные формы для перорального применения включают штампованные капсулы из желатина, а также мягкие заплавленные капсулы из желатина и пластификатора, такого как глицерин или сорбит. Капсулы могут содержать активные компоненты в смеси с наполнителем, таким как лактоза, связующим компонентом, таким как крахмал, и/или замасливателем, таким как тальк или стеарат магния. В мягких капсулах активные компоненты могут быть растворены или суспендированы в подходящих жидкостях, таких как жидкий парафин или жидкие полиэтиленгликоли. Кроме того, в эти композиции могут быть добавлены стабилизаторы.
Перечень фигур чертежей
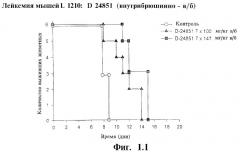
На Фиг.1.1 и 1.2 продемонстрировано действие соединения согласно изобретению на лимфатическую лейкемию мышей.
На Фиг.2.1-2.10 представлены структура и свойства соединений, соответствующих изобретению, полученных согласно схеме реакций 1.
На Фиг.3.1 и 3.2 представлены структура и свойства соединений, соответствующих изобретению, полученных согласно схемам реакций 1 и 2.
Сведения, подтверждающие возможность осуществления изобретения
Способы получения соединений по изобретению представлены на схемах реакций 1 и 2, а также описаны в общем виде. Для получения всех соединений можно использовать описанные схемы реакции или использовать аналогичные способы.
Соединения общей формулы 1, где Z означает О, R1 означает арил, аралкил, гетероарил и гетероаралкил, а также где R2 означает алкил, аралкил и гетероаралкил, получают по следующей схеме 1:
Схема 1
Стадия 1
Производное индола, незамещенное или содержащее один или более заместителей в положении С-2 или в фенильном остатке, растворяют в протонном, диполярном апротонном или неполярном органическом растворителе, таком как изопропанол, тетрагидрофуран, диметилсульфоксид, диметилформамид, диметилацетамид, N-метилпирролидон, диоксан, толуол или хлористый метилен, и добавляют по каплям в трехгорлую колбу, содержащую приготовленную в атмосфере азота суспензию основания в молярном или избыточном количестве, такого как гидрид натрия, порошкообразный гидроксид калия, трет-бутилат калия, диметиламинопиридин или амид натрия в подходящем растворителе. Затем проводят реакцию, например, подходящего алкил-, аралкил- или гетероаралкилгалогенида, при необходимости в присутствии катализатора, такого как медь, в течение определенного времени, например от 30 мин до 12 ч, и поддерживают температуру в диапазоне от 0 до 120°С, предпочтительно от 30 до 80°С, более предпочтительно от 50 до 65°С. После завершения реакции реакционную смесь выливают в воду, раствор экстрагируют, например диэтиловым эфиром, дихлорметаном, хлороформом, метил-трет-бутиловым эфиром или тетрагидрофураном, и полученную органическую фазу сушат безводным сульфатом натрия. Органическую фазу концентрируют в вакууме, полученный остаток кристаллизуют путем растирания или очищают маслообразный остаток перекристаллизацией, дистилляцией или колоночной или, соответственно, экспресс-хроматографией на кизельгеле или оксиде алюминия. В качестве подвижной фазы используют, например, смесь дихлорэтан/диэтиловй эфир в соотношении 8:2 (об./об.) или смесь дихлорэтан/этанол в соотношении 9:1 (об./об.).
Стадия 2
N-замещенный индол, полученный согласно вышеописанной стадии 1, растворяют в атмосфере азота в апротонном или неполярном органическом растворителе, таком как диэтиловый эфир, метил-трет-бутиловый эфир, тетрагидрофуран, диоксан, толуол, ксилол, хлористый метилен или хлороформ, и к полученному в атмосфере азота раствору добавляют оксалилхлорид в количестве от эквимолярного до 60%-ного избытка в апротонном или неполярном растворителе, таком как диэтиловый эфир, метил-трет-бутиловый эфир, тетрагидрофуран, диоксан, толуол, ксилол, хлористый метилен, при этом температура реакции составляет от -5 до 20°C. Затем реакционную смесь нагревают при температуре от 10 до 130°С, предпочтительно от 20 до 80°С, более предпочтительно от 30 до 50°С, в течение от 30 мин до 5 ч и, наконец, упаривают растворитель. Полученный остаток, содержащий образовавшийся хлорангидрид индолил-3-глиоксиловой кислоты, растворяют в апротонном растворителе, таком как тетрагидрофуран, диоксан, диэтиловый эфир, толуол, или также в диполярном апротонном растворителе, таком как диметилформамид, диметилацетамид или диметилсульфоксид, охлаждают до температуры от 10 до -15°С, предпочтительно от -5 до 0°С, и смешивают в присутствии поглотителя кислоты с раствором первичного или вторичного амина в разбавителе. В качестве разбавителя можно использовать упомянутые растворители для растворения хлорангидрида индолил-3-глиоксиловой кислоты. В качестве поглотителя кислоты используют триэтиламин, пиридин, диметиламинопиридин, основную ионообменную смолу, карбонат натрия, карбонат калия, порошкообразный гидроксид калия, а также добавленный в избытке в реакционную смесь первичный или вторичный амин. Реакцию проводят при температуре от 0 до 120°С, предпочтительно от 20 до 80°С, более предпочтительно от 40 до 60°С. После проведения реакции в течение 1-3 ч и инкубирования реакционной смеси при комнатной температуре в течение 24 ч гидрохлорид поглотителя кислоты отфильтровывают, фильтрат концентрируют в вакууме и остаток перекристаллизовывают из органического растворителя или очищают хроматографией на колонке с кизельгелем или оксидом алюминия. В качестве подвижной фазы используют, например, смесь дихлометан/этанол (95:5 об./об.).
Примеры
Согласно данному общему описанию стадий 1 и 2, представленных на схеме синтеза 1, синтезируют следующие соединения, которые определены с указанием соответствующей химической структуры в представленных ниже таблицах. В Таблицах 1.1-1.10 на Фиг.2.1-2.10 представлены структуры этих соединений общей формулы 1 с указанием структуры заместителей R4 и Z и температуры плавления.
Пример 1. N-(Пиридин-4-ил)-[1-(4-фторбензил)индол-3-ил]глиоксиламид (D 24241)
Стадия 1
1-(4-Фторбензил)индол
К смеси 2,64 г гидрида натрия (0,11 моль, суспензия в минеральном масле) и 100 мл диметилсульфоксида добавляют раствор 11,72 г (0,1 моль) индола в 50 мл диметилсульфоксида. Реакционную смесь нагревают при 60°С в течение 1,5 ч, затем охлаждают и по каплям добавляют 15,9 г (0,11 моль) 4-фторбензилхлорида. Раствор нагревают до 60°С, инкубируют в течение ночи, затем выливают при перемешивании в 400 мл воды. Реакционную смесь несколько раз экстрагируют хлористым метиленом (общий объем растворителя составляет 150 мл), органическую фазу сушат безводным сульфатом натрия, отфильтровывают и фильтрат концентрируют в вакууме. Остаток перегоняют в высоком вакууме, при этом получают 21,0 г (96% от теории) целевого продукта. Т.кип.(0,5 мм): 140°С.
Стадия 2
N-(Пиридин-4-ил)-[1-(4-фторбензил)индол-3-ил]глиоксиламид (D 24241)
К раствору 2,25 мл оксалилхлорида в 25 мл эфира при 0°С в атмосфере азота по каплям добавляют раствор 4,75 г (21,1 ммоль) 1-(4-фторбензил)индола в 25 мл эфира. Реакционную смесь нагревают с обратным холодильником в течение 2 ч, затем растворитель упаривают. К остатку добавляют 50 мл тетрагидрофурана, раствор охлаждают до -5°С и по каплям добавляют раствор 4,66 г (49,5 ммоль) 4-аминопиридина в 200 мл ТГФ. Реакционную смесь кипятят с обратным холодильником в течение 3 ч, затем инкубируют в течение ночи при комнатной температуре. Гидрохлорид 4-аминопиридина отфильтровывают, осадок промывают ТГФ, фильтрат концентрируют в вакууме и остаток перекристаллизовывают из этилацетата.
Выход: 7,09 г (90% от теории)
Т пл.: 225-226°С
Элементный анализ:
рассчитано С 70,77 Н 4,32 N 11,25
найдено С 71,09 Н 4,36 N 11,26
Пример 2. D 24242 N-(Пиридин-4-ил)-(1-метилиндол-3-ил)глиоксиламид
Пример 3. D 24834 N-(Пиридин-3-ил)-[1-(4-фторбензил)индол-3-ил]глиоксиламид
Пример 4. D 24835 N-(Пиридин-3-ил)-(1-бензилиндол-3-ил)глиоксиламид
Пример 5. D 24836 N-(Пиридин-3-ил)-[1-(2-хлорбензил)индол-3-ил]глиоксиламид
Пример 6. D 24840 N-(4-Фторфенил)-[1-(4-фторбензил)индол-3-ил]глиоксиламид
Пример 7. D 24841 N-(4-Нитрофенил)-[1-(4-фторбензил)индол-3-ил]глиоксиламид
Пример 8. D 24842 N-(2-Хлорпиридин-3-ил)-[1-(4-фторбензил)индол-3-ил]глиоксиламид
Пример 9. D 24843 N-(Пиридин-4-ил)-(1-бензилиндол-3-ил)глиоксиламид
Пример 10. D 24848 N-(Пиридин-4-ил)-[1-(3-пиридилметил)индол-3-ил]глиоксиламид
Пример 11. D 24849 N-(4-Фторфенил)-[1-(2-пиридилметил)индол-3-ил]глиоксиламид
Пример 12. D 24850 N-(4-Фторфенил)-[1-(3-пиридилметил)индол-3-ил]глиоксиламид
Пример 13. D 24851 N-(Пиридин-4-ил)-[1-(4-хлорбензил)индол-3-ил]глиоксиламид
Пример 14. D 24852 N-(Пиридин-4-ил)-[1-(2-хлорбензил)индол-3-ил]глиоксиламид
Пример 15. D 24853 N-(Пиридин-2-ил)-[1-(4-фторбензил)индол-3-ил]глиоксиламид
Пример 16. D 24847 N-(Пиридин-4-ил)-[1-(2-пиридилметил)индол-3-ил]глиоксиламид
Пример 17. D 24858 (4-Фенилпиперазин-1-ил)-[1-(4-фторбензил)индол-3-ил]глиоксиламид
Пример 18. D 24854 N-(Пиридин-2-ил)-(1-бензилиндол-3-ил)глиоксиламид
Пример 19. D 25421 N-(Пиридин-4-ил)-[1-(4-фторбензил)-6-этоксикарбониламиноиндол-3-ил]глиоксиламид
Пример 20. D 25422 N-(Пиридин-4-ил)-[1-(4-фторбензил)-5-этоксикарбониламиноиндол-3-ил]глиоксиламид
Пример 21. D 25423 N-(Пиридин-4-ил)-[1-(4-фторбензил)-6-циклопентилоксикарбониламиноиндол-3-ил]глиоксиламид
Пример 22. D 25420 4-(Пиридин-4-ил)пиперазин-1-ил)-[1-(4-фторбензил)индол-3-ил]глиоксиламид
Пример 23. D 24866 N-(3,4,5-Триметоксибензил)-N-(аллиламинокарбонил-2-метилпроп-1-ил)-[1-(4-фторбензил)индол-3-ил]глиоксиламид
Пример 24. N-(Пиридин-4-ил)-[1-(4-фторбензил)-5-метоксииндол-3-ил]глиоксиламид
Пример 25. N-(Пиридин-4-ил)-[1-(4-фторбензил)-5-этоксикарбониламинометилиндол-3-ил]глиоксиламид
Исходные соединения для синтеза соединений общей формулы 1, полученных по схеме 1 и указанных в Таблице 1
Для получения следующих соединений:
D 24241 D 24242 D 24834 D 24835
D 24836 D 24840 D 24841 D 24842
D 24843 D 24848 D 24849 D 24850
D 24851 D 24852 D 24853 D 24847
D 24858 D 24854 D 25420 D 25422
D 25421 D 25423 все исходные соединения имеются в продаже. Соединения общей формулы 1, где Z означает О, R1 означает арил, аралкил, гетероарил, гетероаралкил и аллиламинокарбонил-2-метилпроп-1-ил, а также R2 означает арил, аралкил и гетероаралкил, получают по схеме 2
Схема 2
Согласно приведенной выше схеме 2 получают соединения D 24241, D 24841, D 24840 и D 24834 (стадия 2 схемы реакции 2, см. также Таблицу 1), а также соответствующие промежуточные соединения D 24825, D 24831, D 24832 и D 24833 (стадия 1, схема 2, см. также Таблицу 2 на Фиг.3.1).
N-(Пиридин-4-ил)-[1-(4-фторбензил)индол-3-ил]глиоксиламид (D 24241)
Стадия 1
N-(Пиридин-4-ил)-(индол-3-ил)глиоксиламид
К раствору 9 мл оксалилхлорида в 100 мл безводного эфира при температуре 0°С по каплям добавляют раствор 10 г (85,3 ммоль) индола в 100 мл эфира. Реакционную смесь кипятят с обратным холодильником в течение 3 ч. Затем при температуре -5°С по каплям добавляют суспензию 12 г (127,9 ммоль) 4-аминопиридина в 500 мл тетрагидрофурана, реакционную смесь при перемешивании нагревают с обратным холодильником в течение 3 ч и инкубируют при комнатной температуре в течение ночи. Осадок отфильтровывают, промывают водой и высушенное соединение очищают хроматографией на колонке с кизельгелем (Kieselgel 60, Fa. Merck AG, Darmstadt), используя в качестве элюента смесь хлористый метилен/этанол (10:1, об./об.).
Выход: 9,8 г (43,3% от теории)
Т.пл.: от 250°С
Стадия 2:
N-(Пиридин-4-ил)-[1-(4-фторбензил)индол-3-ил]глиоксиламид (D 24241)
N-(Пиридин-4-ил)-(индол-3-ил)глиоксиламид, полученный на стадии 1, бензилируют с использованием 4-фторбензилхлорида согласно стадии бензилирования и выделяют полученное соединение D 24241.
Выход: 41% (от теории)
Т.пл.: 224-225°С
Элементный анализ:
рассчитано С 70,77 Н 4,32 N 11,25
найдено С 70,98 Н 4,40 N 11,49
Общий метод получения соединений общей формулы 1 согласно схеме 2
Стадия 1
К раствору, содержащему оксалилхлорид в количестве от эквимолярного до 60%-ного избытка, приготовленному в атмосфере азота в апротонном или неполярном растворителе, таком как диэтиловый эфир, метил-трет-бутиловый эфир, тетрагидрофуран, диоксан или дихлорметан, при температуре от -5 до +5°С по каплям добавляют производное индола, растворенное в одном из растворителей, например перечисленных выше для оксалилхлорида, причем упомянутое производное индола может быть незамещенным или замещенным в положении 2 фенильного кольца. Затем реакционную смесь нагревают в течение от 1 до 5 ч до температуры в интервале от 10 до 120°С, предпочтительно от 20 до 80°С, наиболее предпочтительно от 30 до 60°С, затем растворитель упаривают. Полученный остаток хлорангидрида (индол-3-ил)глиоксиловой кислоты растворяют или суспендируют в апротонном растворителе, таком как тетрагидрофуран, диоксан, диэтиловый эфир, толуол или в биполярном апротонном растворителе, таком как диметилформамид, диметилацетамид или диметилсульфоксид, охлаждают до температуры в интервале от -10 до +10°С, предпочтительно от -5 до 0°С, и смешивают в присутствии поглотителя кислоте раствором первичного или вторичного амина в разбавителе. В качестве разбавителя могут быть использованы растворители, использованные для растворения хлорангидрида индолил-3-глиоксиловой кислоты. В качестве поглотителя кислот применяют триэтиламин, пиридин, диметиламинопиридин, основную ионообменную смолу, карбонат натрия, карбонат калия, порошкообразный гидроксид калия или добавленный в избытке в реакционную смесь первичный или вторичный амин. Реакцию проводят при температуре от 0 до 120°С, предпочтительно от 20 до 80°С, наиболее предпочтительно от 40 до 60°С. Реакцию проводят в течение 1-4 ч, затем реакционную смесь инкубируют при комнатной температуре в течение 24 ч, отфильтровывают, осадок настаивают в воде, отфильтровывают и сушат в вакууме. Требуемое соединение очищают при помощи перекристаллизации из органического растворителя или колоночной хроматографии на кизельгеле или оксиде алюминия. В качестве подвижной фазы используют, например, смесь дихлорметан/этанол (10:1 об./об.).
Стадия 2
Индол-3-ил-глиоксиламид, полученный согласно стадии 1, растворяют в протонном, биполярном апротонном или неполярном органическом растворителе, таком как изопропанол, тетрагидрофуран, диметилсульфоксид, диметилформамид, диметилацетамид, N-метилпирролидон, диоксан, толуол или хлористый метилен, и по каплям добавляют в трехгорлую колбу к суспензии, приготовленной в атмосфере азота и содержащей эквимолярное количество или избыток основания, например гидрида натрия, порошкообразного гидроксида калия, трет-бутилата калия, диметиламинопиридина или амида натрия в подходящем растворителе. Затем добавляют требуемый алкил-, аралкил- или гетероаралкилгалогенид либо в неразбавленном виде, либо в растворителе, например, в использованном для растворения индол-3-ил-глиоксиламида, в данном случае в присутствии катализатора, такого как медь, и реакцию проводят в течение определенного времени, например, от 30 мин до 12 ч, при этом поддерживают температуру в интервале от 0 до 120°С, предпочтительно от 30 до 80°С, наиболее предпочтительно от 50 до 70°С. После завершения реакции реакционную смесь выливают в воду, раствор экстрагируют, например диэтиловым эфиром, дихлорметаном, хлороформом, метил-трет-бутиловым эфиром, тетрагидрофураном или н-бутанолом, и полученную органическую фазу сушат безводным сульфатом натрия.
Полученную органическую фазу концентрируют в вакууме, остаток кристаллизуют растиранием или очищают маслообразный остаток путем перегонки или колоночной, или экспресс-хроматографии на кизельгеле или оксиде алюминия. В качестве подвижной фазы используют, например, смесь хлористый метилен/диэтиловый эфир в соотношении 8:2 (об./об.) или смесь хлористый метилен/этанол в соотношении 9:1 (об./об.).
Соединения D 24241, D 24841, D 24840 и D 24834 синтезируют согласно описанному общему методу синтеза (стадии 1 и 2, схема 2), упомянутые соединения представлены также на схеме 1 и в Таблице 1. Промежуточные производные для синтеза этих соединений приведены в Таблицах 2, 2.1 и 2.2 на Фиг.3.1 и 3.2.
Соединения проявляют достаточно высокую дозозависимую противоопухолевую активность в следующих фармакологических моделях:
Наиболее высокую активность при исследовании пролиферации и цитотоксичности в системе ХТТ проявляют индолы, прежде всего, соединения D-24851 и D-24241 (Таблица 3 и Таблица 3.1). Указанную тест-систему используют для исследования влияния соединений на пролиферацию линий опухолевых клеток. При этом определяют также цитотоксические свойства этих соединений. Метод тестирования описан Scudiero и соавт. в статье Cancer Res. (1988) т.48, стр.4827.
В экспериментах используют следующие линии опухолевых клеток:
клеточная линия KB эпидермальной карциномы ротовой полости,
клеточная линия L-1210 лимфатической лейкемии мышей,
клеточная линия LNCAP карциномы простаты и
клеточная линия SK-OV-3 карциномы яичника.
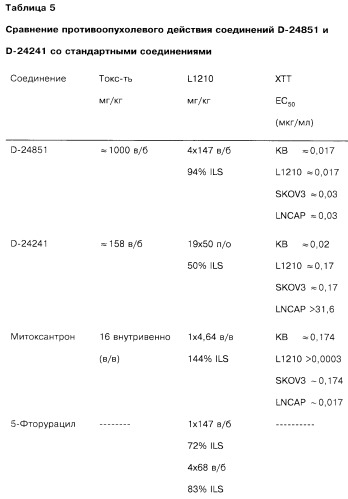
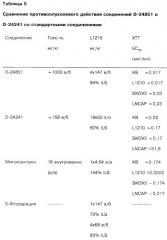
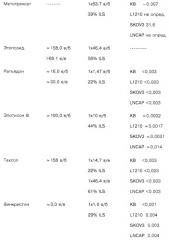
Большинство исследованных индолов обладают активностью при тестировании на всех четырех линиях опухолевых клеток. Наиболее значительным действием обладают соединения D-24851 и D-24241, причем соединение D-24851 более активно по сравнению с соединением D-24241 (Таблица 3 и 4).
В дальнейших сравнительных эксприментах при тестировании по Хольфазеру на голых мышах и с использованием клеточной линии L1210 (мыши) наблюдается высокая дозозависимая противоопухолевая активность соединений D-24851 и D-24241 (Таблицы 3 и 5). В тестировании по Хольфазеру оба соединения проявляют практически одинаковую активность, в то время как при тестировании на клеточной линии L1210 соединение D-24851 при пероральном и внутрибрюшинном введении обладает более высокой активностью по сравнению с соединением D-24241.
Соединение D-24851 в большинстве случаев обладает значительно более высокой активностью при исследовании на модели лейкемии по сравнению с известными промышленно выпускаемыми противоопухолевыми соединениями, использованными для сравнения (Таблица 5).
Еще одним преимуществом соединения D-24851 по сравнению с известными промышленно выпускаемыми противоопухолевыми препаратами является незначительная токсичность соединения (Таблицы 3 и 5). Значение LD50 для указанного соединения составляет 1000 мг/кг при пероральном введении и >1000 мг/кг при внутрибрюшинном введении, что свидетельствует о широкой области применения соединения.
Более того, после введения соединения D 24851 не наблюдается фрагментации ДНК.
При анализе кроветворных функций после внутрибрюшинного введения соединения D 24851 показано, что ни один из исследованных параметров крови не изменяется.
При дальнейшем исследовании в химиотерапевтической модели опухоли Даннинга на крысах после многократного перорального введения соединения D 24851 наблюдается прекращение роста опухоли и у некоторых животных даже уменьшение ее размеров.
При исследовании клеточной линией KB на голой мыши при введении индолов D 24851 и D 24241 наблюдается одинаковая противоопухолевая активность (Таблицы 3, 3.1 и 4).
При исследовании клеточной линии L1210 (лимфатическая лейкемия мышей) после многократного внутрибрюшинного и перорального введения соединения D 24851 в дозе 100 и 147 мг/кг, соответственно, наблюдается достоверное увеличение времени жизни (Фиг.1.1 и 1.2).
Благодаря экспериментально доказанному достаточно широкому спектру терапевтического применения соединения могут быть использованы в более высоких дозах по сравнению с широкораспространенными промышленно выпускаемыми противоопухолевыми фармацевтическими средствами.
Следует отметить, что без ограничения области настоящего изобретения перечисленным суточные дозы при пероральном введении могут составлять приблизительно от 20 до 500 мг в день. При внутривенном введении в виде инъекции или вливания дозу можно увеличить до 250 мг и более в день в зависимости от веса тела пациента и индивидуальной переносимости препарата.
| Таблица 3Сопоставление свойств соединения D-24851, полученного согласно примеру 13D24851N-(Пиридин-4-ил)-[1-(4-хлорбензил)индол-3-ил]глиоксиламид | |||||||
| Модель | Результаты | SK-OV-3 | KB | L1210 | LNCAP | MCF-7 | Токсичность |
| ХТТ (мкг/мл) | ЕС50 | ≈0,03 | ≈0,017 | ≈0,017 | ≈0,03 | ||
| 1× внутрибрюшинно (в/б) (мг/кг) | DL50 | ≈1000 | |||||
| 1× перор (п/о)(мг/кг) | DL50 | >1000 | |||||
| Хольфазер в/б 4×46 мг/кг в/б | % INH | He влияет | 56 | 38 | |||
| Хольфазер в/б 4×147 мг/кг в/б | % INH | 12 | 60 | 68 | |||
| Хольфазер подкожн (п/к) 4×46 мг/кг в/б | % INH | 44 | Не влияет | 47 | |||
| Хольфазер п/к 4×147 мг/кг в/б | % INH | 35 | 67 | 68 | |||
| Эксперименты In Vivo | |||||||
| 1×681 мг/кг в/б | % ILS | 0 | |||||
| 1× 464 мг/кг в/б | 18 | ||||||
| 4×215 мг/кг в/б | % ILS | 13 | |||||
| 4×147 мг/кг в/б | 94 | ||||||
| 7×100 мг/кг в/б | % ILS | 35 | |||||
| 7×147 мг/кг в/б | 59 | ||||||
| 1×681 мг/кг п/о | % ILS | 22 | |||||
| 4×215 мг/кг п/о | 31 | ||||||
| 7×100 мг/кг п/о | 63 | ||||||
| 7×147 мг/кг п/о | 75 | ||||||
| 7×46 мг/кг в/б | % WHI | 33 | |||||
| 2×215 мг/кг п/о | 18 |
| Таблица 3.1 | ||||
| Соединение, полученное согласно примеру | Опухолевые клетки ХТТ | |||
| (D номер) | KB | L 1210 | LNCAP | SK-OV-3 |
| EC50 (м кг/мл) | EC50 (м кг/мл) | EC50 (м кг/мл) | EC50 (м кг/мл) | |
| 1 (D 24241) | 0,020 | 0,170 | >31,600 | 0,170 |
| 3 (D 24834) | 1,75 | 1,75 | 9,250 | 1,750 |
| 4 (D 24835) | 17,5 | 1,750 | >31,6 | 9,200 |
| 6 (D 24840) | 3,100 | 1,750 | >31,6 | 17,5 |
| 9 (D 24843) | 0,050 | 0,090 | 3,240 | 1,750 |
| 10 (D 24848) | 4,060 | 1,75 | >31,6 | 7,220 |
| 11 (D 24849) | 4,590 | 1,750 | 17,500 | 4,250 |
| 12 (024850) | >31,6 | 0,017 | >31,6 | >31,6 |
| 13 (D 24851) | 0,017 | 0,017 | 0,030 | 0,030 |
| 14 (D 24852) | 1,75 | 1,75 | 17,5 | 2,58 |
| 15 (D 24853) | >31,6 | 3,1 | >31,6 | >31,6 |
| 16 (D 24847) | 4,59 | 1,75 | 17,500 | 4,250 |
| Таблица 2 (D 24831) | 17,5 | 17,5 | 17,5 | 17,5 |
Результаты дальнейших экспериментов на животных
При исследовании опухоли Даннинга после перорального введения соединения D-24851 по схеме 7×100 мг/кг и 7×147 мг/кг наблюдается прекращение роста опухоли и у некоторых животных даже уменьшение ее размеров.
Исследование кристалл