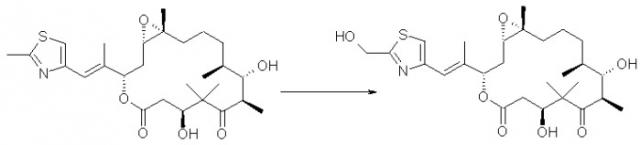
Синергические способы и композиции для лечения рака
Иллюстрации
Показать всеИзобретение относится к области медицины, к лечению рака. Способ включает введение млекопитающему, нуждающемуся в этом, синергически терапевтически эффективного количества (1) агента, выбранного из группы, состоящей из цитотоксических агентов и цитостатических агентов и (2) соединения формулы (I) или его фармацевтически приемлемой соли. Способ обеспечивает синергический противоопухолевый эффект при использовании меньших доз одного или обоих активных ингредиентов, предотвращает или замедляет развитие мультилекарственной резистентности опухоли с обеспечением поражения как пролиферативных, так и непролиферативных опухолевых клеток. 6 з.п. ф-лы, 6 табл., 23 ил.
Реферат
Область изобретения
Настоящее изобретение относится к терапиям лечения рака, в особенности к синергическому применению двух или более противораковых агентов, имеющих антипролиферативную цитотоксическую и цитостатическую активности.
Уровень техники
Химиотерапию, представляющую собой систематическое введение противоопухолевых агентов, которые проходят сквозь организм через циркулирующую систему крови, перед и часто вместе с хирургическим вмешательством и/или лучевой терапией, широко используют на протяжении многих лет при лечении различных раковых образований. К сожалению, доступные химиотерапевтические лекарственные препараты часто оказываются вредными для пациентов, потому что убивают множество здоровых клеток и, таким образом, вызывают серьезные побочные эффекты, что приводит к необходимости ограничения доз, которые могут быть введены пациентам.
В особенности, раковые опухоли трудно лечить, потому что они содержат как пролиферативные, так и непролиферативные раковые клетки. Поскольку раковая опухоль растет, васкулярное развитие часто не может успевать за быстрым размножением популяции злокачественных клеток. Следовательно, твердые массы раковых опухолей обычно демонстрируют аномальную сеть кровеносных сосудов, которые в отличие от сосудов в нормальных тканях не могут обеспечить адекватное питание злокачественных раковых клеток, для оптимального роста. В большинстве злокачественных твердых опухолей непролиферативные опухолевые клетки составляют большую часть от общей популяции раковых клеток. Более того, по мере того, как опухоль увеличивается в размере, пропорция непролиферативных опухолевых клеток в соотношении также увеличивается. Поскольку наиболее распространено то, что противораковые агенты поражают пролиферативные клетки, популяцию непролиферативных опухолевых клеткок определяют как главный фактор, влияющий на неудачу при проведении лучевой или химиотерапии, когда их используют по отдельности или вместе при лечении опухолевой болезни.
Как упомянуто выше, по мере того, как опухоль увеличивается в размере, она обычно становится все более невосприимчивой к большинству курсов химиотерапии. Соответственно множество курсов, направленных на уничтожение опухоли, включают стадию уменьшения ее в объеме для снижения массы перед введением противоопухолевых агентов.
Однако уменьшение в объеме не всегда приводит к разрушению опухоли, даже когда оно протекает совместно с применением сильных противоопухолевых агентов. Таким образом, существует потребность в разработке новых способов лечения, которые нацелены как на пролиферативные, так и непролиферативные раковые клетки для лечения злокачественных опухолей.
WO 98/54966 раскрывает комбинацию терапий, применяющих противоопухолевый агент или лучевую терапию совместно с ингибитором пренил-протеиновой трансферазы, который может быть полезньм при лечении рака. Однако WO 98/54966 не раскрывает применение соединений формулы I по настоящему изобретению.
US 6011029 раскрывает соединения формулы I по настоящему изобретению и способы их применения в качестве противораковых агентов. Кроме того, патент вообще раскрывает, что соединения формулы I могут быть пригодны в комбинации с другими терапиями рака. Однако US 6011029 не раскрывает никакую конкретную комбинацию способов лечения, которая действует синергически в качестве противораковых способов лечения.
Таким образом, объектом настоящего изобретения является обеспечение синергического способа лечения рака.
Также объектом настоящего изобретения является создание фармацевтической композиции для синергического лечения рака.
Эти и другие объекты настоящего изобретения будут более понятны из описания, которое представлено ниже.
Сущность изобретения
Настоящее изобретение предусматривает синергический способ лечении рака, который включает введение такому виду как млекопитающее, нуждающемуся в этом, синергически терапевтически эффективного количества (1) по крайней мере одного агента, выбранного из группы, состоящей из антипролиферативных цитотоксических агентов и антипролиферативных цитостатических агентов, паклитаксел [1S-[1R*,3R*(E),7R*,10S*,11R*,12R*,16S*]]-7-11-дигидрокси-8,8,10, 12, 16-пентаметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17 оксабицикло [14.1.0] гептадекан-5,9-дион, СРТ-11, гемцитабин, 4-(3 бромфениламино)-6,7-бис (метокси)хиназолин, трастузумаб, 4-(3-хлор-4-фторфениламино)-7-метокси -6-(3-(4-морфофенил)пропокси)хиназолин, тамоксифен и N-[5-[[[5-(1,1-диметилэтил)-2-оксазолил]метил]тио]-2-тиазолил]-4-пиперидинкарбоксамид, а также соединения формулы (I)
или его фармацевтически приемлемой соли, где
R1 представляет собой Br или CN;
R2 представляет собой необязательно замещенный бензил;
R3 представляет собой необязательно замещенный низший алкил, необязательно замещенный фенил, необязательно замещенный 2-тиенил или необязательно замещенный 1-пиперидинил;
R4 представляет собой водород или метил;
Z1 представляет собой CO, SO2 или SO2N(R5)-; и
n имеет значение 1; а
R5 представляет собой необязательно замещенный низший алкил или необязательно замещенный фенил;
при условии, что противораковый агент вводят одновременно с или до введения соединения формулы I.
В предпочтительном воплощении изобретения цитотоксический или цитостатический агент вводят до введения соединения формулы I. В другом воплощении изобретения цитотоксический или цитостатический агент вводят одновременно с соединением формулы I.
Краткое описание чертежей
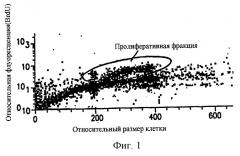
Фиг.1 показывает, что в НСТ-116 модели твердой карциномы прямой кишки человека, развитой в лишенных шерсти мышах, большинство опухолевых клеток находятся в непролиферативной (G0) фазе роста. Непролиферативные клетки, присутствующие в НСТ-116 твердом новообразовании карциномы прямой кишки человека, развитом подкожно, идентифицируют путем введения пролонгированной BrdUrd метки (24 часа) при длительном вливании. Только 20% от общей популяции опухолевых клеток, рассасываемых из твердого новообразования, окрашены точно BrdUrd, которые селективно метят пролиферативные клетки.
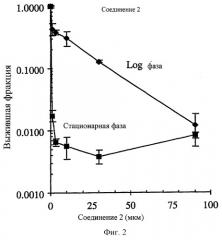
Фиг.2 показывает селективное поражение непролиферативных НСТ-116 опухолевых клеток in vitro соединением 2. Опухолевые клетки в экспоненциальном росте (день 2 несливающихся и высоко пролиферативных клеток) были в >44 раза менее чувствительными к соединению 2 (IC90=0.3 мкм) по сравнению с опухолевыми клетками в стационарной фазе роста (день 8 высоко сливающихся и непролиферативных клеток).
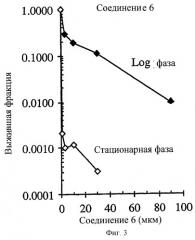
Фиг.3 показывает селективное поражение непролиферативных НСТ-116 опухолевых клеток in vitro соединением 6. Опухолевые клетки в экспоненциальном росте (день 2 несливающихся и высоко пролиферативных клеток) были в ˜67 раз менее чувствительными к соединению 6 (IC90=1.04 μМ) по сравнению с клетками новообразования в стационарной фазе роста (день 8 высоко сливающихся и нелролиферативных клеток).
Фиг.4 показывает селективное поражение непролиферативных НСТ-116 опухолевых клеток in vitro соединением 4. Опухолевые клетки в экспоненциальном росте (день 2 несливающихся и высоко пролиферативных клеток) были в ˜91.2 раз менее чувствительным к соединению 4 (IC90=1.05 мкм) по сравнению с клетками новообразования в стационарной фазе роста (день 8 высоко сливающихся и непролиферативных клеток).
Фиг.5 показывает, что в отличие от соединения 2 и близких к нему соединений, антипролиферативные агенты, такие как паклитаксел, селективно поражают размножающиеся НСТ-116 опухолевые клетки in vitro. Раковые клетки в экспоненциальном росте (день 2 несливающихся и высоко пролиферативных клеток) были ≫10 раз более чувствительным к паклитакселю (IC90=17.8 μМ) по сравнению с клетками новообразования в стационарной фазе роста (день 8 высоко сливающихся и непролиферативных клеток).
Фиг.6 показывает, что эпотилоны, другой класс противоопухолевых антипролиферативных агентов, селективно поражает пролиферативные клетки. В этом примере НСТ-116 раковые клетки в экспоненциальном росте (день 2 несливающихся и высоко пролиферативных клеток) были ≫83 раз более чувствительным к эпотилону В (IC90=1.3 нМ) по сравнению с НСТ-116 клетками в стационарной фазе роста (день 8 высоко сливающихся и непролиферативных клеток).
Фиг.7 показывает результаты комбинированной химиотерапии с соединением 2 и паклитакселем в клеточной линии карциномы прямой кишки человека, НСТ-116. Эти данные показывают, что применение комбинированного лечения соединением 2 и паклитакселем для лечения НСТ-116 раковых клеток in vitro приводит к заметно синергической противораковой активности. Последовательность, при которой вводят два агента, как было показано, является важной для определения того, будет ли проявляться синергизм. Паклитаксел вводят сначала в течение 20 часов с последующим введением соединения 2 (0.33 мкм), период в течение последующих 20 часов является явно синергическим, как при одновременном лечении двумя агентами при установленных концентрациях в течение 20 часов. Наоборот, комбинирование соединения 2 (0.3 μМ) с последующим введением паклитакселя, как было обнаружено, является антагонистическим.
Фиг.8 показывает комбинированную химиотерапию с соединением 2 и соединением 1 в клеточной линии карциномы прямой кишки человека НСТ-116. Эти данные показывают, что применение комбинированного лечения соединением 2 и соединением 1 для лечения НСТ-116 раковых клеток in vitro приводит к заметной синергической противораковой активности. Соединение 1 вводят сначала в течение 20 часов с последующим введением соединения 2 (1 мкм) в течение последующих 20 часов периода лечения.
Фиг.9 и 10 дополнительно показывают синергизм комбинированной химиотерапии с использованием соединения 2 и соединения 1. Синергизм получают в области концентраций соединения 1 и соединения 2 и, как оказалось, он не зависит от конкретной концентрации каждого агента, используемого в комбинации. В случае использования соединения 2 концентрации 1 мкм (фиг.8), 0.33 мкм (фиг.9) и 0.11 мкм (фиг.10) все приводят к синергическому взаимодействию с соединением 1 в различных концентрациях. В этих экспериментах соединение 1 вводят сначала в течение 20 часов с последующим введением соединения 2 в течение последующих 20 часов периода лечения.
Фиг.11 показывает синергизм in vivo в ксенотрансплантантах опухолей человека (НСТ-116 карциномы прямой кишки человека), развитых в лишенных шерсти мышах, полученный путем следующей комбинированной химиотерапии, использующей соединение 2 и паклитаксел. В этом эксперименте соединение 2 вводят пролонгированным внутривенным вливанием (24 часа) в дозе 125 мг/кг. Паклитаксел вводят внутрибрюшинно в дозе 24 мг/кг в конце периода вливания соединения 2 (считается одновременным введением).
Фиг.12 показывает синергизм in vivo в паклитаксел-резистентном ксенотрансплантанте опухоли человека (Pat-7 карцинома яичников человека), развитом в лишенных шерсти мышах, с последующей комбинированной химиотерапией при использовании соединения 2 и паклитаксел. Паклитаксел и соединение 2 вводят одновременно; паклитаксел путем внутривенного введения и соединение 2 путем внутрибрюшинного введения. Приведенные данные отражают максимальные толерантные режимы: паклитаксел (36 мг/кг, внутривенно, q3dx3); соединение 2 (350 мг/кг, внутрибрюшинно, q3dx3).
Фиг.13 показывает терапевтический синергизм in vivo в лекарственно-резистентном ксенотрансплантанте опухоли человека (HCTVM46 карциномы прямой кишки человека), развитом в лишенных шерсти мышах с последующей комбинированной химиотерапией, при использовании соединения 2 и соединения 1. Соединение 1 вводят внутривенно за 24 часа до введения соединения 2 внутрибрюшинно. Приведенные данные отражают максимальные толерантные режимы: соединение 1 отдельно (15 мг/кг, q4dx3), соединение 2 отдельно (400 мг/кг, q4dx3), комбинированно (соединение 1 при 6 мг/кг с последующим введением соединения 2 при 400 мг/кг).
Фиг.14 показывает схематичную зависимость комбинирования соединения 1 и соединения 2 in vivo против лекарственно-резистентного ксенотрансплантанта опухоли человека (HC7VM46 карцинома прямой кишки человека), развитого в лишенных шерсти мышах. В противоположность другим схемам, описанными выше, введение соединения 2 за один день до соединения 1 не приводит к терапевтическому синергизму. Приведенные данные отражают максимальные толерантные режимы: соединение 1 отдельно (10 мг/кг, внутривенно, q4dx3), соединение 2 отдельно (400 мг/кг, внутрибрюшинно, q4dx3), комбинированно (соединение 2 при 300 мг/кг с последующим введением соединения 1 при 10 мг/кг).
Фиг.15 показывает, что комбинированная химиотерапия с соединением 2 и СРТ-11 приводит к синергической противоопухолевой активности в обширной (300-500 мг) карциноме прямой кишки человека НСТ116, развитой в лишенных шерсти мышах. СРТ-11 вводят за 1 час до соединения 2. СРТ-11 вводят внутривенно при или около его MTD в 30 мг/кг/инъекцию. Соединение 2 вводят двумя различными уровнями доз: 60 и 80 мг/кг/ инъекцию, внутривенно.
Фиг.16 (А) показывает, что комбинированная химиотерапия с гемцитабином (Gem) плюс соединение 2 вызывает повышение ингибирования роста новообразования карциномы прямой кишки человека НТ-29. Фиг. 16 (В) показывает, что синергическая противоопухолевая активность, являющаяся результатом комбинированной терапии гемцитабина и соединения 2, также имеет место, когда регрессию опухоли используют как конечную точку канцирогенного эффекта. Gem вводят за 1 час до соединения 2. Gem вводят внутривенно при двух уровнях доз, 24 и 36 мг/кг/инъекцию, Q2D×4 (MTD=36 мг/кг/инъекцию.). Соединение 2 вводят при двух различных уровнях доз: 60 и 80 мг/кг/инъекцию, внутривенно.
Фиг.17 (А) показывает, что комбинированная химиотерапия с паклитакселем (Ptxl) плюс соединение 2 вызывает синергическую противоопухолевую активность с точки зрения роста опухоли, против карциномы прямой кишки человека НСТ116. Фиг. 17 (В) показывает, что синергическая противоопухолевая активность, являющаяся результатом комбинированной терапии паклитакселя и соединения 2, также имеет место, когда регрессия опухоли и скорость лечения используют как конечные точки отклика канцирогенного эффекта. Паклитаксел вводят за 3 часа до соединения 2. Паклитаксел вводят внутривенно при 20 мг/кг/инъекцию, Q7D×4. Соединение 2 вводят двумя различными уровнями доз: 40 и 80 мг/кг/инъекцию, внутривенно.
Фиг.18A-18G показывают противораковое действие различных противоопухолевых агентов, используемых отдельно или в комбинации. Результаты показывают, что соединение 2 и Her-1 ингибитор (соединение 8) при использовании в комбинации вызывают синергическое цитотоксическое действие in vitro против Her-1 активированной SAL-2 раковой клеточной линии (сравнить фиг.18В с фиг.18D). Фиг.18А: клоногенная выживаемость SAL-2 клеточной линии под воздействием паклитакселя в течение 20 часов при указанных концентрациях. Фиг.18В, клоногенная выживаемость SAL-2 клеточной линии под воздействием соединения 2 в течение 20 часов при указанных концентрациях. Фиг.18 С: антагонистическое взаимодействие между паклитакселем и Her-1 ингибитором, соединение 8. SAL-2 клетки сначала обрабатывают соединением 8 в течение 20 часов до дополнительного воздействия паклитакселем в течение дополнительных 20 часов. Фиг.18D: синергическое взаимодействие между соединением 2 и Her-1 ингибитором, соединение 8. SAL-2 клетки сначала обрабатывают соединением 9 в течение 20 часов до дополнительного воздействия соединением 2 в течение дополнительных 20 часов. Соединение 2 повышает противоопухолевую активность Her-1 (EGFR) ингибитора Iressa® в Her-1 экспрессированной А431 модели ксенотрансплантанта карциномы чешуйчатой клетки человека в лишенных шерсти мышах. Фиг.18Е: Комбинированное действие Iressa® (200 мг/кг/прием, РО, QlD×11) и соединения 2 (60 мг/кг/инъекцию, внутривенно, Q2D×5). Iressa® терапию проводят за 3 дня до начала лечения соединением 2. Фиг.18F: Комбинированное действие Iressa® (200 мг/кг/прием, РО, Q1D×11) и соединения 2 (80 мг/кг/инъекцию, внутривенно, Q2D×5). Фиг.18G: Комбинированное действие Iressa® (200 мг/кг/прием, РО, Q1D×11) и паклитакселя (24 мг/кг/инъекцию, внутривенно, Q2D×5).
Фиг.19 показывает, что комбинированное лечение соединением 2 и герцептином приводит к синергической антипролиферативной активности против ВТ474 клеточной линии карциномы молочной железы человека. Лечение Herceptin® проводят за 2 дня до соединения 2, как показано на чертеже.
Фиг.20 Соединение 2 усиливает противоопухолевую активность Тамоксифена в MCF-7 эстрогензависимой ксенотрансплантантной моделе карциномы груди человека в лишенных шерсти мышах. Тамоксифен вводят РО, Q2D×14. Соединение 2 вводят РО в течение 2 курсов, Q1D×10, как проиллюстрированно на чертеже.
Фиг.21 Соединение 2 усиливает противоопухолевую активность хирургической кастрации в андрогензависимой ксенотрансплантантной модели карциномы простаты человека MDA-PCa-2b в лишенных шерсти мышах. Хирургическую кастрацию осуществляют на 21 день после имплантации опухоли. Соединение 2 и терапию паклитакселя начинают спустя 3 дня после хирургической кастрации. Соединение 2 вводят РО, Q1D×10. Паклитаксел вводят IV, Q2D×5.
Фиг.22 Соединение 2 повышает противоопухолевую активность ингибитора андрогенового рецептора Casodex® против андрогензависимой, Casodex®-чувствительной карциномы простаты человека на ксенотрансплантантной моделе MDA-РСа-2b-AI в лишенных шерсти мышах. Casodex® вводят РО, Q1D×10. Терапию Соединения 2 начинают спустя 3 дня после введения Casodex®. Соединение 2 вводят РО, QlD×10.
Фиг.23 показывает, что комбинация ингибитора CDK (CDKI), Соединения 9, с Соединением 2 обеспечивает последовательно-зависимое, синергическое цитотоксическое воздействие на А2780 раковые клетки яичников in vitro. 4-часовое лечение с помощью 1.5 мкМ Соединения 9 (неэффективная доза) объединяют с 20 часовым лечением в повышающихся концентрациях соединения 2. Образование колоний оценивают на 10 день. Panel А. Обработка CDKI предшествует Соединению 2. Panel В, обработка Соединением 2 предшествует CDKI.
Детальное описание изобретения
Преимущественно настоящее изобретение представляет собой способ синергического лечения рака, который включает введение синергически терапевтически эффективного количества (1) по крайней мере одного агента, выбранного из группы, состоящей из антипролиферативного цитотоксического агента и антипролиферативного цитостатического агента, и (2) соединения формулы I, такому виду как млекопитающее, предпочтительно человеку, нуждающемуся в этом.
Неожиданно было найдено, что применение (1) по крайней мере одного антипролиферативного цитотоксического агента и/или антипролиферативного цитостатического агента и (2) соединения формулы I, когда их используют в комбинации, обеспечивает синергический способ лечения рака. Как его используют здесь, термин "синергический" означает, что эффект, достигнутый с помощью способов и композиций настоящего изобретения, оказывается выше, чем сумма эффектов, полученных от способов и композиций, содержащих цитотоксический или цитостатический агент или агенты и соединение формулы I настоящего изобретения по отдельности и в количествах, используемых в предложенных способах и композициях. Преимущество такого синергизма между активными инградиентами позволяет использовать меньшие дозы одного или обоих активных ингредиентов, позволяет использовать более низкие дозы противоопухолевых агентов или агента, лучевой терапии, обеспечивает большую эффективность при одних и тех же дозах и/или предотвращает или замедляет наращивание мультилекарственной резистентности.
Кроме того, дополнительные преимущества по сравнению с раскрытыми ранее способами заключаются в способности настоящей комбинации соединений формулы I и по крайней мере одного агента, выбранного из группы, состоящей из цитостатического агента и цитотоксического агента(ов) к индивидуальному варьированию в зависимости от природы раковых клеток, которые должны быть обработаны. Также предвидится, что терапевтический эффект от настоящей композиции может быть достигнут с меньшими количествами цитотоксического или цитостатического агента(ов) и соединения формулы I, которые потребуются, если такие противоопухолевые агенты и соединения формулы I будут вводиться по одному. Такой подход исключает любые не базирующиеся на механизме вредные токсические эффекты, которые могут появиться от введения определенного количества противоопухолевого агента или агентов, или соединения формулы I, или одной лучевой терапии, достаточных для достижения того же самого терапевтического эффекта. Настоящие композиции достигают синергический терапевтический эффект и демонстрируют неожиданное терапевтическое преимущество над эффективностью любого из компонентов соединений или способов, которые используют по одному.
Степень селективности двух или более противоопухолевых агентов, которые составляют способ по настоящему изобретению, обеспечивает терапевтические преимущества над ранее раскрытыми способами использования одного противоопухолевого агента для лечения рака. В частности, использование двух или более независимых фармацевтически активных компонентов, которые обладают комплементарными, по существу неперекрывающимися активностями, позволяет врачу, использующему настоящий способ лечения, независимо и точно варьировать активность комбинации без необходимости синтезировать единственное лекарственное средство, имеющее определенный фармацевтический профиль. В дополнение, такие комбинации должны эффективно поражать как пролиферативные, так и непролиферативные клетки.
Антипролиферативный цитотоксический агент(ы), который включает лучевую терапию, может быть применен одновременно с или перед соединением формулы I. В предпочтительном воплощении настоящего изобретения антипролиферативный цитотоксический агент(ы) вводят и/или лучевую терапию осуществляют до применения соединения формулы I. Как используют здесь, термин "одновременный" или "одновременно" означает, что антипролиферативный цитотоксический агент(ы) или лучевую терапию и соединение формулы I вводят в течение 24 часов, предпочтительно 12 часов, более предпочтительно 6 часов и более предпочтительно 3 часа или менее, каждого из остальных.
В дополнение к антипролиферативному цитотоксическому агенту(ам) и лучевой терапии, описанных выше, агенты, которые заставляют клетки становиться "непролиферативными" или "неактивными", которые определяют здесь как "антипролиферативные цитостатические агенты" или "неактивные агенты," могут необязательно быть введены пациенту, нуждающемуся в этом. Антипролиферативные цитостатические агенты могут быть введены одновременно или последовательно с соединением формулы I или лучевой терапией или цитотоксическим агентом(ами).
Настоящее изобретение предусматривает способы синергического лечения разнообразных раковых образований, включая в том числе, но не ограничиваясь ими, следующие: карцинома, в том числе мочевого пузыря (в том числе быстротекущего и метастатического рака мочевого пузыря), молочной железы, толстой или прямой кишки (в том числе проктологического рака), почки, печени, легкого (в том числе маленьких и немаленьких клеток рака легкого и аденокарценомы легкого), яичников, простаты, яичка, мочеполового тракта, лимфатической системы, гортани, поджелудочной железы (в том числе внешнесекреторная карцинома поджелудочной железы), пищевода, желудка, желчного пузыря, шеи, щитовидной железы и кожи (в том числе сквамозная карцинома клетки);
кроветворные опухоли лимфоидного происхождения, в том числе лейкемия, острая лимфоцитарная лейкемия, острая лимфобластная лейкемия, лимфома В-клетки, лимфома Т-клетки, лимфома Ходкинса (Hodgkins), лимфома не-Hodgkins, лимфома опасной клетки, гистоцитарная лимфома и лимфома Бюркета (Burketts лимфома);
кроветворные опухоли миелоидного происхождения, в том числе острая и хроническая миеломная лейкемии, миелодисплазийный синдром, миелоидная лейкемия и промиеломоноцитная лейкемия;
опухоли центральной и периферийной нервной системы, в том числе астроцитома, нейробластома, глиома и шваномасс;
опухоли мезенхимального происхождения в том числе фиброкарцинома, рабдомиокарцинома, и остеокарцинома и другие опухоли, в том числе меланома, остеокарцинома, пигментолсан, кератоактантома, симинома, фолликулярный рак щитовидной железы и тератосаркинома.
Более предпочтительно изобретение используют для лечения быстротекущих или метастатических раковых образований мочевого пузыря, рака поджелудочной железы, рака предстательной железы, рака небольших клеток легкого, проктологического рака и рака молочной железы.
В предпочтительном воплощении настоящего изобретения способ обеспечивает синергическое лечение раковых опухолей. Преимущественно синергический способ по настоящему изобретению подавляет развитие опухолей, подавляет бремя опухоли или вызывает регрессию опухоли в организме млекопитающего.
Как используют здесь, определение "лучевая терапия" включает, но не ограничивается, рентгеновским излучением или гамма-излучением, которое поступает либо из внешнего применяемого источника, такого как лазер, или путем имплантации небольших источников излучения. Лучевая терапия может также рассматриваться как антипролиферативный цитотоксический агент.
Как используют здесь, определение "противоопухолевый агент" представляет собой синоним "химиотерапевтического агента" и относится к соединениям, которые предотвращают размножение раковых клеток (т.е. антипролиферативные агенты). Вообщем, агент(ы) по настоящему изобретению попадают в два класса, антипролиферативные цитотоксический и антипролиферативные цитостатические. Цитотоксические агенты предотвращают раковые клетки от размножения за счет того, что (1) лишают клетку способности репродуцировать ДНК и (2) вызывают некроз клетки и/или апоптоз раковых клеток. Антипролиферативные цитостатические или неактивные агенты действуют через модуляцию, предотвращение или ингибирование процессов импульсной модулярной трансдукции клетки, которая регулирует размножение клетки. Большинство химиотерапевтических агентов являются цитотоксическими, которые поражают пролиферативные клетки.
Классы соединений, которые могут быть использованы в качестве антипролиферативных цитотоксических агентов включают следующие:
Алкилирующие агенты (в том числе без ограничения азотные иприты, производные этиленимина, алкилсульфонаты, нитрозомочевины и триазены): урациловый иприт, хлорметин, циклофосфамид (Cytoxan®), ифосфамид, мелфалан, хлорамбуцил, пипоброман, триэтиленмеламин, триэтилентиофосфорамин, бузулфан, кармустин, ломустин, стрептозоцин, дакарбазин и темозоломид.
Антиметаболиты (в том числе без ограничесния антагонисты фолиевой кислоты, аналоги пиримидина, аналоги пурина и ингибиторы аденозин деаминазы): метотрексат, 5-фторурацил, флоксуридин, цитарабин, 6-меркаптопурин, 6-тиогуанин, фосфат флударабина, пентостатин и гемцитабин.
Природные продукты и их производные (например, винка алкалоиды, противоопухолевые антибиотики, ферменты, лимфокины и эпиподофиллотоксины): винбластин, винкристин, виндезин, блеомицин, дактиномицин, даунорубицин, доксорубицин, эпирубицин, идарубицин, Ара-С, паклитаксел (паклитаксел имеет коммерческое название Taxol®), митрамицин, деоксоформицин, митомицин-С, L-аспаргиназа, интерфероны (особенно IFN-a), этопозид и тенипозид.
Другие антипролиферативные цитотоксические агенты представляют собой навелбен, СРТ-11, анастразол, летразол, капецитабин, релоксафин, циклофосфамид, ифозамид и дролоксафин.
Агенты, поражающие микроканальцы, препятствуют клеточному делению и хорошо известны из уровня техники благодаря их антипролиферативной цитотоксической активности. Агенты, поражающие микроканальцы, пригодные по изобретению, включают без ограничения аллоколхицин (NSC 406042), Халихлондрин В (NSC 609395), колхицин (NSC 757), производные колхицина (например, NSC 33410), доластатин 10 (NSC 376128), маитанзин (NSC 153858), ризоксин (NSC 332598), паклитаксел (Taxol®, NSC 125973), производные Taxol® (например, производные (например, NSC 608832), тиоколхицин NSC 361792), тритилцистеин (NSC 83265), винбластин сульфат (NSC 49842), винкристин сульфат (NSC 67574), природные и синтетические эпотилоны, включающие в том числе без ограничения эпотилон А, эпотилон В и дискодермолид (see Service, (1996) Science, 274:2009), эстрамустин, нокодазол, МАР4 и тому подобное. Примеры таких агентов также описаны в научной и патентной литературе, см, например, Bulinski (1997) J. Cell Sci. 110:3055 3064; Panda (1997) Proc. Nat. Acad. Sci. USA 94:10560-10564; Muhlradt (1997) Cancer Res. 57:3344-3346; Nicolaou (1997) Nature 387:268-272; Vasquez (1997) Mol. Biol. Cell. 8:973-985; Panda (1996) J. Biol. Chem 271:29807-29812.
Термин "паклитаксел", как его используют здесь, относится к коммерчески доступному лекарственному средству Taxol® (NSC номер: 125973). Taxol® ингибирует репликацию эукариотической клетки путем усиления полимеризации тубилиновых остатков в стабилизированных пучках микроканальцев, которые не способны организоваться в подходящие структуры из-за митоза. Из многих пригодных химиотерапевтических лекарственных средств паклитаксел вызывает интерес благодаря его эффективности в клинических испытаниях против устойчивых к лекарственным средствам опухолям, включая опухоли яичников и молочной железы (Hawkins (1992) Oncology, 6: 17-23, Horwitz (1992) Trends Pharmacol. Sci. 13: 134-146, Rowinsky (1990) J. Natl. Cane. Inst. 82: 1247-1259).
Особенно предпочтительные антипролиферативные цитотоксические агенты представляют собой соединения с активностью, аналогичной активности паклитакселя. Они включают без ограничения паклитаксел и производные паклитакселя (паклитакселподобные соединения) и аналоги. Паклитаксел и его производные являются коммерчески доступными. Кроме того, способы получения паклитакселя и производных паклитакселя, а также аналогов хорошо известны специалистам в данной области (см., например, US Patent Nos: 5,569,729; 5,565,478; 5,530,020; 5,527,924; 5,508,447; 5,489,589; 5,488,116; 5,484,809; 5,478,854; 5,478,736; 5,475,120; 5,468,769; 5,461,169; 5,440,057; 5,422,364; 5,411,984; 5,405,972 и 5,296,506).
Таким образом, антипролиферативные цитотоксические агенты, которые пригодны для применения в способах и композициях настоящего изобретение, включают без ограничения агенты, стабилизирующие микроканальцы, такие как паклитаксел (также известный как Taxol®), доцетаксел (также известный как Taxotere®), 7-O-метилтиометилпаклитаксел (раскрытый в US 5,646,176), 4-дезацетил-4-метилкарбонатпаклитаксел, 3'-трет-бутил-3'-N-трет-бутилоксикарбонил-4-децетил-3'-дефенил-3'-N-дебензоил-4-O-метоксикарбонилпаклитаксел (раскрытый в USSN 60/179,965 filed on February 3, 2000, и пример 17 здесь), С-4 метилкарбонатпаклитаксел (раскрытый в WO 94/14787), эпотилон А, эпотилон В, эпотилон С, эпотилон D, дезоксиэпотилон А, дезоксиэпотилон В [1S-[1R*,3R*(E),7R*,10S*,11R*,12R*,16S*]]-7-11-дигидрокси-8,8,10, 12, 16-пентаметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-аза-17 оксабицикло [14.1.0]гептадекан-5,9-дион (раскрытый в WO 99/02514), [1S-[1R*,3R*(Е),7R*,10S*,11R*,12R*,16S*]]-3-[2-[2-(аминометил)-4-тиазолил]-1-метилэтенил]-7,11-дигидрокси-8,8,10,12,16-пентаметил-4-17-оксабицикло[14.1.0]-гептадекан-5,9-дион (раскрытый в USSN 09/506,481 filed on February 17, 2000 и примеры 7 и 8, приведенные здесь) и его производные, а также агенты, разрушающие микроканальцы.
Также пригодными являются цитотоксические агенты, такие как эпидофиллотоксин; противоопухолевый энзим; ингибитор топоизомеразы; прокарбазин; митоксантрон; координационные комплексы платины, такие как цис-платин и карбоплатин; биологически чувствительные модификаторы; ингибиторы роста; антигормональные терапевтические агенты; лейкворин; тегафур и плазмотопоитические факторы роста.
Кроме того, антипролиферативные цитотоксические агенты включают мелфалан, гексаметилмеламин, тиотепу, цитарабин, идатрексат, триметрексат, дакарбазин, L-аспарагиназу, камтофецин, топотекан, бикалутамид, флутамид, лейпролид, производные пиридобензоиндола, интерфероны и интерлейкины. Предпочтительные классы антипролиферативных цитотоксических агентов представляют собой EGFR ингибиторы, Her-2 ингибиторы, CDK ингибиторы и Herceptin® (трастузумаб). Некоторые особенно предпочтительные антипролиферативные цитостатические агенты представляют собой паклитаксел, цис-платин, карбоплатин, эпотилоны, гемцитабин, СРТ-11,5-фторурацил, тегафур, лейковорин и EGFR ингибиторы, такие как Iressa® (ZD 1839,4-(3-хлор-4-фторфениламино)-7-метокси-6-(3-(4-морфолинил)пропокси)хиназолин и OSI-774 (4-(3-этинилфениламино)-6,7-бис(2-метоксиэтокси)хиназолин.
В одном воплощении настоящего изобретения пролиферативные раковые клетки оказываются непролиферативными перед или во время лечения в соответствии с настоящим изобретением при обработке цитостатическим агентом. Как используют здесь, "цитостатический агент" представляет собой синоним "неактивного агента" и относится к любым агентам, снижающим скорость деления клетки или роста опухоли, так что клетки становятся непролиферативными или, таким образом, что их поведение приближается к поведению непролиферативных клеток. Типичные антипролиферативные цитостатические или "неактивные" агенты по изобретению включают без ограничения гормоны и стероиды (в том числе синтетические аналоги): 17α-Этинилэстрадиол, Диэтилстилбестрол, Тестостерон, Преднизон, Флуоксиместерон, Дромостанолон пропионат, Тестолактон, Мегестролацетат, Метилпреднизолон, Метилтестостерон, Преднизолон, Триамцинолон, Хлортрианизен, Гидроксипрогестерон, Аминоглутетимид, Эстрамустин, Медроксипрогестеронацетат, Лейпролид, Флутамид, Торемифен, Золадекс.
Также пригодны для применения в качестве цитостатических агентов, агенты, предотвращающие развитие кровеносных сосудов, такие как матричные ингибиторы маталлопротеиназы и другие VEGF ингибиторы, такие как анти-VEG антитела и небольшие молекулы, такие как ZD6474 и SU6668, которые также включены. Анти-Нег2 антитела из Genetech могут быть также использованы. Пригодный EGFR ингибитор представляет собой ЕКВ-569 (необратимый ингибитор). Также включено Imclone антитело С225, иммуноспецифическое для EGFR, и src ингибиторы.
Кроме того, пригодными для применения в качестве антипролиферативного цитостатического агента является Казодекс (Casodex®) (бикалутамид, Astra Zeneca), который оказывается андрогензависимым карциномным непролиферативным. Еще один пример цитостатического агента представляет собой антиэстрогенный Тамоксифен, который ингибирует пролиферацию или рост эстрогензависимого рака молочной железы. Ингибиторы трансдукции клеточных пролиферативных импульсов представляют собой цитостатические агенты. Примерами являются эпидермальные ингибиторы фактора роста, Her-2 ингибиторы, ингибиторы МЕК-1 киназы, ингибиторы МАРК киназы, PI3 ингибиторы, Src ингибиторы киназы и ингибиторы PDGF.
Как указывалось, цитостатические агенты также содержат агенты, предотвращающие развитие кровеносных сосудов, а также антиваскулярные агенты, которые путем прерывания потока крови в твердых опухолях делают раковые клетки неактивными из-за отсутствия питания. Кастрация, которая также делает андрогензависимую карциному непролиферативной, также может быть использована. Голодание другими средствами, отличными от хирургического разрушения потока крови, является другим примером цитостатического агента. Особенно предпочтительный класс антиваскулярных цитостатических агентов относится к комбретастатинам. Другие примеры цитостатических агентов включают ингибиторы MET киназы, ингибиторы MAP киназы, ингибиторы нерецепторных и рецепторных тирозинкиназ, интегринсигнальные ингибиторы и ингибиторы рецепторов инсулинподобных факторов роста.
В предпочтительных воплощениях изобретения способ включает введение комбинации двух или более противоопухолевых агентов. Например, данные, приведенные в описании, показывают, что ксенотрансплантанты рака простаты человека MDA-PCa-2b оказываются неактивными в случае хирургической кастрации, произведенной в организме животных перед лечением их с помощью соединения формулы I.
Способы безопасного и эффективного введения большинства из этих химиотерапевтических агентов хорошо известны специалисту в этой области. Кроме того, их введение описано в стандартной литературе. Например, введение большинства химиотерапевтических агентов описано в "Physicians' Desk Reference" (PDR), например, 1996 edition (Medical Economics Company, Montvale, NJ 07645-1742, USA), которая включена в описание в качестве ссылки.
Предпочтитель