Новые фенилэтаноламиновые соединения в качестве агонистов и бета2-рецептора и способ их получения
Иллюстрации
Показать всеДанное изобретение относится к соединениям формулы (I)
и их фармацевтически приемлемым солям, где R1 обозначает Н, хлор или бром, R2 обозначает электроноакцепторные группы CF3, CN, фтор, COSO3H, CF3SO3 и NO2; R3 обозначает линейный или разветвленный алкил, содержащий от 2 до 10 атомов углерода, линейный или разветвленный алкоксиалкил, алифатический спирт, содержащий от 1 до 10 атомов углерода, или циклоалкил, содержащий от 3 до 6 атомов углерода. Данное изобретение также относится к способам получения указанных соединений и к содержащей их фармацевтической композиции. Соединения настоящего изобретения являются агонистами β2-рецептора и могут использоваться для лечения астмы и бронхита. 5 н. и 4 з.п. ф-лы, 1 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым соединениям для лечения астмы и бронхита, в особенности к новым фенилэтаноламиновым соединениям в качестве агонистов β2-рецептора.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Астма и бронхит являются распространенными заболеваниями. В общем случае их лечат антибиотиками, которые не очень эффективны и при длительном применении обладают побочным эффектом. Хорошо известно, что агонисты β2-рецептора могут служить противоастматическими средствами. Однако действие данных средств, а также их физические и химические свойства имеют недостатки.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение относится к фенилэтаноламиновым соединениям формулы (I) и их фармацевтически приемлемым солям:
где
R1 обозначает Н, хлор или бром;
R2 обозначает группы, имеющие сродство к электронам, выбранные из группы, состоящей из CF3, CN, фтора, COSO3Н, CF3SO3 и NO2;
R3 обозначает линейный или разветвленный алкил, содержащий от 1 до 10 атомов углерода, линейный или разветвленный алкоксиалкил, содержащий от 2 до 10 атомов углерода, алифатический спирт, содержащий от 1 до 10 атомов углерода, или циклоалкил, содержащий от 3 до 6 атомов углерода.
В соответствии с одним воплощением изобретения R2 обозначает предпочтительно CF3 или CN.
В соответствии с другим воплощением изобретения R3 обозначает линейный или разветвленный алкил, содержащий от 1 до 6 атомов углерода, линейный или разветвленный алкокси, содержащий от 2 до 6 атомов углерода, алифатический спирт, содержащий от 1 до 6 атомов углерода, или циклоалкил, содержащий от 3 до 6 атомов углерода.
Термин "фармацевтически приемлемая соль" в данном описании относится к обычным кислотно-аддитивным или основно-аддитивным солям, которые сохраняют биологическую активность и свойства соединений формулы (I) и которые получают с использованием подходящих нетоксичных органических или неорганических кислот или органических или неорганических оснований. Примеры кислотно-аддитивных солей включают соли, образованные неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, фосфорная кислота и азотная кислота, соли, образованные органическими кислотами, такими как уксусная кислота, винная кислота, салициловая кислота, метансульфоновая кислота, бутандиовая кислота, лимонная кислота, яблочная кислота, молочная кислота, фумаровая кислота и подобные. Примеры основно-аддитивных солей включают соли калия, натрия, аммония. В частности, предпочтительными фармацевтически приемлемыми солями соединений формулы (I) являются гидрохлорид или гидробромид.
В настоящем изобретении также предлагается способ получения соединений формулы (I), включающий
взаимодействие свободного основания формулы (III) или его фармацевтически приемлемых солей
где R1 и R2 такие, как определены выше,
с соединениями формулы (IV)
H2NR3, (IV)
где R3 такой, как определен выше.
Соединения формулы (I) можно получить вышеуказанными способами. Взаимодействие соединений формулы (III) и соединений формулы (IV) проводят в безводных условиях, например, используя в качестве растворителя спирты, такие, как безводный этанол или ароматические углеводороды, такие, как толуол, при температуре кипения растворителя в течение 10-15 ч. Выход составляет 20-30%.
В настоящем изобретении соединения формулы (III) можно получить по следующей схеме:
где в качестве свободного основания формулы (II) или его фармацевтически приемлемых солей можно использовать п-аминоацетофенон.
Способ получения соединений формулы (V) из соединений формулы (II) хорошо известен специалистам в данной области (например, Kurger G, Keck J. And Pieper H., Synthesis of amino-Halogen-Substituted Phenyl-aminoethanols. Arzneim Forsch./Drug res. 34(11), Nr. Ba, 1984:1612-1624, которая включена в данное описание в качестве ссылки).
Соединения формулы (III) получают восстановлением соединений формулы (V) боргидридом калия в метаноле и воде при комнатной температуре в течение 5 ч.
Настоящее изобретение также относится к фармацевтической композиции, содержащей по меньшей мере одно соединение формулы (I) или его фармацевтически приемлемые соли. Фармацевтическая композиция настоящего изобретения дополнительно включает один или несколько фармацевтически приемлемых наполнителей и другие активные ингредиенты.
Термин "фармацевтически приемлемые наполнители" относится к наполнителям, которые могут применяться в фармацевтической области, то есть, в основном являются безопасными, нетоксичными, не обладают биологической активностью и не оказывают нежелательного действия. Данные наполнители также включают лактозу, крахмал, воду, спирт и подобные.
Фармацевтическая композиция настоящего изобретения также может включать пропелленты, антисептические средства, солюбилизирующие средства, стабилизирующие средства, увлажняющие средства, эмульгаторы, подсластители, красители, ароматизаторы, соли для регуляции осмотического давления, буфер, покрывающие средства, антиоксиданты и подобные. Фармацевтическая композиция настоящего изобретения также может включать другие терапевтически полезные вещества, например, активные ингредиенты, отличные от соединения формулы (I).
Фармацевтическая композиция настоящего изобретения может быть получена в виде таблеток, капсул, растворов, спреев, препаратов для инъекций и подобных. Ее можно вводить перорально, парентерально, распылением, вдыханием через оральную или назальную полость, или другим способом.
Соединения настоящего изобретения являются агонистами β2-рецептора и могут использоваться для лечения астмы и бронхита. Настоящее изобретение относится к применению соединения формулы (I) для получения лекарственных средств, обладающих действием агонистов β2-рецептора. Настоящее изобретение также относится к применению соединения формулы (I) для получения лекарственных средств для лечения астмы и бронхита.
Соединения настоящего изобретения можно вводить в терапевтически эффективном количестве. Термин "терапевтически эффективное количество" обозначает количество, которое позволяет обеспечивать эффективную профилактику заболевания, эффективное облегчение и улучшение состояния заболевания. "Терапевтически эффективное количество" может установить специалист в данной области.
Терапевтически эффективное количество или доза может изменяться в широком диапазоне и может устанавливаться индивидуально в каждом отдельном случае. Как правило, для взрослых с массой приблизительно 70 кг предпочтительно доза составляет приблизительно 50 мкг-10 мг/день при пероральном или парентеральном введении. При необходимости верхняя и нижняя границы дозы могут быть изменены. Дневная доза может быть введена в один прием или разделена на несколько раз.
Соединения настоящего изобретения можно получить по описанной выше схеме, используя известные способы синтеза. Нижеследующие примеры иллюстрируют предпочтительный способ синтеза данных соединений.
ПРИМЕР 1
Гидрохлорид 2-(4-амино-3-хлор-5-трифторметилфенил)-2-трет-бутиламиноэтанола
a. Получение 4-амино-3-хлор-5-трифторметилбензоилхлорида
13 г (0,0543 моль) 4-амино-3-хлор-5-трифторметилбензойной кислоты добавляют к 32,5 мл тионилхлорида. Суспензию нагревают до растворения кристаллов, затем кипячение с обратным холодильником продолжают еще 2 ч. После охлаждения до комнатной температуры оставшийся тионилхлорид упаривают при пониженном давлении, получая неочищенный 3-хлор-4-амино-5-трифторметилбензоилхлорид, который растворяют в хлороформе при нагревании. Фильтруют при нагревании и упаривают при пониженном давлении для удаления хлороформа, получая целевой продукт. Выход: 80-90%, температура плавления: 110-115°С.
b. 4-Амино-3-хлор-5-трифторметилацетофенон
В колбу при комнатной температуре добавляют 1,31 г (0,0535 моль) магниевой стружки, 1,6 мл абсолютного этанола и 0,12 мл четыреххлористого углерода. При нагревании добавляют 14,6 мл абсолютного тетрагидрофурана с такой скоростью, при которой поддерживается кипение с обратным холодильником. Продолжая кипячение с обратным холодильником и перемешивание, к вышеуказанному реакционному раствору добавляют по каплям смесь 8,1 мл (0, 0534 моль) диэтилмалоната, 4,8 мл абсолютного этанола и 5,6 мл тетрагидрофурана в течение 1 ч, продолжая кипячение с обратным холодильником в течение 2 ч. 13,1 г (0,051 моль) 4-амино-3-хлор-5-трифторметилбензолхлорида растворяют в 43,5 мл тетрагидрофурана, добавляя по каплям в течение 0,5 ч. После окончания добавления кипячение с обратным холодильником продолжают 2 ч. После охлаждения до комнатной температуры добавляют по каплям 2 н серную кислоту для доведения рН до 2. Органическую фазу отделяют и упаривают при пониженном давлении, получая масло. Добавляют смесь 45,8 мл ледяной уксусной кислоты, 30,6 мл воды и 5,7 мл концентрированной серной кислоты и нагревают с обратным холодильником в течение 5 ч. Упаривают при пониженном давлении для удаления растворителя. Полученное твердое вещество растворяют в хлороформе. Добавляют воду со льдом и рН доводят до 8, используя 50% раствор гидроксида натрия. Хлороформную фазу отделяют, промывают водой, сушат, фильтруют и упаривают при пониженном давлении для удаления хлороформа. Получают неочищенное вещество. Выход: 75-85%, температура плавления: 120-130°С.
c. 4-Амино-3-хлор-5-трифторметил-альфа-бромацетофенон
8,5 г (0,0358 моль) 4-амино-3-хлор-5-трифторметилацетофенона растворяют в 85 мл ледяной уксусной кислоты. При 45-50°С по каплям добавляют раствор 2 мл (0,0394 моль) брома в 17 мл ледяной уксусной кислоты. Нагревание продолжают еще 30 мин. Уксусную кислоту упаривают, масляный остаток помещают в 100 мл этилацетата, промывают раствором гидрокарбоната натрия и водой в указанном порядке, сушат и упаривают при пониженном давлении, получая неочищенный продукт, который перекристаллизовывают из смеси растворителей толуол/гексан с получением очищенных кристаллов. Выход: 50-60%, температура плавления: 113-115°С.
d. 5,6 г (0,01769 моль) 4-амино-3-хлор-5-трифторметил-альфа-бромацетофенона растворяют в 56 мл метанола и добавляют 4,9 мл воды. При комнатной температуре маленькими порциями добавляют 0,96 г (0,1769 моль) боргидрида калия и реакционную смесь перемешивают 5 ч, затем охлаждают до 0°С водой со льдом и осторожно подкисляют до рН 2 2 н хлористоводородной кислотой. Упаривают при пониженном давлении и оставшуюся массу растворяют в 11,2 мл воды и экстрагируют хлороформом (3×10 мл). Органическую фазу промывают водой до получения нейтрального рН, сушат над безводным MgSO4 и упаривают досуха, получая (4-амино-3-хлор-5-трифторметилфенил)этиленоксид в виде масла. Выход: 85-95%;
1Н ЯМР(DMSO-d6) δ: 2,88 (2Н, д), 3,89 (1Н, т), 7,08 (1Н, с), 7,24 (1Н, с)
e. 5,2 г (0,022 моль) (4-амино-3-хлор-5-трифторметилфенил)этиленоксида растворяют в 26 мл безводного этанола и обрабатывают 5,1 мл (0,049 моль) трет-бутиламина. Смесь кипятят с обратным холодильником 13 ч и затем упаривают. Остаток экстрагируют 2 н хлористоводородной кислотой несколько раз. Водные слои объединяют, экстрагируют толуолом и обрабатывают активированным углем. рН доводят до 10 20% раствором гидроксида натрия. Осадок собирают фильтрацией, получая 2-(4-амино-3-хлор-5-трифторметилфенил)-2-трет-бутиламиноэтанол. Выход: 20-30%; температура плавления: 85-90°С.
f. 1,0 г 2-(4-амино-3-хлор-5-трифторметилфенил)-2-трет-бутиламиноэтанола растворяют в 20 мл диэтилового эфира и фильтруют. Добавляют по каплям насыщенный раствор хлористого водорода в изопропаноле и подкисляют до рН 2. Осадок собирают фильтрацией, промывают безводным эфиром и сушат, получая неочищенный гидрохлорид 2-(4-амино-3-хлор-5-трифторметилфенил)-2-трет-бутиламиноэтанола. Неочищенный продукт растворяют в абсолютном этаноле в соотношении 1:5 мас./об. Фильтруют, по каплям добавляют безводный эфир до осаждения небольшого количества кристаллов. Лиофилизируют и фильтруют, получая гидрохлорид 2-(4-амино-3-хлор-5-трифторметилфенил)-2-трет-бутиламиноэтанола. Выход: 80-90%; температура плавления: 205-206°С (разложение). 1Н ЯМР(DMSO-d6) δ: 1,24 (9Н, с), 3,77 (2Н, д), 4,42-4,44 (1Н, м), 7,72 (1Н, с), 7,87 (1Н, с).
ПРИМЕР 2
a. Получение 3-иод-4-аминоацетофенона
40 г 4-аминоацетофенона, 150 г йода и 59,4 г карбоната кальция растворяют в 1,2 л метанола и 230 мл воды и перемешивают при комнатной температуре в течение 70-80 ч. Добавляют тиосульфат натрия, перемешивают, фильтруют и упаривают. Водный слой экстрагируют хлороформом и последовательно промывают тиосульфатом натрия и водой. Упаривают, получая продукт в виде красно-коричневого масла. Выход 60-90%.
b. Получение 3-циано-4-аминоацетофенона
Полученный на предыдущей стадии 3-иод-4-аминоацетофенон растворяют в 95 мл ДМФ и добавляют 20,9 г CuCN. Кипятят с обратным холодильником при перемешивании в течение 6 ч и охлаждают до 100°С. Реакционную смесь выливают в воду объемом 2 л и охлаждают. Осадок отфильтровывают, сушат на воздухе и экстрагируют ТГФ. Упаривают, промывают этанолом, фильтруют и сушат, получая продукт в виде желтых кристаллов. Выход: 56,9%; температура плавления 150-152°С.
c. Получение 3-циано-4-амино-альфа-бромацетофенона
Смесь 20,0 г 3-циано-4-аминоацетофенона и 54,28 г бромида меди в 300 мл ТГФ кипятят с обратным холодильником в течение 4 ч, охлаждают и фильтруют при комнатной температуре. Фильтрат перегоняют в вакууме для удаления ТГФ. Остаток промывают небольшим количеством этанола, получая указанный в заголовке продукт в виде желтого твердого вещества. Выход: 94,8%; температура плавления 160-161°С (разложение).
d. Получение 3-циано-4-амино-5-бромацетофенона
2,0 г 3-циано-4-амино-альфа-бромацетофенона растворяют в 40 мл ледяной уксусной кислоты. Перемешивают и нагревают до 35°С. К раствору маленькими порциями добавляют 1,48 г NBS и продолжают перемешивание в течение 1 ч при той же температуре, затем выливают в воду объемом 120 мл. Осадок отфильтровывают и сушат, получая указанный в заголовке продукт в виде желтого твердого вещества. Выход: 82,8%; температура плавления 165-167°С.
ПРИМЕР 3
Гидрохлорид 2-(4-амино-3-хлор-5-трифторметилфенил)-2-изопропиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,08 (6Н, д), 2,84-2,86 (1Н, м), 3,80 (2Н, д), 4,37-4,39 (1Н, м), 7,70 (1Н, с), 7,80 (1Н, с).
ПРИМЕР 4
Гидрохлорид 2-(4-амино-3-хлор-5-трифторметилфенил)-2-циклопентиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,62-1,64 (4Н, м), 1,65-1,69 (4Н, м), 2,64-2,68 (1Н, м), 3,79 (2Н, д), 4,43-4,46 (1Н, м), 7,62 (1Н, с), 7,77 (1Н, с).
ПРИМЕР 5
Гидрохлорид 2-(4-амино-3-хлор-5-трифторметилфенил)-2-циклогексиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,29-1,31 (6Н, м), 1,40-1,44 (4Н, м), 2,78-2,81 (1Н, м), 3,74 (2Н, д), 4,39-4,41 (1Н, м), 7,62 (1Н, с), 7,89 (1Н, с).
ПРИМЕР 6
Гидрохлорид 2-(4-амино-3-бром-5-трифторметилфенил)-2-трет-бутиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,25 (9Н, с), 3,76 (2Н, д), 4,40-4,42 (1Н, м), 7,62 (1Н, с), 7,78 (1Н, с).
ПРИМЕР 7
Гидрохлорид 2-(4-амино-3-бром-5-трифторметилфенил)-2-изопропиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,08 (6Н, д), 2,83-2,86 (1Н, м), 3,82 (2Н, д), 4,32-4,34 (1Н, м), 7,76 (1Н, с), 7,90 (1Н, с).
ПРИМЕР 8
Гидрохлорид 2-(4-амино-3-бром-5-трифторметилфенил)-2-циклопропиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 0,80-0,86 (4Н, м), 1,60-1,63 (1Н, м), 3,82 (2Н, д), 4,40-4,42 (1Н, м), 7,69 (1Н, с), 7,88 (1Н, с).
ПРИМЕР 9
Гидрохлорид 2-(4-амино-3-бром-5-трифторметилфенил)-2-циклобутиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 2,00-2,05 (2Н, м), 2,14-2,18 (4Н, м), 3,13-3,16 (1Н, м), 3,79 (2Н, д), 4,40-4,42 (1Н, м), 7,68 (1Н, с), 7,78 (1Н, с).
ПРИМЕР 10
Гидрохлорид 2-(4-амино-3-хлор-5-цианофенил)-2-трет-бутиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,26 (9Н, с), 3,75 (2Н, д), 4,39-4,41 (1Н, м), 7,79 (1Н, с), 7,92 (1Н, с).
ПРИМЕР 11
Гидрохлорид 2-(4-амино-3-хлор-5-цианофенил)-2-изопропиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,08 (6Н, д), 2,82-2,86 (1Н, м), 3,78 (2Н, д), 4,38-4,40 (1Н, м), 7,75 (1Н, с), 7,89 (1Н, с).
ПРИМЕР 12
Гидрохлорид 2-(4-амино-3-хлор-5-цианофенил)-2-циклобутиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 2,05-2,07 (2Н, м), 2,11-2,16 (4Н, м), 3,10-3,13 (1Н, м), 3,77 (2Н, д), 4,41-4,43 (1Н, м), 7,78 (1Н, с), 7,88 (1Н, с).
ПРИМЕР 13
Гидрохлорид 2-(4-амино-3-хлор-5-цианофенил)-2-циклопентиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,62-1,65 (4Н, м), 1,67-1,69 (4Н, м), 2,53-2,57 (1Н, м, 3,75 (2Н, д), 4,44-4,46 (1Н, м), 7,72 (1Н, с), 7,97 (1Н, с).
ПРИМЕР 14
Гидрохлорид 2-(4-амино-3-бром-5-цианофенил)-2-трет-бутиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,24 (9Н, с), 3,72 (2Н, д), 4,36-4,38 (1Н, м), 7,75 (1Н, с), 7,95 (1Н, с).
ПРИМЕР 15
Гидрохлорид 2-(4-амино-3-бром-5-цианофенил)-2-изопропиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,06 (6Н, д), 2,84-2,87 (1Н, м), 3,75 (2Н, д), 4,40-4,43 (1Н, м), 7,79 (1Н, с), 7,89 (1Н, с).
ПРИМЕР 16
Гидрохлорид 2-(4-амино-3-бром-5-цианофенил)-2-циклобутиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 2,10-2,13 (2Н, м), 2,14-2,17 (4Н, м), 3,13-3,16 (1Н, м), 3,76 (2Н, д), 4,40-4,43 (1Н, м), 7,78 (1Н, с), 7,92 (1Н, с).
ПРИМЕР 17
Гидрохлорид 2-(4-амино-3-бром-5-цианофенил)-2-циклопентиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,60-1,63 (4Н, м), 1,65-1,68 (4Н, м), 2,51-2,53 (1Н, м), 3,73 (2Н, д), 4,42 (1Н, м), 7,78 (1Н, с), 7,87 (1Н, с).
ПРИМЕР 18
Гидрохлорид 2-(4-амино-3-бром-5-цианофенил)-2-циклогексиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,30-1,35 (6Н, м), 1,45-1,49 (4Н, м), 2,80-2,86 (1Н, м), 3,76 (2Н, д), 4,38-4,43 (1Н, м), 7,76 (1Н, с), 7,89 (1Н, с).
ПРИМЕР 19
Гидрохлорид 2-(4-амино-3-цианофенил)-2-трет-бутиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,25 (9Н, с), 3,72 (2Н, д), 4,41-4,42 (1Н, м), 7,62 (1Н, д), 7,70 (1Н, с), 7,85 (1Н, д).
ПРИМЕР 20
Гидрохлорид 2-(4-амино-3-цианофенил)-2-изопропиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,08 (6Н, д), 2,77-2,79 (1Н, м), 3,79 (2Н, д), 4,43-4,46 (1Н, м), 7,69 (1Н, д), 7,72 (1Н, с), 7,80 (1Н, д).
ПРИМЕР 21
Гидрохлорид 2-(4-амино-3-цианофенил)-2-циклобутиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 2,09-2,11 (2Н, м), 2,13-2,19 (4Н, м), 3,18-3,21 (1Н, м), 3,75 (2Н, д), 4,38-4,31 (1Н, м), 7,68 (1Н, д), 7,75 (1Н, с), 7,82 (1Н, д).
ПРИМЕР 22
Гидрохлорид 2-(4-амино-3-цианофенил)-2-циклопентиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,62-1,65 (4Н, м), 1,68-1,72 (4Н, м), 2,53-2,56 (1Н, м), 3,70 (2Н, д), 4,48-4,51 (1Н, м), 7,68 (1Н, д), 7,73 (1Н, с), 7,87 (1Н, д).
ПРИМЕР 23
Гидрохлорид 2-(4-амино-3-цианофенил)-2-циклопропиламиноэтанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 0,89-0,93 (4Н, м), 1,23-1,26 (1Н, м), 3,75 (2Н, д), 4,38-4,42 (1Н, м), 7,69 (1Н, д), 7,76 (1Н, с), 7,80 (1Н, д).
ПРИМЕР 24
Гидрохлорид 2-(4-амино-3-хлор-5-трифторметилфенил)-2-(2-метил-3-гидрокси-2-пропиламино)этанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,18 (6Н, с), 3,61 (2Н, с), 3,94 (2Н, д), 4,20-4,23 (1Н, м), 6,95 (1Н, с), 7,11 (1Н, с).
ПРИМЕР 25
Гидрохлорид 2-(4-амино-3-бром-5-трифторметилфенил)-2-(2-метил-3-гидрокси-2-пропиламино)этанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,18 (6Н, с), 3,68 (2Н, с), 3,94 (2Н, д), 4,18-4,21 (1Н, м), 7,06 (1Н, с), 7,08 (1Н, с).
ПРИМЕР 26
Гидрохлорид 2-(4-амино-3-хлор-5-цианофенил)-2-(2-метил-3-гидрокси-2-пропиламино)этанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,17 (6Н, с), 3,62 (2Н, с), 4,01 (2Н, д), 4,16-4,18 (1Н, м), 7,09 (1Н, с), 7,20 (1Н, с).
ПРИМЕР 27
Гидрохлорид 2-(4-амино-3-бром-5-цианофенил)-2-(2-метил-3-гидрокси-2-пропиламино)этанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,19 (6Н, с), 3,60 (2Н, с), 3,98 (2Н, д), 4,06-4,09 (1Н, м), 7,09 (1Н, с), 7,32 (1Н, с).
ПРИМЕР 28
Гидрохлорид 2-(4-амино-3-цианофенил)-2-(2-метил-3-гидрокси-2-пропиламино)этанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,20 (6Н, с), 3,56 (2Н, с), 3,98 (2Н, д), 4,10-4,13 (1Н, м), 6,60 (1Н, д), 7,13 (1Н, с), 7,20 (1Н, д).
ПРИМЕР 29
Гидробромид 2-(4-амино-3-хлор-5-трифторметилфенил)-2-трет-бутиламиноэтанола
1,0 г 2-(3-хлор-4-амино-5-трифторметилфенил)-2-трет-бутиламиноэтанола растворяют в 20 мл безводного диэтилового эфира и раствор подкисляют до рН 2, добавляя по каплям при перемешивании раствор бромистоводородной кислоты в изопропаноле. Осадок собирают фильтрацией, промывают небольшим количеством безводного диэтилового эфира и сушат, получая неочищенный гидробромид 2-(4-амино-3-хлор-5-трифторметилфенил)-2-трет-бутиламиноэтанола. Неочищенный продукт растворяют в абсолютном этаноле в соотношении 1:5 масс./об. Фильтруют и по каплям добавляют безводный диэтиловый эфир до выпадения небольшого количества кристаллов. Лиофилизируют и фильтруют, получая гидробромид 2-(4-амино-3-хлор-5-трифторметилфенил)-2-трет-бутиламиноэтанола. Выход: 80-90%; температура плавления 208-210°С (разложение). 1Н ЯМР(DMSO-d6) δ: 1,24 (9Н, с), 3,79 (2Н, д), 4,46-4,51 (1Н, м), 7,72 (1Н, с), 7,89 (1Н, с).
ПРИМЕР 30
Гидрохлорид 2-(4-амино-3-хлор-5-трифторметилфенил)-2-(3-этокси-2-пропиламино)этанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,08 (3Н, т), 1,84-1,98 (2Н, м), 2,71-2,84 (2Н, м), 3,32-3,39 (4Н, м), 3,82 (2Н, д), 4,25-4,27 (1Н, м), 5,60 (1Н, с), 5,90 (2Н, с), 7,69 (1Н, с0, 7,87 (1Н, с), 9,39 (2Н, с).
ПРИМЕР 31
Гидрохлорид 2-(4-амино-3-бром-5-трифторметилфенил)-2-(3-этокси-2-пропиламино)этанола получают по способу примера 1.
1Н ЯМР(DMSO-d6) δ: 1,09 (3Н, т), 1,92-1,98 (2Н, м), 2,73-2,78 (2Н, м), 3,30-3,36 (4Н, м), 3,79 (2Н, д), 4,22-4,26 (1Н, м), 5,68 (1Н, с), 5,89 (2Н, с), 7,71 (1Н, с), 7,86 (1Н, с), 9,38 (2Н, с).
ПРИМЕР ТЕСТА НА БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ
Антагонистическое действие соединений настоящего изобретения по отношению к вызванной гистамином бронхоконстрикции оценивают, используя отдельные полоски трахеи морской свинки.
Аппаратура: многоканальное регистрирующее устройство, тензометрический датчик.
Условия: раствор Кребса-Хенслейта (Krebs-Hensleit 2,78 (2Н, м), 3,30-3,36 (4Н, м), 3,79 (2Н, д), 4,22-4,26 (1Н, м), 5,68 (1Н, с), 5,89 (2Н, с), 7,71 (1Н, с), 7,86 (1Н, с), 9,38 (2Н, с).
ПРИМЕР 32
Гидрохлорид 2-(4-амино-3-хлор-5-нитрофенил)-2-трет-бутил-аминоэтанола получают по способу примера 1.
1H ЯМР(DMSO-d6) δ: 1,09 (9Н, с), 3,94 (2Н, м), 4,31 (1Н, д), 7,26 (1Н, с), 7,70 (1Н, с).
ПРИМЕР 33
Гидрохлорид 2-(4-амино-3-хлор-5-нитрофенил)-2-изопропил-аминоэтпанола получают по способу примера 1.
1H ЯМР(DMSO-d6) δ: 1,06 (6Н, д), 2,98 (1Н, м), 3,96 (2Н, м), 4,28 (1Н, д), 7,28 (1Н, с), 7,68 (1Н, с).
ПРИМЕР 34
Гидрохлорид 2-(4-амино-3-хлор-5-нитрофенил)-2-циклопентил-этанола получают по способу примера 1.
1H ЯМР(DMSO-d6) δ: 1,51 (4Н, м), 1,62 (4Н, м), 2,64 (1Н, м), 3,94 (2Н,м), 4,26 (1Н, д), 7,27 (1Н, с), 7,70(1Н, с).
ПРИМЕР 35
Гидрохлорид 2-(4-амино-3-хлор-5-нитрофенил)-2-циклогексил-аминоэтанола получают по способу примера 1.
1H ЯМР(DMSO-d6) δ: 1,45 (6Н, м), 1,52 (4Н, м), 2,57 (1Н, м), 3,93 (2Н, м), 4,3 (1Н, д), 7,24 (1Н, с), 7,66(1Н, с).
ПРИМЕР 36
Гидрохлорид 2-(4-амино-3-хлор-5-фторфенил)-2-трет-бутиламиноэтанола получают по способу примера 1.
1H ЯМР(DMSO-d6) δ: 1,12 (9Н, с), 3,94 (2Н, м), 4,38 (1Н, д), 6,50 (1Н, с), 6,68 (1Н, с).
ПРИМЕР 37
Гидрохлорид 2-(4-амино-3-хлор-5-фторфенил)-2-изопропил-аминоэтанола получают по способу примера 1.
1H ЯМР(DMSO-d6) δ: 1,05 (6Н, д), 2,97 (1Н, м), 3,94 (2Н, м), 4,41 (1Н, d), 6,47 (1Н, с), 6,67 (1H, с).
ПРИМЕР 38
Гидрохлорид 2-(4-амино-3-хлор-5-фторфенил)-2-циклопентил-этанола получают по способу примера 1.
1H ЯМР(DMSO-d6) δ: 1,51 (4Н, м), 1,60 (4Н, м), 2,64 (1H, м), 3,93 (2Н, м), 4,39 (1H, д), 6,43 (1H, с), 6,64 (1Н, с).
ПРИМЕР 39
Гидрохлорид 2-(4-амино-3-хлор-5-фторфенил)-2-циклогексил-аминоэтанола получают по способу примера 1.
1H ЯМР(DMSO-d6) δ: 1,44 (6Н, м), 1,52 (4Н, м), 2,58 (1H, м), 3,98 (2Н, м), 4,5 (1H, д), 6,49 (1H, с), 6,69 (1H, с).
ПРИМЕР 40
Гидрохлорид 2-(4-амино-3-хлор-5-метилсульфонилфенил)-2-трет-бутиламиноэтанола получают по способу примера 1.
1H ЯМР(DMSO-d6) δ: 1,09 (9Н, с), 2,93 (3Н, с), 3,94 (2Н, м), 4,45 (1H, д), 6,7 (1H, с), 7,46 (1H, с).
ПРИМЕР 41
Гидрохлорид 2-(4-амино-3-хлор-5-метилсульфонилфенил)-2-изо-пропиламиноэтанола получают по способу примера 1.
1H ЯМР(DMSO-d6) δ: 1,05 (6Н, д), 2,89 (3Н, с), 2,97 (1Н, м), 3,90 (2Н, м), 4,39 (1Н, д), 7,0 (1Н, с), 7,44 (1Н, с).
ПРИМЕР 42
Гидрохлорид 2-(4-амино-3-хлор-5-метилсульфонилфенил)-2-циклопентилэтанола получают по способу примера 1.
1H ЯМР(DMSO-d6) δ: 1,51 (4Н, m), 1,59 (4Н, м), 2,64 (1Н, м), 2,98 (3Н, с), 3,93 (2Н, м), 4,48 (1Н, д), 6,9 (1Н, с), 7,42 (1Н, с).
ПРИМЕР 43
Гидрохлорид 2-(4-амино-3-хлор-5-метилсульфонилфенил)-2-циклогексиламиноэтанола получают по способу примера 1.
1H ЯМР(DMSO-d6) δ: 1,45 (6Н, м), 1,52 (4Н, м), 2,57 (1Н, м), 2,95 (3Н, с), 3,97 (2Н, м), 4,42 (1Н, д), 7,0 (1Н, с), 7,44 (1Н, с).
ПРИМЕР 44
Гидрохлорид 2-(4-амино-3-хлор-5-трифторметилсульфонилфенил)-2-трет-бутиламиноэтанола получают по способу примера 1.
1H ЯМР(DMSO-d6) δ: 1,12 (9Н, с), 3,94 (2Н, м), 4,39 (1Н, д), 6,93 (1Н, с), 7,45 (1Н, с).
ПРИМЕР 45
Гидрохлорид 2-(4-амино-3-хлор-5-трифторметилсульфонилфенил)-2-изопропиламиноэтанола получают по способу примера 1.
1H ЯМР(DMSO-d6) δ: 1,05 (6Н, д), 2,97 (1Н, м), 3,94 (2Н, м), 4,50 (1Н,д), 6,9 (1Н, с), 7,44 (1Н, с).
ПРИМЕР 46
Гидрохлорид 2-(4-амино-3-хлор-5-трифторметилсульфонилфенил)-2-циклопентилэтанола получают по способу примера 1.
1H ЯМР(DMSO-d6) δ: 1,49 (4Н, м), 1,65 (4Н, м), 2,64 (1Н, м), 3,92 (2Н, м), 4,48 (1Н, д), 6,8 (1Н, с), 7,48 (1Н, с).
ПРИМЕР 47
Гидрохлорид 2-(4-амино-3-хлор-5-трифторметилсульфонилфенил)-2-циклогексиламиноэтанола получают по способу примера 1.
1H ЯМР(DMSO-d6) δ: 1,45 (6Н, м), 1,52 (4Н, м), 2,57 (1Н, м), 3,96 (2Н, м), 4,49 (1Н, д), 7,1 (1Н, с), 7,4 (1Н, с).
ПРИМЕР ТЕСТА НА БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ
Антагонистическое действие соединений настоящего изобретения по отношению к вызванной гистамином бронхоконстрикции оценивают, используя отдельные полоски трахеи морской свинки.
Аппаратура: многоканальное регистрирующее устройство, тензометрический датчик.
Условия: раствор Кребса-Хенслейта (Krebs-Hensleit solution); газообразная смесь (95% О2, 5% CO2); скорость бумаги: 4 мм/мин; 37°С.
Животные: используют морских свинок (Harley, полученных из Центра разведения экспериментальных животных Китайского медицинского университета) любого пола, массой 350-500 г.
Реагент: раствор фосфата гистамина (10-6-10-4 М).
Образец: в зависимости от активности, соединения тестировали при концентрации 10-5 или 3×10-4М.
Способ: Морских свинок умерщвляют и получают препараты трахеи в виде полосок (2 см×3 мм); затем препараты закрепляют при растягивающем усилии 2 г в бане для органов, содержащей 10 мл раствора Кребса-Хенслейтса, при 37°С, насыщенного указанной выше газообразной смесью и препараты оставляют для достижения равновесия в течение 2 ч перед добавлением гистамина. Когда натяжение полосок трахеи достигает 50% по отношению к максимальному сокращению, в баню добавляют тестируемые соединения и антагонистический эффект (представленный как степень релаксации) рассчитывают по следующему уравнению: степень релаксации = (интенсивность сокращения после добавления гистамина - интенсивность сокращения после добавления тестируемых соединений)/(интенсивность сокращения после добавления тестируемых соединений)×100%.
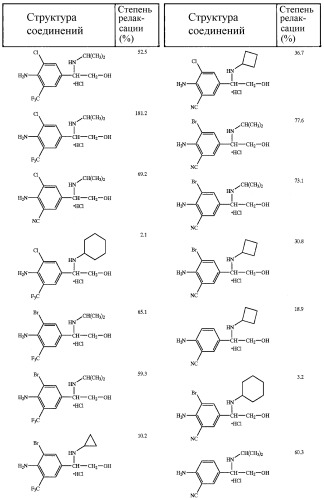
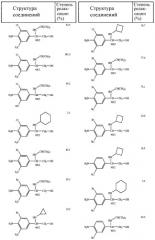
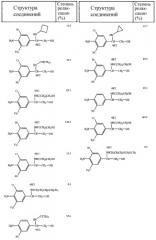
Степень релаксации для каждого соединения приведена в таблице 1.
Таблица 1
Антагонистическое действие активных соединений на сокращение бронхов, вызванное гистамином
Приведенные выше результаты показывают, что соединения настоящего изобретения уменьшают спазм трахеи, вызванный гистамином.
1. Соединения формулы (I)
где R1 обозначает Н, хлор или бром;
R2 обозначает электроноакцепторные группы, выбранные из группы, состоящей из CF3, CN, фтора, COSO3H, CF3SO3 и NO2;
R3 обозначает линейный или разветвленный алкил, содержащий 1 - 10 атомов углерода, линейный или разветвленный алкоксиалкил, содержащий 2 - 10 атомов углерода, алифатический спирт, содержащий 1 - 10 атомов углерода, или циклоалкил, содержащий 3 - 6 атомов углерода;
и его фармацевтически приемлемые соли.
2. Соединение по п.1, где R2 обозначает CF3 или CN.
3. Соединение по п.1, где R3 обозначает линейный или разветвленный алкил, содержащий 1 - 6 атомов углерода, линейный или разветвленный алкокси, содержащий 2 - 6 атомов углерода, алифатический спирт, содержащий 1 - 6 атомов углерода, или циклоалкил, содержащий 3 - 6 атомов углерода.
4. Соединение по п.1, где фармацевтически приемлемыми солями соединений формулы (I) являются гидрохлорид или гидробромид.
5. Способ получения соединений по п.1, включающий
взаимодействие свободного основания формулы (III) или его фармацевтически приемлемых солей
где R1 и R2 такие, как определены выше,
с соединениями формулы (IV)
H2NR3 (IV),
где R3 такой, как определен выше, где взаимодействие проводят в течение 10-15 ч в присутствии безводного растворителя, при температуре кипения растворителя.
6. Способ по п.5, где взаимодействие соединений формулы (III) и соединений формулы (IV) проводят в безводных условиях, используя в качестве растворителя спирты или ароматические углеводороды, при температуре кипения растворителя, в течение 10-15 ч, выход составляет 20-30%.
7. Фармацевтическая композиция, обладающая агонистическим действием в отношении ß2-рецептора, содержащая соединения по любому из пп.1-4 и фармацевтически приемлемые наполнители.
8. Применение соединения по любому из пп.1-4 для производства лекарственных средств, обладающих действием агонистов β2-рецептора.
9. Применение соединения по любому из пп.1-4 для производства лекарственных средств для лечения астмы и бронхита.