Способ получения l-аминокислот с использованием бактерии, принадлежащей к роду escherichia, содержащей неактивный ген gadb
Иллюстрации
Показать всеИзобретение относится к биотехнологии. L-аминокислоты, такие как L-глутаминовая кислота, L-пролин и L-лейцин, получают культивированием бактерий, принадлежащих к роду Escherichia, в которых инактивирован ген gadB, кодирующий изозим глутаматдекарбоксилазы. В качестве штаммов-продуцентов используют штаммы E.coli VL 334 thrC+ΔgadB::cat, E.coli 702ilvA Δ gadB::cat, E.coli 57/pMWleuA 479-ΔgadB::cat. Заявленное изобретение позволяет получать L-аминокислоты с высокой степенью активности. 4 н. и 9 з.п. ф-лы, 2 ил., 3 табл.
Реферат
Область техники
Настоящее изобретение относится к микробиологической промышленности, в частности к способу получения L-аминокислоты, такой как L-глутаминовая кислота, L-пролин и L-лейцин, с использованием бактерии, принадлежащей к роду Escherichia, в которой ген gadB инактивирован.
Описание предшествующего уровня техники
L-аминокислоты, такие как L-глутаминовая кислота, L-пролин и L-лейцин, трандиционно производят методом ферментации с использованием различных бактерий, принадлежащих к родам Escherichia, Corynebacterium, Klebsiella, Erwinia, Pantoea, Enterobactor, Serratia, или мутантов, полученных из них.
Известны штаммы Е. coli, обладающие повышенным уровнем синтеза L-глутаминовой кислоты. В частности, мутанты, полученные из штамма Е. coli К-12, в которых активность 2-кетоглутаратдегидрогеназы снижена или полностью отсутствует, способны синтезировать L-глутаминовую кислоту с достаточно высокой степенью продуктивности (патенты США 5,393,671 и 5,908,768).
Также известно, что некоторые мутанты Е. coli способны продуцировать L-аргинин и L-пролин. Такие мутанты были получены путем отбора среди мутантов, устойчивых к аналогам указанных аминокислот, с последующим клонированием в них некоторых генов, важных для биосинтеза этих аминокислот (патентная заявка Великобритании №2080825 А).
Было установлено, что ауксотрофные по L-изолейцину бактерии Е. coli, дефицитные по гену ilvA, продуцируют L-глутаминовую кислоту. Кроме того, штаммы, дефицитные по гену ilvA, могут быть использованы в качестве исходных штаммов для выведения продуцентов L-пролина и L-аргинина. Другими словами, ауксотрофия по L-изолейцину используется для улучшения продуцентов L-глутаминовой кислоты, L-пролина и L-аргинина (Российская патентная заявка 2000124295).
Ранее было показано, что в трансгенных растениях снижение экспрессии гена gad, кодирующего глутаматдекарбоксилазу, приводит к накоплению в съедобных частях растений свободных аминокислот, таких как L-глутаминовая кислота, L-аспарагин, L-аспарагиновая кислота, L-серин, L-треонин, L-аланин и L-гистидин (выложенная заявка Японии JP2001-238555A2). Также было высказано предположение, что модификация микроорганизмов - продуцентов L-глутаминовой кислоты, принадлежащих к родам Klebsiella, Erwinia или Pantoea, заключающаяся в снижении активности или полной инактивации ферментов, катализирующих реакции, ответвляющиеся от пути биосинтеза L-глутаминовой кислоты, включая глутаматдекарбоксилазу, может привести к увеличению накопления L-глутаминовой кислоты (патент США 6,197,559).
Но к настоящему моменту нет сообщений, подтверждающих, что полная инактивация гена gadB в бактерии - продуценте L-аминокислоты, принадлежащей к роду Escherichia, не влияет на жизнеспособность этой бактерии и приводит к увеличению накопления указанной L-аминокислоты такой бактерией.
Описание изобретения
Целью настоящего изобретения является увеличение продуктивности L-аминокислот штаммов - продуцентов L-аминокислот и предоставление способа получения L-аминокислот с использованием указанных штаммов.
Ранее авторы настоящего изобретения установили, что ауксотрофные по L-изолейцину бактерии, принадлежащие к роду Escherichia, при выращивании в питательной среде, содержащей L-изолейцин в количестве, большем, чем это необходимо для комплементации ауксотрофии по L-изолейцину, образуют γ-аминомасляную кислоту (GABA) (Российская патентная заявка 2002116774). Другими словами, в условиях, когда наличие L-изолейцина не является лимитирующим рост фактором для ауксотрофных по L-изолейцину бактерий, выращивание указанных бактерий приводит к накоплению GABA в питательной среде. Концентрация L-изолейцина в питательной среде должна быть не менее 100 мг/л. Но детальный механизм установленного факта остается неизвестным.
В бактерии, принадлежащей к роду Escherichia, GABA получается при декарбоксилировании L-глутаминовой кислоты, катализируемом глутаматдекарбоксилазами GadA и GadB - продуктами генов gadA и gadB. Но в настоящее время нет сообщений о том, что инактивация гена gadB могла быть использована для продукции L-аминокислот, таких как L-глутаминовая кислота, L-пролин и L-лейцин.
Авторы настоящего изобретения предположили, что предотвращение утилизации L-глутаминовой кислоты в путях, ответвляющихся от основного пути синтеза L-глутаминовой кислоты, таком, например, как получение GABA, может быть полезным для увеличения продукции L-глутаминовой кислоты и других аминокислот, получающихся из L-глутаминовой кислоты, такой как L-пролин, и L-аминокислот, синтезирующихся с использованием L-глутаминовой кислоты в качестве донора аминогруппы, такой как L-лейцин.
Указанная цель была достигнута путем установления того факта, что инактивация гена gadB, кодирующего изозим глутаматдекарбоксилазы, увеличивает продукцию L-аминокислот, таких как L-глутаминовая кислота, L-пролин и L-лейцин. Таким образом было осуществлено настоящее изобретение.
К настоящему изобретению относятся:
1) Бактерия, принадлежащая к роду Escherichia, - продуцент L-аминокислоты, которая модифицирована таким образом, что в ней инактивирован ген gadB.
2) Бактерия - продуцент L-аминокислоты в соответствии с 1), где L-аминокислотой является L-глутаминовая кислота.
3) Бактерия - продуцент L-аминокислоты в соответствии с 2), где указанная бактерия модифицирована для увеличения экспрессии генов биосинтеза L-глутаминовой кислоты.
4) Бактерия - продуцент L-аминокислоты в соответствии с 1), где L-аминокислотой является L-пролин.
5) Бактерия - продуцент L-аминокислоты в соответствии с 4), где указанная бактерия модифицирована для увеличения экспрессии генов биосинтеза L-пролина.
6) Бактерия - продуцент L-аминокислоты в соответствии с 1), где L-аминокислотой является L-лейцин.
7) Бактерия - продуцент L-аминокислоты в соответствии с 6), где указанная бактерия модифицирована для увеличения экспрессии генов биосинтеза L-лейцина.
8) Способ получения L-аминокислоты, включающий стадии:
- выращивания бактерии в соответствии с любым из п.1) -7) в питательной среде с целью продукции и накопления L-аминокислоты, и
- выделения L-аминокислоты из культуральной жидкости.
Настоящее изобретение более детально описано ниже.
1. Бактерия согласно настоящему изобретению
Бактерией согласно настоящему изобретению является бактерия, принадлежащая к роду Escherichia, - продуцент L-аминокислоты, которая модифицирована с целью инактивации гена gadB.
Согласно настоящему изобретению «бактерия - продуцент L-аминокислоты» означает бактерию, обладающую способностью к накоплению L-аминокислоты в питательной среде в условиях, когда бактерия согласно настоящему изобретению выращивается в указанной питательной среде. Способность к продукции L-аминокислоты может быть придана или улучшена путем селекции. Термин «бактерия - продуцент L-аминокислоты», использованный здесь, также означает бактерию, обладающую способностью к продукции и накоплению L-аминокислоты в питательной среде в количестве, большем, чем родительский штамм или штамм дикого типа Е. coli, такой как штамм Е. coli К-12. Предпочтительно, термин «бактерия - продуцент L-аминокислоты», означает бактерию, обладающую способностью к продукции и накоплению в питательной среде не менее 0.5 г/л, более предпочтительно не менее 1 г/л целевой L-аминокислоты.
Термин "бактерия, принадлежащая к роду Escherichia" означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. В качестве примера микроорганизма, принадлежащего к роду Escherichia, использованного в настоящем изобретении, может быть упомянута бактерия Escherichia coli.
Круг бактерий, принадлежащих к роду Escherichia, которые могут быть использованы в настоящем изобретении, не ограничен каким-либо образом, однако, например, бактерии, описанные в Neidhardt, F.C. et al. (Escherichia coli and Salmonella typhimurium, American Society for Microbiology, Washington D.C., 1208, Таблица 1), могут быть упомянуты.
Термин «ген gadB инактивирован» означает, что указанный целевой ген модифицирован таким образом, что модифицированный ген кодирует мутантный белок с пониженным уровнем активности, предпочтительно это означает, что такой ген кодирует абсолютно неактивный белок. Также возможно, что модифицированный участок ДНК не способен к естественной экспрессии белка GadB вследствие делеции части указанного гена или модификации участка, примыкающего к гену.
Инактивация гена gadB, кодирующего изозим глутаматдекарбоксилазы, приводит к увеличению продукции L-аминокислоты, получающейся из глутамата, вследствие предотвращения утилизации глутамата в путях, ответвляющихся от основного, например продукция GABA.
Ген gadB кодирует белок GadB (466 аминокислотных остатков), являющийся изозимом глутаматдекарбоксилазы. Ген gadB (b1493, gi:16129452, номера нуклеотидов с 1568669 по 1570069 в последовательности с инвентарным номером NC_000913.1 в базе данных GenBank), расположен между генами xasA и pqqL в хромосоме штамма Е. coli К-12.
Инактивация указанного гена может быть осуществлена традиционными методами, такими как мутагенез с использованием УФ-излучения или обработка нитрозогуанидином (N-метил-N'-нитро-N-нитрозогуанидин), сайт-направленный мутагенез, разрушение гена с использованием гомологичной рекомбинации и/или инсерционно-делеционный мутагенез (Datsenko K.A. and Wanner B.L., Proc. Natl. Acad. Sci. USA, 2000, 97:12: 6640-45), также называемый "Red-driven integration" (интеграция с использованием Red-системы).
Бактерия согласно настоящему изобретению может быть получена путем инактивации гена gadB в бактерии, уже обладающей способностью к продукции L-аминокислоты. В качестве альтернативы бактерия согласно настоящему изобретению может быть получена путем придания способности к продукции L-аминокислоты бактерии с предварительно инактивированным геном gadB.
Бактерия - продуцент L-глутаминовой кислоты.
В качестве бактерии согласно настоящему изобретению, в которой должен быть инактивирован ген gadB, могут быть использованы бактерии - продуценты L-глутаминовой кислоты.
Примерами бактерий, принадлежащих к роду Escherichia и обладающих способностью к продукции L-глутаминовой кислоты, являются следующие штаммы Е. coli: штаммы, обладающие устойчивостью к антиметаболитам аспарагиновой кислоты и дефицитные по активности α-кетоглутаратдегидрогеназы, например штамм АJ13199 (FERM ВР-5807) (патент США 5,908,768) или штамм FERM Р-12379, дополнительно обладающий низкой активностью по расщеплению L-глутаминовой кислоты (патент США 5,393,671); штамм Е. coli AJ13138 (FERM ВР-5565) (патент США 6,110,714) и подобные им.
Бактерия - продуцент L-пролина.
В качестве бактерии согласно настоящему изобретению, в которой должен быть инактивирован ген gadB, могут быть использованы бактерии - продуценты L-пролина.
Примерами бактерий, принадлежащих к роду Escherichia и обладающих способностью к продукции L-пролина, являются следующие штаммы Е. coli: NRRL В-12403 и NRRL В-12404 (патент Великобритании 2075056); ВКПМ В-8012 (Российская патентная заявка 2000124295); плазмидные мутанты, описанные в патенте Германии 3127361; плазмидные мутанты, описанные Bloom F.R. et al (The 15th Miami winter symposium, 1983, p.34) и подобные им.
Бактерия согласно настоящему изобретению может быть улучшена путем усиления экспрессии одного или нескольких генов, вовлеченных в биосинтез L-пролина. Примерами таких генов для бактерий - продуцентов L-пролина являются гены биосинтеза L-пролина, предпочтительно ген proB, кодирующий глутаматкиназу, в которой чувствительность к ингибированию L-пролином по типу обратной связи утрачена (патент Германии 3127361). В дополнение, бактерия согласно настоящему изобретению может быть улучшена путем усиления экспрессии одного или нескольких генов, кодирующих белки, экскретирующие L-аминокислоты из клетки бактерии. Примерами таких генов являются гены b2682 и b2683 (гены ygaZH) (Российская патентная заявка 2001117632).
Бактерия - продуцент L-лейцина.
В качестве бактерии согласно настоящему изобретению, в которой должен быть инактивирован ген gadB, могут быть использованы бактерии - продуценты L-лейцина.
Примерами бактерий, принадлежащих к роду Escherichia и обладающих способностью к продукции L-лейцина, являются следующие штаммы Е. coli: штаммы, устойчивые к аналогам лейцина, таким как β-2-тиенилаланин, 3-гидроксилейцин, 4-азалейцин, 5,5,5-трифторлейцин (выложенные патентные заявки Японии 62-34397 и 8-70879); штаммы Е. coli, полученные генно-инженерными методами, описанные в заявке РСТ WO 96/06926; штамм Е. coli H-9068 (JP 8-70879A2) и подобные им.
Бактерия согласно настоящему изобретению может быть улучшена путем усиления экспрессии одного или нескольких генов, вовлеченных в биосинтез L-лейцина. Примерами таких генов являются гены оперона leuABCD, предпочтительно ген leuA, кодирующий изопропилмалатсинтазу, нечувствительную к ингибированию L-лейцином по типу обратной связи (патент США 6,403,342). В дополнение, бактерия согласно настоящему изобретению может быть улучшена путем усиления экспрессии одного или нескольких генов, кодирующих белки, экскретирующие L-аминокислоты из клетки бактерии. Примерами таких генов являются гены b2682 и b2683 (гены ygaZH) (Российская патентная заявка 2001117632).
Методы получения плазмидных ДНК, расщепления и лигирования ДНК, трансформации, подбора олигонуклеотидов в качестве затравок и подобные им являются традиционными методами, хорошо известными специалисту в данной области. Эти методы описаны, например, в Sambrook, J., Fritsch, E.F. and Maniatis, Т., "Molecular Cloning A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989).
Способ согласно настоящему изобретению
Способом согласно настоящему изобретению является способ получения L-аминокислот, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления L-аминокислоты в питательной среде и выделения L-аминокислоты из культуральной жидкости. В частности, способом согласно настоящему изобретению является способ получения L-глутаминовой кислоты, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления L-глутаминовой кислоты в питательной среде и выделения L-глутаминовой кислоты из культуральной жидкости. Также способом согласно настоящему изобретению является способ получения L-пролина, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления L-пролина в питательной среде и выделения L-пролина из культуральной жидкости. А также способом согласно настоящему изобретению является способ получения L-лейцина, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления L-лейцина в питательной среде и выделения L-лейцина из культуральной жидкости
В настоящем изобретении выращивание, выделение и очистка L-аминокислоты из культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам ферментации, в которых аминокислота продуцируется с использованием бактерии.
Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, необходимых для роста бактерий. К источникам углерода относятся различные углеводы, такие как глюкоза и сахароза, а также различные органические кислоты. В зависимости от характера ассимиляции используемого микроорганизма могут использоваться спирты, такие как этанол и глицерин. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов, ферментолизат микроорганизмов. В качестве минеральных добавок могут использоваться фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. В качестве витаминов могут использоваться тиамин и дрожжевой экстракт.
Выращивание осуществляется предпочтительно в аэробных условиях, таких как перемешивание культуральной жидкости на качалке, взбалтывание с аэрацией, при температуре в пределах от 20 до 40°С, предпочтительно в пределах от 30 до 38°С. рН среды поддерживают в пределах от 5 до 9, предпочтительно от 6.5 до 7.2. рН среды может регулироваться аммиаком, карбонатом кальция, различными кислотами, основаниями и буферными растворами. Обычно выращивание в течение от 1 до 5 дней приводит к накоплению целевой L-аминокислоты в культуральной жидкости.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрацией через мембрану, а затем L-аминокислота может быть выделена и очищена методами ионообменной хроматографии, концентрирования и кристаллизации.
Краткое описание рисунков
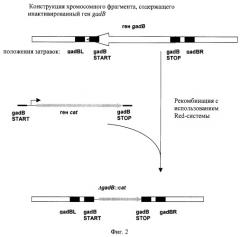
На фиг.1 показаны относительные положения затравок gadBSTART и gadBSTOP на плазмиде pACYC184, использованных для амплификации гена cat. На фиг.2 показана конструкция хромосомного фрагмента, содержащего инактивированный ген gadB.
Наилучший способ осуществления изобретения
Более детально настоящее изобретение будет разъяснено ниже со ссылкой на примеры.
Пример 1. Конструирование штамма с инактивированным геном gadB.
1. Деления в гене gadB
Делеция в гене gadB была получена с использованием метода, впервые разработанного Datsenko и Wanner (Proc. Natl. Acad. Sci. USA, 2000, 97(12), 6640-6645), также называемого рекомбинацией с использованием Red-системы. Для этого были сконструированы затравки для ПЦР gadBSTART (SEQ ID NO: 1) и gadBSTOP (SEQ ID NO: 2), гомологичные как участкам, прилегающим к гену gadB, так и участкам гена cat, придающему устойчивость к антибиотику и находящемуся на плазмиде, использованной в качестве матрицы для ПЦР. Плазмида pACYC148 (NBL Gene Sciences Ltd., UK) (инвентарный номер Х06403 в GenBank/EMBL) была использована в качестве матрицы для ПЦР. Условия ПЦР были следующими: денатурация 3 мин при 95°С; первые два цикла: 1 мин при 95°С, 30 сек при 34°С, 40 сек при 72°С; следующие тридцать циклов: 30 сек при 95°С, 30 сек при 50°С, 40 сек при 72°С; последняя стадия 5 мин при 72°С.
Полученный продукт ПЦР длиной 938 п.о. (Фиг.1, SEQ ID NO: 3) был очищен в агарозном геле и использован для электропорации штамма Е. coli MG1655, содержащего плазмиду pKD46 с термочувствительным репликоном. Плазмида pKD46 (Datsenko и Wanner (Proc. Natl. Acad. Sci. USA, 2000, 97(12), 6640-6645)) содержит фрагмент ДНК длиной 2154 нуклеотида (31088-33241) фага лямбда (инвентарный номер J02459 в GenBank), состоящий из генов системы гомологичной рекомбинации λ Red (гены γ, β, ехо), находящихся под контролем промотора РaraB индуцируемого арабинозой. Плазмида pKD46 необходима для интеграции продукта ПЦР в хромосому штамма MG1655.
Электрокомпетентные клетки были приготовлены следующим образом: ночная культура штамма Е. coli MG1655, выросшая при 30°С в LB среде, содержащей ампициллин (100 мг/л), была разбавлена в 100 раз 5-тью мл среды SOB (Sambrook et al. "Molecular Cloning A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989)) с ампициллином и L-арабинозой (1 mM). Полученную культуру выращивали при аэрации при 30°С до достижения оптической плотности OD600≈0.6 и затем делали электрокомпетентной путем концентрирования в 100 раз и тройной промывкой деионизованной водой, охлажденной во льду. Электропорацию осуществляли, используя 70 мкл клеток и 100 нг продукта ПЦР. После электропорации клетки инкубировали в 1 мл среды SOC (Sambrook et al. "Molecular Cloning A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989)) при 37°С в течение 2,5 часов, после этого высевали на L-агар и растили при 37°С для отбора CmR рекомбинантов. Затем для элиминирования плазмиды pKD46 осуществляли два пассажа на L-агаре с Cm при 42°С и полученные клоны проверяли на чувствительность к ампициллину.
2. Подтверждение наличия делеции в гене gadB методом ПЦР.
Мутанты, содержащие делецию в гене gadB и маркированные геном устойчивости к Cm, были проверены с помощью ПЦР. Для этого были использованы локусспецифические затравки gadBL(SEQ ID NO: 4) и gadBR (SEQ ID NO: 5). Условия ПЦР были следующими: денатурация 3 мин при 94°С; тридцать циклов: 30 сек при 94°С, 30 сек при 52°С, 2 мин при 72°С; последняя стадия 7 мин при 72°С. Продукт ПЦР, полученный с использованием в качестве матрицы ДНК из клеток родительского GadB+ штамма MG1655, был длиной в 1698 пар нуклеотидов (фиг.2, SEQ ID NO: 6). Продукт ПЦР, полученный с использованием в качестве матрицы ДНК из клеток мутантного штамма MG1655 ΔgadB::cat, был длиной в 1217 пар нуклеотидов (фиг.2, SEQ ID NO: 7).
3. Конструирование штамма - продуцента L-глутаминовой кислоты с инактивированным геном gadB.
Штамм VL334 (ВКПМ В-1641) является ауксотрофным по L-изолейцину и L-треонину штаммом, содержащим мутации в генах thrC и ilvA (патент США 4,278,765). Природный аллель гена thrC был перенесен методом общей трансдукции с использованием бактериофага Р1, выращенного на клетках штамма дикого типа Е. coli К-12 (ВКПМ В-7). В результате был получен ауксотрофный по L-изолейцину штамм VL334thrC+. Штамм VL334thrC+ обладал способностью к продукции L-глутаминовой кислоты (Российская патентная заявка 2000124295, Европейская патентная заявка ЕР1172433).
Штамм VL334thrC+ - продуцент L-глутаминовой кислоты был подвергнут стандартной процедуре Р1 трансдукции для получения устойчивости к Cm (Sambrook et al. "Molecular Cloning A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989)). В качестве донора использовали штамм MG1655 ▵gadB::cat. Полученный штамм VL334thrC+ ▵gadB::cat был проверен с помощью ПЦР на наличие делеции ▵gadB::cat с использованием затравок gadBL(SEQ ID NO: 4) и gadBR (SEQ ID NO: 5).
4. Конструирование штамма - продуцента L-пролина с инактивированным геном gadB.
Штамм Е. coli 702ilvA - продуцент L-пролина (ВКПМ В-8012, Российская патентная заявка 2000124295, Европейская патентная заявка ЕР1172433) был подвергнут стандартной процедуре Р1 трансдукции для получения устойчивости к Cm (Sambrook et al. "Molecular Cloning A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989)). В качестве донора использовали штамм MG1655 ΔgadB::cat. Полученный штамм 702ilvA ΔgadB::cat был проверен с помощью ПЦР на наличие делеции ΔgadB::cat с использованием затравок gadBL(SEQ ID NO: 4) и gadBR (SEQ ID NO: 5).
5. Конструирование штамма - продуцента L-лейцина с инактивированным геном gadB.
Штамм Е. coli 57 (ВКПМ В-7368, патент РФ 2140450) трансформирован плазмидой, содержащей фрагмент ДНК с мутантной изопропилмалатсинтазой (IPMS, Gly479 → Cys), описанной в патенте США 6,403,342. Полученный штамм Е. coli 57/pMWleuA479 был подвергнут стандартной процедуре Р1 трансдукции для получения устойчивости к Cm (Sambrook et al. "Molecular Cloning A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989)). В качестве донора использовали штамм MG1655 ΔgadB::cat. Полученный штамм 57/pMWleuA479 ΔgadB::cat был проверен с помощью ПЦР на наличие делеции ΔgadB::cat с использованием затравок gadBL(SEQ ID NO: 4) и gadBR (SEQ ID NO: 5).
Пример 2. Продукция L-глутаминовой кислоты штаммом с инактивированным геном gadB.
Оба штамма VL334thrC+ и VL334thrC+ ΔgadB::cat выращивали в течение 18-24 часов при 37°С на чашках с L-агаром. Затем по одной петле клеток переносили в пробирки, содержащие 2 мл среды для ферментации. Среда для ферментации содержала глюкозу (60 г/л), сульфат аммония (25 г/л), KH2PO4 (2 г/л), MgSO4 (1 г/л), тиамин (0.1 мг/мл) и мел (25 г/л) (рН 7.2). L-изолейцин добавляли в концентрации 70 и 250 мкг/мл. Глюкозу и мел стерилизовали раздельно. Выращивание проводили при 30°С в течение 3 дней с перемешиванием. Количества GABA и L-глутаминовой кислоты определяли методом бумажной хроматографии (состав подвижной фазы: бутанол:уксусная кислота: вода - 4:1:1) с последующим прокрашиванием нингидрином (1% раствор в ацетоне) и элюцией соединений 50% этанолом с 0.5% CdCl2. Результаты представлены в Таблице 1.
| Таблица 1 | ||||
| Штамм | Концентрация L-из 70 мкг/мл | олейцина в среде 250 мкг/мл | ||
| Количество L-Glu, г/л | Количество GABA, г/л | Количество L-Glu, г/л | Количество GABA, г/л | |
| VL334thrC+ VL34thrС+ΔgadB::cat | 6.58.4 | 0 0 | 0.9 6.4 | 6.7 1.1 |
Как видно из Таблицы 1, инактивация гена gadB увеличивала накопление L-глутаминовой кислоты штаммом VL334thrC+ - продуцентом L-глутаминовой кислоты.
Пример 3. Продукция L-пролина штаммом с инактивированным геном gadB.
Оба штамма 702ilvA и 702ilvA ΔgadB::cat выращивали в течение 18-24 часов при 37°С на чашках с L-агаром. Затем эти штаммы выращивали в условиях, идентичных описанным в примере 2. Результаты представлены в Таблице 2.
| Таблица 2 | ||||||
| Концентрация L-изолейцина в среде | ||||||
| Штамм | 70 мкг/мл | 250 мкг/мл | ||||
| Количество | Количество | Количество | Количество | Количество | Количество | |
| L-Pro, г/л | L-Glu, r/л | GABA, г/л | L-Pro, г/л | L-Glu, г/л | GABA, г/л | |
| 702ilvA | 7.1 | 2.8 | 0 | 0 | 0.1 | 4.2 |
| 702ilvA | 7.8 | 1.3 | 0 | 4.2 | 3.3 | 0.4 |
| ΔgadB::cat |
Как видно из Таблицы 2, инактивация гена gadB увеличивала накопление L- пролина штаммом 702ilvA - продуцентом L-пролина.
Пример 4. Продукция L-лейцина штаммом с инактивированным геном gadB.
Оба штамма 57/pMWleuA479 и 57/pMWleuA479 ΔgadB::cat выращивали в течение 18-24 часов при 37°С на чашках с L-агаром. Затем эти штаммы выращивали в условиях, идентичных описанным в примере 2 без добавления изолейцина в среду. Результаты представлены в Таблице 3.
| Таблица 3 | |
| Штамм | Количество L-Leu, г/л |
| 57/pMWleuA47957 /pMWleuA479 ΔgadB::cat | 6.17.5 |
Как видно из Таблицы 2, инактивация гена gadB увеличивала накопление L-лейцина штаммом 57/pMWleuA479 - продуцентом L-лейцина.
1. Способ получения L-аминокислоты, включающий стадии выращивания бактерии, принадлежащей к роду Escherichia, - продуцента L-аминокислоты в питательной среде и выделения L-аминокислоты из культуральной жидкости, отличающийся тем, что в качестве бактерии-продуцента используют бактерию, модифицированную таким образом, что в ней инактивирован ген gadB.
2. Способ по п.1, отличающийся тем, что в качестве бактерии-продуцента L-аминокислоты используют бактерию - продуцент L-глутаминовой кислоты.
3. Способ по п.2, отличающийся тем, что в такой бактерии увеличена экспрессия генов биосинтеза L-глутаминовой кислоты.
4. Способ по п.2, отличающийся тем, что используют штамм бактерии Escherichia coli VL 334thrC+ΔgadB::cat.
5. Способ по п.1, отличающийся тем, что в качестве бактерии-продуцента L-аминокислоты используют бактерию - продуцент L-пролина.
6. Способ по п.5, отличающийся тем, что в такой бактерии увеличена экспрессия генов биосинтеза L-пролина.
7. Способ по п.5, отличающийся тем, что используют штамм бактерии Escherichia coli 702ilvA Δ gadB:: cat.
8. Способ по п.1, отличающийся тем, что в качестве бактерии-продуцента L-аминокислоты используют бактерию - продуцент L-лейцина.
9. Способ по п.8, отличающийся тем, что в такой бактерии увеличена экспрессия генов биосинтеза L-лейцина.
10. Способ по п.8, отличающийся тем, что используют штамм бактерии Escherichia coli 57/pMWleuA479 AgadB::cat.
11. Штамм бактерии Escherichia coli. VL334thrC+AgadB:: cat-продуцент L-глутаминовой кислоты.
12. Штамм бактерий Escherichia coli. 702ilvA A gadB::cat-продуцент L пролина.
13. Штамм бактерии Escherichia coli. 57/pMWleuA479 AgadB::cat-продуцент L-лейцина.