Штамм бактерий sphingobacterium mizutae-32 - продуцент эндонуклеазы рестрикции spmi, узнающей и расщепляющей последовательность нуклеотидов 5'-ат'cgat-3'
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой штамм бактерий Sphingobacterium Mizutae-32, продуцирующий эндонуклеазу рестрикции, названную SpmI, которая узнает и расщепляет последовательность нуклеотидов 5'-AT'CGAT-3'. Штамм выделен из талой воды в результате поиска штаммов-продуцентов эндонуклеазы, способных проявлять высокую активность при низких температурах. Штамм способен расти при температуре 6°С, сохраняет стабильность в течение двух недель хранения при +20°С, а продуцируемый штаммом фермент гидролизует ДНК фага лямбда и Т7 при температуре 6-10°С. Выход фермента из 10 г клеток 300000 ед. акт. 2 ил., 1 табл.
Реферат
Изобретение относится к поиску новых штаммов - продуцентов биологически активных веществ, перспективных для микробиологической промышленности и генной инженерии, и касается получения нового штамма, обладающего свойством роста при низких температурах и продуцирующего сайт-специфическую эндонуклеазу рестрикции, способную узнавать и расщеплять последовательность нуклеотидов 5'-ATCGAT-3'.
Психрофильные микроорганизмы мало изучены из-за их экстремальных условий обитания и трудности их выделения. Однако в настоящее время они привлекают все больше внимания ученых.
Эндонуклеаза рестрикции данной специфичности используется для исследования первичной структуры ДНК, физического картирования различных геномов и ранее не обнаружена в штаммах рода Sphingobacterium.
В настоящее время в литературе описаны изошизомеры данной эндонуклеазы рестрикции [3]. Однако ни один из них не выделялся из психрофильных микроорганизмов и не проявлял оптимума действия ниже 10°С.
Известны несколько штаммов [2-8], способных продуцировать эндонуклеазу рестрикции (сайт узнавания 5'-ATCGAT-3'). Однако ни один из них не относится к роду Sphingobacterium.
В литературе приводятся данные о выходе ферментов для некоторых изошизомеров [4-7]. Выход фермента ClaI из штамма Caryophanon latum L составляет 400 Е/г [6], BsmI из Bacillus species-12000 Е/г [7], а BspXI из Bacillus sphericus - 42000 Е/г [4]. Однако в последнем штамме содержатся два фермента, а не один, как в нашем штамме. Наличие нескольких эндонуклеаз рестрикции всегда затрудняет процесс выделения чистого препарата фермента.
Наиболее доступным и близким к заявляемому штамму является штамм В. Stearothermophilus 29, продуцирующий рестриктазу Bsa29I [3, 5], прототип.
Штамм культивируется при температуре 50°С. Фермент сохраняет активность от двух до шести месяцев хранения при -20°С. Выход фермента составляет 12000 ед/г препарата.
Недостатком данного штамма является невысокий выход эндонуклеазы рестрикции и отсутствие способности расти при низких температурах.
Технической задачей изобретения является получение штамма, продуцирующего эндонуклеазу рестрикции, узнающую и расщепляющую нуклеотидную последовательность 5'-ATCGAT-3', с высоким выходом фермента, стабильного при хранении и способного проявлять высокую активность при низкотемпературных условиях реакции.
Поставленная техническая задача решается выявлением и использованием штамма-продуцента сайт-специфической эндонуклеазы рестрикции SpmI.
В процессе анализа образцов талой воды был выделен штамм Sphingobacterium mizutae, являющийся продуцентом эндонуклеазы рестрикции, названной SpmI согласно общепринятой номенклатуре [1]. Штамм культивируется при низких температурах и является продуцентом эндонуклеазы рестрикции, обладающей высокой активностью при температуре 6-10°С. Фермент является изошизомером известной эндонуклеазы рестрикции ClaI [2], но отличается от выделенных ранее изошизомеров тем, что он более активен при низких температурах и полностью инактивируется при 50°С.
Согласно классификации Бердже этот род был описан еще в 1983 г. и включает 3 вида, выделенные из рода Flavobacterium [8].
Идентификацию проводят общепринятыми методами [9-10].
Штамм обладает следующими свойствами.
Палочки прямые, спор не образуют, грамотрицательные, неподвижные, каталазоположительные. Ферментируют лактозу и сахарозу. Растет на минимальной среде с лактозой. Колонии первоначально белые, непрозрачные, через несколько суток инкубации при комнатной температуре становятся желтыми. Индол не образует, желатину не гидролизует. Образует кислоту из углеводов в результате их окисления, газ не выделяет. Штамм утилизирует рамнозу и характеризуется отсутствием дезоксирибонулеазы; отсутствие образования кислоты при окислении маннитола, этанола и гликогена. Штамм относится к психрофильным микроорганизмам, не растет при 37°С, хорошо растет при температуре 6-20°С.
Вид идентифицирован по определителю [8] как штамм бактерии Sphingobacterium mizutae 32.
Полученный штамм Sphingobacterium mizutae 32 депонирован в НИИ ККМ Государственного Научного Центра вирусологии и биотехнологии "Вектор" под регистрационным номером В-907, а продуцируемая им рестриктаза названа SpmI согласно общепринятой номенклатуре.
Штамм хранится в лиофильном состоянии и в питательной среде с глицерином.
Для культивирования Sphingobacterium mizutae 32 применяют среду следующего состава (г/л): бактотриптон (Difco) 10.0, дрожжевой экстракт (Difco) 5.0, NaCl 5.0, рН 7.0-7.2.
Для получения препарата фермента штамм выращивают в поллитровых колбах в качалке при 200 об/мин и 12-14°С в течение 48 ч или в холодильнике при температуре 6°С. Клетки осаждают центрифугированием при 5000 об/мин и температуре 4-5°С. Выделение проводят путем хроматографической очистки на фосфоцеллюлозе Р-11 ("Whatman", Англия). Все операции по выделению SpmI проводят при температуре 4-5°С. Клетки суспендируют в буфере А (10 мМ калийфосфатный буфер рН 7.5, 7 мМ β-меркаптоэтанол, 0.1 мМ ЭДТА) из расчета 4 мл на 1 г биомассы и разрушают ультразвуком на дезинтеграторе ("MSE", Англия), затем осветляют центрифугированием на центрифуге J-21B ("Bekman", США) со скоростью 18000 об/мин в течение 30 мин. Экстракт наносят на колонку (1.6×14 см) фосфоцеллюлозы Р-11 ("Whatman", Англия), промывают буфером А и смывают фермент в градиенте концентрации NaCl (0.0-0.8 М). Фракции, содержащие рестриктазу, диализуют против буфера В (10 мМ трис-HCl рН 7,5, 1 мМ β-меркаптоэтанол, 0.1 мМ ЭДТА). Фракции с ферментом диализуют против 50%-ного раствора глицерина в буфере А.
Для электрофореза используют агарозу фирмы "Sigma", США. Рестрикционный анализ проводят в 20 мкл реакционной смеси, содержащей 10 мМ трис рН 7.5, 10 мМ MgCl2, 10 мМ NaCl, 1 мМ дитиотреитол (ДТТ) и 1 мкг ДНК λсI857 при температуре 6-10°С.
Выход фермента из 10 г клеток составляет 300000 ед. акт. За единицу активности (Е) принимают минимальное количество фермента, которое в течение 1 ч при температуре 6-10°С в оптимальных условиях полностью гидролизует 1 мкг ДНК фага λcI857.
Штамм является уникальным не только по наличию данной эндонуклеазы рестрикции, но и имеет дополнительные свойства. Клетки штамма способны расти при низких температурах, а фермент гидролизует ДНК фага лямбда и Т7 при температуре 6-10°С.
Определяющим отличием предлагаемого штамма от штамма-прототипа является:
- штамм относится к роду Sphingobacterium и растет при низких температурах,
- высокая продуктивность штамма, превышающая по данному показателю штамм-прототип,
- высокая стабильность фермента (сохранение активности в течение двух недель хранения при +20°С),
- широкий температурный оптимум работы фермента, в результате чего расширяется температурный спектр его использования в области низких температур.
Для определения узнаваемой последовательности нукпеотидов эндонуклеазой рестрикции SpmI проводят сравнение экспериментально полученных путем электрофореза в 1%-ном агарозном геле фрагментов, образующихся при гидролизе ДНК фага λсI857. Результаты сравнительного анализа позволяют сделать вывод, что данная эндонуклеаза рестрикции узнает последовательность нуклеотидов (5'-CTGCAG-3').
На фиг.1 представлена электрофореграмма продуктов гидролиза ДНК фага λсI857 ферментом Spml (дор.1), SpmI и Bsa29I (дор.2) Bsa29I (дор.3), (сайт узнавания 5'-ATCGAT-3') (дор.3).
Как видно из представленной фиг.1, идентичность полос расщепления при параллельном и совместном гидролизе подтверждает их изошизомерию.
Интерпретация полученных экспериментальных данных позволяет утверждать, что исследуемая эндонуклеаза рестрикции является изошизомером рестриктазы Bsa29I и может заменить его во всех молекулярно-биологических и генно-инженерных работах. Также установлено, что Bsa29I и SpmI и имеют общую точку расщепления и гидролизуют ДНК между нуклеотидами Т и С. Таким образом, впервые выделена эндонуклеаза рестрикции из психрофильного штамма, относящегося к роду Sphingobacterium, имеющая оптимальную температуру рестрикции 6-10°С.
Поскольку предлагаемый штамм получен впервые и никогда не использовался, можно сделать вывод о соответствии предлагаемого штамма критериям изобретения "новизна" и "изобретательский уровень".
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1. Получение биомассы и выделение фермента. Перед началом работы клетки штамма-продуцента пересевают бактериологической петлей на агаризованную среду. Косяки помещают в холодильник при температуре 10±2°С. После 42 ч инкубации подросшие клетки пересевают в колбы со свежей питательной средой.
Культивирование проводят в холодильном шкафу "MSE, Англия" при 10±2°С с аэрацией, при перемешивании 200 об/мин. Клетки собирают центрифугированием на центрифуге J-21 при 5000 об/мин и температуре 4-5°С. Дезинтеграцию, выделение и очистку проводят при описанной выше методике.
Пример 2. Определение специфичности и активности фермента. Специфичность фермента определяют по картине параллельного и совместного гидролиза ДНК Фага лямбда (фиг.1). Идентичность картин гидролиза на 1-3 дорожках говорит о том, что эти ферменты узнают и расщепляют одинаковую последовательность нуклеотидов 5'-ATCGAT-3'.
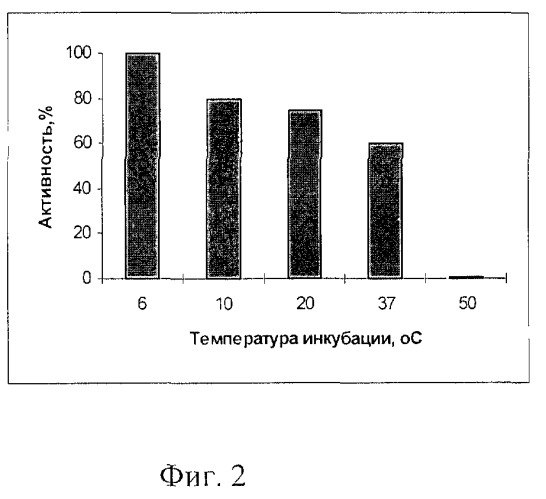
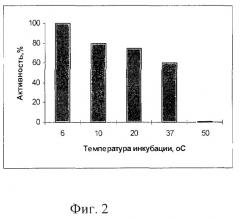
Пример 3. Определение влияния температуры на активность фермента. Гидролиз ДНК фага лямбда проводят в стандартных условиях, но при различных температурах от 6 до 50°С в течение 60 мин. Фермент полностью инактивируется при 50°С, сохраняет свою активность при 37°С, максимальная активность наблюдается при температуре 6-10°С (фиг.2, табл.1).
| Таблица | ||
| Сохранение активности рестриктазы SpmI при разных температурах инкубации | ||
| №п/п | Температура инкубации, °С | Наличие полного гидролиза * |
| 1 | 6 | + |
| 2 | 10 | + |
| 3 | 20 | ± |
| 4 | 37 | ± |
| 5 | 50 | - |
| * - Гидролиз проводят в стандартных условиях с 1 мкг ДНК λсI857, в течение 1 ч |
Поскольку эндонуклеаза рестрикции SpmI имеет сайт узнавания AT^CGAT, идентичный сайту узнавания эндонуклеазы рестрикции Bsa29I, которая также является изошизомером ClaI, она может заменить прототип во всех генно-инженерных работах.
Пример 4. Культивирование штамма. Клетки штамма-продуцента пересевают бактериологической петлей на скошенную агаризованную среду. Культуру на скошенном агаре помещают в термостат на 37±2°С. После 48 ч инкубации роста клеток не наблюдают.
СПИСОК ЛИТЕРАТУРЫ
1. Roberts R.J., Belfort M., Bestor Т., Bhagwat A.S., Bickle T.A., Bitinaite J. // Nucleic Acids Res. - 2003. - V.31. - P.1805-1812.
2. Kessler C., Neumaier P.S., Wolf W., (1985) Gene, vol. 33, pp.1-102.
3. Roberts R.J., Vincze Т., Posfai J., Macelis D. // Nucleic Acids Res. - 2003. - V.31 - P.418-420.
4. Zieger M., Patillon M., Roizes G., Lerouge Т., Dupret D., Jeltsch, J.M.// Nucleic Acids Res - 1987. - V.15 - P.3919.
5. Repin V., Lebedev L., Puchkova L., Serov G., Terechenko Т., Chizikov V., Andreeva I.// Gene. - 1995. - V.157. - №1-2. - P.321-322.
6. Mayer, H., Grosschedl, R., Schutte, H., Hobom, G., Nucleic Acids Res., - 1981. - vol.9, p.4833-4845.
7. Суджювене О.Ф., Тарасов А.П. // Мол. генет. микробиол. вирусология, 1987. №4, с.19-22.
8. Определитель бактерий Берджи. В 2-х т. Т.1; Пер. с англ./ Под ред. Дж.Хоулта, H.Крига, П.Снита, Дж.Стейли, С.Уилльямса. - M.: Мир, 1997. - 432 с.
9. Методы общей бактериологии: Пер. с англ./ Под ред. Ф.Герхардта и др. - M.: Мир, 1984. - 264 с.
10. А.С.Лабинская. Микробиология с техникой микробиологических исследований - M.: Медицина, 1972. - 479 с.
Штамм бактерий Sphingobacterium mizutae-32, депонированный в НИИ коллекции культур микроорганизмов ГНЦ ВБ "Вектор" под №В-907 - продуцент эндонуклеазы рестрикции Spml, узнающей и расщепляющей последовательность нуклеотидов 5'-AT'CGAT-3'.