Способы ингибирования ангиогенеза и роста опухолей
Иллюстрации
Показать всеИзобретение относится к области онкологической фармакологии. Сущность его заключается в разработке способа ингибирования взаимодействия металлопротеиназы 2 с интегрином αvβ3 в клетках хозяина, который включает контактирование интегрина с ингибирующим взаимодействие количеством соединения, представленного формулой где G1 и G2, каждый независимо, представляет -NH-С(O)-O-R1, -NH-С(O)-O-(СН2)v-(С6Н4)-Х3, -NH-С(О)-NH-(СН2)v-(С6H4)-X3, -O-С(О)-NH-(СН2)v-(С6Н4)-X3, -O-С(O)-O-(СН2)v-(С6Н4)-Х3 или -NH-С(O)-СН2-(С6Н4)-Х3, Y1 и Y2, каждый независимо, представляют -ОН, С1-С4 алкил, С1-С4 гидроксиалкил, С1-С4 алкокси, фенил, бензил или -NH2; R1 представляет С1-С4 алкил; X1 и X2, каждый независимо, представляют галоген или С1-С4 алкокси; Х3 представляет галоген, нитро, С1-С4 алкил, С1-С4 алкокси или С1-С4 перфторалкил; Z представляет -С≡С-, -С6Н4-, цис-СН=СН-, транс-СН=СН-, цис-СН2-СН=СН-СН2-, транс-СН2-СН=СН-СН2-, 1,4-нафтил, цис-1,3-циклогексил, транс-1,3-циклогексил, цис-1,4-циклогексил или транс-1,4-циклогексил; А представляет Н или ковалентную связь; m и n, каждый независимо, представляют целое число, имеющее значение 0 или 1; t представляет целое число, имеющее значение 0 или 1; и р, r и v, каждый независимо, представляют целое число, имеющее значение 1 или 2; при условиях, что когда А является Н, t равно 0; когда А является ковалентной связью, t равно 1; когда m равно 0, Y1 представляет С1-С4 гидроксиалкил; и когда n является 0, Y2 представляет С1-С4 гидроксиалкил. Описан также способ индукции апоптоза, включающий введение вышеуказанного вещества в терапевтически эффективном количестве. Технический результат - расширение арсенала противоопухолевых средств. 5 н. и 32 з.п. ф-лы, 9 ил.
Реферат
Область изобретения
Данное изобретение относится к способам ингибирования ангиогенеза и роста опухолей. Более конкретно, данное изобретение относится к способам ингибирования ангиогенеза и роста опухолей с использованием соединений, которые селективно связываются с интегрином αvβ3 и блокируют взаимодействие интегрина αvβ3 с матриксной металлопротеиназой 2 (ММП2).
Исходный уровень техники
Инвазия сосудистых клеток в ткани требует координированного взаимодействия многочисленных факторов, включая протеиназы, которые ремоделируют архитектуру экстраклеточного матрикса, а также молекулы клеточной адгезии, которые распознают этот предварительный матрикс. В недавних сообщениях показано, что 72 кДа матриксная металлопротеиназа 2 (ММП2) играет ключевую роль в развитии сосудов и ангиогенеза. Например, Kitoh et al. (J. Cell Sci., 109, 953-8 (1996)) сообщают, что ММП2 и ее активатор мембранная матриксная металлопротеиназа типа 1 (МТ1-ММП) координированно экспрессируются мезенхимальными клетками почти исключительно во время эмбрионального развития, указывая на специфические ограничения реконструкции матрикса в этих тканях. Кроме того, ангиогенез и соответствующий рост опухолей снижается у дефектных по ММП2 мышей (см. Itoh et al., Cancer Res. 58, 1048-51 (1998)). Интересно, что Saftor et al. (Proc. Natl. Acad. Sci. U.S.A., 89, 1557-61 (1992)) показали, что лигирование интегрина αvβ3, известного как медиатор ангиогенеза, вызывает продукцию ММП2, что наводит на мысль о координированном взаимодействии этих двух молекул во время сосудистого ремоделирования, связанного с формированием кровеносного сосуда (см. также Bafetti et al., J. Biol. Chem., 273, 143-9 (1998)). Фактически прямое взаимодействие между ММП2 и интегрином αvβ3 было продемонстрировано Brooks et al. (Cell, 85, 683-93 (1996)). Негативная регуляция ММП2 во время сосудистой инвазии и созревания, как позднее показано Brooks et al., зависит от экспрессии αvβ3 (Cell, 92, 391-400 (1998)).
Хотя ингибирование ангиогенеза и сопутствующее подавление роста опухоли природными, а также синтетическими ингибиторами ММП, включая ММП2, подтверждено документами, осуществление такой стратегии в клинических условиях имело ограниченный успех, в основном из-за опасных побочных действий таких ингибиторов широкого спектра. Так как действие ММП, в основном, может быть необходимо для многих процессов в организме взрослых, ингибирование активного сайта фермента, вероятно будет оказывать глубокое воздействие на различные биологические процессы, участвующие в ремоделировании тканей, такие как заживление ран. Действительно, было документально подтверждено, что терапия ингибиторами ММП с широким спектром действия при клиническом изучении различных типов рака дает тяжелые побочные эффекты, включая воспалительные тендинит, полиартрит и болевые мышечно-скелетные синдромы, которые ограничивают дозу и часто сохраняются после прерывания терапии. При условии ограниченного распределения интегрина αvβ3 в организме взрослых, однако, можно предсказать, что направленность взаимодействия между ММП2 и αvβ3 на области неоваскуляризации или клеточной инвазии должна соответственно ограничивать действия такой связанной с лечением токсичности. Действительно, рекомбинантный некаталитический карбокси-концевой гемопексиновый домен ММП2 (ПЕКС), который опосредует связывание ММП2 с интегрином αvβ3, продемонстрировал антиангиогенную и противоопухолевую активность in vivo. Потенциальная пригодность такого большого белкового фрагмента, но с сопутствующими недостатками (например, проблемы большого масштаба производства, вопросы качества по требованиям FDA и контроля безопасности и антигенность), привела к потребности в более практичном решении этой проблемы.
Поэтому существует потребность в методах ингибирования ангиогенеза и роста опухолей с использованием химических соединений, которые селективно ингибируют активность ММП в месте роста опухоли с минимальным ингибированием ММП в других частях тела. Существует также потребность в способах специфического связывания с сайтом связывания ММП2 интегрина αvβ3.
Краткое изложение изобретения
Данное изобретение представляет способ ингибирования взаимодействия ММП2 с интегрином αvβ3 и способ ингибирования ангиогенеза в клетках, содержащих интегрин αvβ3. Кроме того, данное изобретение представляет способ ингибирования роста опухоли путем введения ингибиторов взаимодействия ММП2-αvβ3. Активные ингибиторные соединения, представляемые формулой (I) ниже, контактируют с интегрином αvβ3 на клетке, что, в свою очередь, ингибирует связывание ММП2 с αvβ3. Ингибирование связывания ММП с αvβ3 способами данного изобретения приводит к угнетению ангиогенеза и, таким образом, роста опухоли. Кроме того, αvβ3 участвует в воспалении, и, таким образом, соединения формулы (I), используемые в соответствии с методами данного изобретения, могут также подавлять воспалительные проявления.
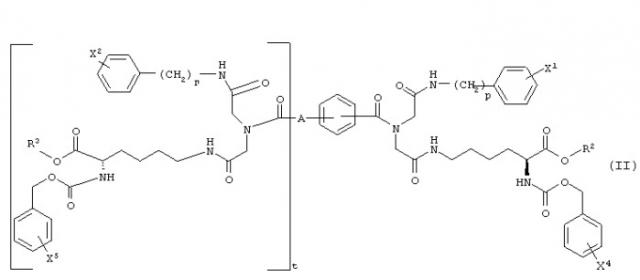
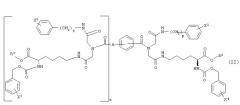
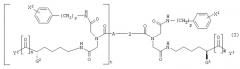
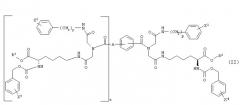
где G1 и G2, каждый независимо, представляет -NH-С(О)-О-R1, -NH-С(О)-О-(СН2)v-(С6Н4)-Х3, -NH-С(О)-NH-(СН2)v-(С6Н4)-Х3, -О-С(О)-NH-(СН2)v-(С6Н4)-Х3, -О-С(О)-О-(СН2)v-(С6Н4)-Х3 или -NH-С(О)-СН2-(С6Н4)-Х3, Y1 и Y2, каждый независимо, представляют -ОН, С1-С4 алкил, С1-С4 гидроксиалкил, С1-С4 алкокси, фенил, бензил или -NH2; R1 представляет С1-С4 алкил, Х1 и Х2, каждый независимо, представляют галоген или С1-С4 алкокси; Х3 представляет галоген, нитро, С1-С4 алкил, С1-С4 алкокси или С1-С4 перфторалкил; Z представляет -С≡С-, -С6Н4-, цис-СН=СН-, транс-СН=СН-, цис-СН2-СН=СН-СН2-, транс-СН2-СН=СН-СН2-, 1,4-нафтил, цис-1,3-циклогексил, транс-1,3-циклогексил, цис-1,4-циклогексил или транс-1,4-циклогексил; А представляет Н или ковалентную связь; m и n, каждый независимо, представляют целое число, имеющее значение 0 или 1; t представляет целое число, имеющее значение 0 или 1; и р, r и v, каждый независимо, представляют целое число, имеющее значение 1 или 2; при условиях, что когда А является Н, t равно 0; когда А является ковалентной связью, t равно 1; когда m равно 0, Y1 представляет С1-С4 гидроксиалкил; и когда n является 0, Y2 представляет С1-С4 гидроксиалкил.
Предпочтительные соединения в границах структурной формулы (I) представлены в структурной формуле (II):
где R2 и R3, каждый независимо, представляют Н, С1-С4 алкил, фенил или бензил; Х1 и Х2, каждый независимо, представляют галоген или С1-С4 алкокси, Х4 и Х5, каждый независимо, представляют галоген, нитро, С1-С4 алкокси, С1-С4 алкил или С1-С4 перфторалкил; А представляет Н или ковалентную связь; р и r, каждый независимо, представляют целое число, имеющее значение 1 или 2; и t представляет целое число, имеющее значение 0 или 1, при условии, что когда А представляет Н, t равно 0, и когда А является ковалентной связью, t равно 1. Когда А является ковалентной связью и t равно 1, иминодиацетамидные производные группы могут быть соединены с бензольной связывающей группой в орто-, мета- или пара-положении.
Когда соединения формул (I) и (II) контактируют с клетками, содержащими αvβ3, связывание αvβ3 с ММП2 ингибируется, таким образом мешая основному механизму ангиогенеза. Воздействие на ангиогенез может также подавлять рост опухолей за счет предотвращения васкуляризации опухоли, таким образом, лишая ее питания. Соединения данного изобретения, ингибирующие ангиогенез и рост опухоли, таким образом, являются полезными терапевтическими средствами для лечения пациентов с опухолевыми и ангиогенными заболеваниями. Так как данные соединения связываются с αvβ3, эти соединения могут также использоваться для подавления явлений воспаления.
Соединения данного изобретения могут быть введены в подходящую фармацевтически приемлемую основу. Фармацевтические композиции с данными активными соединениями назначают пациенту с опухолью для снижения или прекращения роста опухоли. Данные активные соединения можно вводить парентерально путем инъекции или постепенного вливания в течение некоторого времени или любым другим способом, подходящим для конкретной дозированной формы.
Краткое описание фигур
В прилагаемых чертежах:
ФИГ.1 представляет схематическую иллюстрацию, изображающую взаимодействие ММП2 с интегрином αvβ3 и его роль в ангиогенезе.
ФИГ.2 представляет структурные субъединицы А, В и С комбинаторной библиотеки из 600 соединений, описанных у Boger et al., Bioorg. Med. Chem., 6, 1347-1378 (1998).
ФИГ.3 графически иллюстрирует связывание 60 комбинаторных смесей соединений с интегрином αvβ3 при конкуренции с ММП2.
ФИГ.4 иллюстрирует связывание смесей АхВ10 с интегрином αvβ3 и связывание 10 отдельных компонентов А6В10С4.
ФИГ.5 представляет структуры аналогов А6В10С4.
ФИГ.6А графически иллюстрирует связывание аналогов (соединения 2 - 26) А6В10С4 (соединение 1) с интегрином αvβ3 при конкуренции с ММП2.
ФИГ.6В графически иллюстрирует связывание соединений 9 и 19 с интегрином αvβ3 при сравнении с ММП2.
ФИГ.7 иллюстрирует то, что [14С]-меченное соединение 19 специфически связывается с αvβ3 и может быть конкурентно вытеснено с αvβ3 25-кратным избытком немеченного соединения 19, но не избытком соединения 9, пептидом RGD или пептидом с(RGDfV).
ФИГ.8 показывает, что соединение 19 разрывает связь ММП2 с интегрином αvβ3, но не мешает связыванию витронектина с интегрином αvβ3.
ФИГ.9 показывает, что соединение 19 непосредственно не подавляет протеолиза очищенного активного ММП2.
Подробное описание изобретения
Связывание ММП2 с интегрином αvβ3 является важным механизмом в процессе ангиогенеза. Специфическое ингибирование этого взаимодействия со связыванием приводит к снижению васкуляризации в растущих тканях, таких как опухоли, и таким образом, замедляет развитие опухоли. Взаимодействие ММП2 с интегрином αvβ3 графически иллюстрируется на ФИГ. 1. Новая группа ингибиторов ангиогенеза и роста опухолей, описанных ниже, специфически связывается с интегрином αvβ3 при конкуренции с ММП2, представляя, таким образом, важное новое терапевтическое средство.
Некоторые соединения данного изобретения могут иметь один асимметрический центр или более и могут существовать в оптически активных формах. Дополнительные асимметрические центры могут присутствовать в замещающей группе, такой как алкильная группа. Чистые S-изомеры и чистые R-изомеры, рацемические смеси данных изомеров и их смеси, как подразумевается, входят в объем данного изобретения. Хиральные формы некоторых соединений данного изобретения рассмотрены и, в частности, включены в объем данного изобретения.
Термин "алкокси" означает кислородный атом, связанный простой эфирной связью с алкильной группой, которой дано определение ниже, указанного размера. Примерами алкоксигрупп являются метокси, этокси, трет-бутокси и тому подобное. Термин "алкил" означает углеродный радикал с прямой или разветвленной цепью указанного размера. Примерами алкильных радикалов являются метил, этил, н-пропил, изопропил, н-бутил, вторичный бутил, изобутил, трет-бутил, 2-этилгексил, н-октил, 2,4-диметилпентил и тому подобное. Термин "гидроксиалкил" означает алкильную группу, которой дано определение выше, указанного размера, связанную с гидроксильной группой. Примеры включают гидроксиметил, 2-гидроксиэтил, 3-гидрокси-1-пропил, 2-гидрокси-1-пропил, 4-гидроксибутил и тому подобное.
Термин "перфторалкил" относится к алкильной группе указанного размера, которой дано определение ниже, имеющей заместители из атомов фтора вместо каждого водорода, например трифторметил и пентафторэтил.
Термины "галогено" или "галоген" относятся к брому, хлору, фтору и йоду.
Соединения, пригодные для способов данного изобретения, представлены формулой (I) и включают иминодиацетамидные производные, химически соединенные со связывающей группой
где G1 и G2, каждый независимо, представляют -NH-С(О)-О-R1, -NH-С(О)-О-(СН2)v-(С6Н4)-Х3, -NH-С(О)-NH-(СН2)v-(С6Н4)-Х3, -О-С(О)-NH-(СН2)v-(С6Н4)-Х3, -О-С(О)-О-(СН2)v-(С6Н4)-Х3 или -NH-С(О)-СН2-(С6Н4)-Х3, Y1 и Y2, каждый независимо, представляют -ОН, С1-С4 алкил, С1-С4 гидроксиалкил, С1-С4 алкокси, фенил, бензил или -NH2; R1 представляет С1-С4 алкил; Х1 и Х2, каждый независимо, представляют галоген или С1-С4 алкокси; Х3 представляет галоген, нитро, С1-С4 алкил, С1-С4 алкокси или С1-С4 перфторалкил; Z представляет -С≡С-, -С6Н4-, цис-СН=СН-, транс-СН=СН-, цис-СН2-СН=СН-СН2-, транс-СН2-СН=СН-СН2-, 1,4-нафтил, цис-1,3-циклогексил, транс-1,3-циклогексил, цис-1,4-циклогексил или транс-1,4-циклогексил; А представляет Н или ковалентную связь; m и n, каждый независимо, представляют целое число, имеющее значение 0 или 1; t представляет целое число, имеющее значение 0 или 1; и р, r и v, каждый независимо, представляют целое число, имеющее значение 1 или 2; при условиях, что когда А является Н, t равно 0; когда А является ковалентной связью, t равно 1; когда m равно 0, Y1 представляет С1-С4 гидроксиалкил; и когда n равно 0, Y2 представляет С1-С4 гидроксиалкил.
Предпочтительные соединения в границах структурной формулы (I) представлены структурной формулой (II) и включают иминодиацетамидные производные, соединенные с бензольной связывающей группой в или орто-, или мета-, или пара-ориентации:
где R2 и R3, каждый независимо, представляют Н, С1-С4 алкил, фенил или бензил; Х1 и Х2, каждый независимо, представляют галоген или С1-С4 алкокси, Х4 и Х5, каждый независимо, представляют галоген, нитро, С1-С4 алкокси, С1-С4 алкил или С1-С4 перфторалкил; А представляет Н или ковалентную связь; р и r, каждый независимо, представляют целое число, имеющее значение 1 или 2; и t представляет целое число, имеющее значение 0 или 1, при условии, что когда А представляет Н, t равно 0, и когда А является ковалентной связью, t равно 1.
Предпочтительно заместители Х1 и Х2 связаны с фенильным кольцом в 4-положении относительно СН2 групп (т.е. паразаместитель). Предпочтительно, по меньшей мере, один из Х1 и Х2 представляет собой фтор, наиболее предпочтительно Х1 и Х2, оба являются пара-фторо. Предпочтительно r и р равны 2. Х4 и Х5 предпочтительно представляют С1-С4 перфторалкил, наиболее предпочтительно пара-трифторметил. Предпочтительными R2 и R3 группами являются водород и метил. Заместители Х2 и Х3 могут быть одинаковыми или разными, и заместители R2 и R3 также могут быть одинаковыми или разными.
Соединения формул (I) и (II) описаны подробно вместе со способами их синтеза в работе Boger et al., Bioorg. Med. Chem., 6, 1347-1378 (1998), включенной сюда в виде ссылки.
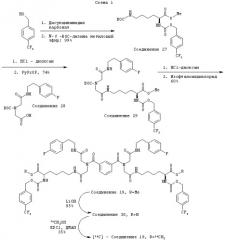
Особенно активным представителем семейства соединений, представляемых формулой (II), где А является ковалентной связью, а t равно 1, является соединение 19 на схеме 1, ниже.
Синтез соединения 19 является иллюстрацией общего способа получения соединений формул (I) и (II), описанного Boger et al. Соединение 19 синтезировали в три стадии, начиная с доступного для приобретения метилового эфира N-ε-ВОС-L-лизина. Карбамат собирали с выходом 99% в реакции 4-(трифторметил)бензилового спирта с N,N-дисукцинимидилкарбонатом и с последующим добавлением активированного продукта со свободной α-аминогруппой, получая промежуточное соединение 27. У этого лизинового производного затем удаляют защиту N-Вос (HCl) и соединяют с помощью бромтрипирролидинфосфония гексафторфосфата (PyBrOP, 74%) со свободной функциональной группой карбоновой кислоты моноамида иминодиуксусной кислоты, соединение 28, получая диамидное соединение 29. После удаления защиты N-ВОС (HCl) данное соединение димеризовали реакцией с изофталоилдихлоридом, завершая синтез и получая соединение 19 с выходом 60%. Радиоактивную метку включали в молекулу путем омыления двух метиловых эфиров (LiOH, 95%), получая дикарбоновую кислоту, соединение 30, с последующей эстерификацией [14С]-метанолом, опосредуемой 1-(3-диметиламино)пропил)-3-этилкарбодиимида гидрохлоридом (ЭДКИ) и катализом 4-диметиламинопиридином (ДМАП) с получением [14С]-соединения 1 при 35% выходе.
Фармацевтические препараты соединений формул (I) и (II) могут быть получены путем создания рецептуры с соединением и фармацевтически приемлемой несущей основой. Фармацевтические композиции, содержащие активные соединения формул (I) и (II), вводят в организм-хозяин с опухолью для снижения или прекращения роста опухоли. Активные соединения можно вводить парентерально путем инъекции или постепенного вливания в течение некоторого времени. Хотя на ткань, которая требует лечения, наиболее часто воздействуют путем внутрибрюшинного или подкожного введения, активные соединения можно также вводить в глаза, внутривенно, внутримышечно, внутрь сустава, в полости или трансдермально, и их можно также доставлять с помощью перистальтического устройства.
Термин "введение" соединения или композиции данного изобретения, как он использован здесь, относится к системному применению, такому как когда вводят перорально, парентерально, с помощью ингаляционного аэрозоля, интраназальным, ректальным или буккальным путями, или местно в препаратах в виде единичной дозированной формы, содержащих общепринятые нетоксичные фармацевтически приемлемые носители, вспомогательные вещества и разбавители, которые желательны. Термин "парентеральное", как он использован здесь, включает внутривенные, внутримышечные, внутрибрюшинные, в грудину, подкожные и внутрисуставные инъекции и инфузионные методы.
Под "фармацевтически приемлемыми" подразумеваются те соли, амиды и сложные эфиры, которые в границах корректной медицинской оценки пригодны для использования при контакте с тканями людей и низших животных без излишних токсичности, раздражения, аллергической реакции и тому подобного, и соответствуют рациональному соотношению благотворного действия/риска, эффективны в отношении предназначенного им применения для лечения опухолей и заболеваний, связанных с ангиогенезом.
Фармацевтически приемлемые соли хорошо известны специалистам. Например, S.M.Berge, et al. подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 66, 1-19 (1977). Примеры солей с присоединением кислот включают гидрохлорид, гидробромид, сульфат, бисульфат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, толуолсульфонат, метансульфонат, цитрат, малеат, фумарат, сукцинат, тартрат, аскорбат, глюкогептонат, лактобионат, лаурилсульфатные соли и тому подобное. Примеры солей щелочных или щелочноземельных металлов включают соли натрия, кальция, калия, магния и тому подобное.
Как он использован здесь, термин "фармацевтически приемлемые носители" означает нетоксичный, инертный твердый, полутвердый или жидкий наполнитель, растворитель, инкапсулирующий материал или вспомогательное вещество любого типа для лекарственной формы. Некоторыми примерами данных материалов, которые могут служить в качестве фармацевтически приемлемых носителей, являются сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; наполнители, такие как масло какао и мягкие суппозиторные основы; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический солевой раствор; раствор Рингера; этиловый спирт и фосфатно-буферные растворы, а также другие нетоксичные вещества, используемые в фармацевтических препаратах.
Смачиватели, эмульгаторы и лубриканты, такие как лаурилсульфат натрия и стеарат магния, а также красители, высвобождающие вещества, вещества покрытия, подсластители, улучшающие вкус и запах вещества, консерванты и антиоксиданты также могут присутствовать в данной композиции, по усмотрению специалиста, разрабатывающего лекарственную форму. Примеры фармацевтически приемлемых антиоксидантов включают водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфит натрия, метабисульфит натрия, сульфит натрия и тому подобное; жирорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (БГА), бутилированный гидрокситолуол (БГТ), лецитин, пропилгаллат, альфа-токоферол и тому подобное; и металлохелатирующие вещества, такие как лимонная кислота, этилендиаминтетрауксусная кислота (ЭДТУ), сорбит, винная кислота, фосфорная кислота и тому подобное.
Под "терапевтически эффективным количеством" вещества или соединения данного изобретения подразумевается количество соединения, достаточное для лечения опухолей и связанных с ангиогенезом заболеваний при рациональном отношении благотворного действия/риска, применимое при любом медицинском лечении. Будет понятно, однако, что вопрос об общем суточном потреблении соединений и композиций данного изобретения будет решать лечащий врач в рамках рациональной медицинской оценки. Конкретный уровень терапевтически эффективной дозы для любого конкретного пациента будет зависеть от ряда факторов, включая заболевание, которое нужно лечить, и тяжести данного заболевания; активности конкретного используемого соединения; конкретной используемой композиции; возраста, веса тела, общего состояния здоровья, пола и диеты пациента; времени введения, пути введения и скорости выведения конкретного используемого соединения; продолжительности введения; лекарственных средств, используемых в сочетании или одновременно с конкретным используемым соединением; и тому подобных факторов, хорошо известных специалистам в области медицины.
Данное изобретение также представляет фармацевтические композиции в единичных дозированных формах, содержащих терапевтически эффективное количество соединения (или соединений) данного изобретения в сочетании с обычным фармацевтическим носителем. Инъекционные препараты, например стерильные инъекционные водные или масляные суспензии, могут быть изготовлены в соответствии с известной технологией, при использовании подходящих диспергирующих или смачивающих средств и суспендирующих средств. Стерильный инъекционный препарат может также быть стерильным инъекционным раствором, стерильной инъекционной суспензией или эмульсией в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые могут использоваться, находятся вода, раствор Рингера по U.S.Р. (Фармакопея США) и изотонический раствор хлорида натрия. Кроме того, обычно используются жирные масла в качестве растворителя или суспензирующей среды. Для этой цели можно использовать любое чистое жирное масло, включая синтетические моно- или диглицериды.
Кроме того, для приготовления инъекционных препаратов используют жирные кислоты, такие как олеиновая кислота. Инъекционный препарат может быть стерилизован, например, фильтрованием через задерживающий бактерии фильтр или включением стерилизующих средств в виде стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой стерильной инъекционной среде непосредственно перед применением.
Чтобы продлить действие лекарства, часто желательно замедлить всасывание лекарственного вещества при подкожной или внутримышечной инъекции. Наиболее общим путем выполнения этого является инъекция суспензии кристаллического или аморфного вещества с плохой растворимостью в воде. Скорость всасывания лекарства становится зависимой от скорости растворения лекарства, которая, в свою очередь, зависит от физического состояния лекарственного вещества, например размера кристаллов и формы кристаллов. Другим подходом к замедлению всасывания лекарства является введение лекарственного вещества в виде раствора или суспензии в масле. Инъекционные депо-формы могут также изготавливаться путем создания микрокапсульных матриц из лекарственных веществ и биоразлагаемых полимеров, таких как полилактид-полигликолид. Скорость высвобождения лекарственного вещества может регулироваться в зависимости от соотношения лекарственного вещества к полимеру и композиции полимера. Примеры других биоразлагаемых полимеров включают полиортоэфиры и полиангидриды. Инъекционные препараты-депо можно также изготавливать путем заключения лекарственного вещества в липосомы или микроэмульсии, которые совместимы с тканями организма.
Суппозитории для ректального введения лекарства могут быть получены путем смешивания лекарственного вещества с подходящим нераздражающим наполнителем, таким как масло какао и полиэтиленгликоль, которые являются твердыми при обычной температуре, но жидкими при ректальной температуре и поэтому будут плавиться в прямой кишке и высвобождать лекарственное вещество.
Твердые дозированные формы для орального введения могут включать капсулы, таблетки, пилюли, порошки, драже и гранулы. В таких твердых дозированных формах активное соединение может быть смешано с, по меньшей мере, одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие дозированные формы могут также включать, что является практически обычным, дополнительные вещества, кроме инертных разбавителей, например лубриканты для таблетирования и другие вспомогательные вещества для таблетирования, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль дозированные формы могут также включать буферные вещества. Таблетки и пилюли могут быть, кроме того, изготовлены с энтеральными покрытиями и другими регулирующими высвобождение покрытиями. Твердые композиции подобного типа могут также использоваться в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах, с применением таких наполнителей, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и тому подобное.
Жидкие дозированные формы для перорального применения могут включать фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры, содержащие инертные разбавители (растворители), обычно используемые в данной области, такие как вода. Подобные композиции могут также включать вспомогательные вещества, такие как смачивающие вещества; эмульгирующие средства и суспендирующие средства; подсластители, улучшающие вкус и запах вещества. Если желательно, соединения данного изобретения могут включаться в системы доставки с медленным высвобождением или с направленной доставкой, такие как полимерные матрицы, липосомы и микросферы. Они могут быть стерилизованы, например, фильтрованием через задерживающий бактерии фильтр, или путем включения стерилизующих веществ в виде стерильных твердых композиций, которые могут растворяться в стерильной воде, или какой-то другой стерильной инъекционной среде непосредственно перед использованием. Активные соединения могут быть также представлены в микроинкапсулированном виде с помощью одного или более вспомогательных веществ, которые указаны выше.
Твердые дозированные формы из таблеток, драже, капсул, пилюль и гранул могут быть изготовлены с покрытиями и оболочками, такими как энтеральные покрытия и другие покрытия, хорошо известные в области фармацевтической технологии. Они могут, необязательно, содержать придающие непрозрачность вещества, а также могут состоять из такой композиции, что они высвобождают только активные ингредиент(ы), или предпочтительно, в определенной части кишечного тракта, необязательно, замедленным способом. Примеры оболочечных композиций, которые могут использоваться, включают полимерные вещества и воски. Дозированные формы для местного или трансдермального введения соединения данного изобретения, кроме того, включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, ингаляционные препараты и пластыри. Активный компонент смешивают в стерильных условиях с фармацевтически приемлемым носителем и какими-либо необходимыми консервантами или буферами, когда может потребоваться.
Офтальмологические препараты, глазные капли, глазные мази, порошки и растворы также рассматриваются как находящиеся в объеме данного изобретения. Мази, пасты, кремы и гели, кроме активного соединения данного изобретения, могут содержать такие наполнители, как животные и растительные жиры, масла, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевую кислоту, тальк и оксид цинка или их смеси.
Порошки и распыляемые препараты могут содержать, кроме соединений данного изобретения, такие наполнители как лактоза, тальк, кремниевая кислота, гидроксид алюминия, силикаты кальция и порошок полиамида, или смеси этих веществ. Распыляемые препараты могут дополнительно содержать обычные пропелленты, такие как хлорфторуглеводороды.
Трансдермальные пластыри обладают дополнительным преимуществом обеспечения регулируемой доставки соединения в организм. Такие дозированные формы могут быть изготовлены растворением или диспергированием соединения в соответствующей среде. Для увеличения проникновения соединения через кожу могут также использоваться усилители всасывания. Скорость может регулироваться или обеспечением регулирующей скорость мембраной или диспергированием соединения в полимерной основе или геле.
Композиции, содержащие активные соединения, применяют способом, подходящим для данного дозированного препарата, и в терапевтически эффективном количестве. Количество, которое нужно вводить, и распределение введений во времени зависит от организма хозяина, которого нужно лечить, объема системы организма-хозяина для применения активного ингредиента и степени желаемого терапевтического эффекта. Точное количество активного ингредиента, необходимое для введения, зависит от оценки лечащего врача и специфично для каждого индивидуума.
Подходящие интервалы доз для системного применения описаны здесь и зависят от пути введения. Подходящие режимы введения также различны, но являются типичными при первоначальном введении с последующими повторными введениями доз через один предопределенный интервал или более, путем последующей инъекции или другим путем введения.
Данное изобретение представляет также фармацевтическую композицию, пригодную для практического осуществления терапевтических методов, описанных здесь. Данные композиции содержат активное соединение, описанное выше, вместе с фармацевтически приемлемым носителем.
Препараты для парентерального введения настоящих соединений или композиций включают стерильные водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло и применяемые для инъекций органические сложные эфиры, такие как олеилолеат. Водные носители включают воду, растворы спирт/вода, эмульсии или суспензии, включая физиологический солевой раствор и буферную среду. Носители для парентеральных препаратов включают раствор хлорида натрия, раствор Рингера с декстрозой, декстрозу и хлорид натрия, лактозный раствор Рингера или жирные масла. Внутривенные носители включают жидкость и добавки питательных веществ, добавки электролитов (такие как лежащие в основе раствора Рингера с декстрозой) и тому подобное. Могут также присутствовать консерванты и другие добавки, такие как, например, антимикробные вещества, антиоксиданты, хелатирующие вещества, инертные газы и тому подобное.
Другой аспект данного изобретения представляет способ ингибирования взаимодействия ММП2 с αvβ3 и, таким образом, ангиогенез в опухолевой ткани. Способ ингибирования включает введение хозяину композиции, содержащей подавляющее ангиогенез количество соединения, описанного выше. Взаимодействие ММП2 с αvβ3 подавляется путем контакта αvβ3 с соединением данного изобретения.
Ангиогенез представляет собой формирование неоваскулярной сети из ранее существовавших сосудов хозяина и является необходимым для роста опухоли свыше 1-2 мм3. Для цели данного изобретения ангиогенез ингибируют до тех пор, пока ангиогенез и симптомы заболевания, опосредуемые ангиогенезом, не уменьшатся.
Интервалы доз активного соединения для введения хозяину зависят от конкретного активного соединения и его активности в отношении конкретных опухоли или интегрина. Опытный специалист может легко определить соответствующую дозировку для конкретного активного соединения без излишнего экспериментирования. Хозяин может быть любым млекопитающим. Доза должна быть достаточно большой для получения желаемого терапевтического эффекта, при котором ангиогенез и симптомы заболевания, опосредуемые ангиогенезом, уменьшаются, и обычно является количеством, достаточным для поддержания уровня активного соединения в плазме в пределах от примерно 0,01 до примерно 100 микромолей (мкМ), предпочтительно от примерно 0,2 до примерно 20 мкМ, более предпочтительно от примерно 1 до примерно 10 мкМ. Доза, однако, не должна быть такой большой, чтобы вызвать вредные побочные эффекты. Дозировка на килограмм (кг) веса тела может меняться от 1 до 20 мг на дозу при одном или более введений дозы в сутки в течение одного дня или нескольких дней, или неограниченно.
Для ингибирования ангиогенеза терапевтически эффективное количество равно количеству активного соединения, достаточному для получения измеряемого подавления ангиогенеза в ткани, которая нуждается в лечении, т.е. подавляющему ангиогенез количеству или количеству, подавляющему взаимодействие ММП2 - αvβ3. Ингибирование ангиогенеза может быть количественно оценено in situ с помощью иммуногистохимии, как описано здесь, или другими методами, известными специалистам.
Данное изобретение дополнительно представляет фармацевтические композиции, пригодные для осуществления на практике терапевтических способов, описанных здесь. Данные композиции содержат активное соединение, получившее определение здесь выше, вместе с фармацевтически приемлемым носителем.
Данное изобретение представляет также способ индукции апоптоза опухолевых клеток. Этот способ включает введение хозяину терапевтически эффективного количества активного соединения, достаточного для того, чтобы вызвать апоптоз опухолевых клеток.
Для целей данного изобретения апоптоз опухолевых клеток считается индуцированным,