Производные сульфонилпирролидина
Иллюстрации
Показать всеИзобретение относится к новым производным сульфонилпирролидина формулы I:
где R1 означает арил, необязательно замещенный галогеном; R2 означает арил, необязательно замещенный галогеном или (низш.)алкилом; R3 означает -OR', циано, галоген, N-гидроксиамидино, -C(O)-OR, -C(O)NR'R'', -N(R')-C(O)-R4, -N(R')-S(O)2-R, -N(R')-C(S)-NR'R или 5- или 6-членную гетероарильную группу, содержащую от 1 до 4 гетероатомов, один из которых представляет собой кислород, а остальные представляют собой азот, или все гетероатомы представляют собой только азот, и необязательно замещенные (низш.)алкилом или С3-С7циклоалкилом; R4 означает С3-С7циклоалкил, фенил или (низш.)алкил, необязательно замещены галогеном; R означает (низш.)алкил; R' означает Н, (низш.)алкил или С3-С7циклоалкил(низш.)алкил, независимо друг от друга, если присутствует более одного R'; R'' означает Н, (низш.)алкил, и n означает целое число от 0 до 5; и их фармацевтически приемлемые соли, при условии, что исключен 1-[4-(метилфенил)сульфонил]-5-фенилпирролидинметанол. Соединения I обладают сродством к метаботропным глутаматным рецепторам группы I, что позволяет использовать их в качестве лекарственного средства для лечения, профилактики острых и/или хронических неврологических нарушений и состояний, которые приводят к развитию глутаматной недостаточности, выбранных из: повреждения спинного мозга, травмы головы, гипоксия, вызванная беременностью, гипогликемия, болезнь Альцгеймера, хорея Гентингтона, боковой амиотрофический склероз (ALS), расстройство познавательной способности, нарушения памяти, а также хроническая и острая боль, шизофрения, идиопатический паркинсонизм и паркинсонизм, вызванный лекарственными средствами, судороги, тревога (страх) и депрессии. 2 н. и 19 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к производным 1-сульфонилпирролидина общей формулы
где R1 означает арил, необязательно замещенный галогеном,
R2 означает арил, необязательно замещенный галогеном или (низш.)алкилом,
R3 означает -OR', циано, галоген, N-гидроксиамидино, -C(O)-OR, -C(O)NR'R'', -N(R')-C(O)-R4, -N(R')-S(O)2-R, -N(R')-C(S)-NR'R или 5- или 6-членные гетероарильные группы, содержащие от 1 до 4 гетероатомов, которые независимо друг от друга выбирают из N или О, и необязательно замещенные (низш.)алкилом или циклоалкилом,
R4 означает циклоалкил, фенил или (низш.)алкил, необязательно замещенный галогеном,
R означает (низш.)алкил,
R' означает водород, (низш.)алкил или циклоалкил(низш.)алкил, независимо друг от друга, если присутствует более одного R',
R'' означает водород, (низш.)алкил или (низш.)алкил, замещенный 5- или 6-членной гетероарильной группой, содержащей от 1 до 4 гетероатомов, которые независимо друг от друга выбирают из N или О, необязательно замещенной (низш.)алкилом или циклоалкилом,
n означает целое число от 0 до 5,
а также к их фармацевтически приемлемым солям, при условии, что исключен 1-[4-(метилфенил)сульфонил]-5-фенилпирролидинметанол.
Неожиданно было установлено, что соединения общей формулы I обладают сродством к метаботропным глутаматным рецепторам. Соединения формулы I характеризуются ценными терапевтическими свойствами.
В центральной нервной системе (ЦНС) передача сигнала происходит посредством взаимодействия нейромедиатора, секретируемого нейроном, с нейрорецептором.
L-Глутаминовая кислота, наиболее распространенный в ЦНС нейромедиатор, играет решающую роль во многих физиологических процессах. Глутамат-зависимые сигнальные рецепторы подразделяются на две основные группы. Первая основная группа, а именно ионотропные рецепторы, образует лиганд-управляемые ионные каналы. Метаботропные глутаматные рецепторы (mGluR) относятся ко второй основной группе, и, кроме того, принадлежат к семейству рецепторов, опосредованных G-белком.
В настоящее время известно восемь различных членов группы mGluR, причем для некоторых из них известны подвиды. На основании структурных характеристик, различному влиянию на синтез вторичных метаболитов и различного сродства к низкомолекулярным соединениям эти восемь рецепторов могут быть разделены на три подгруппы: группа I включает mGluRl и mGluR5, группа II включает mGluR2 и mGluR3, группа III включает mGluR4, mGluR6, mGluR7 и mGluR8.
Лиганды метаботропных глутаматных рецепторов, относящихся к первой группе, могут найти применение для лечения и профилактики острых и/или хронических неврологических нарушений, таких, как психоз, шизофрения, болезнь Альцгеймера, расстройство познавательной способности и нарушения памяти, в также хроническая и острая боль.
В этой связи другими показаниями для лечения являются ограниченная функция мозга, наблюдаемая при использовании искусственного кровообращения или трансплантатов, недостаточное кровоснабжение мозга, повреждения спинного мозга, травмы головы, гипоксия, вызванная беременностью, остановка сердца и гипогликемия. Другими показаниями для лечения являются хорея Гентингтона, боковой амиотрофический склероз (ALS), деменция, вызванная заболеванием СПИДом, повреждения глаз, ретинопатия, идиопатический паркинсонизм и паркинсонизм, вызванный лекарственными средствами, а также состояния, которые приводят к развитию глутаматной недостаточности, например, такие, как мышечные спазмы, судороги, мигрень, недержание мочи, привыкание к никотину, привыкание к наркотическим средствам, тревога (страх), рвота, дискинезия и депрессии.
Объектами настоящего изобретения являются соединения формулы I и их фармацевтически приемлемые соли, рацемические смеси и их соответствующие энантиомеры, вышеуказанные соединения в качестве фармацевтически активных соединений, способы их получения, лекарственные средства на основе соединения по настоящему изобретению, и их получение, а также применение соединений по изобретению для лечения или профилактики вышеуказанных заболеваний, и, соответственно, для получения соответствующих лекарственных средств.
В объеме настоящего изобретения предпочтительными соединениями формулы I являются соединения, в которых R3 означает 5- или 6-членные гетероарильные группы, содержащие от 1 до 4 гетероатомов, которые независимо друг от друга выбирают из N или О, и необязательно замещенные (низш.)алкилом или циклоалкилом.
Прежде всего, предпочтительны соединения формулы I, в которых гетероарильная группа выбрана из ряда имидазол, пиразол, [1,2,4]триазол, [1,2,4]оксадиазол или тетразол, необязательно замещенный (низш.)алкилом или циклоалкилом.
Примерами таких соединений являются
(2RS,5RS)-5-{2-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]этил}-3-метил-[1,2,4]оксадиазол,
(2RS,5RS)-5-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-илметил]-2-метил-2Н-тетразол,
(2RS,5RS)-5-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}-2-метил-2Н-тетразол,
(2RS,5RS)-5-{4-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]бутил}-1-метил-1Н-тетразол,
(2R,5S)-5-{2-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]этил}-2-метил-2Н-тетразол,
(2R,5S)-5-{2-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]этил}-1-метил-1Н-тетразол,
(2RS,5RS)-5-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}-1-метил-1Н-[1,2,4]триазол,
(2RS,5RS)-5-{2-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]этил}-1-метил-1Н-[1,2,4]триазол,
(2RS,5RS)-3-{2-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]этил}-1-метил-1Н-[1,2,4]триазол,
(2RS,5RS)-1-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}-1Н-[1,2,4]триазол,
(2RS,5RS)-1-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}-1Н-имидазол,
(2RS,5RS)-1-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}-1Н-пиразол,
(2RS,5RS)-1-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}-1Н-тетразол,
(2RS,5RS)-3-циклопропил-5-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-илметил]-[1,2,4]оксадиазол,
(2RS,5RS)-1-{2-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]этил}-1Н-[1,2,4]триазол,
(2R,5S)-1-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}-1Н-[1,2,4]триазол,
(2S,5S)-1-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}-1Н-имидазол,
(2S,5S)-1-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}-1Н-пиразол,
(2S,5S)-5-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}-1-метил-1Н-[1,2,4]триазол,
(2RS,5RS)-1-{4-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]бутил}-1Н-[1,2,4]триазол,
(2RS,5RS)-2-{4-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]бутил}-2Н-тетразол,
(2S,5S)-1-{4-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]бутил}-1Н-имидазол или
(2S,5S)-1-{4-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]бутил}-1Н-[1,2,4]триазол.
Другими предпочтительными соединениями формулы I являются соединения, в которых гетероарильная группа выбрана из [1,3,4]оксадиазола или оксазола, который необязательно замещен (низш.)алкилом или циклоалкилом.
Примерами таких соединений являются
(2RS,5SR)-2-{2-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]этил}-[1,3,4]оксадиазол,
(2RS,5SR)-2-{2-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]этил}-5-метил-[1,3,4]оксадиазол,
(2RS,5SR)-5-{2-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]этил}оксазол,
(2RS,5SR)-2-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}-[1,3,4]оксадиазол или
(2RS,5SR)-2-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил] пропил}-5-метил-[1,3,4]оксадиазол.
Другими предпочтительными соединениями формулы I являются такие соединения, в которых
R3 означает -N(R')-C(O)-R4, a
R4 означает циклоалкил или (низш.)алкил, необязательно замещенный галогеном.
Примерами таких соединений являются
[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-илметил]амид(2RS,5SR)-циклопропанкарбоновой кислоты,
{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}амид(2RS,5SR)-циклопропанкарбоновой кислоты,
{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}амид
(2S,5S)-циклопропанкарбоновой кислоты,
(2SR,5SR)-N-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}ацетамид,
(2RS,5RS)-N-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}пропионамид,
(2RS,5RS)-N-{4-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]бутил}ацетамид,
(2RS,5RS)-N-{5-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пентил}ацетамид,
(2S,5S)-N-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}ацетамид,
(2RS,5RS)-2,2,2-трифтор-N-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}ацетамид или
(2RS,5RS)-N-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}изобутирамид.
Кроме того, предпочтительны соединения формулы I, в которых R3 означает -OR', a
R' означает водород или метил.
Примерами таких соединений являются
(2RS,5RS)-3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропан-1-ол,
(2S,5S)-3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропан-1-ол,
(2RS,5SR)-2-(4-фторфенил)-5-(2-метоксиэтил)-1-(толуол-4-сульфонил)пирролидин,
(2RS,5RS)-2-(4-фторфенил)-5-(3-метоксипропил)-1-(толуол-4-сульфонил)пирролидин,
(2RS,5RS)-4-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]бутан-1-ол или
(2S,5S)-2-(4-фторфенил)-5-(4-метоксибутил)-1-(толуол-4-сульфонил)пирролидин.
Кроме того, предпочтительны соединения формулы I, в которых R3 означает -C(O)NR'R'',
R' означает водород или (низш.)алкил, а
R'' означает водород, (низш.)алкил или (низш.)алкил, замещенный 5- или 6-членной гетероарильной группой, содержащей от 1 до 4 гетероатомов, которые независимо друг от друга выбирают из N или О, и необязательно замещенной (низш.)алкилом или циклоалкилом.
Примерами таких соединений являются
амид(2RS,5RS)-5-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пентановой кислоты или
(2R,5S)-3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропионамид.
Предпочтительны также соединения формулы I, в которых R3 означает -N(R')-S(O)2-R,
R означает (низш.)алкил, а
R' означает водород, (низш.)алкил или (низш.)алкил, замещенный 5- или 6-членной гетероарильной группой, содержащей от 1 до 4 гетероатомов, которые независимо друг от друга выбирают из N или О, и необязательно замещенной (низш.)алкилом или циклоалкилом.
Примером такого соединения является
(2RS,5RS)-N-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}метансульфонамид.
Наряду с рацематами изобретение включает все стереоизомерные формы.
Термин «(низш.)алкил», используемый в настоящем описании, означает остаток насыщенного углеводорода с прямой или разветвленной цепью, содержащий от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, такой, как метил, этил, н-пропил, изопропил, трет-бутил и т.п.
Термин «циклоалкил» означает насыщенную карбоциклическую группу, содержащую от 3 до 7 атомов углерода, предпочтительно циклопропил и циклопентил.
Термин «циклоалкил«(низш.)алкил» означает остаток (низш.)алкил, имеющий значения, указанные выше, который замещен циклоалкильной группой, имеющей значения, указанные выше, предпочтительно циклопропилметил.
Термин «галоген» означает фтор, хлор, бром и иод.
Термин «арил» означает одновалентный ароматический карбоциклический радикал, включающий один цикл, или один или более конденсированных циклов, из которых по меньшей мере один цикл является ароматическим. Предпочтительными арильными группами являются фенил или нафтил.
Термин «гетероарил» означает одновалентный ароматический циклический радикал, включающий один или более гетероатомов. Термин «5- или 6-членные гетероарильные группы, содержащие от 1 до 4 гетероатомов, выбранных из N или О», означает фурил, пирролил, 1H-имидазолил, 2Н-имидазолил, 4Н-имидазолил, 1H-пиразолил, 3Н-пиразолил, 4Н-пиразолил, 1,2-оксазолил, 1,3-оксазолил, 1Н-[1,2,4]триазолил, 4Н-[1,2,4]триазолил, 1Н-[1,2,3]триазолил, 2Н-[1,2,3]триазолил, 4Н-[1,2,3]триазолил, [1,2,4]оксадиазолил, [1,3,4]оксадиазолил, [1,2,3]оксадиазолил, 1Н-тетразолил, 2Н-тетразолил, [1,2,3,4]оксатриазолил, [1,2,3,5]оксатриазолил, 1H-пентазолил, пиридил, пиразинил, пиримидинил, пиридазинил и их дигидропроизводные. Гетероарильная группа необязательно замещена (низш.)алкилом или циклоалкилом.
Предпочтительными являются следующие 5-членные гетероарильные группы: 1H-имидазолил, 1H-пиразолил, 1Н-[1,2,4]триазолил, [1,2,4]оксадиазолил, 4,5-дигидро-[1,2,4]оксадиазолил, [1,3,4]оксадиазолил, оксазолил, 1Н-тетразолил и 2Н-тетразолил.
Предпочтительными 6-членными гетероарильными группами являются пиридил или пиримидил.
Соединения общей формулы I и их фармацевтически приемлемые соли могут быть получены взаимодействием соединения формулы
с соединением формулы
с образованием соединения формулы
и, если необходимо, превращением функциональной группы R в соединении формулы I в другую функциональную группу, и, если необходимо, превращением соединения формулы I в фармацевтически приемлемую соль.
Соединения формулы I могут быть также получены простой заменой функциональной группы в положении R3 на другую функциональную группу.
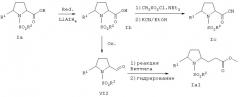
Согласно изобретению, соответственно замещенное соединение формулы II, например, метиловый эфир (2RS,5SR)-5-(4-фторфенил)-1-пирролидин-2-карбоновой кислоты, взаимодействует с соответствующим соединением формулы III, например, толуол-4-сульфонилхлоридом и триэтиламином (см. схему 1). R1, R2 и n имеют значения, указанные выше. Реакцию проводят известным способом, при комнатной температуре в течение 16 ч и в инертном растворителе, например, в дихлорметане.
Схема 1
Соединение формулы II получают взаимодействием соответствующего соединения формулы V с диэтиловым эфиром ацетаминомалоновой кислоты (IV) и последующим гидрированием в присутствии оксида платины, как показано на схеме 2.
Схема 2
Стереоселективный синтез соединения формулы II можно проводить взаимодействием оптически чистого N-Boc-пироглутамата с (4-фторфенил)магнийбромидом по методам, описанным в статьях Tetrahedron Letters, 34, 6317-6320 (1999), J. Med. Chem., 39, 2594-2608 (1996) и Tetrahedron: Asymmetry, 10, 2245-2303 (1999).
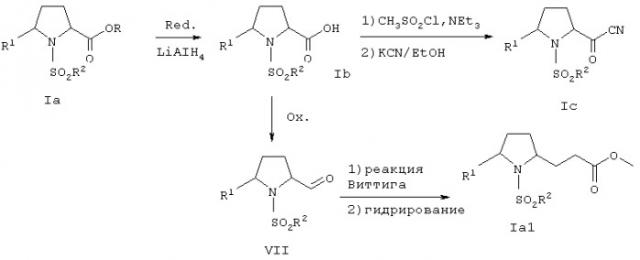
На схеме 3 показано удлинение боковой цепи в исходном соединении формулы Ia, например, метиловой эфире (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбоновой кислоты (пример 1). Например, после восстановления алюмогидридом лития в соответствующий спирт, мезилирования и нуклеофильного замещения цианидом образуются соединения формулы Iв, содержащие боковую цепь из двух атомов углерода. Соединения формулы Ia1, содержащие боковую цепь из трех атомов углерода, получают окислением спирта в альдегид VII с последующим проведением реакции Виттига и гидрирования.
Схема 3
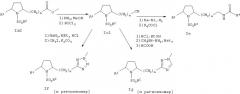
Тетразолил-производные формулы Ie (например, примеры 27, 39, 40, 49, 50) могут быть получены 1,3-диполярным присодинением азида натрия к нитрилу формулы Iв1. Нитрил предпочтительно получают превращением сложноэфирной группы соединения Ia2 в амид и дегидратацией амида оксихлоридом фосфора. Метил-1,2,4-триазолилпроизводные формулы Iж (например, примеры 26, 69,70) могут быть получены присоединением к нитрилу метилгидразина. Затем цианогруппу в соединении Iв1 можно гидрированием перевести в соответствующий амин, который может быть ацилирован соответствующим ацилхлоридом с образованием соединения формулы Iд (например, примеры 9, 15, 16). Ацилирование предпочтительно проводят в дихлорметане в присутствии пиридина. Эти реакции показаны ниже на схеме 4. R4 имеет значения, указанные выше.
Схема 4
1,2,4-Оксадиазолильный цикл может быть получен конденсацией кислоты формулы VIII с N-гидроксиацетамидином. Например, раствор кислоты и 1,1'-карбонилдиимидазола в ДМФ перемешивают при комнатной температуре в течение 2 ч. Затем добавляют N-гидроксиацетамидин и реакционную смесь нагревают при 80°С в течение 2 ч. Затем реакционную смесь упаривают, растворяют в уксусной кислоте и кипятят с обратным холодильником в течение 2 ч. После очистки известными способами получают соединение формулы Iз (например, пример 25) (см. схему 5).
1,2,4-Оксадиазолилпроизводные формулы Iк (например, пример 13) могут быть получены из нитрила формулы Iв1 взаимодействием с гидрохлоридом гидроксиламина с образованием карбоксиамидина 1и, который конденсируют с уксусной кислотой в ДМФ в присутствии 1,1'-карбонилдиимидазола с образованием 1,2,4-оксадиазолильного цикла.
Схема 5
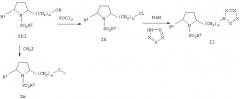
Гидроксильная группа в соединении формулы Iб1 может быть метилирована известными способами с образованием соединения формулы Iн или соединения, замещенного атомом галогена. Например, взаимодействие с тионилхлоридом приводит к образованию соответствующего хлоралкилпроизводного (Iл). Затем атом галогена может быть замещен циклическим амином, например 1,2,4-триазолом (см. пример 82), с использованием гидрида натрия при 0°С. Продукт, соединение формулы II, очищают известными способами. На схеме 6 атом Х независимо друг от друга означает атом азота (N) или атом кислорода (О).
Схема 6
Фармацевтически приемлемые соли могут быть получены известными способами в соответствии с природой соединения, которое необходимо првратить в соль. Для получения фармацевтически приемлемых солей основных соединений формулы I пригодными являются неорганические и органические кислоты, например, такие, как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота или лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, пара-толуолсульфоновая кислота и т.п. Для получения фармацевтически приемлемых солей кислотных соединений пригодными являются соединения, которые содержат щелочные или щелочноземельные металлы, например, натрий, калий, кальций, магний и т.п., или пригодными также являются основные амины или основные аминокислоты.
Как отмечалось выше, соединения формулы I и их фармацевтически приемлемые соли обладают сродством к метаботропным глутаматным рецепторам (mGlu рецепторам группы 1) и могут найти применение для лечения и профилактики острых и/или хронических неврологических нарушений, таких, как психоз, шизофрения, болезнь Альгеймера, расстройство познавательной способности и нарушения памяти, в также хроническая и острая боль. Другими показаниями для лечения являются ограниченная функция мозга, наблюдаемая при использовании искусственного кровообращения или трансплантатов, недостаточное кровоснабжение мозга, повреждения спинного мозга, травмы головы, гипоксия, вызванная беременностью, остановка сердца и гипогликемия. Другими показаниями для лечения являются болезнь Альцгеймера, хорея Гентингтона, боковой амиотрофический склероз (ALS), деменция, вызванная заболеванием СПИДом, повреждения глаз, ретинопатия, идиопатический паркинсонизм и паркинсонизм, вызванный лекарственными средствами, а также состояния, которые приводят к развитию глутаматной недостаточности, например, такие, как мышечные спазмы, судороги, мигрень, недержание мочи, привыкание к никотину, психозы, привыкание к наркотическим средствам, тревога (страх), рвота, дискинезия и депрессии.
Фармакологическую активность соединений определяют следующим способом.
кДНК, кодирующую mGlu1a рецептор крысы, временно вводят в клетки EBNA трансфекцией по методике, описанной в статье E.-J.Schlaeger и K.Christensen, Transient gene expression in mammalian cells grown in serum-free suspension culture, Cytotechnology, 30, 71-83 (1999). Определение [Са2+]i проводят после инкубации трансфектных клеток EBNA в присутствии реактива Fluo-3 AM (при конечной концентрации 0,5 мкМ) при 37°С в течение 1 ч с последующим 4-кратным промывании буферным раствором для анализа (среда DMEM, содержащая дополнительно соль Хэнкса и 20 мМ HEPES). Определение [Са+2]i проводят с использованием ридера флуоресценции (FLIPR, Molecular Devices Corporation, La Jolla, Са, США). Если соединения являются антагонистами, они могут быть проанализированы в присутствии 10 мкМ глутамата в качестве агонистов.
По графикам ингибирования (антагонисты) или активации (агонисты), полученным с использованием логистического уравнения с четырьмя параметрами и итеративного нелинейного графика, построенного с использованием программы Origin (Microcal Software Inc., Northampton, MA, США), определяют величины ЕС50, IC50 и коэффициент Хилла.
Соединения по настоящему изобретению являются агонистами mGlu рецептора группы 1. Соединения обладают активностью, которую определяли, как описано выше, от 10 мкМ или менее, обычно 1 мкМ или менее, в наилучшем варианте от 0,3 мкМ или менее. Некоторые данные по активности приведены в таблице.
| Пример № | Соединение | EC50 (мкМ) |
| 4 | (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбонитрил | 4,40 |
| 5 | (2RS,5SR)-2-хлорметил-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин | 1,40 |
| 16 | [5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-илметил]амид(2RS,5SR)-циклопропанкарбоновой кислоты | 0,21 |
| 21 | (2RS,5SR)-3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-илметил]-5-метил-[1,2,4]оксадиазол | 0,63 |
| 39 | (2RS,5SR)-5-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-илметил]-2-метил-2Н-тетразол | 0,36 |
| 64 | (2S,5S)-3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропан-1-ол | 0,20 |
| 77 | (2RS,5RS)-N-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}метансульфонамид | 0,16 |
| 99 | (2RS,5SR)-2-{2-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]этил}-2Н-тетразол | 1,47 |
| 113 | (2S,5S)-1-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}-1Н-имидазол | 0,22 |
| 120 | (2RS,5RS)-2-{3-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]пропил}-4,6-диметилпиримидин | 1,28 |
| 134 | (2RS,5SR)-2-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]-[1,3,4]оксадиазол | 1,24 |
| 140 | (2RS,5RS)-2-{4-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]бутил}-2Н-тетразол | 0,35 |
Соединения формулы I и их фармацевтически приемлемые соли могут быть использованы в качестве лекарственных средств, например, в форме фармацевтических препаратов. Фармацевтические препараты можно вводить перорально, например, в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение можно также проводить ректально, например, в форме суппозиториев, или парентерально, например, в форме растворов для инъекции.
Для получения фармацевтических препаратов соединения формулы I и их фармацевтически приемлемые соли могут быть переработаны с фармацевтически инертными неорганическими или органическими носителями. В качестве таких носителей для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул можно использовать, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т.п. Пригодными носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п.; однако в зависимости от природы активного соединения в случае мягких желатиновых капсул обычно нет необходимости в использовании носителя. Пригодными носителями для приготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар, глюкоза и т.п. Для водных растворов для инъекции водорастворимых солей соединений формулы I можно использовать адьюванты, такие, как спирты, полиолы, глицерин, растительные масла и т.п., но обычно в этом нет необходимости. Пригодными носителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.п.
Кроме того, фармацевтические препараты могут содержать консерванты, солибилизирующие агенты, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для регуляции осмотического давления, буферные вещества, маскирующие агенты или антиоксиданты. Кроме того, они могут содержать другие терапевтически ценные соединения.
Как отмечалось выше, лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный эксципиент, также являются объектом настоящего изобретения. Объектом изобретения является также способ получения таких лекаственных средств, который включает переработку одного или более соединений формулы I или их фармацевтически приемлемых солей и, при необходимости, одного или более других терапевтически ценных соединений в галеновую готовую форму в смеси с одним или более терапевтически инертных носителей.
Дозировки могут варьировать в широком интервале и должны соответствовать индивидуальным требованиям в каждом конкретном случае. Обычно при пероральном или паретеральном введении эффективная доза составляет 0,01-20 мг/кг/сут, причем для всех описанных показаний предпочтительной является доза 0,1-10 мг/кг/сут. Суточная доза для взрослого пациента массой 70 кг находится в интервале 0,7-1400 мг/сут, предпочтительно в интервале 7-700 мг/сут.
Наконец, как указано выше, объектом изобретения является также применение соединений формулы I и их фармацевтически приемлемых солей для получения лекарственных средств, презназначенных для лечения или профилактики острых и/или хронических неврологичеких нарушений, описанных выше.
Пример 1
Метиловый эфир (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбоновой кислоты
А) Диэтиловый эфир ацетамидо[2-(4-фторбензоил)этил]малоновой кислоты
К раствору диэтилацетаминомалоната (4,34 г, 0,02 моля) в EtOH (30 мл) при перемешивании при комнатной температуре добавляли этанолят натрия (1,46 г, 20,4 ммоля), а затем 3-хлор-4'-фторпропиофенон (3,73 г, 0,02 моля).
Реакционную смесь кипятили с обратным холодильником в течение 5 ч, выливали в воду со льдом (70 мл), подкисляли (25 мл 3 н. серной кислоты) и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали солевым раствором (70 мл), сушили (MgSO4) и упаривали, при этом получали масло коричневого цвета (7,95 г). После кристаллизации из этилацетата/гексана получали диэтиловый эфир ацетамидо[2-(4-фторбензоил)этил]малоновой кислоты в виде твердого вещества грязно-белого цвета (5,72 г, выход 78%), tпл 73°С
б) Метиловый эфир (RS)-2-(4-фторфенил)-1-пирролин-5-карбоновой кислоты
Раствор диэтилового эфира ацетамидо-[2-(4-фторбензоил)этил]малоновой кислоты (5,72 г, 15,6 ммоля) в конц.соляной кислоте (45 мл) кипятили с обратным холодильником при перемешивании в течение 15 ч, фильтровали и упаривали. Затем добавляли 3 н.соляную кислоту в МеОН (30 мл) и раствор перемешивали при комнатной температуре в течение 20 ч. Реакционную смесь упаривали, добавляли насыщенный раствор NaHCO3 (50 мл) и водную фазу экстрагировали этилацетатом (2×100 мл). Объединенные органические экстракты промывали солевым раствором (70 мл), сушили (MgSO4) и упаривали, при этом получали метиловый эфир (RS)-2-(4-фторфенил)-1-пирролин-5-карбоновой кислоты в виде масла бледно-коричневого цвета (2,3 г, выход 67%), МС: m/е 221 (М+).
в) Метиловый эфир (2RS,5SR)-5-(4-фторфенил)-1-пирролидин-2-карбоновой кислоты
Метиловый эфир (RS)-2-(4-фторфенил)-1-пирролин-5-карбоновой кислоты (2,3 г, 10,4 ммоля) в МеОН (120 мл) гидрировали в присутствии оксида платины (260 мг) при комнатной температуре в течение 3 ч. Метиловый эфир (2RS,5SR)-5-(4-фторфенил)-1-пирролидин-2-карбоновой кислоты получали в виде масла светло-коричневого цвета (2,27 г, выход 98%), МС: m/е 224,2 (М+Н+).
г) Метиловый эфир (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбоновой кислоты
К раствору метилового эфира (2RS,5SR)-5-(4-фторфенил)-1-пирролидин-2-карбоновой кислоты (2,27 г, 10,2 ммоля) и триэтиламина (2,13 мл, 15,3 ммоля) в дихлорметане (60 мл) при перемешивании при 0°С добавляли толуол-4-сульфонилхлорид (2,32 г, 12,2 ммоля). Смесь перемешивали при КТ в течение 16 ч, упаривали, растворяли в воде (50 мл) и экстрагировали дихлорметаном (2×40 мл). Объединенные органические слои промывали водой (40 мл), солевым раствором (40 мл), сушили (MgSO4) и упаривали. Неочищенный продукт очищали кристаллизацией из диэтилового эфира/гексана, при этом получали указанное в заголовке соединение в виде твердого вещества грязно-белого цвета, tпл 91°С, МС: m/е 378,3 (М+Н+).
Пример 2
(2RS,5SR)-[5-(4-Фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]метанол
Указанное в заголовке соединение получали в виде твердого вещества белого цвета, tпл 82°С, МС: m/е 350 (М+Н+), восстановлением метилового эфира (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбоновой кислоты в присутствии алюмогидрида лития (1,5 экв.) в ТГФ при КТ с последующей обработкой водой и кристаллизацией из диэтилового эфира/гексана.
Пример 3
Амид (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбоновой кислоты
Раствор метилового эфира (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбоновой кислоты (1,3 г, 3,44 ммоля) в МеОН (75 мл) и раствор гидроксида аммония (50 мл, 25%) перемешивали при комнатной температуре в течение 72 ч. Раствор концентрировали до 50 мл и добавляли воду (150 мл). Указанное в заголовке соединение выпадало в осадок в виде твердого вещества белого цвета (0,95 г, выход 76%), tпл 137°C, МС: m/e 363,1 (М+Н+).
Пример 4
(2RS,5SR)-5-(4-Фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбонитрил
Смесь амида (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбоновой кислоты (1,15 г, 3,17 ммоля) и хлорокиси фосфора (8 мл) кипятили с обратным холодильником при перемешивании в течение 5 мин. После обработки водой и кристаллизации из этилацетата/гексана получали указанное в заголовке соединение в виде твердого вещества светло-желтого цвета (0,9 г, выход 82%), tпл 128°C, MC: m/e 344 (М+).
Пример 5
(2RS,5SR)-2-Хлорметил-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин
Смесь (2RS,5SR)-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]метанола (1,25 г, 3,58 ммоля) и тионилхлорида (2 мл) перемешивали при 80°С в течение 4 ч. После обработки водой и кристаллизации из этилацетата/гексана получали указанное в заголовке соединение в виде твердого вещества грязно-белого цвета (1,12 г, выход 85%), tпл 130°С, MC: m/e 367 (М+).
Пример 6
Гидрохлорид (пиридин-3-илметил)амида (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбоновой кислоты
а) (2RS,5SR)-5-(4-Фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбоновая кислота
Раствор метилового эфира (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбоновой кислоты (4,35 г, 11,5 ммоля) в 1 н. гидроксиде калия (100 мл) перемешивали при комнатной температуре в течение 17 ч. После обработки водой получали (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбоновую кислоту в виде твердого вещества белого цвета (4,05 г, выход 97%), tпл 166°С.
б) Хлорангидрид (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбоновой кислоты
К перемешиваемой суспензии (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбоновой кислоты (4,05 г, 11,1 ммоля) в толуоле (60 мл) добавляли тионилхлорид (1,21 мл, 16,7 ммоля) и смесь перемешивали при 80°С в течение 1,5 ч. После выпаривания растворителя получали хлорангидрид (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбоновой кислоты в виде твердого вещества светло-коричневого цвета.
в) Гидрохлорид (пиридин-3-илметил)амида (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбоновой кислоты
К перемешиваемому и охлаждаемому (0°С) раствору хлорангидрида (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбоновой кислоты (764 мг, 2 ммоля) в дихлорметане (30 мл) добавляли пиридин (0,16 мл, 2 ммоля) и 3-пиколиламин (0,18 мл, 1,8 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение 22 ч. После обработки водой, получения гидрохлорида (3 н. HCl/МеОН) и кристаллизации (диэтиловый эфир) получали указанное в заголовке соединение в виде твердого вещества белого цвета (0,69 г, выход 70%), tпл 186°C, MC: m/e 454,5 (М+Н+).
Пример 7
(2RS,5SR)-5-(4-Фторфенил)-N-гидрокси-1-(толуол-4-сульфонил)пирролидин-2-карбоксамидин
К перемешиваемой суспензии (2RS,5SR)-5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбонитрила (0,74 г, 2,15 ммоля) в EtOH (25 мл) добавляли карбонат калия (0,89 г, 6,45 ммоля) и гидрохлорид гидроксиламина (0,30 г, 4,30 ммоля). Реакционную смесь кипятили с обратным холодильником в течение 18 ч, образующийся осадок собирали и промывали дихлорметаном/метанолом. Органические растворители выпаривали, неочищенный продукт очищали хроматографией на колонке с силикагелем (этилацетат/гексан 3:2). После кристаллизации из диэтилового эфира/метанола получали указанное в заголовке соединение в виде твердого вещества белого цвета (0,31 г, выход 38%), tпл 217°С, MC: m/e 378,3 (М+Н+).
Пример 8
(2RS,5SR)-2-(4-Фторфенил)-5-метоксиметил-1-(толуол-4-сульфонил)пирролидин
К перемешиваемому и охлаждаемому (0°С) раствору (2RS,5SR)-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]метанола в ТГФ (10 мл) добавляли гидрид натрия (147 мг, 3,66 ммоля, 60%) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Затем при 0°С добавляли метилиодид (0,34 мл, 5,5 ммоля) и перемешивание продолжали при комнатной температуре в течение 3 ч. После обработки водой и кристаллизации из этилацетата/гексана получали указанное в заголовке соединение в виде твердого вещества белого цвета (0,53 г, выход 79%), tпл 152°C, MC: m/e 364,3 (М+Н+).
Пример 9
(2RS,5SR)-N-[5-(4-Фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-илметил]ацетамид
а) (2RS,5SR)-[5-(4-Фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]метиламин
(2RS,5SR)-5-(4-Фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-карбонитрил (1,22 г, 3,54 ммоля) в 7 н. NH3/МеОН при КТ гидрировали в присутствии Ni-Ra (никеля Ренея) в качестве катализатора, при этом получали (2RS,5SR)-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]метиламин в виде масла светло-желтого цвета (1,06 г, выход 86%).
б) (2RS,5SR)-N-[5-(4-Фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-илметил]ацетамид
Указанное в заголовке соединение получали в виде твердого вещества белого цвета, tпл 117°С, МС: m/е 391,2 (М+Н+), ацетилированием (2RS,5SR)-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]метиламина по общему методу, описанному в примере 6в, с последующей кристаллизацией из этилацетата/гексана.
Пример 10
(2RS,5SR)-[5-(4-Фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]ацетонитрил
При взаимодействии (2RS,5SR)-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]метанола (2,15 г, 6,15 ммоля) и метансульфонилхлорида (0,57 мл, 7,38 ммоля) по общему методу, описанному в примере 1 г, получали соответствующий (2RS,5SR)-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]метансульфонат (2,60 г, 99%), который затем кипятили с обратным холодильником в присутствии цианида калия (0,61 г, 9,43 ммоля) в EtOH/воде (95:5, 130 мл) в течение 24 ч. После обработки водой и хроматографии на колонке с силикагелем (этилацетат/гексан, 2:3) получали исходный материал (1,02 г, выход 47%) и указанное в заголовке соединение в виде твердого вещества грязно-белого цвета (0,64 г, выход 29%), tпл 116°С, МС: m/е 359,2 (М+Н+).
Пример 11
(2RS,5SR)-[1-(4-Этилбензолсульфонил)-5-(4-фторфенил)пирролидин-2-ил]метанол
Указанное в заголовке соединение получали в виде масла бледно-желтого цвета, МС: m/е 363 (М+), по общему методу, описанному в примере 1 г, из метилового эфира (2RS,5SR)-5-(4-фторфенил)пирролидин-2-карбоновой кислоты и 4-этилбензолсульфонилхлорида с последующим восстановлением метилового эфира (2RS,5SR)-5-(4-фторфенил)-1-(4-этилбензолсульфонил)пирролидин-2-карбоновой кислоты в присутствии алюмогидрида лития по общему методу, описанному в примере 2.
Пример 12
(2RS,5SR)-2-[5-(4-Фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]-]N-гидроксиацетамидин
Указанное в заголовке соединение получали в виде твердого вещества грязно-белого цвета, tпл 84°С, МС: т/е 390,3 (М+Н+), из (2RS,5SR)-[5-(4-фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]ацетонитрила по общему методу, описанному в примере 7.
Пример 13
(2RS,5SR)-3-[5-(4-Фторфенил)-1-(толуол-4-сульфонил)пирролидин-2-ил]-5-метил[1,2,4]оксадиазол
Раствор уксусной кислоты (0,11 мл, 1,99 ммоля), 1,1'-карбонилдиимидазола (0,32 г, 1,99 ммоля) в ДМФ (12 мл) перемешивали при комнатной температуре в течение 2 ч и затем добавляли (2RS,5SR)-5-(4-фторфенил)-N-гидрокси-1-(толуол-4-сульфони