Усиление иммунной реакции, медиатором которой является слитый протеин антитело-цитокин, при помощи комбинированного лечения агентами, увеличивающими поглощение иммуноцитокина
Иллюстрации
Показать всеИзобретение относится к области иммунологии. Сущность его заключается в разработке способа и композиции, способствующей повышению поглощения иммуноцитокинов в опухолях. Композиции основаны на комбинировании цитокина с агентом, увеличивающим поглощение иммуноцитокина. Технический результат - повышение эффективности терапии опухолей и метастазов у млекопитающих. 2 н. и 25 з.п. ф-лы, 13 ил., 1 табл.
Реферат
Связанные заявки
Данная заявка предоставляет приоритет и использует информацию, раскрытую в заявке 60/215038, зарегистрированной 29 июня 2000 г., сведения из которой здесь введены посредством ссылок.
Область изобретения
Настоящее изобретение относится к слитым протеинам антитело-цитокин, полезным для целевой иммунотерапии. В общем случае изобретение относится к применению агентов, увеличивающих поглощение иммуноцитокина, в комбинированной терапии, направленной на усиление иммунной реакции, медиатором которой является слитый протеин антитело-цитокин, против предварительно выбранной мишени, например клеток в опухоли. В частности, изобретение относится к назначению слитых протеинов антитело-цитокин в комбинации с химиотерапевтическими препаратами, такими, как таксаны и/или алкилирующие агенты, для обработки клеток опухоли и других раковых или больных клеток.
Обоснование изобретения
Эффективное лечение таких заболеваний, как рак, требует усиления иммунных реакций одного или более типов эффекторных клеток, таких, как природные убийцы (NK), макрофаги и Т-лимфоциты. У животных и людей с опухолями иммунная система не способна эффективно реагировать на рост опухоли, главным образом, из-за того, что в опухоли задействованы специфические механизмы для подавления иммунной реакции. Во многих случаях потенциально способные разрушать опухоль моноцитные клетки, т.е. макрофаги, мигрируют к месту роста опухоли, но клетки опухоли секретируют такие факторы, как простагландины, TGF-β и IL-10, которые снижают их цитотоксическую активность (см., например, Sharma et al., 1999, J. IMMUNOL. 163:5020-5028). Аналогичным образом лимфоцитные клетки, такие, как NK и Т-клетки, мигрирующие внутрь опухолей, могут подавляться факторами, которые секретирует опухоль, так же, как и взаимодействиями с рецепторами, которые экспрессируются на поверхности опухолевых клеток и активируют апоптоз иммунных клеток (см., например, Villunger et al., 1997, BLOOD 90: 12-20). У этих лимфоцитов, которые подвергаются иммуноподавляющему воздействию моноцитных клеток в окрестности опухоли, может в дальнейшем уменьшаться способность к эффективной антиопухолевой реакции.
Попытки преодолеть иммуноподавляющее воздействие микроокружения опухоли включают направленную иммуностимуляцию, такую, как лечение слитым протеином антитело-цитокин, обладающим специфическим сродством к опухоли. Эффективное лечение на основе этого подхода продемонстрировано на нескольких моделях метастазов опухолей у мышей, однако это лечение становится значительно менее эффективным при увеличении размера опухоли. Вероятно, это обусловлено повышением, при большей массе опухоли, уровня ее секреции подавляющих факторов, а также и другими причинами, такими, как увеличение давления внутритканевой жидкости в опухоли (Griffon-Etienne et al. 1999, CANCER RES. 59: 3776-3782), которое препятствует проникновению в твердую опухоль терапевтических агентов.
В то время как для лечения большинства раковых пациентов по-прежнему назначают один или более курсов химиотерапии, хорошо известно, что цитотоксическая терапия рака создает угрозу иммунной системе. В человеческом организме иммунные клетки делятся быстрее, чем подавляющее большинство других типов клеток, и любое лечение, которое убивает размножающиеся клетки, будет убивать также и иммунные клетки. Следовательно, все варианты лечения, включающего облучение, повреждающие ДНК химические вещества, ингибиторы синтеза ДНК и ингибиторы микротубулярной функции, разрушают иммунную систему. Пересадка костного мозга как дополнение терапии рака требуется именно потому, что необходимо восстанавливать обусловленные противораковыми препаратами нарушения иммунной системы. Метотрексат и другие противораковые лекарства часто используют в качестве иммунодепрессантов. Очевидно также, что противораковые назначения могут специфически ингибировать функцию клеток Т. Например, пациенты, которых лечили от болезни Ходжкина путем облучения всего тела, страдают от постоянной потери простых клеток Т (Watanabe et al., 1997, Blood 90: 3662).
На основе современного уровня знаний становится очевидным, что обычные способы лечения (химиотерапия и облучение) и местная иммуностимуляция не могут составить полезный комбинированный подход к эффективному лечению рака. Следовательно, имеется необходимость в разработке способов усиления иммунной реакции, медиатором которой является слитый протеин антитело-цитокины, направленной против предварительно выбранных типов клеток, например клеток опухоли, и композиций, которые можно применять с этой целью.
Краткое описание изобретения
Обнаружено, что при назначении слитого протеина антитело-цитокин (иммуноцитокин) млекопитающим с опухолью или опухолевыми метастазами можно вызывать более сильную антиопухолевую реакцию в случаях, когда его назначают до, одновременно или после лечения агентом, увеличивающим поглощение иммуноцитокина, который повышает или усиливает терапевтическое действие слитого протеина антитело-цитокин за счет усиления или увеличения его поглощения опухолью. Было обнаружено, что в число полезных агентов, увеличивающих поглощение иммуноцитокина, входят алкилирующие химиотерапевтические агенты и таксаны, такие, как паклитаксел. В частности, было обнаружено, что такие комбинации полезны как посредники иммунного разрушения предварительно выбранных типов клеток, таких, как клетки опухоли вирусно-инфицированные клетки.
В одном из аспектов воплощения изобретение предоставляет способ стимулирования у млекопитающих убивающей клетки иммунной реакции против предварительно выбранных типов клеток. Способ включает назначение млекопитающим (i) иммуноцитокина, содержащего связывающий антитело сайт, который может связывать клетки предварительно выбранного типа, и цитокин, который может индуцировать такую иммунную реакцию против клеток предварительно выбранного типа, и (ii) агент, увеличивающий поглощение иммуноцитокина, в количестве, достаточном для усиления иммунной реакции, аналогичной той иммунной реакции, которую стимулирует сам иммуноцитокин, применяемый самостоятельно.
В предпочтительном воплощении изобретения клетками предварительно выбранного типа могут быть раковые клетки, присутствующие, например, в твердой опухоли, более предпочтительно в твердой опухоли большего размера (т.е. больше 100 мм3). Альтернативно клетками предварительно выбранного типа могут быть раковые клетки, присутствующие в виде мелких метастазов.
В другом предпочтительном воплощении изобретения агент, увеличивающий поглощение иммуноцитокина, можно назначать одновременно с иммуноцитокином. Альтернативно агент, увеличивающий поглощение иммуноцитокина, можно назначать до назначения иммуноцитокина. Более того, предполагается, что иммуноцитокин можно назначать вместе с множеством различных агентов, увеличивающих поглощение иммуноцитокина. Альтернативно предполагается, что агент, увеличивающий поглощение иммуноцитокина, можно назначать вместе с множеством различных иммуноцитокинов.
В другом аспекте изобретение предлагает композицию для стимулирования у млекопитающих убивающей клетки иммунной реакции. Эта композиция включает комбинацию: (i) иммуноцитокин, содержащий связывающий антитело сайт, который может связывать клетки предварительно выбранного типа, и цитокин, который может индуцировать такую иммунную реакцию против клеток предварительно выбранного типа у млекопитающих, и (ii) агент, увеличивающий поглощение иммуноцитокина, в количестве, достаточном для усиления убивающей клетки реакции, которую стимулирует иммуноцитокин из комбинации, аналогичной убивающей клетки реакции, которую иммуноцитокин стимулирует при самостоятельном назначении.
В предпочтительном воплощении изобретения связывающий антитело сайт иммуноцитокина предпочтительно включает высокомолекулярную цепочку иммуноглобулина или ее фрагмент, связывающий антиген. Высокомолекулярная цепочка иммуноглобулина предпочтительно включает, на конце с аминогруппой в направлении конца с карбоксигруппой, домен вариабельной области (VH) иммуноглобулина, способный связывать предварительно выбранный антиген, высокомолекулярный домен постоянной области иммуноглобулина 1 (СН1), высокомолекулярный домен постоянной области иммуноглобулина 2 (СН2) и может, кроме того, включать высокомолекулярный домен постоянной области иммуноглобулина 3 (СН3). В более предпочтительном воплощении изобретения иммуноцитокин представляет собой слитый протеин, включающий высокомолекулярную цепочку иммуноглобулина или ее фрагмент, связывающий антиген, слитый с цитокином через полипептидную связь. Следовательно, предпочтительный слитый протеин антитело-цитокин включает, на амино-конце в направлении карбокси-конца, (i) связывающий антитело сайт, который содержит вариабельную область иммуноглобулина, которая может связывать антиген поверхности клетки предварительно выбранного типа клетки, домен СН1 иммуноглобулина, домен СН2 иммуноглобулина (возможно, домен СН3), и (ii) цитокин. Способы получения и применения таких слитых протеинов подробно описаны в работе Gillies et al. (1992) Proc. Natl. Acad. Sci. USA 89: 1428-1432; Gillies et al. (1998) J. Immunol. 160: 6195-6203, и US Patent No. 5650150.
Домены постоянной области иммуноглобулина (т.е. домены СН1, СН2 и/или СН3) могут быть доменами постоянной области, которые обычно связаны с доменом вариабельной области встречающихся в природе антител. Альтернативно один или более доменов постоянной области иммуноглобулина можно извлечь из антител, отличных от антител, которые используют как источник домена вариабельной области. Иными словами, домены вариабельной и постоянной областей иммуноглобулина можно извлекать из различных антител, например антител, выделенных из различных биологических видов. См., например, US Patent No. 4816567. Более того, вариабельные области иммуноглобулина могут включать последовательности области рамки (FR), извлеченные из других видов, например человека, и последовательности области, определяющей дополнительность (CDR), помещенные между последовательностями FR, извлеченные из второго, отличного вида, например мыши. Способы получения и применения таких химерических вариабельных областей иммуноглобулина раскрыты, например, в патентах US №5225539 и 5585089.
Основанные на антителе иммуноцитокины предпочтительно включают, кроме того, низкомолекулярную цепочку иммуноглобулина, которая предпочтительно ковалентно связана с высокомолекулярной цепочкой иммуноглобулина посредством, например, дисульфидной связи. Вариабельные области связанных высокомолекулярной и низкомолекулярной цепочек иммуноглобулина вместе определяют единственный и полный связывающий сайт для связывания предварительно выбранного антигена. В других воплощениях изобретения иммуноцитокины включают две химерических цепочки, каждая из которых содержит по крайней мере часть высокомолекулярной цепочки иммуноглобулина, слитого с цитокином. Две химерические цепочки предпочтительно связаны друг с другом ковалентно, например, одной или более внутрицепочечными дисульфидными связями.
Изобретение, таким образом, предлагает слитые протеины, в которых специфичность связывания антигена и активность антитела объединены с высокой биологической активностью цитокина. Слитый протеин по настоящему изобренению можно применять для избирательной доставки цитокина к клетке-мишени in vivo, таким образом, чтобы цитокин мог оказывать локализованное биологическое действие в окрестности клетки-мишени. В предпочтительном воплощении изобретения компонент антитела слитого протеина специфически связывает антиген, который находится на поверхности или внутри раковой клетки, и в результате слитый протеин проявляет локализованную противораковую активность. В альтернативном предпочтительном воплощении изобретения компонент антитела слитого протеина специфически связывает вирусно-инфицированные клетки, такие, как ВИЧ-инфицированные клетки, и в результате слитый протеин проявляет локализованную антивирусную активность.
В число цитокинов, которые могут быть включены в иммуноцитокины по данному изобретению, входят, например, факторы некроза опухоли, интерлейкины, колониестимулирующие факторы и лимфокины, а также другие известные в настоящее время цитокины. Предпочтительная группа факторов некроза опухоли включает, например, фактор некроза тканей α (TNFα). Предпочтительная группа интерлейкинов включает, например, интерлейкин-2 (IL-2), интерлейкин-4 (IL-4), интерлейкин-5 (IL-5), интерлейкин-7 (IL-7), интерлейкин-12 (IL-12), интерлейкин-15 (IL-15) и интерлейкин-18 (IL-18). Предпочтительные колониестимулирующие факторы включают, например, гранулоцит-макрофаг-колониестимулирующий фактор (GM-CSF) и макрофаг-колониестимулирующий фактор (M-CSF). В группу предпочтительных лимфокинов входит, например, лимфотоксин (LT). В число других полезных цитокинов входят интерфероны, включая IFN-α, IFN-β и IFN-γ, каждый из которых проявляет иммунологическое действие, так же, как и антиангиогенное действие, которые не зависят от их антивирусных активностей.
Было обнаружено, что некоторые типы химиотерапевтических агентов являются эффективными агентами для увеличения поглощения иммуноцитокина. В частности, в число полезных агентов, увеличивающих поглощение иммуноцитокина, входят таксаны и алкилирующие химиотерапевтические агенты. Некоторые таксаны известны в этой области (см. Bissery и Lavelle, 1997, в Cancer Therapeutics: Experimental and Clinical Agents, Chapter 8, В. Teicher, ed.). В предпочтительном воплощении изобретения таксаном является Taxol, известный также под названием паклитаксел. Другие воплощения изобретения включают полусинтетический таксан, доцетаксел, который в некоторых моделях опухолей и при некоторых клинических показаниях оказался более эффективным, чем паклитаксел. Дальнейшие воплощения изобретения включают дополнительные производные таксана, такие, как выделенный из природного исходного материала 10-деацетил Baccatin III, экстрагированный из хвои Европейского Тиса. Одним из таких примеров является соединение для орального приема IDN5109, которое представляет собой также бедный субстрат для Р-гликопротеина и в общем случае более активно действует против опухолей, проявляющих высокую устойчивость к множеству лекарственных препаратов. В дополнение к его пригодности для орального приема, это соединение толерантно при более высоких дозах и обладает меньшими нейротоксическими побочными эффектами (Polizzi et al., 1999, Cancer Res. 59: 1036-1040).
В изобретении предлагаются также предпочтительные дозировки и курсы назначений для назначения иммуноцитокинов в комбинации с агентами, увеличивающими поглощение иммуноцитокина.
Описание чертежей:
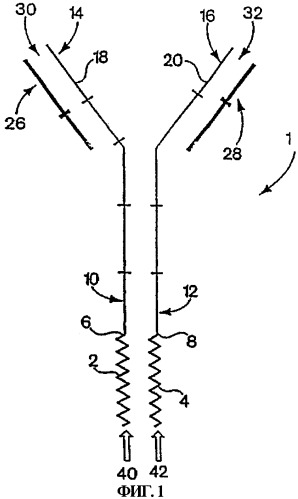
фиг.1 - схематическое представление цитокина;
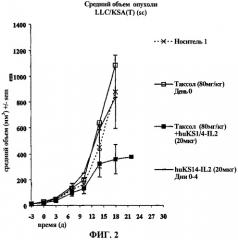
фиг.2 - влияние паклитаксела и иммуноцитокина на изменение объема опухоли LLC/KSA с течением времени;
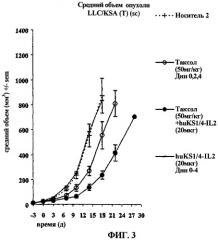
фиг.3 - влияние многократных доз паклитаксела и иммуноцитокина на изменение среднего объема опухоли с течением времени;
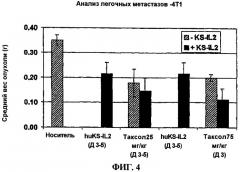
фиг.4 - влияние паклитаксела и иммуноцитокина на вес опухоли по результатам анализа метастазов в легких;
фиг.5 - влияние паклитаксела и иммуноцитокина на изменение объема опухоли CT26/KSA с течением времени;
фиг.6 - влияние паклитаксела и иммуноцитокина на вес опухоли по результатам анализа метастазов в печени;
фиг.7А и 7Б - влияние паклитаксела на поглощение иммуноцитокина в опухоли;
фиг.8 - влияние циклофосфамида на поглощение иммуноцитокина в опухоли;
фиг.9А - влияние циклофосфамида и иммуноцитокина на вес опухоли по результатам анализа метастазов в легких;
фиг.9Б - влияние циклофосфамида и иммуноцитокина на объем опухоли по результатам анализа роста опухоли;
фиг.9В: влияние циклофосфамида и иммуноцитокина на объем опухоли по результатам анализа роста опухоли;
фиг.10: влияние карбоплатина и иммуноцитокина на объем опухоли по результатам анализа роста опухоли.
Подробное описание изобретения
Исследования свидетельствуют, что твердые опухоли большого размера значительно более устойчивы по отношению к терапевтическому вмешательству посредством антител и к иммунотерапии в целом, чем рассредоточенные метастатические образования (Sulitzeanu et al. (1993) Adv. Cancer Res. 60: 247-267). Считается, слабая реакция на терапию, основанную на антителах, частично обусловлена тем, что опухоли генерируют иммуноподавляющие факторы.
Хотя механизм уничтожения опухоли еще не известен полностью, предполагается, что реакция цитотоксических Т-лимфоцитов (CTL) может приводить к разрушению раковых клеток и обеспечивать иммунную память. Более того, предполагается, что при определенных обстоятельствах клетки природные убийцы (NK) ответственны за уничтожение опухоли в отсутствие CTL. Различные иммунные реакции могут быть следствием факта, что определенные опухоли генерируют различные типы и количества веществ, способных подавлять Т-клетки. Это более верно для твердых опухолей, чем для микрометастатических образований, т.е. для таких, которые достигли критической массы и способны генерировать и секретировать иммуноподавляющие факторы на уровнях, достаточных для снижения иммунной реакции против опухоли.
Теперь обнаружено, что иммунные реакции, приводящие к уничтожению клеток опухоли, инициированные иммуноцитокином против предварительно выбранных типов клеток, могут быть значительно усилены путем назначения иммуноцитокина вместе с агентом, усиливающим поглощение иммуноцитокина. Комбинированная терапия особенно эффективна в плане содействия иммунному разрушению больных тканей, таких, как упрочившаяся опухоль. Без попыток создать связь с теорией предполагается, что агент, увеличивающий поглощение иммуноцитокина, увеличивает проникновение иммуноцитокина в микроокружение опухоли, что позволяет ему преодолевать иммуноподавляющее действие и быть более эффективным в плане активирования клеточной иммунной реакции против опухоли. Аналогичным образом предполагается, что такой способ может быть полезньм для лечения определенных вирусных заболеваний, при которых аналогичный иммуноподавляющий механизм предотвращает эффективное проявление клеточного иммунитета, например, при инфекции ВИЧ. Предполагается, что агент, увеличивающий поглощение иммуноцитокина, вместе с иммуноцитокином оказывает синергическое действие как медиатор иммунного разрушения больных тканей, таких, как упрочившаяся опухоль, или вирусно инфицированных клеток. В настоящем изобретении описаны также способы изготовления и применения полезных иммуноцитокинов, а также анализ, пригодный для тестирования в доклиническом моделировании на животных in vivo их фармакокинетических активностей при комбинировании с подходящими агентами, увеличивающими поглощение иммуноцитокина.
Используемый здесь термин «агент, увеличивающий поглощение иммуноцитокина» следует понимать как любой агент, который усиливает иммунную реакцию, приводящую к уничтожению клеток опухоли, инициируемую иммуноцитокином против предварительно выбранного типа клеток. Более конкретно, предпочтительный агент, увеличивающий поглощение иммуноцитокина, это агент, который увеличивает поглощение опухолью иммуноцитокина и, таким образом, увеличивает его проникновение внутрь опухоли. Примеры агентов, увеличивающих поглощение иммуноцитокина, включают, но не ограничиваются ими, химиотерапевтические агенты, такие, как таксаны, агенты, разрушающие ДНК, в том числе алкилирующие химиотерапевтические агенты, агенты лучевой терапии и агенты, снижающие кровяное давление. Предпочтительными таксанами являются таксол, доцетаксел, 10-деацетил Baccatin III и их производные. Предпочтительными алкилирующими агентами являются циклофосфамид, карбоплатин, цисплатин и их производные. Предпочтительным видом облучения является гамма-излучение. Предпочтительным агентом, снижающим кровяное давление, является агонист ангиотенсина II, такой, как сам ангиотенсин II, предпочтительно назначаемый периодически в соответствии с общими принципами, описанными в работах Netti et al. (Cancer Research [1995] 55: 5451-8) и Netti et al. (Proc. Nat. Acad. Sci. [1999] 96: 3137-3142). Иммунную реакцию можно определять по известным методикам и/или по описанному здесь способу.
Используемый здесь термин "иммунная реакция, приводящая к уничтожению клеток опухоли" следует понимать как любую иммунную реакцию в млекопитающих либо гуморальной, либо клеточной природы, которая стимулируется иммуноцитокином и которая либо убивает, либо иным способом уменьшает жизнеспособность предварительно выбранного типа клеток в млекопитающих. Иммунная реакция может включать один или более типов клеток, в том числе Т-клетки, клетки NK и макрофаги.
Используемый здесь термин "иммуноцитокин" означает слияние (i) связывающего антитело сайта, обладающего специфичностью к связыванию предварительно выбранного антигена и способностью его связывать, например, специфического антигена клеточного типа, и (ii) цитокина, способного инициировать или стимулировать иммунную реакцию, приводящую к уничтожению клеток опухоли, обычно - против раковых или вирусно инфицированных клеток. В число примеров предварительно выбранных входят антигены поверхности клеток, таких, которые присутствуют на раковых клетках или вирусно инфицированных клетках, и нерастворимые внутриклеточные антигены, например, некротических клеток, которые могут оставаться присоединенньми к клеточной мембране. Предпочтительными антигенами являются целевые антигены, характерные для клеток опухоли, такие, как специфические к опухоли антигены. Следовательно, иммуноцитокин может селективно доставлять цитокин к мишени (которой обычно является клетка) in vivo таким образом, что цитокин может служить медиатором локализованной иммунной реакции против целевой клетки. Например, если компонент антитела иммуноцитокина селективно связывает антиген на раковой клетке, такой, как раковая клетка в твердой опухоли, в частности в большей твердой опухоли, размер которой превышает 100 мм, иммуноцитокин усиливает локализованную антираковую активность, если компонент антитела иммуноцитокина селективно связывает антиген на вирусно инфицированной клетке, такой, как клетка, инфицированная HIV, иммуноцитокин усиливает локализованную антивирусную активность.
Используемый здесь термин "сайт, связывающий антитело" следует понимать как по крайней мере часть высокомолекулярной цепочки иммуноглобулина, например вариабельную область иммуноглобулина, способную связывать предварительно выбранный антиген типа клеточного антигена. Сайт, связывающий антитело, также предпочтительно включает по крайней мере часть постоянной области иммуноглобулина, в том числе, например, домен CH1, домен СН2, и, возможно, домен СН3, или по крайней мере домен СН2, или одну или более их частей. Более того, высокомолекулярная цепочка иммуноглобулина может быть связана либо ковалентно, либо нековалентно с низкомолекулярной цепочкой иммуноглобулина, включая, например, вариабельную область низкомолекулярной цепочки иммуноглобулина и, возможно, постоянную область низкомолекулярной цепочки. Соответственно, предполагается, что сайт, связывающий антитело, может содержать целое антитело или его фрагмент либо отдельную цепочку антитела, способную связывать предварительно выбранный антиген.
Относительно иммуноцитокина предполагается, что фрагмент антитела может быть связан с цитокином множеством широко известных способов. Например, сайт, связывающий антитело, предпочтительно связан через полипептидную связь или линкер с цитокином в структуре слитого протеина. Альтернативно сайт, связывающий антитело, может быть химически спарен с цитокином через химически активные группы, например сульфгидрильные группы, внутри боковых цепочек аминокислот, присутствующих в сайте, связывающем антитело и цитокин.
Используемый здесь термин "цитокин" следует понимать как любой протеин или пептид, их аналог или функциональный фрагмент, который способен стимулировать или инициировать иммунную реакцию, приводящую к уничтожению клеток против предварительно выбранного типа клеток, например раковой клетки или вирусно инфицированной клетки, в млекопитающих. Следовательно, предполагается, что в иммуноцитокины по данному изобретению может быть включено множество цитокинов. В группу полезных цитокинов входят, например, факторы некроза опухоли (TNF), интерлейкины (IL), лимфокины (L), колониестимулирующие факторы (CSF), интерфероны (IFN), включая варианты видов и их усеченные аналоги, которые способны стимулировать или инициировать иммунную реакцию, приводящую к уничтожению клеток. В число подходящих факторов некроза опухоли входят, например, TNFα. В число подходящих лимфокинов входят, например, LT. В число подходящих колониестимулирующих факторов, входят, например, GM-CSF и M-CSF. В число подходящих интерлейкинов входят, например, IL-2, IL-4, IL-5, IL-7, IL-12, IL-15 и IL-18. В число подходящих интерферонов входят, например, IFN-α, IFN-β и IFN-γ. Ген, кодирующий цитокин, который представляет особый интерес, может быть клонирован de novo, получен из доступных источников или синтезирован в стандартном синтезе ДНК из известных нуклеотидных последовательностей. Например, последовательность ДНК LT известна (см., например, Nedwin et al. (1985) Nucleic acids res. 13: 6361), известны также и последовательности для IL-2 (см., например, Taniguchi et al. (1983) NATURE 302: 305-318), GM-CSF (см., например, Gasson et al. (1984) Science 266: 1339-1342) и TNF α (см., например, Nedwin et al. (1985) NUCLEIC ACIDS RES. 13: 6361).
В предпочтительном воплощении изобретения иммуноцитокины представляют собой рекомбинантные слитые протеины, полученные в рамках традиционных методологий рекомбинантных ДНК, т.е. путем формирования структуры нуклеиновой кислоты, кодирующей химерический иммуноцитокин. Конструирование рекомбинантного слитого протеина антитело-цитокин было описано в прототипе. См., например, Gillies et al. (1992) Proc. Natl. Acad. Sci. USA 89: 1428-1432; Gillies et al. (1998) J. Immunol. 160: 6195-6203, и патент US №5650150. Предпочтительно генная конструкция, кодирующая иммуноцитокин по данному изобретению, включает, в направлении от 5' к 3', сегмент ДНК, кодирующий домен вариабельной области высокомолекулярной цепочки иммуноглобулина, сегмент ДНК, кодирующий домен постоянной области высокомолекулярной цепочки иммуноглобулина и ДНК, кодирующую цитокин. Слитый ген монтируют или вставляют в вектор экспрессии для трансфекции в подходящую клетку-реципиент, в которой слитый ген экспрессируют. Гибридную полипептидную цепочку предпочтительно комбинируют с низкомолекулярной цепочкой иммуноглобулина таким образом, чтобы вариабельная область высокомолекулярной цепочки (VH) иммуноглобулина и вариабельная область низкомолекулярной цепочки (VL) иммуноглобулина вместе образовывали единый и полный сайт для связывания предварительно выбранного антигена. В предпочтительном воплощении изобретения высокомолекулярная и низкомолекулярная цепочки иммуноглобулина ковалентно связаны, например, через внутрицепочечную дисульфидную связь. Более того, высокомолекулярные цепочки двух иммуноглобулинов, один или оба из которых слиты с цитокином, могут быть ковалентно связаны, например, посредством одной или более внутрицепочечных дисульфидных связей.
Следовательно, способы по данному изобретению пригодны для повышения антиопухолевой активности иммуноцитокина, который применяется в терапевтическом методе лечения опухоли, включая иммуноцитокиновые композиции и способы, раскрытые в WO 99/29732, WO 99/43713, WO 99/52562, WO 99/53958 и WO 01/10912, и основаны на антителе слитых протеинов с измененной аминокислотной последовательностью в области связывания. В одном из воплощений способы по данному изобретению полезно применять в комбинации со слитыми протеинами Fc, такими, как Fc-интерферон-α.
На фиг.1 показано схематическое представление типичного иммуноцитокина 1. В этом воплощении молекулы цитокина 2 и 4 пептидно связаны с карбокси-концами 6 и 8 областей СН3 10 и 12 высокомолекулярных цепочек антитела 14 и 16. Области 26 и 28 VL показаны спаренными с областями 18 и 20 VH в обычной конфигурации IgG, что обеспечивает наличие двух связывающих антиген сайтов 30 и 32 на амино-концах иммуноцитокина 1 и двух связывающих рецептор цитокина сайтов 40 и 42 на карбокси-концах иммуноцитокина 1. Разумеется, в более широких аспектах нет необходимости спаривать иммуноцитокины, как это показано, или требуется сливать с молекулой цитокина только одну из двух высокомолекулярных цепочек иммуноглобулина.
Иммуноцитокины по данному изобретению можно рассматривать как химерические в силу двух аспектов их структуры. Во-первых, иммуноцитокин является химерическим в том, что включает высокомолекулярную цепочку иммуноглобулина, содержащую связывающую антиген специфичность, привязанную к данному цитокину. Во-вторых, иммуноцитокин по данному изобретению может быть химерическим в том смысле, что он включает вариабельную область (V) иммуноглобулина и постоянную область (С) иммуноглобулина, каждая из которых извлечена из различных антител, так что получающийся протеин является химерой V/C. Например, вариабельная и постоянная области могут быть извлечены из молекул встречающихся в природе антител, которые можно выделить из различных биологических видов. См., например, патент US 4816567. Кроме того, приемлемыми являются конструкции, в которых любая из двух или обе вариабельные области иммуноглобулина включают последовательности области рамки (FR) и последовательности области, определяющей дополнительность (CDR), извлеченные из различных биологических видов. Такие конструкции раскрыты, например, в работах Jones et al. (1986) Nature 321: 522-525, Verhoyen et al. (1988) SCIENCE 239: 1534-1535, и в патентах US №№5225539 и 5585089. Кроме того, предполагается, что последовательности вариабельной области могут быть получены скринированием библиотек, например библиотек фагов, для последовательностей вариабельной области, которые связывают предварительно выбранный антиген с желательной степенью сродства. Способы создания и библиотек фагов раскрыты, например, в работах Huse et al. (1989) Science 246: 1275-1281, и Kang et al. (1991) Proc. Natl. Acad. Sci. USA 88: 11120-11123.
Домены постоянной области высокомолекулярной цепочки иммуноглобулина иммуноцитокина могут быть выбраны из любого из пяти классов иммуноглобулина, на которые ссылаются как на IgA (Igα), IgD (Igδ), IgE (Igε), IgG (Igγ) и IgM (Igμ). Тем не менее постоянные области из высокомолекулярной цепочки иммуноглобулина класса IgG являются предпочтительными. Кроме того, предполагается, что высокомолекулярные цепочки иммуноглобулина можно извлекать из любого из подклассов антител IgG, которые известны как IgG1, IgG2, IgG3 и IgG4. Как известно, каждая постоянная область высокомолекулярной цепочки иммуноглобулина включает четыре или пять доменов. Домены называются в следующей последовательности: СН1-шарнир-СН2-СН3-(-СН4). СН4 присутствует в IgM, который не содержит областей шарнира. Последовательности ДНК доменов высокомолекулярной цепочки имеют пересекающуюся гомологию среди классов иммуноглобулина, например, домен СН2 из IgG является гомологическим домену СН2 из IgA и IgD и домену СН3 из IgM и IgE. Низкомолекулярные цепочки иммуноглобулина могут иметь постоянную цепочку либо каппа (κ), либо лямбда (λ). Последовательности и расположение последовательностей этих областей иммуноглобулина хорошо известны (см., например, Kabat et al., "Sequences of Proteins Immunological Interest, "U.S. Department of Health и Human Services, третье издание 1983, четвертое издание 1987, и Huck et al. (1986) NUC. ACIDS RES. 14: 1779-1789).
В предпочтительных воплощениях данного изобретения вариабельные области извлекают из антител, специфических по отношению к антигену поверхности предварительно выбранной клетки (антигену, связанному с больными клетками, такими, как раковая клетка или вирусно инфицированная клетка), а постоянные области включают домены СН1 и СН2 (и возможно, СН3) из антитела, которое является таким же или отличным от антитела, которое является источником вариабельной области. В практическом осуществлении данного изобретения относящаяся к антителу часть иммуноцитокина предпочтительно является неиммуногенной или слабо иммуногенной в намеченном реципиенте. Соответственно, относящуюся к антителу часть, максимально насколько это возможно, предпочтительно извлекают из тех же самых биологических видов, что и намеченный реципиент. Например, если иммуноцитокин предполагается назначать людям, домены постоянной области предпочтительно получают из человеческого источника. См., например, патент US №4816567. Более того, если вариабельную область иммуноглобулина извлекают из видов, иных, чем намеченный реципиент, например, когда источником последовательностей вариабельной области являются мыши, а намеченный реципиент - человек, то вариабельная область предпочтительно включает последовательности FR человека и мышиные последовательности CDR, помещенные между последовательностями FR, так, чтобы получалась химерическая вариабельная область, которая обладает специфичностью к связыванию предварительно выбранного антигена, но по-прежнему минимизирует иммунную активность намеченного хозяина. Конструирование и синтез таких химерических вариабельных областей описаны в работах Jones et al. (1986) Nature 321: 522-525, Verhoyen et al. (1988) SCIENCE 239: 1534-1535, и патенты US №№5225539 и 5585089. Клонирование и экспрессия приспособленного для человека слитого протеина антитело-цитокин, KS-1/4 анти-ЕрСАМ антитело -EL-12 слитый протеин, а также его способность разрушать упрочившуюся колонию метастазов карциномы была описана в работе Gillies et al. (1998) J. Immunol. 160: 6195-6203.
Ген, кодирующий цитокин, присоединен либо прямо, либо через линкер, например, при помощи линкера (Gly4-Ser)3, кодирующего ДНК в рамке, к концу 3' гена, кодирующего постоянную область иммуноглобулина (т.е. экзоны СН2 или СН3). В определенных воплощениях данного изобретения линкер может включать нуклеотидную последовательность, кодирующую сайт протеолитического расщепления. Этот сайт, если он помещен между постоянной областью иммуноглобулина и цитокином, может быть спроектирован таким образом, чтобы обеспечивать протеолитическое высвобождение цитокина на сайте мишени. Например, хорошо известно, что плазмин и трипсин отщепляются после радикалов лизина и аргинина на сайгах, которые являются подходящими для протеаз. Многие другие специфические к сайту эндопротеазы и аминокислотные последовательности, которые они отщепляют, хорошо известны. Предпочтительные сайты протеолитического расщепления и протеолитические ферменты, проявляющие активность с такими сайтами расщепления, раскрыты в патентах US №№5541087 и 5726044.
Структура нуклеиновой кислоты необязательно может включать эндогенный промотор и энхансер для гена, кодирующего вариабельную область, чтобы регулировать экспрессию химерической цепочки иммуноглобулина. Например, гены, кодирующие вариабельную область, могут быть получены в виде фрагментов ДНК, включающих лидирующий пептид, ген VJ (функционально перегруппированные вариабельные области (V) с присоединением сегмента (J)) для низкомолекулярной цепочки, или ген VDJ для высокомолекулярной цепочки, и эндогенный промотор и энхансер для этих генов. Альтернативно ген, кодирующий вариабельную область, может быть получен без регулирующих эндогенных элементов, и его можно применять в векторе экспрессии, который обеспечивает эти элементы.
Гены вариабельной области можно получать по обычной методике клонирования ДНК из клеток, которые генерируют желательные антитела. Скринирование библиотеки генов для специфической функционально перегруппированной вариабельной области можно произвести при помощи подходящих образцов ДНК, таких, как сегменты ДНК, содержащие область J последовательности ДНК и дальше отстоящие последовательности. Идентификация и подтверждение правильных клонов достигаются секвенированием клонированных генов и сравнением последовательности с соответствующей последовательностью полной длины, по сути, сплайсингованной mРНК.
Антиген-мишень может быть антигеном поверхности клетки опухоли, поверхности раковой клетки, вирусно инфицированной клетки или другой больной клетки. Антиген-мишень может также быть нерастворимым внутриклеточным антигеном некротической клетки (см., например, патент US №5019368). Гены, кодирующие подходящие вариабельные области, можно в общем случае получать из генерирующих иммуноглоб