(r)-2-арилпропионамиды, полезные при ингибировании ил-8-индуцированного хемотаксиса нейтрофилов, способ и промежуточные соединения для их получения, фармацевтическая композиция, ингибирующая хемотаксис нейтрофилов, индуцированный интерлейкином-8
Иллюстрации
Показать всеИзобретение относится к (R)-энантиомерам 2-арилпропионамидам формулы (Ia)
и их фармацевтически приемлемым солям, где Aryl представляет фенильную группу, замещенную группой, выбранной из изопропила, ацетила, (2'',6''-дихлорфенил)амино, α-гидроксиизопропила, (R,S)-α-гидроксибензила и его индивидуального R-изомера, (R,S)-(α-метилбензила) и его индивидуального R-изомера и (R,S)-α-гидрокси-α-метилбензила и его индивидуального R-изомера; R представляет Н или С1-С4-алкил; R' представляет: аминокислотный остаток, состоящий из неразветвленного или разветвленного C1-С6-алкила, замещенного карбоксигруппой CO2H; остаток формулы -СН2-СН2Х-(СН2-СН2O)nR, где R имеет указанные выше значения; n равно целому числу от 0 до 1, тогда как Х представляет собой кислород; гетероарил, выбранный из группы, состоящей из 2-пиримидинила или 4-пиримидинила. Предложена фармацевтическая композиция, ингибирующая хемотаксис нейтрофилов, индуцированный интерлейкином-8, содержащая в качестве активного начала (R)-энантиомеры 2-арилпропионамидов формулы (I) и их фармацевтически приемлемые соли в смеси с его подходящим носителем. Предложен способ получения соединений формулы (Ia). Также предложены (R)-энантиомеры 2-арилпропионовых кислот формулы (Va) и их фармацевтически приемлемые соли. Технический результат - (R)-2-арилпропионамиды, полезные при профилактике и лечении повреждения ткани, обусловленного усиленным пополнением полиморфоядерных нейтрофилов в местах воспаления. 4 н. и 9 з.п. ф-лы, 6 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к N-(2-арилпропионил)амидам, способу их получения и их фармацевтическим композициям, полезным при профилактике и лечении повреждения ткани, обусловленного усиленным пополнением полиморфоядерных нейтрофилов (PMN лейкоцитов) в местах воспаления. В частности, изобретение относится к R-энантиомерам N-(2-арилпропионил)амидов для применения при ингибировании хемотаксиса нейтрофилов, индуцированного ИЛ-8 (IL-8).
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Хемокины образуют семейство цитокинов низкой молекулярной массы, непосредственно вовлеченное в воспалительную ответную реакцию, в перемещение иммунных клеток и в направленную миграцию клеточных элементов. Термин «хемокины», который является сокращением слов хемотактические цитокины, придает большое значение типичной биологической функции этих медиаторов клетки.
Хемокины делят на два подвида, которые отличаются по последовательностям аминокислот СС и СХС, содержащих два цистеиновых остатка, постоянно присутствующих в N-концевой части белка. В одном случае, например в случае моноцитного белка-1-хемоаттрактанта (МСР-1), два цистеиновых остатка являются смежными, в другом случае, например в случае интерлейкина-8 (ИЛ-8) и некоторых его близкородственных аналогов (GRO-α,β,γ, ENA-78, NAP-2, GCP-2), вторая аминокислота расположена между двумя цистеинами.
С функциональной точки зрения хемокины отличаются от других цитокинов клеточной специфичностью их действия: каждый из них регулирует в специфическом пути миграцию и выполняемые функции одного вида клеток. Так, если МСР-1 влияет на движения и управляет движениями моноцитов, ИЛ-8 играет важную роль специфичного для нейтрофилов фактора-хемоаттрактанта. Подтверждение этого обеспечивается присутствием высоких концентраций ИЛ-8 в местах воспаления и в окружающих жидкостях, обнаруженных во время многих острых заболеваний, опосредованных нейтрофилами, а также предотвращением степени тяжести повреждения ткани и пониженной инфильтрацией нейтрофилов, наблюдаемых после введения антител против ИЛ-8 во время экспериментов, проводимых на животных моделях, представляющих нейтрофилзависимые заболевания. Типичными клиническими состояниями являются повреждения, вызванные церебральной реперфузией, и повреждение, вызванное ишемией и реперфузией миокарда.
Указанные наблюдения подтверждают гипотезу, что ИЛ-8 составляет основной медиатор повреждения ткани, вызванного нейтрофилами, в такой степени, что можно предположить, что ИЛ-8 является оптимальной мишенью для терапевтических вмешательств, направленных на устранение острых воспалительных состояний, опосредованных нейтрофилами (N. Mukaida et al., Inflammation Research 47 (Suppl.3) S151, 1998). Для этой цели в качестве альтернативы использованию антител против ИЛ-8 могут представлять большой интерес и клиническую пригодность вещества с низкой молекулярной массой, которые сами, включаясь в межклеточный и внутриклеточный циклы передачи сигнала, могут быть способны ингибировать миграцию нейтрофилов человека, стимулированную ИЛ-8 и его близкородственными аналогами в очень специфическом пути.
Недавно в РСТ/ЕР/9907740 описаны N-ацилсульфонамиды (R)-2-арилпропионовых кислот, оказывающие ингибирующее действие на хемотаксис нейтрофилов, стимулированный ИЛ-8, независимо от воспалительных процессов, связанных с ингибированием циклооксигеназы (СОХ-1 и/или СОХ-2).
С другой стороны, может оказаться, что ингибирование синтеза простагландинов (ПГ), характерное для (S)-энантиомеров 2-арилпропионовых кислот и некоторых их производных, оказывает отрицательное влияние на динамику нейтрофилзависимого процесса воспаления, стимулированного ИЛ-8, так что происходит обострение самого заболевания. В указанных случаях, при ингибировании синтеза ПГ, эндогенный фактор, ПГЕ2, который регулирует синтез фактора-альфа некроза опухоли (TNF-α), исчезает. Следовательно, в соревновании с самим ИЛ-8 TNF-α может содействовать, вместе с цитокинами ИЛ-6 и ИЛ-1 и с молекулами адгезии (Е-селектин, ICAM-1 и С-реактивный белок), обострению степени и тяжести повреждения ткани во время острого инфаркта миокарда (R. Pudil et al., Clin. Chim. Acta, 280, 127, 1999).
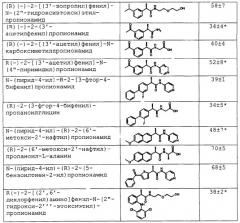
Кроме того, оказывается, что известный (R)-2-(4-изобутилфенил)пропионамид (РСТ/ЕР/9907740) является активным при предотвращении и ингибировании хемотаксиса лейкоцитов человека, индуцированного ИЛ-8, свойство, полностью отсутствующее у (S)-энантиомера (таблица 1).
| Таблица 1 | |
| Соединение | % ингибирования хемотаксиса PMNs человека, стимулированного ИЛ-8 (10 г/мл) |
| (R)-2-(4-изобутилфенил) пропионамид* | 57±12 |
| (S)-2-(4-изобутилфенил) пропионамид* | -2±8 |
| * Конц. 10-8 М |
Кроме того, то же самое соединение и соответствующий (R)-N-метил-2-(4-изобутилфенил)пропионамид, хотя и менее сильнодействующий [25+9% ингибирования при концентрации 10-8 М], в качестве ингибитора хемотаксиса лейкоцитов, стимулированного ИЛ-8 (10 нг/мл), характеризуются тем, что они негативно регулируют продуцирование TNF-α (стимулированного в мышиных макрофагах H2O2 и липополисахаридами), а также тем, что они не ингибируют синтез ПГЕ2 в макрофагах после стимуляции липополисахаридами (LPS) при 1 мкг/мл. Вместо этого в таких же экспериментальных условиях S-кетопрофен (взятый в качестве типичного примера (S)-энантиомера 2-арилпропионовых кислот, ингибиторов СОХ) стимулирует в макрофагах амплификацию синтеза TNF-α, индуцируемого LPS с процентным отклонением 300% для синтеза и высвобождения TNF-α; фактически в присутствии контрольных величин цитокина, одного присутствующего в инкубационной среде, меньших, чем поддающийся детектированию минимум (20 пг/мл), величины 10±5 нг/мл обнаружены в присутствии LPS, тогда как величины 39±5 нг/мл обнаружены в присутствии LPS и 10-5 М S-кетопрофена (Ghezzi et al., J. Pharmacol. Exp. Therap., 287, 969-974, 1998). Позднее было обнаружено, что указанное заметное повышение в высвобождении TNF-α является прямым следствием стимуляции мРНК TNF-α S-кетопрофеном (Р.Mascagni et al., Eur. Cytokine Netw., 11:185-192, 2000).
Амиды 2-арилпропионовых кислот с аминоспиртами описаны в ES 500990 и в ES 2007236 для получения N-(α-гидроксиэтил)-d,1-2-(4-изобутил)пропионамидов.
Известны также амиды ибупрофена с L- и D,L-аминокислотами (W. Kwapiszewski et al., Ada Pol. Pharm., 42, 545, 1985) и более широко амиды рацематов и S-энантиомеров 2-арилпропионовых кислот с глицином (Р Singh et al., Indian J. Chem. Sect. В, 29В, 551, 1990) и со следующими аминокислотами: лизином, глутаминовой кислотой и аспарагиновой кислотой [А.Reiner, патент США №4341798]. Более часто указанные соединения были оценены в виде смесей диастереомеров без возможности определить вклад индивидуальных диастереоизомеров.
Амиды энантиомеров 2-арилпропионовых кислот с таурином, глутамином, орнитином, аргинином, глутаминовой кислотой, аспарагиновой кислотой, серином и аланином хорошо известны в качестве мочевых метаболитов этих кислот у различных видов животных (R.I.Jeffrey et al., Xenobiotica, 4, 253, 1978 и цитированные в ней ссылки).
Другие амиды, изученные в качестве пролекарств 2-арилпропионовых кислот, были описаны S. Biniecki et al., PL 114050, H.A.Kguen et al., Arzneim-Forsh, 46, 891, 1986 и G.L.Levitt et al., Russ. J. Org. Chem., 34, 346, 1998. Такие амиды наделены довольно высокой противовоспалительной активностью, связанной с пониженными побочными эффектами и хорошей переносимостью на желудочно-кишечном уровне, которые, как считают, компенсируют потерю эффективности, наблюдаемую по сравнению с их предшественниками.
Потеря всякой остаточной фибринолитической активности была описана для (±)-ибупрофена и других нестероидных противовоспалительных агентов, таких как индометацин, флуфенаминовая кислота и мефенаминовая кислота, после превращения в соответствующие амиды с 2-аминометилпиридином (G.Orzalesi et al., Progress in Fibrinolysis and Thrombolysis, 3, 483, 1978).
В сравнительном исследовании противовоспалительные, аналгезирующие и жаропонижающие свойства, воздействие на поведение и острую токсичность у мышей оценивали для различных амидов ибупрофена, кетопрофена (оба как рацематы) и 3-бензоилфенилуксусной кислоты (R.C.W. Spickett et al., J. Med. Chem. Chim. Ther., 11, 7, 1976). Сравнение проводится с простыми амидами(-CONH2) и их N-этил- и N-диметилпроизводными, соответствующими уреидами и тиоуреидами, а также анилидами и некоторыми циклическими амидами, такими как амиды с 2-аминотиазолидином, 2-аминотиазолом, 2-амино-4-метилпиридином и 1-фенил-2,3-диметил-4-аминопиразолом. Фармакологическое исследование привело к отбору и разработке (R,S)-2-[3-бензоилфенилпропионамидо]-4-метилпиридина, известного также под названием пиркетопрофен (A.Gallardo, патент Великобритании 1436502].
Кроме того, недавно было описано использование R-2-арилпропионовых кислот в качестве лекарств для лечения колоректальных опухолей и муковисцидоза (патент США 5955504 и патент США 5981592).
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Теперь обнаружено, что амиды, структурно связанные с (R)-2-(4-изобутилфенил)пропионамидом, характеризующиеся подходящими заместителями, проявляют неожиданно свойства ингибирования хемотаксиса, индуцированного ИЛ-8.
Примерами таких заместителей являются остатки α-аминокислоты, выбранной из группы, состоящей из глицина, L-аланина, D-аланина и L-серина, группы формулы -СН2-СН2ОН, CH2CH2O-CH2-CH2OH или ароматические и гетероароматические радикалы, такие как фенил и пиридил.
Соединения получают взаимодействием (в присутствии подходящего основания) хлорангидрида (R)-2-(4-изобутилфенил) пропионовой кислоты с подходящим амином и с метиловыми эфирами α-аминокислот, ранее указанных.
В последнем случае последующее омыление карбоксиэфиров в нерацемизирующих условиях давало возможность получить свободные кислоты индивидуальных амидов. Амиды изобретения, как таковые или после омыления, имеют хорошие характеристики растворимости.
Было доказано, что свойства ингибирования хемотаксиса, индуцированного ИЛ-8, неожиданно зависят от стереохимии и от стерического, электронного и полярного влияний заместителей на амидном азоте. Фактически было отмечено, например, что амиды с аминокислотами ряда L являются более активными, чем амиды с аминокислотами ряда D. Кроме того, в случае ароматических или гетероароматических амидов присутствие заместителей на ароматическом кольце сильно влияет на активность. Кроме того, полярные взаимодействия внутримолекулярного типа, например, внутримолекулярные водородные связи, имеют иногда доказанную критичность для фармакологической активности.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В следующих абзацах представлены определения известных химических остатков, которые составляют соединения изобретения и предназначаются для использования единообразно по всему описанию и формуле изобретения, если только в противном случае специально представленные определения не предусматривают более широкое определение.
«С1-С4-Алкил», или «С1-С5-алкил», или «C1-С6-алкил» относится к одновалентным алкильным группам, имеющим от 1 до 4, или от 1 до 5, или от 1 до 6 атомов углерода. Примерами этих терминов являются такие группы, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил и тому подобное. «Арил» относится к ненасыщенной ароматической карбоциклической группе с атомами углерода от 6 до 14, имеющей одно кольцо (например, фенил) или несколько конденсированных колец (например, нафтил). Предпочтительный арил включает фенил, бифенил, нафтил, фенантренил и тому подобное. «Алкенил» относится к алкенильным группам, предпочтительно имеющим от 2 до 5 атомов углерода и имеющим один или несколько центров алкенильной ненасыщенности. Предпочтительные алкенильные группы включают этенил (-СН=СН2), н-2-пропенил (аллил, -СН2СН=СН2) и тому подобное.
«Замещенный или незамещенный»: если только в противном случае такие термины не ограничены определением отдельного заместителя, выше представленные группы, подобные «алкильной», «алкенильной», «арильной» группам и т.д. могут, необязательно, быть замещены заместителями от 1 до 5, выбранными из группы, состоящей из «С1-С6-алкила», «С1-С6-алкиларила», «С1-С6-алкилгетероарила», «С2-С6-алкенила», первичных, вторичных или третичных аминогрупп или четвертичных аммониевых групп, «ацила», «ацилокси», «ациламино», «аминокарбонила», «алкоксикарбонила», «арила», «гетероарила», карбоксила, циано, галогена, гидрокси, меркапто, нитро, сульфокси, сульфонила, алкокси, тиоалкокси, тригалогенметила и тому подобное. В пределах объема настоящего изобретения указанное «замещение» означает, что оно включает также случаи, когда соседние заместители подвергаются циклизации, особенно, когда включены вицинальные функциональные заместители, таким образом образуя, например, лактамы, лактоны, циклические ангидриды или циклоалканы, а также ацетали, тиоацетали, аминали, образованные циклизацией, например, при необходимости получить защитную группу.
«Фармацевтически приемлемые соли» относятся к солям или комплексам идентифицированных ниже соединений формулы I, которые сохраняют требуемую биологическую активность. Примеры таких солей включают, но не ограничиваются ими, кислотно-аддитивные соли, образованные с неорганическими кислотами (например, хлористоводородной кислотой, бромистоводородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и тому подобное), и соли, образованные с органическими кислотами, такими как уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, фумаровая кислота, малеиновая кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, памоевая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновая кислота, нафталиндисульфоновая кислота и полигалактуроновая кислота. Указанные соединения можно также ввести в виде фармацевтически приемлемых четвертичных солей, известных специалисту в данной области. Примеры солей включают также основно-аддитивные соли, образованные с неорганическими основаниями, такими как гидроксид натрия, и с органическими основаниями, такими как трометамин, L-лизин, L-аргинин и тому подобное.
Настоящее изобретение относится к амидам R-энантиомеров 2-арилпропионовых кислот формулы (I)
и их фармацевтически приемлемым солям,
где Aryl представляет замещенную или незамещенную арильную группу;
R представляет Н, С1-С4-алкил, аллил, пропаргил, CH2-CO2H
или (СН2)2-CO2Н;
R' представляет:
- аминокислотный остаток, состоящий из неразветвленного или разветвленного С1-С6-алкила, алкенила, циклоалкила, фенилалкила, замещенного одной или несколькими карбоксигруппами CO2Н;
- аминокислотный остаток, состоящий из неразветвленного или разветвленного С1-С6-алкила, алкенила, циклоалкила, фенилалкила, замещенного одной или несколькими карбоксигруппами CO2Н и гетероатомом, выбранным из кислорода или серы;
- остаток формулы -СН2-СН2Х-(CH2-CH2O)nR, где R имеет значения, указанные выше; n равно целому числу от 0 до 5, тогда как Х представляет кислород или серу;
- остаток формулы (R)- или (S)-СН(СН3)-СН2-O-СН2-СН2-ОН;
- остаток формулы OR, где R имеет значения, указанные выше;
- остаток формулы (III)
где Ф представляет 2-(1-метилпирролидил), 2-пиридил, 4-пиридил, 1-имидазолил, 4-имидазолил, 1-метил-4-имидазолил, 1-метил-5-имидазолил или группу NRaRb, где каждый из Ra и Rb, которые могут быть одинаковыми или разными, представляет С1-С6-алкил или гидроксиалкил -(СН2)m-ОН, где m равно целому числу 2 или 3, или же Ra и Rb вместе с атомом N, с которым они связаны, образуют гетероцикл из 3-7 членов формулы (IV)
где
- Y представляет прямую связь, СН2, О, S или N-Rc, причем Rc представляет Н, С1-С6-алкил, гидроксиалкил (СН2)m-ОН, остаток -(СН2)m-Ar', где Ar' представляет арил, гетероарил, циклоалифатический и/или гетероциклоалифатический остаток, m' равно нулю или целому числу от 1 до 3, р и q, каждый независимо, представляет целое число от 1 до 3;
- гетероарил, выбранный из группы, состоящей из 2-пиридила или 4-пиридила, 2-пиримидинила или 4-пиримидинила; 2-пиразинила, 5-метил-2-пиразинила; 3-1,2,4-тиазинила; 3-1,2,4-тиазолила, 3-1-бензил-1,2,4-тиазолила; 2-1,3-тиазолидинила, 2-1,3-тиазолила, 1,3-оксазолила, 3-изоксазолила, 4-дигидро-З-оксоизоксазолила, 5-метилизоксазол-4-ила, 2-имидазолила, 4-имидазолил-5-карбоксамида и 2-имидазолил-4,5-дикарбонитрила, 5-инданила, 5-индазолила, 7-азаиндол-3-ила, 2-, 3-, или 4-хинолинила;
для применения в качестве агентов, ингибирующих хемотаксис нейтрофилов, индуцированный интерлейкином-8.
Настоящее изобретение далее относится к новым (R)-энантиомерам 2-арилпропионамидов формулы (Ia)
и их фармацевтически приемлемым солям,
где Aryl представляет фенильную группу, замещенную группой, выбранной из изопропила, ацетила, (2'',6''-дихлорфенил)амино, α-гидроксиизопропила, (R,S)-α-гидроксиэтила и его индивидуальных R- и S-изомеров, (R,S)-α-гидроксибензила и его индивидуальных R- и S-изомеров и (R,S)-(α-метилбензила) и его индивидуальных R- и S-изомеров; (R,S)-α-гидрокси-α-метилбензила и его индивидуальных R- и S-изомеров;
R представляет Н, C1-C4-алкил, аллил, пропаргил, CH2-CO2H или (СН2)2-CO2Н;
R' представляет:
- аминокислотный остаток, состоящий из неразветвленного или разветвленного С1-С6-алкила, алкенила, циклоалкила, фенилалкила, замещенного одной или несколькими карбоксигруппами CO2H;
- аминокислотный остаток, состоящий из неразветвленного или разветвленного C1-С6-алкила, алкенила, циклоалкила, фенилалкила, замещенного одной или несколькими карбоксигруппами CO2H и гетероатомом, выбранным из кислорода или серы;
- остаток формулы -СН2-СН2Х-(CH2-CH2O)nR, где R имеет значения, указанные выше; n равно целому числу от 0 до 5, тогда как Х представляет кислород или серу;
- остаток формулы (R)- или (S)-CH(СН3)-CH2-O-CH2-CH2-OH;
- остаток формулы OR, где R имеет значения, указанные выше;
- остаток формулы (III)
где Ф представляет 2-(1-метилпирролидил), 2-пиридил, 4-пиридил, 1-имидазолил, 4-имидазолил, 1-метил-4-имидазолил, 1-метил-5-имидазолил или группу NRaRb, где каждый из Ra и Rb, которые могут быть одинаковыми или разными, представляет С1-С5-алкил или гидроксиалкил -(CH2)m-OH, где m равно целому числу 2 или 3, или же Ra и Rb вместе с атомом N, с которым они связаны, образуют гетероцикл из 3-7 членов формулы (IV)
где
- Y представляет прямую связь, СН2, О, S или N-Rc, причем Rc представляет Н, С1-С5-алкил, гидроксиалкил (CH2)m-OH, остаток -(СН2)m-Ar', где Ar' представляет арил, ароматический гетероарил, циклоалифатический и/или гетероциклоалифатический остаток, m' равно нулю или целому числу от 1 до 3, каждый р и q, независимо друг от друга, представляет целое число от 1 до 3;
- гетероарил выбран из группы, состоящей из 2-пиридила или 4-пиридила, 2-пиримидинила или 4-пиримидинила; 2-пиразинила, 5-метил-2-пиразинила; 3-1,2,4-тиазинила, 3-1,2,4-тиазолила, 3-1-бензил-1,2,4-тиазолила; 2-1,3-тиазолидинила, 2-1,3-тиазолила, 1,3-оксазолила, 3-изоксазолила, 4-дигидро-3-оксоизоксазолила, 5-метилизоксазол-4-ила, 2-имидазолила, 4-имидазолил-5-карбоксамида и 2-имидазолил-4,5-дикарбонитрила, 5-инданила, 5-индазолила, 7-азаиндол-3-ила, 2-, 3-, или 4-хинолинила.
Примерами арильного остатка Ar' являются фенил, дифенилметил, 4,4'-дифтордифенилметил; примерами гетероарильных ароматических остатков являются пиридил, имидазолил; примерами циклоалифатических или гетероциклоалифатических остатков являются циклогексил, циклопентил, 4-морфолил и 1-пиперидил.
Изобретение далее относится к соединениям, указанным здесь выше, для применения в качестве лекарственных средств.
Термин «арильная группа» предпочтительно означает фенил, необязательно замещенный от одного до трех заместителями, которые являются одинаковыми или разными и выбраны из атомов галогена, С1-С4-алкила, С1-С4-алкокси, гидрокси, С1-С7-ацилокси, циано, нитро, амино, С1-С3-ациламино, галоген-С1-С3-алкила, гидрокси-С1-С3-алкила, галоген-С1-С3-алкокси, гидрокси-С1-С3-арилалкила, бензоила или известных остатков известных противовоспалительных 2-арилпропионовых кислот, таких как ибупрофен, кетопрофен, супрофен, пирпрофен, фенопрофен. Арильная группа более предпочтительно выбрана из группы, состоящей из фенила, 4-метилфенила, 3-изопропилфенила, 4-метоксифенила, 4-ацетоксифенила, 4-бензоилоксифенила, 4-гидроксифенила, 4-изобутилфенила, 4-(2,2-диметил)винилфенила, (СН3)2С=СН-С6Н4-, 4-(2-метил)аллилфенила, 3-бензоилфенила, 3-феноксифенила, 3-бензилфенила, 3-С6Н5-СН(ОН)-фенила, 5-бензоилтиен-2-ила, 4-тиеноилфенила, 1-оксо-2-изоиндолинилфенила, 2-фтор-4-бифенилила, 6-метоксинафтила, 5-бензоил-2-ацетоксифенила, 5-бензоил-2-гидроксифенила, 3-α-метилбензилфенила, 3-гидроксипропилфенила, 3-гидроксиэтилфенила.
Аминокислотный остаток R', имеющий указанные выше значения, предпочтительно представляет остаток L-α-аминокислоты и более предпочтительно выбран из группы, состоящей из аланина, валина, лейцина, изолейцина, норлейцина, фенилаланина, тирозина, гистидина, S-метилцистеина, S-карбоксиметилцистеина, S-2-гидроксиэтилцистеина, метионина, O-метилсерина, O-2-гидроксиэтилсерина, пролина, гидроксипролина, глутаминовой кислоты, аспарагиновой кислоты, глутамина или остатка глицина, фенилглицина, β-аланина, γ-аминомасляной кислоты, δ-аминовалериановой кислоты, цис-4-аминоциклогексанкарбоновой кислоты, транс-4-аминометилциклогексанкарбоновой кислоты, 3-амино-1,5-пентандиовой кислоты или остатка формулы (II)
где заместитель А представляет Н, неразветвленный или разветвленный С1-С6-алкил, (CH2)ni-CO2H, где ni равно целому числу между 1 и 3, бензил, п-гидроксибензил, -CH2-O-C2H5, СН2-S-СН3, CH2-S-CH2-CO2H, причем остатки кислот, указанных выше, находятся в форме свободных кислот или солей, как указывается ниже, или в форме их метиловых, этиловых и аллиловых сложных эфиров.
Другой целью настоящего изобретения являются также соли соединений формулы (I) с фармацевтически приемлемыми основаниями или кислотами.
В соединениях формулы (I) R более предпочтительно представляет водород и R' представляет остаток аминокислоты, такой как глицин, цис-4-циклогексанкарбоновая кислота, аминомалоновая кислота, аминометилмалоновая кислота, бензиламиномалоновая кислота, или остаток монокарбоновой или дикарбоновой L-α-аминокислоты или, кроме того, остаток дипептида, выбранного из группы, состоящей из L-аланилглицина, глицил-L-аланина и глицил-D-аланина.
Более предпочтительными являются соединения формулы (I), в которых R представляет водород и R' представляет остаток L-аланина, L-карбоксиметилцистеина, L-фенилаланина, L-лейцина, L-метионина, L-O-метилсерина, L-аланилглицина.
Особенно предпочтительными амидами формулами (I) являются амиды, где R представляет водород и R' является указанной здесь выше группой -CH2-CH2-O-(-CH2-CH2-O)n-R, n равно целому числу от 0 до 2, более предпочтительно целому числу 1.
Предпочтительными амидами формулы (I) являются также амиды, где R представляет водород и R' представляет заместитель формулы (III)
где Ф представляет основный остаток -NRaRb, такой как N,N-диметиламин, N,N-диэтиламин, N,N-диизопропиламин, 4-морфолил, 1-пиперидил, 1-пирролидил, 1-пиперазинил, 1-(4-бензил)пиперазинил, 1-(4-дифенилметил)пиперазинил, 1-(4-[4',4''-дифтордифенил)метил)пиперазинил, 1-(4-этил)пиперазинил, 1-(4-гидроксиэтил)пиперазинил.
Особенно предпочтительными монозамещенными амидами формулы (I) являются амиды, в которых гетероарил R' представляет 2- или 4-пиридил, 2- и 4-пиримидинил, 2-пиразинил, 2-1,3-тиазолил, 1-1,3-тиазолидинил или 2-имидазолидил и более предпочтительно 4-пиридил.
Конкретными примерами соединений изобретения являются:
(R)-(-)-2-(4'-изобутилфенил)-N-метилпропионамид;
(R)-(-)-2-[(4'-изобутил)фенил]-N-карбоксиметилпропионамид;
(R)-(-)-2-[(4'-изобутил)фенил]-N-метоксикарбонилметилпропионамид;
цис-(R)-2-[(4'-изобутил)фенил]-N-(4'-карбоксициклогексил)пропионамид;
транс-(R)-2-[(4'-изобутил)фенил]-N-(4'-карбоксиметилциклогексил)пропионамид;
(R,S')-2-[(4'-изобутил)фенил]-N-(2-метоксикарбонилэтил)пропионамид;
(R,S')-2-[(4'-изобутил)фенил]-N-(2-карбоксиэтил)пропионамид;
(R,S')-2-[(4'-метокси)фенил]-N-(2-карбоксиэтил)пропионамид;
(R)-N-[2'-(4''-изобутилфенил)пропаноил]-2-аминоакриловая кислота и ее метиловый эфир;
(R)-(-)-2-[(4'-изобутил)фенил]-N-(2''-гидроксиэтоксиэтил)пропионамид;
(R,S')-2-[(4''-изобутил)фенил]-N-[1'-метил-2'-(2''-гидроксиэтокси)этил]пропионамид;
(R,R')-2-[(4''-изобутил)фенил]-N-[1'-метил-2'-(2''-гидроксиэтокси)этил]пропионамид;
(R)-(-)-2-(4'-изобутилфенил)-N-(2''-пиридил)пропионамид и его гидрохлорид;
(R)-(-)-2-(4'-изобутилфенил)-N-(4''-пиридил)пропионамид и его гидрохлорид;
(R)-(-)-2-[(3'-бензоил)фенил]-N-(2''-пиридил)пропионамид и его гидрохлорид;
(R)-(-)-2-[(2'-гидрокси-5'-бензоил)фенил]-N-(2''-пиридил)пропионамид и его гидрохлорид;
(R)-(-)-2-[(2'-гидрокси-5'-бензоил)фенил]-N-(4''-пиридил)пропионамид и его гидрохлорид;
(R)-(-)-2-[(2'-гидрокси-5'-бензоил)фенил]-N-карбоксиметилпропионамид;
(R)-(-)-2-(4'-изобутилфенил)-N-(2''-пиразинил)пропионамид и его гидрохлорид;
(R)-(-)-2-(4'-изобутилфенил)-N-(2''-пиримидинил)пропионамид и его гидрохлорид;
(R)-(-)-2-(4'-изобутилфенил)-N-(4''-пиримидинил)пропионамид и его гидрохлорид;
(R)-(-)-2-[(3'-изопропил)фенил]-N-карбоксиметилпропионамид;
(R,S')-(-)-2-[(3'-α-метилбензил)фенил]-N-карбоксиметилпропионамид;
(R,R')-(-)-2-[(3'-α-метилбензил)фенил]-N-карбоксиметилпропионамид.
Для получения амидов изобретения формулы (I) используют известные способы, которые состоят во взаимодействии подходящей активированной формы R-2-арилпропионовой кислоты формулы (V) с амином формулы (VI) в нерацемизирующих условиях реакции в присутствии, если требуется, молярного избытка основания:
где AT в соединениях формулы (V) представляет остаток, активирующий карбоксигруппу.
Примерами активированных форм 2-арилпропионовых кислот формулы (V) с AT=Н являются соответствующие хлорангидриды (AT=Cl), имидазолиды (AT=1-имидазол), эфиры с фонолами, такими как п-нитрофенол (AT=п-NO2-C6H4O), или активированные формы, полученные взаимодействием в присутствии 1-гидроксибензотриазола (НОВТ) или карбодиимида, такого как дициклогексилкарбодиимид.
Аминами формулы (VI) являются первичные или вторичные амины, где R имеет значения, указанные выше, и R'a представляет:
- остаток эфира L-α-аминокислоты, выбранной из группы, состоящей из аланина, валина, лейцина, изолейцина, норлейцина, фенилаланина, тирозина, гистидина, S-метилцистеина, S-карбоксиметилцистеина, S-2-гидроксиэтилцистеина, метионина, O-метилсерина, O-2-гидроксиэтилсерина, пролина, гидроксипролина;
- остаток эфира глицина, фенилглицина, β-аланина, γ-аминомасляной кислоты, δ-аминовалериановой кислоты, цис-4-аминоциклогексанкарбоновой кислоты, транс-4-аминоциклогексанкарбоновой кислоты, 3-амино-1,5-пентандиовой кислоты;
- остаток малоновой кислоты формулы (II')
где
- заместитель А' представляет Н, неразветвленный или разветвленный С1-С5-алкил, -(CH2)niCO2-метиловый и/или -этиловый эфир, где ni представляет целое число между 1 и 3, бензил, п-гидроксибенэил, -CH2-O-C2H5, -CH2-S-СН3- и -СН2-S-СН2-СО2-метиловый эфир и/или этиловый эфир;
- остаток формулы -CH2-CH2X-(СН2-СН2О)nR, где R имеет значения, указанные ранее, или остаток формулы (R)- или (S)-СН(СН3)-СН2-O-СН2-СН2-ОН;
- остаток формулы (III)
где Ф имеет значения, указанные ранее;
- гетероарил, который имеет значения, указанные ранее.
Образование амидов формулы (I) взаимодействием активированной формы кислоты формулы (V) со вторичным или первичным амином формулы (VI) обычно проводят при комнатной температуре с использованием общепринятых протонных или апротонных растворителей, предпочтительно обезвоженных на молекулярных ситах, или их смесей. Указанные растворители включают сложные эфиры, такие как этилацетат, метилацетат и этилформиат, нитрилы, такие как ацетонитрил, неразветвленные или циклические простые эфиры, такие как диоксан, тетрагидрофуран, этиловый эфир и сульфолан, амиды, такие как диметилформамид и формамид, галогенированные растворители, такие как дихлорметан, ароматические углеводороды, такие как толуол и хлорбензол, или гетероароматические углеводороды, такие как пиридин и пиколин.
Реакции можно проводить в присутствии основания; предпочтительными неорганическими основаниями являются карбонаты и бикарбонаты щелочных и щелочноземельных металлов, такие как тонкоизмельченные карбонат калия, бикарбонат калия и карбонат магния или карбонат кальция.
Полученный таким образом продукт формулы (Ia):
где Aryl, R и R'а имеют значения, описанные ранее, как любое соединение формулы (I), если требуется, можно превратить в другой продукт формулы (I) посредством удаления любых защитных групп, которые могут присутствовать в соединениях формулы (Ia), и/или селективным гидролизом групп сложных эфиров. Особенно предпочтительной сложноэфирной группой, наряду с обычными метильными и этильными группами, является аллильная группа, которую можно удалить в очень селективных и в нерацемизирующих условиях, например, превращением аллильной группы в морфолин, который в присутствии Pd(0), как катализатора, действует в качестве переносчика водорода и в качестве нуклеофильного акцептора, по процедуре, описанной в J. Org. Chem., 54, 751 (1989). При желании соединение формулы (Ia), где R'а представляет остаток α-аминокислоты, β-замещенной свободными или превращенными в простые эфиры тиольными группами, или гидрокси, свободной или этерифицированной алифатической кислотой или сульфоновой (метансульфоновой, бензолсульфоновой, п-толуолсульфоновой) кислотой, можно подвергнуть β-элиминированию указанных заместителей, так чтобы получить, обработкой избытком BBr3, соединения формулы (I), где R' представляет 2,3-дегидроаминокислоту.
Наконец, как указано выше, соединение формулы (Ia) можно превратить в родственный продукт формулы (I) посредством способов образования солей первичных, вторичных или третичных основных групп, присутствующих в соединениях формулы (Ia), с исполазованием для данной цели фармацевтически приемлемых кислот или образованием соли любых карбоксильных или сульфоновых остатков, которые могут присутствовать в соединениях формулы (Ia), с фармацевтически приемлемыми основаниями.
Примерами фармацевтически приемлемых кислот являются одноосновные и многоосновные минеральные кислоты, такие как хлористоводородная кислота, серная кислота, азотная кислота, фосфорная кислота; или одноосновные или многоосновные органические кислоты, такие как уксусная кислота, бензойная кислота, винная кислота, лимонная кислота, фумаровая кислота, малеиновая кислота, миндальная кислота, щавелевая кислота и малоновая кислота.
Примерами фармацевтически приемлемых солей являются соли с катионами щелочных или щелочноземельных металлов и, что предпочтительно, натрия и магния, и с органическими основаниями, такими как трометамин, D-глюкозамин, лизин, аргинин, тетраэтиламмоний.
R-Энантиомеры 2-арилпропионовых кислот формулы (Va)
являются известными соединениями, характеризующимися относительно их S-энантиомеров тем, что они иногда являются неэффективными в качестве ингибиторов ферментов циклооксигеназ или их получают по способам, описанным подробно в приведенных ниже примерах. Предпочтительными R-2-арилпропионовыми кислотами формулы (V) являются замещенные R-2-фенилпропионовые кислоты, где замещающей группой на фенильном кольце является 2-(1-оксо-2-изоиндолинил)-, 3-фенокси-, 3-бензоил-, 4-тиеноил-, 4-изобутил, 4-гидрокси-, 4-метокси-, 5-бензоил-2-гидрокси- или где арильной группой является R-2-(5-бензоилокситиен-2-ил)-, 2-(2-фтор-4-бифенил)- и R-2-(6-метоксинафтил).
Особенно предпочтительными R-2-арилпропионовыми кислотами формулы (V) являются кислоты, в которых арильный остаток является одним из R-энантиомеров ибупрофена, кетопрофена, сурпрофена, тиапрофена, напроксена и флурбипрофена. Указанные R-2-арилпропионовые кислоты являются известными соединениями, их можно получить в виде энантиомеров посредством способов оптического разделения соответствующих рацемических 2-арилпропионовых кислот (или (R,S)-2-арилпропионовых кислот). Способы общего и стереоспецифического синтеза индивидуальных 2-арилпропионовых кислот широко описаны. Кроме того, описано превращение (R,S)-2-арилпропионовых кислот в один из энантиомеров через промежуточные 2-арил-2-пропилкетены.
Энантиоселективный синтез 2-арилпропионовых кислот в основном относится к их S-энантиомерам, но может быть модифицирован для получения R-энантиомеров посредством подходящего выбора хирального вспомогательного средства. Для использования арилалкилкетонов в качестве субстратов для синтеза α-арилалкановых кислот, см., например, В.М.Trost and J.H.Rigby, J. Org. Chem., 14, 2936, 1978; для α-арилирования кислот Meldrum см. J.T.Piney and В.A.Rowe, Tetrah. Lett., 21, 965, 1980; для использования винной кислоты в качестве хирального вспомогательного средства см. G.Castaldi et al., J. Org. Chem., 52, 3018, 1987; для использования сложных альфа-гидроксиэфиров в качестве хиральных реагентов см. R.D.Larsen et al., J. Am. Chem. Soc., 111, 7650, 1989 и патент США 4940813 и цитированные в нем ссылки.
Специфический способ получения 2-арилпропионовых кислот, где арилом является 5-бензоил-2-ОН-фенил и его сложные эфиры, описаны в патенте Италии №1283649.
Эффективный способ получения R-энантиомера указанной кислоты состоит в превращении хлорангидрида (R,S)-2-(5-бензоил-2-ацетокси)пропионовой кислоты в 2-(5-бензоил-2-ацетокси)проп-1-кетен обработкой третичным амином, таким как диметилэтиламин, который, в свою очередь, при взаимодействии с R-(-)-пантолактоном дает R-(-)-дигидро-3-гидрокси-4,4-диметил-2(3Н)-фуранон-2-ацетокси-5-бензоилфенилпропионат в виде единственного диастереоизомера (Myers et al., J. Am. Chem. Soc. 119, 6496, 1997 and Larsen R.D. et al., J. Am. Chem. Soc., 111, 7650, 1989). Последующее омыление с применением LiOH дает R-(2-(5-бензоил-2-гидроксифенил)пропионовую кислоту эффективным путем, что позволяет избежать утомительных процедур оптического разделения, например, фракционной кристаллизацией солей правовращающего и/или левовращающего дропропизина.
В общей процедуре получения (R)-2-арилпропионовых кислот формулы (Vb) моно- или полизамещенные гидроксиарилкетоны (Vc) подвергают взаимодействию с перфторбутансульфонилфторидом с получением перфторбутансульфонатного эфира (Vd), где n равно целому числу от 1 до 9.
Соединения (Vd) претерпевают перегруппировку Вильгеродта с образованием, после этерификации и альфа-метилирования, производных арилпропионовых кислот (Ve), где n равно целому числу от 1 до 9 и R3 представляет С1-С4-алкил или C2-C4-алкенил.
Соединения формулы Ve подвергают взаимодействию с подходящим реагентом трибутилолово-R4, где R4 представляет неразветвленный или разветвленный С1-С6-алкил, С2-С6-алкенил или алкинил, незамещенный или замещенный арильной группой, получая при этом соответствующий (R,S)-2-арилпропионат формулы (Vf).
Алкенильные или алкинильные группы м