Пираноиндазолы, фармацевтическая композиция на их основе и их использование при лечении глаукомы
Иллюстрации
Показать всеИзобретение относится к новым пираноиндазолам формулы I:
где R1 и R2 независимо выбирают из водорода или алкильной группы; R3 и R4 представляют собой независимо водород или алкильную группу; R5, R6 и R7 обозначают водород, R8 и R9 обозначают водород, гидроксил, алкокси, NR10R11, OC(=O)NR1R2, ОС(=O)С1-4алкил или алкилтиол; R10 и R11 обозначают водород, А обозначает (СН2)n, С=O; В обозначает одинарную или двойную связь; n=0-2; Y обозначают N, Х обозначает С; и пунктирная линия обозначает соответствующую одинарную или двойную связь. Изобретение также относится к фармацевтической композиции на основе соединений формулы I, способу регулирования нормального или повышенного внутриглазного давления, способу лечения глаукомы и способу блокирования или связывания серотониновых рецепторов. Технический результат - получения новых пираноиндазолов, обладающих ценным фармацевтическим действием. 5 н. и 9 з.п. ф-лы, 3 табл.
Реферат
Настоящая заявка истребует приоритет на основании предварительной заявки на патент США № 60/295 429, поданной 1 июня 2001 года и включенной в него полностью в качестве ссылки.
Предпосылки создания изобретения
Настоящее изобретение относится к различным пираноиндазолам. Указанные новые соединения полезны для снижения и контроля (регуляции) нормального или повышенного внутриглазного давления (ВГД) и для лечения глаукомы.
Болезненное состояние, относящееся к глаукоме, характеризуется наличием постоянной потери зрительной функции из-за необратимого изменения зрительного нерва. Несколько морфологически или функционально различных типов глаукомы обычно характеризуются повышенным ВГД, которое рассматривается как причина, связанная с патологическим развитием заболевания. Глазная гипертензия представляет собой состояние, при котором внутриглазное давление повышается, но без очевидной потери зрительной функции, и такие пациенты рассматриваются как имеющие высокий риск потенциального развития потери зрения, связанного с глаукомой. Если глаукому или внутриглазную гипертензию выявить на ранней стадии и подвергнуть соответствующему лечению лекарственными препаратами, которые способны эффективно снижать повышенное внутриглазное давление, то потеря зрительной функции или ее прогрессивное ухудшение могут быть в основном ослаблены. Лекарственная терапия, которая считается эффективной для снижения внутриглазного давления, включает средства, которые снижают образование глазной жидкости, а также средства, которые повышают отток (способность к выведению жидкости). Указанная терапия осуществляется в основном посредством введения лекарственных средств одним из двух возможных способов, а именно путем местного введения (непосредственное введение в глаз) или путем перорального приема.
Однако имеются некоторые индивидуумы, которые не способны соответствующим образом реагировать на лечение, проводимое в рамках имеющихся способов терапии глаукомы. В этой связи имеется потребность в разработке других местных терапевтических средств, которые могли бы контролировать ВГД.
Имеются сообщения о том, что серотонинергические агонисты 5-HT1A оказывают на моделях животных нейропротекторное действие, и многие из указанных средств были испытаны, в числе других показаний для их применения, для лечения острого нарушения мозгового кровообращения. Указанный класс соединений отмечался в качестве средств для лечения глаукомы (снижения и контроля ВГД), в частности в WO 98/18458 (DeSantis, et al.) и EP 0771563 A2 (Mano, et al.), в работе Осборна с соавт. (Osborne, et al., Ophthalmologica, Vol.210:308-314, 1996), в которых раскрывается, что 8-гидроксидипропиламинотетралин (8-OH-ДПАТ) (агонист 5-HT1A) снижает ВГД у кроликов. Ванг с соавт. (Wang, et al., Current Eye Research, Vol. 16(8):769-775, август 1997 и IVOS, Vol. 39(4), S488, март 1998) указывают, что 5-метилурапидил, α1А антагонист и 5-HT1A агонист снижают ВГД у обезьян, но благодаря их активности в отношении α1А рецептора. Указывается также, что антагонисты 5-HT1A полезны для лечения глаукомы (повышенного ВГД) (например, WO 92/0338, McLees)). Кроме того, Десаи с соавт. (DeSai et al., WO 97/35579) и Макор с соавт. (Macor et al., US 5 578 612) рассматривают использование 5-HT1 и 5-HT1-подобных агонистов для лечения глаукомы (повышенного ВГД). Указанные соединения с противомигреневой активностью, например суматриптан и наратриптан, как и родственные им соединения, являются агонистами 5-HT1B,D,E,F.
Было показано, что серотонинергические соединения, которые обладают агонистической активностью в отношении 5-HT2 рецепторов, эффективно снижают и контролируют нормальное и повышенное ВГД и полезны при лечении глаукомы, смотри одновременно рассматриваемую заявку PCT/US99/19888, включенную в настоящее описание полностью в качестве ссылки. Соединения, которые действуют как агонисты 5-HT2 рецептора, хорошо известны и продемонстрировали множество полезных свойств, прежде всего в случае заболеваний или состояний, связанных с центральной нервной системой (ЦНС). Патент США № 5 494 928 относится к некоторым производным 2-(индол-1-ил)этиламина, которые являются агонистами 5-HT2С, для лечения неврозов навязчивых состояний и других расстройств личности центрального генеза. Патент США № 5571833 относится к производным триптамина, которые являются агонистами 5-HT2, для лечения портальной гипертензии и мигрени. Патент США № 5874477 относится к способу лечения малярии с использованием агонистов 5-HT2A/2С. Патент США № 5902815 относится к использованию агонистов 5-HT2A для предупреждения неблагоприятных (побочных) эффектов, связанных с гипофункцией NMDA рецептора. WO 98/31354 относится к агонистам 5-HT2B, применяемым для лечения депрессий и других состояний ЦНС. WO 00/12475 относится к производным индолина, WO 00/12510 и WO 00/44753 относятся к некоторым производным индола, являющимся агонистами 5-HT2В и5-HT2С рецептора, применяемым для лечения различных расстройств центральной нервной системы, в особенности для лечения ожирения. WO 00/35922 относится к некоторым производным пиразино[1,2-а]хиноксалина, являющимся агонистами 5-HT2С, которые применяются для лечения неврозов навязчивых состояний, депрессии, расстройств аппетита и других расстройств, в которых задействована ЦНС. WO 00/77002 и WO 00/77010 относятся к некоторым замещенным тетрациклическим пиридо[4,3-b]индолам, являющимся агонистами 5-HT2С, с точки зрения их применения для лечения расстройств ЦНС, включающих, в числе других, ожирение, тревожность, депрессию, расстройства сна, головную боль и социальные фобии. Указывается, что реакция агониста на 5-HT2A рецептор является основной активностью, ответственной за галлюциногенное действие, при этом участию 5-HT2С рецептора отводится меньшая роль [Psychopharmacology, Vol. 121:357, 1995].
Описаны несколько конденсированных индазолов, содержащих фуран или пиран. Химический синтез 7-метил- и 1,7-диметил-1Н-фуро[2,3-g]индазола [Gazz. Chim. Ital. 106, 1083 (1976)], а также 3-метил- и 1-(4-аминофенил)-3-метил-1Н-бензо[b]фуро[2,3-g]индазола [An. Asoc. Quim. Argent. 59, 69 (1971)] описаны без обсуждения возможностей их применения. Заявка на европейский патент EP 990650 (Номер международной публикации WO 98/56768) относится к замещенным 2-(фуро[2,3-g]индазол-1-ил)этиламинам, таким как (S)-2-(фуро[2,3-g]индазол-1-ил)-1-метилэтиламин, которые, по данным авторов, обладают высокой селективностью и афинностью в отношении 5-HT2С рецепторов и являются потенциально полезными для лечения различных расстройств центральной нервной системы. Химический синтез 9-метил-1Н-пирано[2,3-g]индазол-7-она и соответствующего неметилированного соединения описан в литературе [Indian J. Chem. 26B, (1987)] без указаний возможностей его применения.
Патенты США №№ 5561150 и 5646173 относятся к некоторым производным соединениям трициклического пиразола, которые идентифицированы как агонисты 5-HT2С, пригодные для лечения заболеваний ЦНС и преимущественно направлены на их липофильные аналоги, обладающие высокой вероятностью поступления в мозг. Аналогично, WO 98/56768 относится к трициклическим агонистам 5-HT2С для лечения заболеваний ЦНС. Все указанные выше, равно как и приведенные далее патенты и публикации включены в настоящее описание в полном объеме в качестве ссылок.
5-Гидрокситриптамин (серотонин) не проходит через гематоэнцефалический барьер и не поступает в мозг. Однако для повышения уровня серотонина в мозге можно вводить 5-гидрокситриптофан. Транспорт 5-гидрокситриптофана в мозг легко осуществляется и уже в мозге 5-гидрокситриптофан легко декарбоксилируется с образованием серотонина.
Соответственно, имеется потребность в разработке новых соединений, которые были бы свободны от указанных выше недостатков и которые бы обеспечивали повышенную химическую стабильность и желательную длительность терапевтической активности в случае, например, применения их для снижения внутриглазного давления и лечения глаукомы.
Краткое описание сущности изобретения
Объектом настоящего изобретения является разработка новых соединений, которые являются агонистами 5-НТ2.
Другим объектом настоящего изобретения является разработка соединений, которые обладают повышенной химической стабильностью и которые полезны с точки зрения снижения или контроля (регуляции) нормального или повышенного внутриглазного давления и/или лечения глаукомы.
Другим объектом настоящего изобретения является разработка соединений, которые обеспечивают желательный уровень терапевтической активности по снижению или контролю нормального или повышенного внутриглазного давления и/или лечению глаукомы.
Дополнительные объекты и преимущества настоящего изобретения будут указаны частично в приведенном ниже описании и частично они будут очевидны из приведенного описания или же они могут быть выявлены на практике в ходе осуществления настоящего изобретения. Цели и другие преимущества настоящего изобретения можно оценить и достигнуть с помощью элементов и их сочетаний, конкретно указанных в описании и в прилагаемой формуле изобретения.
Для достижения указанных и других преимуществ и в соответствии с целями настоящего изобретения, которые составляют его суть и широко представлены в настоящем описании, данное изобретение относится к соединению, имеющему формулу I:
или его фармацевтически приемлемые соли или сольваты или пролекарственные формы соединений формулы I. В указанной формуле
R1 и R2 независимо выбирают из водорода или алкильной группы, такой как С1-4алкил;
R3 и R4 независимо выбирают из водорода или алкильной группы, такой как С1-4алкил, или R3 и R4 и атом углерода, к которому они присоединяются, могут образовывать циклоалкильное кольцо или далее,
R2 и R3 вместе могут представлять собой (CH2)m с образованием насыщенного гетероцикла;
R5 выбирают из водорода, галогена, алкильной группы, такой как С1-6алкил или С1-4алкил, замещенный галогеном;
R6 и R7 независимо выбирают из водорода, галогена, циано, алкилтио, такого как С1-4алкилтио, алкила, такого как С1-4алкил, или замещенного алкила, такого как С1-4алкил, замещенный галогеном;
R8 и R9 независимо выбирают из водорода, гидроксила, алкила, такого как С1-6алкил, алкокси, такого как С1-6алкокси, =O, NR10R11, OC(=O)NR1R2, OC(=O)С1-4алкила, алкилтиола, такого как С1-6алкилтиол, замещенного алкила, такого как С1-6алкил, замещенный галогеном, гидроксилом или NR10R11;
R10 и R11 независимо выбирают из водорода, алкильной группы, такой как С1-4алкил, C(=O)С1-4алкил, C(=O)OC1-4алкил, C(=O)NR1R2, или замещенного алкила, такого как С1-6алкил, замещенный галогеном, гидроксилом, NR1R2 или R10 и R11 вместе могут составлять насыщенное 5- или 6-членное гетероциклическое кольцо, которое может включать дополнительный гетероатом, выбранный из N, O или S, в случае 6-членного кольца;
А обозначает (CH)n, С=О или CHC1-4алкил;
B обозначает одинарную или двойную связь, в том случае, когда B обозначает двойную связь, R8 и R9 выбирают из водорода или насыщенной или ненасыщенной алкильной группы;
m=2-4;
n=0-2;
X и Y обозначают N или C, при этом X и Y отличаются друг от друга; и
пунктирная линия обозначает соответствующую одинарную или двойную связь.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим по меньшей мере одно соединение формулы I.
Настоящее изобретение также относится к способам снижения или контроля нормального или повышенного внутриглазного давления путем введения эффективного количества композиции, содержащей соединение, имеющее описанную выше формулу I.
Настоящее изобретение также относится к способу лечения глаукомы, который включает введение эффективного количества композиции, содержащей соединение, имеющее описанную выше формулу I.
Следует понимать, что приведенные далее как общее описание, так и подробное описание изобретения являются лишь иллюстративными и предназначены для пояснения рассматриваемого изобретения, суть которого выражена в прилагаемой формуле изобретения.
Подробное описание настоящего изобретения
Настоящее изобретение относится к множеству соединений, полезных при их использовании согласно настоящему изобретению. Указанные соединения в основном описываются формулой I
В указанной формуле
R1 и R2 независимо выбирают из водорода или алкильной группы, такой как С1-4алкил;
R3 и R4 независимо выбирают из водорода или алкильной группы, такой как С1-4алкил, или R3 и R4 и атом углерода, к которому они присоединяются, могут образовывать циклоалкильное кольцо (например, циклопропильное кольцо) или далее,
R2 и R3 вместе могут представлять собой (CH2)m с образованием насыщенного гетероцикла;
R5 выбирают из водорода, галогена, замещенной или незамещенной алкильной группы, такой как С1-6алкил или С1-4алкил, замещенный галогеном;
R6 и R7 независимо выбирают из водорода, галогена, циано, алкилтио, такого как С1-4алкилтио, алкила, такого как С1-4алкил, или замещенного алкила, такого как С1-4алкил, замещенный галогеном;
R8 и R9 независимо выбирают из водорода, гидроксила, алкила, такого как С1-6алкил, алкокси, такого как С1-6алкокси, =O, NR10R11, OC(=O)NR1R2, OC(=O)С1-4алкила, алкилтиола, такого как С1-6алкилтиол, замещенного алкила, такого как С1-6алкил, замещенный галогеном, гидроксилом или NR10R11;
R10 и R11 независимо выбирают из водорода, алкильной группы, такой как С1-4алкил, C(=O)С1-4алкил, C(=O)OC1-4алкил, C(=O)NR1R2, или замещенной алкильной группы, такой как С1-6алкил, замещенный галогеном, гидроксилом, NR1R2, или R10 и R11 вместе могут составлять насыщенное 5- или 6-членное гетероциклическое кольцо, которое может включать дополнительный гетероатом, выбранный из N, O или S, в случае 6-членного кольца;
А обозначает (CH2)n или CHC1-4алкил;
B обозначает одинарную или двойную связь, в том случае, когда B обозначает двойную связь, R8 и R9 выбирают из водорода, алкильной группы, такой как С1-4алкил, или замещенной алкильной группы, такой как С1-4алкил, замещенный галогеном, гидроксилом или NR10R11;
m=2-4;
n=0-2;
X и Y обозначают N или C, при этом X и Y отличаются друг от друга; и пунктирная линия обозначает соответствующую одинарную или двойную связь.
Фармацевтически приемлемые соли и сольваты и пролекарственные формы соединения формулы I также составляют часть настоящего изобретения.
Предпочтительными соединениями являются:
Такие, в которых R1 и R2 независимо выбирают из водорода или С1-4алкила;
R3 и R4 независимо выбирают из водорода, С1-4алкила или R2 и R3 вместе могут представлять собой (CH2)m с образованием насыщенного гетероцикла;
R5 выбирают из водорода, галогена или С1-6 алкила;
R6 и R7 независимо выбирают из водорода, галогена, циано, С1-4алкилтио, С1-4алкила или С1-4алкила, замещенного галогеном;
R8 и R9 независимо выбирают из водорода, гидроксила, С1-6алкила, С1-6алкокси, NR10R11 или С1-6 алкила, замещенного галогеном, гидроксилом или NR10R11;
R10 и R11 независимо выбирают из водорода, С1-4алкила, C(=O)С1-4алкила, C(=O)OC1-4алкила, C(=O)NR1R2 или R10 и R11 вместе могут составлять насыщенное 6-членное гетероциклическое кольцо, которое может включать дополнительный гетероатом, выбранный из N, O или S;
А обозначает (CH2)n или CHC1-4алкил;
B обозначает одинарную или двойную связь, в том случае, когда B обозначает двойную связь, R8 и R9 выбирают из водорода, С1-4алкила или С1-4алкила, замещенного галогеном, гидрокси или NR10R11;
m=3-4;
n=1-2;
X и Y обозначают N или C, при этом X и Y отличаются друг от друга; и
пунктирная линия обозначает соответствующую одинарную или двойную связь.
Наиболее предпочтительными соединениями являются:
Такие, в которых R1 и R2 независимо выбирают из водорода или С1-4алкила;
R3 обозначает С1-2алкил или R2 и R3 вместе могут представлять собой (CH2)3 с образованием пирролидина;
R4 обозначает водород;
R5 выбирают из водорода или С1-6алкила;
R6 и R7 независимо выбирают из водорода, галогена или С1-4алкила;
R8 и R9 независимо выбирают из водорода, гидроксила, С1-6алкокси, NR10R11 или С1-6алкила, замещенного гидроксилом или NR10R11;
R10 и R11 независимо выбирают из водорода, С1-4алкила, C(=O)С1-4алкила или R10 и R11 вместе могут составлять насыщенное 6-членное гетероциклическое кольцо, которое может включать дополнительный гетероатом, выбранный из N, O или S;
А обозначает (CH2)n;
B обозначает одинарную связь;
n=1;
X обозначает C и Y обозначает N; и
пунктирная линия обозначает соответствующую одинарную или двойную связь.
Репрезентативные примеры предпочтительных соединений формулы I включают:
1-(2-аминопропил)-1,7,8,9-тетрагидропирано[2,3-g]индазол-8-ол;
1-((S)-2-аминопропил)-1,7,8,9-тетрагидропирано[2,3-g]индазол-8-ол;
(R)-1-((S)-2-аминопропил)-1,7,8,9-тетрагидропирано[2,3-g]индазол-8-ол;
(S)-1-((S)-2-аминопропил)-1,7,8,9-тетрагидропирано[2,3-g]индазол-8-ол;
1-((S)-2-аминопропил)-3-метил-1,7,8,9-тетрагидропирано[2,3-g]индазол-8-ол;
1-(S)-1-пирролидин-2-илметил-1,7,8,9-тетрагидропирано[2,3-g]индазол-8-ол;
1-((S)-2-аминопропил)-5-фтор-1,7,8,9-тетрагидропирано[2,3-g]индазол-8-ол;
(R)-1-((S)-2-аминопропил)-1,7,8,9-тетрагидропирано[2,3-g]индазол-8-иламин;
[1-((S)-2-аминопропил)-1,7,8,9-тетрагидропирано[2,3-g]индазол-8-ил]диметиламин;
[1-((S)-2-аминопропил)-1,7,8,9-тетрагидропирано[2,3-g]индазол-8-ил]метанол;
1-((S)-2-аминопропил)-1,7,8,9-тетрагидропирано[2,3-g]индазол-8,9-диол;
1-((S)-2-аминопропил)-9-метокси-1,7,8,9-тетрагидропирано[2,3-g]индазол-8-ол;
1-(2-аминопропил)-3,7,8,9-тетрагидропирано[3,2-е]индазол-8-ол;
1-(пирролидин-2-илметил)-3,7,8,9-тетрагидропирано[3,2-е]индазол-8-ол;
1-((S)-2-аминопропил)-3,7,8,9-тетрагидропирано[3,2-е]индазол-8-ол;
1-((S)-2-аминопропил)-3-метил-3,7,8,9-тетрагидропирано[3,2-е]индазол-8-ол;
или их сочетания.
Некоторые соединения формулы I могут содержать один или более хиральных центров. Настоящее изобретение включает все энантиомеры, диастереомеры и их смеси.
В приведенных выше определениях общее число атомов углерода в замещающей группе указано префиксом Ci-j, где числа i и j обозначают количество атомов углерода. Указанное определение охватывает линейные цепи, разветвленные цепи и циклические или (циклоалкильные) алкильные группы. Заместитель может быть представлен в единственном или во множественном числе, когда он включается в указанную структурную единицу. Так, например, в случае галогена-заместителя, который представляет собой фтор, хлор, бром или йод, имеется в виду, что структура, к которой он присоединяется, может быть замещена одним или более атомами галогена, которые могут быть одинаковыми или различными.
Синтез
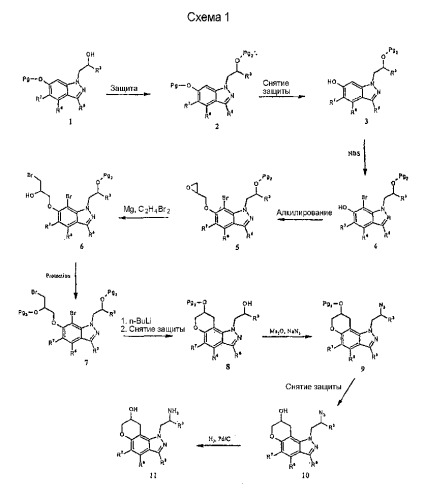
Соединения формулы I могут быть получены с использованием одной из нескольких синтетических методик. Так, например 1-(2-аминометил)-1,7,8,9-тетрагидропирано[2,3-g]индазол-8-олы могут быть получены из соответствующим образом защищенного 1-(6-гидроксииндазол-1-ил)пропан-2-ола 1, как показано на схеме 1. Pg обозначает соответствующую защитную группу, которая вводится для гарантии того, что конкретный атом не будет модифицирован в ходе рассматриваемой химической реакции.
Другие соединения формулы I могут быть получены из соединения 12 путем известных в технике трансформаций выбранной функциональной группы. Например, осуществляя вначале защиту первичной аминогруппы с последующей активацией гидроксильной группы в ходе образования сульфонатного эфира, например метансульфонила, и последующая реакция с желательным нуклеофилом, таким как алкиламины, диалкиламины, арил- или алкилтиолы и т.п., приведет к получению соединения 14 формулы I. Кроме того, прямое окисление 13 подходящим окислителем, например гипервалентным йодным реагентом, таким как О-йодоксибензойная кислота [J.Org. Chem.60, 7272 (1995)], дает кетон 16, который может быть функционализирован с получением других соединений формулы I, таких как 17, посредством восстановительного алкилирования, и 15 - посредством реакции присоединения Гриньяра.
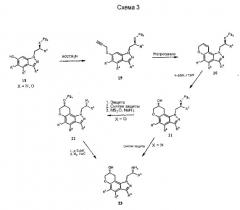
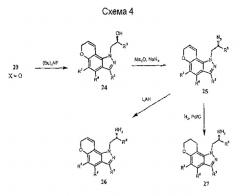
Альтернативно, соединения формулы I могут быть получены из соответствующим образом замещенных 5-пропаргилоксииндазолов (19) через исходные реакции перегруппировки Кляйзена [Tetrahedron Lett. 33, 2179 (1992), ibid. 35, 45 (1994) ibid. 41, 3541 (2000)] с образованием промежуточных замещенных пирано[2,3-g]индазолов 20 (схема 3). Другие процедуры синтеза с использованием 20, как показано, например, на схемах 3-5, с использованием хорошо известных трансформаций функциональных групп, дают другие желательные соединения формулы I.
1-(Гидроксиалкил)индазолы, представляющие интерес для получения соединений формулы I, могут быть синтезированы, как показано на схеме 6, и в совместно рассматриваемой заявке на патент США 60/295 427, включенной в настоящее описание полностью в качестве ссылки. Реакция активированного фторфенола 30 с соответствующим аминоспиртом 31, в том случае, когда А обозначает нитрил, приводит к восстановлению с образованием соответствующего альдегида 32. Нитрозирование дает соединение 33, которое после восстановительной циклизации приводит к получению 1-(гидроксиалкил)индазолов 34.
Промежуточные пираноиндазолы 34 могут быть получены путем алкилирования соответствующего О-защищенного 6-гидроксииндазола (35), в котором соответствующие О-защитные группы представляют собой, например, метил или бензил, с помощью способов, известных в уровне техники и проиллюстрированных на схеме 7 [патент США 5494928 (1997), WO 98/30548 (1998)], с использованием желательного эпоксида, например пропиленоксида. Альтернативно, для целей получения некоторых соединений может быть удобно провести реакцию алкилата 35 с использованием хлорацетона с последующим восстановлением, например, с помощью NaBH4, промежуточного кетона, получая интермедиат 34.
Может быть также удобно для получения некоторых соединений формулы I использовать соответствующим образом замещенный 1,7,8,9-тетрагидропирано[2,3-g]индазол, такой как 36, показанный на схеме 8. Так, например, алкилирование соединения 36 в условиях, описанных выше на схеме 4, с последующим соответствующим активированием гидроксильной группы до достижения нуклеофильного аминирования путем образования сульфонатного эфира [J.Chem. Soc., Perkins Vol. 1:1479, 1981], например метансульфонила, толуолсульфонила, бромфенилсульфонила или нитрофенилсульфонила, и последующая реакция с желательным амином приводят к получению соединения 38 формулы I.
Далее реакция индазолов 36 с активированным аланинолом 39 дает соединение 40, снятие защиты с которого дает соединение 38 формулы I, как показано на схеме 9. Замещение 39 на схеме 9, например, активированным сульфонатным эфиром или соответствующим галогенидом или N-защищенным (например, с помощью трет-бутилоксикарбонила, бензилоксикарбонила) пирролидин-3-метанолом приводит, после удаления аминозащитной группы, к получению другого соединения формулы I. Далее замещение 39 на схеме 9 активированным сульфонатным эфиром N-(2-гидрокси-1,1-диметил-этил)фталимида [J. Amer. Chem. Soc., Vol. 108:3811, 1986], 2-[(т-бутилоксикарбонил)амино]-2-метилпропанола [J. Amer. Chem. Soc., Vol. 113:8879, 1991], 1-[(т-бутилоксикарбонил)амино]циклопропил-1-метанола [J. Med. Chem., Vol. 31:1694, 1988] или 2-метил-2-нитро-пропан-1-ола [J. Amer. Chem. Soc., Vol. 68:12, 1946] приводит, после удаления N-защитных групп в первых трех случаях или после восстановления нитрогруппы, в последнем случае, к другим вариантам получения соединения 38 формулы I.
Некоторые желательные замещенные 1,7,8,9-тетрагидропирано[2,3-g]индазолы могут быть получены из соответствующим образом замещенного 1Н-индазол-6-ола (41), как описано в методике синтеза, приведенной на схеме 10. Алкилирование индазолов 41 аллилиодидом с последующей обработкой в условиях реакции перегруппировки Кляйзена дает соединение 43. Защита гидроксильной группы от других реакций путем превращения, например, в сложный эфир, такой как ацетильный, и аналогичное включение защитной группы по атому азота, например, путем реакции с соответствующим изоцианидом с образованием уреида, дает желательный аллилиндазол 45. Эпоксидирование олефина с использованием, например, 3-хлор-пербензойной кислоты и последующая циклизация в щелочных условиях приводят к получению пираноиндазольного интермедиата 47. Превращение гидроксильной группы пираноиндазола 47 в другие функциональные группы, соответствующие формуле I, может быть осуществлено с помощью известных в технике трансформаций функциональной группы.
Желательные пирано[3,2-e]индазол-3-этиламины 49 (схема 11) формулы I могут быть получены из соответствующим образом замещенного 3-(2-гидроксипропил)1Н-индазол-5-ола 48 с использованием способов, проиллюстрированных на схемах 1 и 3 и описанных в заявке на международный патент № PCT/US00/31143, включенной в настоящее описание полностью в качестве ссылки.
Соединения согласно настоящему изобретению могут использоваться для снижения контроля ВГД, включая ВГД, связанное с глаукомой, развивающейся при нормальном давлении, при глазной гипертензии, и с глаукомой у теплокровных животных, включая человека. Поскольку лечение глаукомы предпочтительно проводят с использованием соединений, которые не проходят в ЦНС, относительно полярные соединения, являющиеся агонистами 5-НТ2, представляют особый интерес. Соединения предпочтительно вводят в состав фармацевтических композиций, которые предпочтительно являются пригодными для местной доставки в глаз пациента.
Соединения согласно настоящему изобретению формулы I могут быть включены в состав фармацевтических композиций различных типов, таких как офтальмологические препараты для введения в глаз (например, для местного введения, внутрь камеры глаза или путем имплантирования). Соединения предпочтительно включают в местные офтальмологические композиции для введения в глаз. Соединения могут быть объединены с офтальмологически приемлемыми консервантами, усилителями вязкости, усилителями проницаемости, буферами, хлоридом натрия и водой с получением водных стерильных глазных суспензий или растворов. Композиции раствора для офтальмологического применения могут быть получены при растворении соединения в физиологически приемлемом изотоническом водном буфере. Далее офтальмологический раствор может включать офтальмологически приемлемое поверхностно-активное вещество для облегчения растворения соединения. Кроме того, офтальмологический раствор может содержать средство, способствующее увеличению вязкости, такое как гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза, метилцеллюлоза, поливинилпирролидон и т.п., для улучшения удерживания композиции в конъюнктивальном мешке. Могут также использоваться желирующие средства, которые включают, не ограничиваясь приведенными средствами, gellan и ксантановую камедь. Для получения стерильных офтальмологических композиций мазей активный ингредиент объединяют с консервантом в соответствующем носителе, таком как минеральное масло, жидкий ланолин или белый вазелин. Стерильные офтальмологические гелевые композиции могут быть получены при суспендировании активного ингредиента в гидрофильной основе, полученной при сочетании, например, с карбополом-974 или аналогичным соединением в соответствии с опубликованными данными по получению аналогичных офтальмологических препаратов, могут быть также включены консерванты и средства для усиления тонуса.
Соединения предпочтительно готовятся в виде местных глазных суспензий или растворов, имеющих pH примерно 5-8. В норме указанные соединения входят в состав рассматриваемых композиций в количестве от 0,01 мас.% до 5 мас.%, предпочтительно в количестве от 0,25 мас.% до 2 мас.% по весу. Таким образом, в случае местной формы композиции (1-2 капли указанных композиций) вводят на поверхность глаза от 1 до 4 раз в день, согласно предписанию лечащего врача.
Соединения могут также использоваться в сочетании с другими средствами, применяемыми для лечения глаукомы, такими как, но не ограничеваясь ими, β-блокаторы (например, тимолол, бетаксолол, левобетаксолол, картеолол, левобунолол, пропранолол), ингибиторы карбоангидразы (например, бринзоламид и дорзоламид), антагонисты α1 (например, нипрадолол), антагонисты α2 (например, йопидин и бримонидин), миотические средства (например, пилокарпин и эпинефрин), аналоги простагландинов (например, латанопрост, травапрост, унопростон и соединения, указанные в патентах США №№ 5889052, 5296504, 5422368 и 5151444, "гипотензивные липиды" (например, лумиган и соединения, указанные в патенте № 5352708) и нейропротекторы (например, соединения, указанные в патенте США № 6690931, в частности элипродил и R-элипродил, указанные в совместно рассматриваемой заявке U.S.S.N. 06/203350, и соответствующие соединения из WO 94/13275, включая мемантин.
В описанных выше формулах алкильная группа может быть линейно-цепочечной, разветвленной или циклической и т.п. Галоген включает Cl, Br, F или I. Алкокси обозначает алкильную группу, соединенную связью через атом кислорода.
Соединения согласно настоящему изобретению предпочтительно функционируют как 5-НТ2 агонисты и предпочтительно не проходят в ЦНС. Более детально, конкретные соединения согласно настоящему изобретению включают в свою структуру фенольный гидроксил, который, как считается, сравним с таковым у серотонина, и, таким образом, соединения согласно настоящему изобретению предпочтительно не пересекают гематоэнцефалический барьер и не поступают в мозг. Соединения, обладающие способностью действовать как 5-НТ2 агонисты, полезны для контроля ВГД, а также для лечения глаукомы, как было показано в публикации заявки на международный патент № WO 00/16761, включенной в настоящее описание полностью в качестве ссылки. Соединения согласно настоящему изобретению предпочтительно обладают повышенной химической стабильностью и предпочтительно демонстрируют желательный уровень терапевтической активности, которая предусматривает снижение или контроль ВГД.
Соединения согласно настоящему изобретению могут использоваться для контроля или снижения ВГД у теплокровных животных, включая человека. Предпочтительно, пациенту вводят эффективное количество соединения, так чтобы достигался контроль или снижение ВГД до приемлемых уровней. Кроме того, соединения согласно настоящему изобретению могут использоваться для лечения глаукомы у теплокровных животных, включая человека, путем введения пациенту эффективного для лечения глаукомы количества соединения при необходимости такого лечения. Примеры подходящих количеств фармацевтически приемлемых соединений согласно настоящему изобретению включают те количества, которые приведены в примерах.
Другой вариант осуществления настоящего изобретения представляет способ активизации или связывания с рецепторами серотонина, включающий введение пациенту эффективного количества по меньшей мере одного соединения согласно настоящему изобретению с использованием количеств, эффективных для активизации или связывания с рецепторами серотонина, таких как, не ограничиваясь указанными значениями, приведенные в настоящем описании дозировки.
Показанные ниже примеры даны для иллюстрации способов получения соединений, которые являются объектом настоящего изобретения, но они не должны рассматриваться как включающие какие-либо ограничения пунктов формулы изобретения. Предпочтительные соединения формулы I описаны в примерах 4 и 5. Наиболее предпочтительное соединение описано в примере 4. Спектр протонного магнитного резонанса каждого соединения, приведенного в примерах, соответствует предполагаемой структуре.
Способ 1
Тест на связывание с 5-НТ2 рецептором
Для оценки афинности серотонинергических соединений к 5-НТ2 рецепторам определяют их способность конкурировать с агонистом радиолигандом [125I]DOI за связывание с 5-HT2 рецепторами головного мозга, как описано ниже, по приведенной в литературе методике, включающую незначительные модификации (Neuropharmology, 26, 1803 (1987)]. Аликвоты гомогенатов коры головного мозга крысы или человека, взятых после смерти (400 мкл), диспергируют в 50 мМ Трис-HCl буфера (pH 7,4) и инкубируют с [125I]DOI (конечная концентрация 80 пМ) в отсутствие или в присутствии метиотепина (конечная концентрация 10 мкМ) в общем объеме 0,5 мл, для определения общего и неспецифического связывания, соответственно. Смесь для анализа инкубируют в течение 1 часа при 23°С в полипропиленовых пробирках и реакцию останавливают быстрым фильтрованием в вакууме на стекловолокнистых фильтрах Whatman GF/B, предварительно вымоченных в 0,3% полиэтиленимине с использованием ледяного буфера. Вместо метиотепина вводят исследуемые соединения (в различных концентрациях). Связанную с фильтром радиоактивность определяют методом сцинтилляционной спектрометрии на бета-счетчике. Для определения показателей афинности соединения полученные данные анализируют с использованием нелинейного итеративного графика, построенного с помощью компьютерной программы [Trends Pharmacol. Sci., 16, 413 (1995)]. Концентрацию соединения, необходимую для ингибирования связывания [125I]DOI на 50% от максимального значения, обозначают как величину ИК50 или Кi.
Способ 2
Функциональный тест на 5-НТ2: мобилизация [Ca2+]I
Изучают опосредованную рецептором мобилизацию внутриклеточного кальция ([Ca2+]I) с использованием флуоресцентного планшет-ридера (счетчика пластин) (FLIPR). Гладкомышечные клетки сосудов крысы А7r5 выращивают в нормальной среде DMEM/10% ФСТ и 10 мкг /мл гентамицина. Монослои слившихся клеток обрабатывают трипсином, получают осадок и ресуспендируют в нормальной среде. Клетки высевают в объеме 50 мкл с плотностью 20000 клеток/ячейку в 96-ячеечные планшеты для культуры ткани с черной стенкой и выращивают в течение 2 дней.
В день эксперимента одну ампулу с красителем из набора для определения кальция FLIPR ресуспендируют в 50 мл FLIPR буфера, состоящего из сбалансированного солевого раствора Хэнкса (HBSS), 20 мМ HEPES и 2,5 мМ пробенецида, pH 7,4. Клетки обрабатывают чувствительным к кальцию красителем, добавляя равный объем (по 50 мкл) к каждой ячейке 96-луночного планшета и инкубируют с красителем в течение 1 часа при 23°С.
В типичном случае исследуемое соединение хранят в концентрации 25 мкМ в растворителе, включающем 50% ДМСО/50% этанол. Соединение разбавляют в соотношении 1:50 смесью 20% ДМСО/20% этанола. Для «хит-скрининга» соединение далее разбавляют в соотношении 1:10 в FLIPR буфере и исследуют в конечной концентрации 10 мкМ. Для экспериментов по типу «доза-ответ» соединение разбавляют в соотношении 1:50 в FLIPR буфере и делают серийные разбавления 1:10 с получением кривых доза-ответ с 5 или 8 точками.
Планшет с соединением и планшет с клетками помещают в анализатор FLIPR. В начале эксперимента проводят сигнальный тест для определения базального флуоресцентного сигнала от клеток, содержащих краситель, и для подтверждения однородности прохождения сигнала через планшет. Базальную флуоресценцию доводят до значения 8000-12000 имп