Соединения, фармацевтическая композиция и способ ингибирования опухолевого роста (варианты)
Иллюстрации
Показать всеИзобретение относится к новым соединениям структуры, указанной ниже, ингибирующим опухолевый рост и ангиогенез.
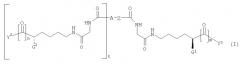
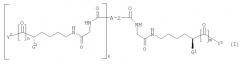
где R2 и R3, каждый, независимо, представляет собой Н, С1-С4 алкил; Х2 и Х3, каждый, независимо, представляет собой С1-С4 перфторалкил; А представляет собой Н или ковалентную связь; и t представляет собой целое число, имеющее значение 0 или 1; при условии, что когда А представляет собой Н, тогда t равно 0, и когда А представляет собой ковалентную связь, тогда t равно 1. Изобретение также относится к фармацевтической композиции и способам ингибирования. 7 н. и 25 з.п ф-лы, 5 ил, 1 табл.
Реферат
Область изобретения
Настоящее изобретение относится к композициям, ингибирующим ангиогенез и опухолевый рост. В частности, изобретение относится к композициям, которые связываются с интегрином αvβ3 и блокируют взаимодействие интегрина αvβ3 и матричной металлопротеиназы 2 (MMP2). Изобретение также относится к способам ингибирования ангиогенеза и опухолевого роста, в которых используются селективные ингибиторы связывания интегрина αvβ3 и MMP2.
Предпосылки изобретения
Инвазивность сосудистых клеток в ткани требует согласованного взаимодействия большого количества факторов, в том числе протеиназ, которые изменяют структуру экстрацеллюлярного матрикса, а также молекул клеточной адгезии, которые узнают этот измененный матрикс. В сообщениях, сделанных недавно, указывалось, что 72 кДа матричная металлопротеиназа 2 (MMP2) играет ключевую роль в образовании новых сосудов и в ангиогенезе. Например, Kitoh et al. (J. Cell Sci., 109, 953-8 (1996)) сообщали о том, что присутствие MMP2 и его активатора мембранного типа 1-матричной металопротеиназы (MT1-MMP), которые взаимосвязано экспрессируются мезенхимальными клетками практически только при эмбриональном развитии, указывает на специфические перестройки связей в матриксе таких тканей. Кроме того, ангиогенез и соответствующий опухолевый рост снижен у мышей с выключенным геном MMP2 (смотри Itoh et al., Cancer Res., 58 1048-51 (1998)). Интересным фактом, на который указывают Saftor et al. (Proc. Natl. Acad. Sci. U.S.A., 89, 1557-61 (1992)), является то, что лигирование интегрина αvβ3, являющегося известным медиатором ангиогенеза, индуцирует продукцию MMP2, что говорит о согласованном взаимодействии этих двух молекул во время сосудистой перестройки, связанной с образованием кровяного сосуда (смотри также Bafetti et al, J. Biol. Chem., 273, 143-9 (1998)). Действительно, Brooks et al (Cell, 85, 683-93 (1996)) продемонстрировали непосредственное взаимодействие MMP2 и интегрина αvβ3. Позднее Brooks et al показали, что такая отрицательная регуляция MMP2 при сосудистой инвазии и формировании связана с экспрессией αvβ3 (Cell, 92, 391-400 (1998)).
Хотя было подтверждено, что природные, а также синтетические ингибиторы MMP, в том числе ингибиторы MMP2, ингибируют ангиогенез и попутно подавляют рост опухоли, введение таких методик в клиническое использование имело ограниченный успех, главным образом из-за вредного побочного действия, такого как широкий спектр ингибирования. Так как функционирование ММР в целом может быть необходимо для многих процессов, протекающих во взрослом организме, то ингибирование активного сайта ферментативной функции, вероятно, может иметь большой диапазон последствий на эффекты в различных биологических процессах, которые включают перестройку ткани, например, при заживлении ран. В самом деле, на стадии клинических испытаний было подтверждено, что лечение различных типов рака ингибиторами ММР с широким спектром действия вызывало серьезное побочное действие, включающее воспаление ткани сухожилия, полиартриты и синдромы мышечной боли, которые ограничивали дозу и зачастую сохранялись после прекращения лечения. Однако, имея ограниченное распределение интегрина αvβ3 во взрослом организме, можно предполагать, что целенаправленное взаимодействие ММР2 и αvβ3 в областях, в которых образуются новые сосуды, или в областях клеточной инвазии может, соответственно, ограничивать эффект такой токсичности, связанной с лечением. Действительно, рекомбинантный некаталитический гемопексиновый домен на карбоксиконце ММР2 (PEX), который опосредует связывание ММР2 с интегрином αvβ3, показал антиангиогенную и противоопухолевую активность in vivo. Возможное использование такого большого белкового фрагмента, сопровождающееся неудобствами (например, проблемы широкомасштабного производства, FDA (управление по контролю за продуктами и лекарствами США) контроль качества и безопасности выпуска и антигенность), предполагает необходимость более удобного решения этой проблемы.
Существует необходимость в химических соединениях, которые бы селективно ингибировали активность ММР в областях опухолевого роста, минимально ингибируя ММР в других областях организма.
Краткое описание изобретения
Настоящее изобретение относится к новым соединениям, используемым в качестве ингибиторов ангиогенеза и опухолевого роста. Настоящее изобретение также относится к способу ингибирования взаимодействия ММР2 и интегрина αvβ3 и способу ингибирования ангиогенеза в клетках, содержащих интегрин αvβ3. Кроме того, настоящее изобретение относится к способу ингибирования опухолевого роста путем введения ингибиторов ММР2-αvβ3 взаимодействия.
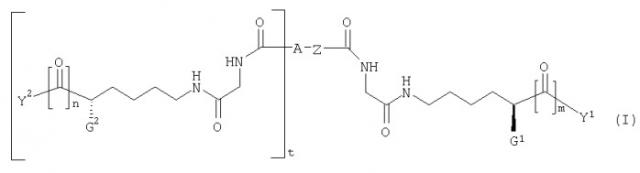
Соединения по настоящему изобретению представлены формулой (I) и включают в себя глициллизиновые производные, химически присоединенные к связывающей группе:
где G1 или G2 каждый независимо представляет собой -NH-C(O)-О-R1, -NH-C(О)-О-(CH2)v-(C6H4)-X1, -NH-C(О)-NH-(CH2)v-(C6H4)-X1, -O-C(O)-NH-(CH2)v-(C6H4)-X1, -O-C(O)-O-(CH2)v-(C6H4)-X1 или -NH-C(O)-CH2-(C6H4)-X1; Y1 и Y2 каждый независимо представляет собой OH, С1-С4 алкил, С1-С4 гидроксиалкил, С1-С4 алкокси, фенил, бензил или -NH2; R1 представляет собой С1-С4 алкил; X1 представляет собой галоген, нитро, С1-С4 алкил, С1-С4 алкокси или С1-С4 перфторалкил; Z представляет собой -С≡С-, -С6Н4-, цис -CH=CH-, транс -CH=CH-, цис -CH2-CH=CH-CH2-, транс -CH2-CH=CH-CH2-, 1,4-нафтил, цис-1,3-циклогексил, транс-1,3-циклогексил, цис-1,4-циклогексил или транс-1,4-циклогексил; A представляет собой H или ковалентную связь; m и n каждый независимо представляет собой целое число, имеющее значение 0 или 1; t представляет собой целое число, имеющее значение 0 или 1; и v представляет собой целое число, имеющее значение 1 или 2; при условии, что когда A представляет собой H, тогда t равно 0; когда A представляет собой ковалентную связь, тогда t равно 1; когда m равно 0, тогда Y1 представляет собой С1-С4 гидроксиалкил; и когда n равно 0, тогда Y2 представляет собой С1-С4 гидроксиалкил. Эти соединения связываются с αvβ3 и ингибируют взаимодействие ММР2 и αvβ3.
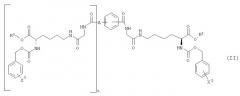
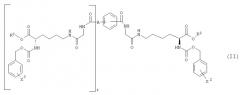
Предпочтительные соединения структурной формулы (I) представлены структурной формулой (II):
где R2 и R3, каждый, независимо представляет собой Н, С1-С4 алкил, фенил или бензил; Х2 и Х3 каждый независимо представляет собой галоген, нитро, С1-С4 алкокси, С1-С4 алкил или С1-С4 перфторалкил; А представляет собой Н или ковалентную связь; и t представляет собой целое число, имеющее значение 0 или 1; при условии, что когда А представляет собой Н, тогда t равно 0, и когда А представляет собой ковалентную связь, тогда t равно 1. Когда А представляет собой ковалентную связь и t равно 1, тогда группы глициллизинового производного могут быть присоединены к бензолсвязывающей группе в орто-, мета- или параположении.
Когда соединения формулы (I) и (II) вводятся в клетки, содержащие αvβ3, связывание αvβ3 и ММР2 ингибируется, что препятствует, таким образом, основному механизму ангиогенеза. Нарушение ангиогенеза также может ингибировать опухолевый рост путем предотвращения васкуляризации опухоли, таким образом, нарушая ее питание. Соединения по настоящему изобретению, которые ингибируют ангиогенез и опухолевый рост, таким образом, являются полезными терапевтическими агентами для лечения пациентов с опухолями и ангиогенными расстройствами. Так как настоящие соединения связываются с αvβ3, то эти соединения также могут быть использованы для подавления воспаления.
Соединения по настоящему изобретению могут находиться в композиции с подходящей фармацевтически приемлемой средой для использования фармацевтической композиции при лечении опухолей и других нарушений, связанных с нежелательным ангиогенезом.
В способе по настоящему изобретению фармацевтические соединения, содержащие соединение формулы (I) и (II), получают путем смешения соединения в фармацевтически приемлемым матриксом. Фармацевтические композиции активных соединений вводятся пациенту с опухолью для снижения или прекращения опухолевого роста. Активные соединения могут вводиться парентерально инъекцией или постепенным вливанием в течение времени или любым другим способом, подходящим для определенной лекарственной формы.
Краткое описание чертежей
Фиг.1 представляет собой схематический рисунок, отражающий взаимодействие MMP2 и интегрина αvβ3, и его роль в ангиогенезе, а также ингибирование взаимодействия MMP2 и αvβ3 антагонистом, таким как соединения по настоящему изобретению.
На фиг.2A графически представлено действие ингибиторных соединений формулы (I) на взаимодействие MMP2 и интегрина αvβ3 в твердофазном анализе связывания.
На фиг.2B представлено связывание соединений формулы (I) с интегрином αvβ3 и α5β1.
На фиг.2C приведено сравнение действия соединения по настоящему изобретению и контрольного соединения на связывание с αvβ3.
На фиг.2D приведено сравнение действия аминокислотных остатков RGD на связывание настоящего изобретения и αvβ3 с действием RGD на связывание bVN и αvβ3.
На фиг.3А графически изображена протеиназная активность в β3 положительных клетках и в β3 отрицательных клетках.
На фиг.3B показано связывание MMP2 и β3 положительных клеток и β3 отрицательных клеток.
Фиг.4A представляет собой наблюдаемую в микроскоп картину ингибирования ангиогенеза в ткани CAM цыпленка.
На фиг.4В графически показано ингибирование ангиогенеза в ткани CAM цыпленка.
На фиг.4С показан уровень ММР2 в обработанных и необработанных клетках.
Фиг.5А представляет собой наблюдаемую в микроскоп картину опухолевого роста и васкуляризации в ткани САМ цыпленка.
Фиг.5B представляет собой наблюдаемую в микроскоп картину интенсивности кровеносных сосудов в ткани CAM цыпленка.
На фиг.5C графически представлен вес опухоли в ткани САМ цыпленка.
На фиг.5D графически представлена васкуляризация ткани САМ цыпленка.
Фиг.5D представляет собой наблюдаемую в микроскоп картину количества опухолевых клеток в ткани CAM цыпленка.
Подробное описание изобретения
Связывание MMP2 и интегрина αvβ3 является важным механизмом в процессе ангиогенеза. Определенные ингибиторы этого связывания приводят к уменьшению васкуляризации растущих тканей, таких как опухолей, и, таким образом, замедлению опухолевого роста. Взаимодействие MMP2 и интегрина αvβ3 графически показано на фиг.1. Новый класс ингибиторов ангиогенеза и опухолевого роста представляет собой низкомолекулярные антагонисты, описанные ниже, которые, в частности, препятствуют связыванию MMP2 и интегрина αvβ3, таким образом, давая новый важный подход в лечении.
Некоторые соединения по настоящему изобретению могут обладать одним или несколькими центрами асимметрии и могут находиться в оптически активных формах. Дополнительные центры асимметрии могут присутствовать в группе заместителя, такой как алкильная группа. Чистые S-изомеры и чистые R-изомеры, рацемические смеси изомеров и их смеси входят в объем настоящего изобретения. Предполагаемые хиральные формы некоторых соединений по данному изобретению конкретно входят в объем настоящего изобретения.
Под термином "алкокси" подразумевается атом кислорода, связанный эфирной связью с определенной ниже алкильной группой указанного размера. Примерами алкоксигрупп являются метокси, этокси, трет-бутокси и тому подобное. Под термином "алкил" подразумеваются углеродные радикалы с прямой или разветвленной цепью указанного размера. Типичными представителями алкильных радикалов являются метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, 2-этилгексил, н-октил, 2,4-диметилпентил и тому подобное. Под термином "гидроксиалкил" подразумевается определенная выше алкильная группа указанного размера, присоединенная к гидроксильной группе. Примеры включают гидроксиметил, 2-гидроксиэтил, 3-гидрокси-1-пропил, 2-гидрокси-1-пропил, 4-гидроксибутил и тому подобное.
Под термином "перфторалкил" подразумевается определенная ниже алкильная группа указанного размера, несущая фтор-заместители на месте каждого водорода, например трифторметил и пентафторэтил.
Термин "галоген" относится к брому, хлору, фтору и йоду.
Соединения по настоящему изобретению представлены формулой (I) и включают глициллизиновые производные, химически присоединенные к связывающей группе:
где G1 или G2 каждый независимо представляет собой -NH-C(O)-О-R1, -NH-C(О)-О-(CH2)v-(C6H4)-X1, -NH-C(О)-NH-(CH2)v-(C6H4)-X1, -O-C(O)-NH-(CH2)v-(C6H4)-X1, -O-C(O)-O-(CH2)v-(C6H4)-X1 или -NH-C(O)-CH2-(C6H4)-X1; Y1 и Y2 каждый независимо представляет собой OH, С1-С4 алкил, С1-С4 гидроксиалкил, С1-С4 алкокси, фенил, бензил или -NH2; R1 представляет собой С1-С4 алкил; X1 представляет собой галоген, нитро, С1-С4 алкил, С1-С4 алкокси или С1-С4 перфторалкил; Z представляет собой -С≡С-, -С6Н4-, цис -CH=CH-, транс -CH=CH-, цис -CH2-CH=CH-CH2-, транс -CH2-CH=CH-CH2-, 1,4-нафтил, цис-1,3-циклогексил, транс-1,3-циклогексил, цис-1,4-циклогексил или транс-1,4-циклогексил; A представляет собой H или ковалентную связь; m и n каждый независимо представляет собой целое число, имеющее значение 0 или 1; t представляет собой целое число, имеющее значение 0 или 1; и v представляет собой целое число, имеющее значение 1 или 2; при условии, что когда A представляет собой H, тогда t равно 0; когда A представляет собой ковалентную связь, тогда t равно 1; когда m равно 0, тогда Y1 представляет собой С1-С4 гидроксиалкил; и когда n равно 0, тогда Y2 представляет собой С1-С4 гидроксиалкил.
Предпочтительно G1 и G2 представляет собой -NH-C(О)-О-(CH2)v-(C6H4)-X1, Y1 и Y2 представляют собой OH, а m и n равны 1. Предпочтительно X1 представляет собой С1-С4 перфторалкил, более предпочтительно, трифторметил. Предпочтительные соединения, входящие в структурную формулу (I), представлены структурной формулой (II) и включают глицинлизиновые производные, присоединенные к бензольной связывающей группе либо в орто-, либо в мета-, либо в параположении:
где R2 и R3, каждый, независимо представляет собой Н, С1-С4 алкил, фенил или бензил; Х2 и Х3, каждый, независимо представляют собой галоген, нитро, С1-С4 алкокси, С1-С4 алкил или С1-С4 перфторалкил; А представляет собой Н или ковалентную связь; и t представляет собой целое число, имеющее значение 0 или 1; при условии, что когда А представляет собой Н, тогда t равно 0, и когда А представляет собой ковалентную связь, тогда t равно 1. Когда А представляет собой ковалентную связь и t равно 1, тогда группы глициллизинового производного могут быть присоединены к бензольной связывающей группе в орто-, мета- или параположении.
Предпочтительно заместители X2 и X3 присоединены к фенильному кольцу бензильной группы в 4-положении относительно бензильного CH2 (то есть, паразаместитель). Предпочтительными X2 и X3 группами являются С1-С4 перфторалкил, более предпочтительными являются паратрифторметил. Предпочтительными R2 и R3 группами являются водород и метил. Заместители X2 и X3 могут быть одинаковыми или различными и заместители R2 и R3 могут также быть одинаковыми или различными.
Особенно активным членом семейства соединений, представленных формулой (II), где A представляет собой ковалентную связь и t равно 1, является соединение, представленное соединением 1 ниже:
(Соединение 1)
Соединения формул (I) и (II) могут быть синтезированы из уже доступных веществ с небольшим числом стадий синтеза. Например, на схеме 1 показан синтез соединения 1, и эта схема иллюстрирует общий способ получения соединений формулы (II), где A является ковалентной связью, R2 и R3 одинаковы, и Х2 и Х3 одинаковы. Схема 1 дополнительно иллюстрирует синтез соединений формулы (II), где Х2 и Х3 оба являются паратрифторметилом, а R2 и R3 оба являются либо метилом, либо водородом.
Схема 1
На схеме 1 показано, что п-трифторметилбензиловый спирт взаимодействует с карбонатом дисукцинимидила с образованием активированного промежуточного эфира, который в свою очередь взаимодействует с метиловым эфиром N-ε-BOC-лизина с получением соединения 2 с 99% выходом. Гидролиз BOC защитной группы и последующее связывание с BOC-глицином дает соединение 3 с 96% выходом. Кислотный гидролиз BOC защитной группы соединения 3 приводит к получению соединения 4 с выходом 99%. Связывание двух эквивалентов соединения 4 с дихлоридом изофталоила приводит к выходу 68% соединения 5, соответствующего формуле (II), где R2 и R3 представляют собой метил, X2 и X3 представляют собой п-трифторметил и A представляет собой ковалентную связь. Гидролиз соединения 5 с гидроксидом лития дает 93% выход соединения 1.
Синтез соединений формулы (I) и (II), которые аналогичны соединению 1, но имеют другие заместители R и X, могут быть получены путем внесения изменений в схему 1, и легко понятны специалисту в области химического синтеза. Использование бензилового спирта с заместителем, отличным от п-трифторметила (например, галогеном, нитро или другим С1-С4 перфторалкильными группами, находящимися либо в орто-, либо в мета-, либо в параположении относительно бензильного CH2), или использование защищенного лизинового эфира, имеющего эфирную группу, отличную от метила, позволит получить другие соединения формулы (II).
Синтез соединений формулы (I), имеющих Z группы, отличные от 1,3-фенила, возможен, например, путем замещения другими дикислотными дихлоридами, такими как бисхлоркарбонилацетилен, дихлорид фумарила, дихлорид фталоила, вместо хлорида изофталоила по схеме 1. Альтернативно, соответствующие кислоты могут использоваться вместо хлорангидридов кислот, и связывание кислоты с соответствующими аминами может достигаться путем обычного пептидного связывания, хорошо известного в данной области. Специалисты в данной области легко подберут другие химические вещества в качестве заместителей, которые могут быть в способах синтеза, проиллюстрированных на схеме 1 и 2, для синтеза других членов группы соединения, представленного формулой (I) и (II). Синтез подобных соединений и полезные химические методики для синтеза соединений формулы (I) и (II) описаны Boger et al. в J. Am. Chem. Soc. 123, 1280-1288 (2001).
Соединения формулы (II), где A представляет собой ковалентную связь, t равно 1 и либо R2, отличающийся от R3, либо X2, отличающийся от X3, или как R2/R3, так и X2/X3 отличны друг от друга, могут быть синтезированы, модифицируя способ, представленный на схеме 1, что будет легко понятно специалисту в данной области. Например, один эквивалент соединения 4 может взаимодействовать с дихлоридом изофталоила или любым другим подходящим галогенангидридом изофталевой кислоты или активным сложным эфиром, и вторая активированная кислотная группа может соответствующим образом взаимодействовать с аналогом соединения 4, который отличается либо Х группой, либо R группой, либо обеими этими группами. Подобным образом, два аналога соединения 4, которые отличаются либо X группой, либо R группой, либо обеими этими группами, могут соответствующим образом взаимодействовать с дихлоридом изофталоила или эквивалентным активированным изофталатом с образованием дополнительных аналогов соединения 1 с отличающейся X и R группами.
Синтез соединений формулы (II), где A представляет собой водород и t равно 0, показан на примере синтеза соединений 6 и 7 на схеме 2 ниже:
Схема 2
На схеме 2 соединение 4 схемы 1 взаимодействует с бензоилхлоридом с образованием соединения 6 (R2= метил; X2 = п-трифторметил) с выходом 90%. Гидролиз сложной эфирной группы соединения 6 гидроксидом лития давал соединение 7 (R2=H, X2 = п-трифторметил) с выходом 88%.
Бензоилирование аналогов соединения 4 с различными R группами (например, с другими С1-С4 алкильными группами) и/или с различными X заместителями на бензильной группе приводил к образованию других соединений формулы (II), имеющих A = H и t = 0.
На схеме 2 также показан синтез соединения 8, неактивного аналога соединений 6 и 7, в которых бензоильная группа, присоединенная к глициновому звену формулы (II), замещается группой дигликолевого амида. Соединение 9 получают с 77% выходом взаимодействием соединения 4 с дигликолевой кислотой.
На схеме 3 ниже в качестве примера приведен синтез соединения 12, неактивного аналога соединения 1, в котором п-трифторметилбензилоксикарбонильная группа формулы (II) замещена бензоиламидом.
Схема 3
В аспекте способа по настоящему изобретению фармацевтические препараты соединений формул (I) и (II) могут быть получены смешением соединения и фармацевтически приемлемого вещества носителя. Фармацевтические композиции, включающие активные соединения формул (I) и (II), вводят в организм с опухолью для снижения или прекращения опухолевого роста. Активные соединения могут вводиться парентерально путем инъекции или постепенной инфузии в течение времени. Хотя подвергающуюся воздействию ткань чаще всего обрабатывают путем внутрибрюшинного или подкожного введения, активные соединения могут вводиться интраокулярно, внутривенно, внутримышечно, внутрисуставно, в полости, чрезкожно или также могут быть доставлены с помощью перистальтических инфузионных насосов.
В данном изобретении под используемым здесь термином "введение" соединения или композиции понимают систематический прием пероральным, парентеральным путями, с помощью спрея для ингаляций, назальным, ректальным или буккальным путями, или местным нанесением композиции в виде лекарственной формы, содержащей необходимые обычные нетоксичные фармацевтически приемлемые носители, адъюванты или растворители. Под используемым здесь термином "парентеральный" понимают внутривенную, внутримышечную, внутрибрюшинную, интрастернальную, подкожную и внутрисуставную инъекцию или способы инфузии.
"Фармацевтически приемлемые" означает такие соли, амиды и сложные эфиры, которые в рамках медицинских значений являются подходящими для взаимодействия с тканями человека и низших животных без неспецифической токсичности, повреждения, аллергического ответа и тому подобное, и соответствуют приемлемому отношению выгода/риск, эффективному для планируемого их применения при лечении опухолей и ангиогенных нарушений.
Фармацевтически приемлемые соли хорошо известны в данной области. Например, S. M. Berge et al. подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 66: 1-19 (1977). Типичными представителями солей добавления кислот являются гидрохлорид, гидробромид, сульфат, бисульфат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, толуолсульфонат, метансульфонат, цитрат, малеат, фумарат, сукцинат, тартрат, аскорбат, глюкогептонат, лактобионат, лаурилсульфат и тому подобное. Типичными представителями солей щелочных или щелочноземельных металлов являются соли натрия, кальция, калия, магния и тому подобное.
Под используемым здесь термином "фармацевтически приемлемые носители" понимают нетоксичное, инертное твердое вещество, полутвердое или жидкое вещество наполнителя, разбавителя, инкапсулирующее вещество или вспомогательную композицию любого типа. Некоторые примеры веществ, которые могут служить фармацевтически приемлемыми носителями, включают сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельной крахмал; целлюлозу и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; трагакант в порошке; солод; желатин; тальк; эксципиенты, такие как масло какао и воска для суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферизирующие агенты, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; воду без пирогенов; изотонический солевой раствор; раствор Рингера; этиловый спирт и забуференные фосфатом растворы, а также другие нетоксические сочетаемые вещества, используемые в фармакологических композициях.
В композиции также могут находиться увлажняющие агенты, эмульгаторы и смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красители, разделительные вещества, покрывающие вещества, подсластители, вкусовые агенты и ароматизаторы, консерванты и антиоксиданты в соответствии с фармацевтическими нормами. Примеры фармацевтически приемлемых антиоксидантов включают антиоксиданты, растворимые в воде, такие как аскорбиновая кислота, цистеингидрохлорид, бисульфит натрия, метабисульфит натрия, сульфит натрия и тому подобное; антиоксиданты, растворимые в масле, такие как аскорбил пальмитат, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), лецитин, пропилгаллат, альфа-токоферол и тому подобное; и металлхелатные добавки, такие как лимонная кислота, этилендиаминтетрауксусная кислота (EDTA), сорбит, винная кислота, фосфорная кислота и тому подобное.
Под "терапевтически эффективным количеством" агента или соединения по данному изобретению понимают достаточное количество соединения для лечения опухолей и ангиогенных нарушений с подходящим соотношением польза/риск для терапевтического использования. Понятно, однако, что общая дневная доза соединений и композиций по данному изобретению будет определена лечащим врачом в пределах медицинских норм. Уровень специфических терапевтически эффективных доз для любого конкретного больного будет зависеть от ряда факторов, в том числе от нарушения, на которое нацелено лечение, и тяжести нарушения; активности конкретных используемых соединений; используемой конкретной композиции; возраста, массы тела, общего состояния здоровья, пола и питания больного; время введения, пути введении и скорости экскреции используемого конкретного соединения; продолжительности лечения; лекарственных средств, используемых в сочетании или одновременно с используемым конкретным соединением; и тому подобными факторами, хорошо известными в области медицины.
Данное изобретение также относится к фармацевтическим композициям в стандартной лекарственной форме, которые включают терапевтически эффективное количество соединения (или соединений) по данному изобретению в сочетании с обычными фармацевтическими носителями. Препараты, вводимые с помощью инъекции, например, стерильные водные жидкости, вводимые инъекцией, или масляные суспензии могут быть получены в соответствии с известными в данной области способами, используя подходящие диспергирующие или увлажняющие агенты и суспендирующие агенты. Стерильный препарат, вводимый инъекцией, также может быть стерильным раствором, вводимым инъекцией, суспензией или эмульсией в нетоксическом разбавителе или растворителе, приемлемом для парентерального введения, например, в виде раствора 1,3-бутандиола. К приемлемым растворителям и транспортным средствам относятся вода, раствор Рингера, U.S.P. и изотоничный раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используются стерильные твердые масла. Для этой цели может быть использовано любое твердое масло, в том числе синтетические моно- или диглицериды.
Кроме того, в препаратах, вводимых инъекцией, используются жирные кислоты, такие как олеиновая кислота. Композиции, вводимые инъекцией, могут быть стерилизованы, например, фильтрацией через фильтр, задерживающий бактерии, или путем смешения стерильных агентов в форме стерильных твердых веществ, которые могут быть растворены или разбавлены непосредственно перед использованием в стерильной воде или других стерильных средах для инъекций.
Для того чтобы продлить действие лекарства, часто желательно замедлить его всасывание при подкожной или внутримышечной инъекции. Наиболее простым способом для достижения такого замедления является введение суспензии кристаллического или аморфного вещества со слабой растворимостью в воде. Скорость всасывания лекарственного средства становится зависимой от скорости его растворения, что в свою очередь зависит от физического состояния лекарственного средства, например размера кристаллов и кристаллической формы. Другим подходом для задержки всасывания лекарственного средства является введение лекарственного средства в виде раствора или суспензии в масле. Также, формовкой микрокапсулярного вещества лекарства и биодеградируемых полимеров, таких как полилактид-полигликолид, может быть получена вводимая инъекцией форма с замедленным всасыванием. Скорость высвобождения лекарства может контролироваться в зависимости от соотношения лекарства и полимера и композиции полимера. Примеры других биодеградируемых полимеров включают полиортоэфиры и полиангидриды. Форма с замедленным всасыванием, вводимая инъекцией, также может быть получена включением лекарственного средства в липосомы или микроэмульсии, совместимые с тканями организма.
Суппозитории для ректального введения лекарственного средства могут быть получены смешением лекарства с подходящим нераздражающим эксципиентом, таким как масло какао и полиэтиленгликолем, который является твердым при обычной температуре и жидким при ректальной и, таким образом, будет растворяться в прямой кишке, высвобождая лекарство.
Твердые лекарственные формы для перорального введения могут включать в себя капсулы, таблетки, пилюли, порошки, шарики и гранулы. В каждой твердой лекарственной форме активное соединение может быть смешено, по крайней мере, с одним инертным разбавителем, таким как сахароза, лактоза и крахмал. Такие лекарственные формы могут также включать в себя в обычном применении дополнительные вещества помимо инертных разбавителей, например лубриканты для таблетирования и другие вспомогательные вещества, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль лекарственные формы также могут включать в себя буферные агенты. Таблетки и пилюли могут дополнительно покрываться энтеросолюбильными покрытиями и другими покрытиями, контролирующими высвобождения лекарства. Твердые композиции подобного типа могут также использоваться в виде наполнителей в мягких и твердых желатиновых капсулах, используя такие эксципиенты, как лактоза или мальтоза, а также высокомолекулярные полиэтиленгликоли и тому подобное.
Жидкие лекарственные формы для перорального введения могут включать в себя фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры, содержащие обычно используемые в данной области инертные разбавители, такие как вода. Такие композиции могут также включать в себя адъюванты, такие как увлажняющие агенты; эмульгирующие и суспендирующие агенты; подсластители, вкусовые агенты и ароматизаторы. При желании, соединения по настоящему изобретению могут вводиться в системы с замедленным высвобождением или нацеленные системы доставки, такие как полимерные матрицы, липосомы и микросферы. Они могут быть стерилизованы, например, фильтрацией через фильтр, задерживающий бактерии, или смешением стерилизованных агентов в виде стерильных твердых соединений, которые могут растворяться непосредственно перед использованием в стерильной воде или некоторых других стерильных средах, вводимых инъекцией. Активные соединения также могут быть микроинкапсулированы с одним или несколькими эксципиентами, как описано выше.
Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул могут быть покрыты оболочками, такими как энтеросолюбильные покрытия и другие оболочки, хорошо известные в области фармацевтических композиций. Они могут необязательно содержать опалесцирующие агенты и также могут быть композициями, которые высвобождают только активный(ые) компонент(ы), или, предпочтительно, в определенной части кишечного тракта, необязательно замедленно. Примеры погруженных композиций, которые могут быть использованы, включают полимерные вещества и воски. Лекарственные формы для местного или чрезкожного введения соединения по данному изобретению включают масла, пасты, кремы, лосьоны, гели, порошки, растворы, спрей, ингаляции или пластыри. Активный компонент примешивают в стерильных условиях к фармацевтически приемлемому носителю и любым необходимым консервантам или буферам, если требуется.
Композиции для глаз, ушные капли, глазные мази, порошки и растворы также входят в рамки данного изобретения. Мази, пасты, кремы и гели могут содержать, кроме активного вещества по данному изобретению, эксципиенты, такие как животные и растительные жиры, масла, воска, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевая кислота, тальк и оксид цинка, или их смеси.
Порошки и спрей могут содержать, кроме соединений по данному изобретению, эксципиенты, такие как лактоза, тальк, кремниевую кислоту, гидроксид алюминия, силикаты кальция и полиамидный порошок, или смеси этих веществ. Спрей может дополнительно содержать обычно используемый пропеллент, такой как хлорфторуглеводороды.
Чрезкожные пластыри имеют дополнительно преимущество, обеспечивая подконтрольное высвобождение соединения в организм. Такие лекарственные формы могут быть получены растворением или диспергированием соединения в характерной среде. Абсорбция транспортных веществ может также использоваться для повышения потока через кожу. Скорость может контролироваться либо обеспечивающей скорость мембраной, либо дисперсией соединения в полимерную матрицу или гель.
Композиции, содержащие активные соединения, вводятся способом, совместимым с лекарственной формой и в терапевтически приемлемом количестве. Вводимое количество и время введения зависят от больного, способности системы больного использовать активное вещество и степени желаемого терапевтического эффекта. Определенное количество активного вещества, требуемого для введения, зависит от назначений лечащего врача и является специфическим для каждого случая.
Области подходящих доз для систематического приема описаны здесь и зависят от пути введения. Подходящие режимы введения также могут быть разными, но обычно включают первоначальное введение, затем введение повторяющихся доз с одним или несколькими заранее определенными интервалами времени последующих инъекций или другого пути введения.
Настоящее изобретение также относится к фармацевтическим композициям, которые применяются в обычных методах лечения, описанных здесь. Композиции содержат активное соеди