Химерные аналоги соматостатина-дофамина
Иллюстрации
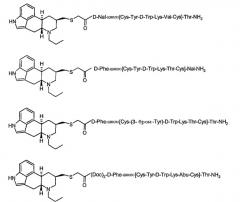
Показать всеОписана серия химерных аналогов соматостатина-дофамина, которые сохраняют in vivo активность и соматостатина, и дофамина. Примером является 6-н-пропил-8β-эрголинилметилтиоацетил-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Abu-Cys)-Thr-NH2. 11 н. и 5 з.п. ф-лы.
Реферат
Предпосылки изобретения
Настоящее изобретение относится к химерным аналогам соматостатина-дофамина.
Дофамин представляет собой катехоламиновый нейротрансмиттер, который вовлечен в патогенез болезни Паркинсона и шизофрении. Graybiel, et al., Adv. Neurol. 53, 17-29 (1990); Goldstein, et al., FASEB J. 6, 2413-2421 (1992); Olanow, et al., Annu. Rev. Neurosci. 22, 123-144 (1999). Egan, et al., Curr. Opin. Neurobiol. 7, 701-707 (1997). Дофамин и родственные молекулы, как было показано, ингибируют рост некоторых типов злокачественных опухолей у мышей, и данная активность различным образом объясняется ингибированием пролиферации опухолевых клеток, стимуляцией противоопухолевого иммунитета или действием на метаболизм меланина в злокачественных меланомах. Wick, M.M., J. Invest. Dermatol. 71, 163-164 (1978); Wick, M.M., J. Natl. Cancer Inst. 63, 1465-1467 (1979); Wick, M.M., Cancer Treat Rep. 63, 991-997 (1979); Wick, M.M., Cancer Res. 40, 1414-1418 (1980); Wick, M.M., Cancer Treat Rep. 65, 861-867 (1981); Wick, M.M. & Mui, J. Natl. Cancer Inst 66, 351-354 (1981); Dasgupta, et al., J. Cancer Res. Clin. Oncol. 113, 363-368 (1987); Basu, et al., Endocrine 12, 237-241 (2000); Basu, et al., J. Neuroimmunol. 102, 113-124 (2000). Последние исследования продемонстрировали наличие D2-дофаминовых рецепторов на эндотелиальных клетках. Ricci, et al., J. Auton. Pharmacol, 14, 61-68 (1994); Bacic, et al., J. Neurochem. 57, 1774-1780 (1991). Недавно появилось сообщение о том, что дофамин сильно и избирательно ингибирует при нетоксичных уровнях активность по повышению проницаемости сосудов и ангиогенную активность VPF/VEGF. Basu et al., Nat. Med. 7 (5), 569-574 (2001).
Показано, что соматостатин (SS), тетрадекапептид, открытый Brazeau et al., оказывает мощное ингибирующее действие на различные секреторные процессы в тканях, таких как гипофиз, поджелудочная железа и желудочно-кишечный тракт. SS также действует как нейромодулятор в центральной нервной системе. Данные биологические эффекты SS, все ингибирующие по природе, осуществляются через серию связанных с G-белком рецепторов, пять различных подтипов которых охарактеризованы (SSTR1-SSTR5) (Reubi JC, et al., Cancer Res 47: 551-558, Reisine T, et al., Endocrine Review 16: 427-442, Lamberts SW, et al., Endocr Rev 12: 450-482, 4 Patel YC, 1999 Front Neuroendocrinology 20: 157-198). Данные пять подтипов имеют сходные аффинности в отношении эндогенных лигандов SS, но имеют разное распределение в различных тканях. Соматостатин связывается с пятью различными подтипами рецептора (SSTR) с относительно высокой и равной аффинностью для каждого подтипа.
Имеется подтверждение того, что SS регулирует пролиферацию клеток путем торможения клеточного роста через подтипы SSTR1, 2, 4 и 5 (Buscail L, et al., 1995 Proc Natl Acad Sci USA 92: 1580-1584; Buscail L, et al., 1994 Proc Natl Acad Sci USA 91: 2315-2319; Florio T, et al., 1999 Mol Endocrinol 13: 24-37; Sharma K, et al., 1999 Mol Endocrinol 13: 82-90) или путем индукции апоптоза через подтип SSTR3 (Sharma K, et al., 1996 Mol Endocrinol 10: 1688-1696). SS и различные его аналоги, как было показано, ингибируют пролиферацию нормальных клеток и клеток неоплазии in vitro и vivo (Lamberts SW, et al., Endocr Rev 12: 450-482) через специфические рецепторы SS (SSTR) (Patel YC, 1999 Front Neuroendocrinology 20: 157-198) и возможно путем различных послерецепторных действий (Weckbecker G, et al., Pharmacol Ther 60: 245-264; Bell GI, Reisine T 1993 Trends Neurosci 16: 34-38; Patel YC, et al., Biochem Biophys Res Commun 198: 605-612; Law SF, et al., Cell Signal 7: 1-8). Кроме того, имеется подтверждение, что различные подтипы SSTR экспрессируются в нормальных и неопластических тканях человека (9), обеспечивая различную тканевую аффинность для разных аналогов SS и различный клинический ответ на их терапевтическое действие.
Связывание с различными видами подтипов рецепторов соматостатина ассоциировано с лечением различных состояний и/или заболеваний. («SSTR2») (Raynor, et al., Molecular Pharmacol. 43: 838 (1993); Lloyd, et al., Am. J. Physiol. 268:G102 (1995)), в то время как ингибирование инсулина приписывается рецептору соматостатина 5 типа («SSTR5») (Coy, et al. 197: 366-371 (1993)). Активация типов 2 и 5 ассоциирована с подавлением гормона роста, и, более конкретно, секретирующих GH аденом (акромегалия) и секретирующих TSH тиреотропный гормон аденом. Активация типа 2, но не типа 5, ассоциирована с лечением секретирующих пролактин аденом. Другие показания, связанные с активацией подтипов рецепторов соматостатина, включают ингибирование инсулина и/или глюкагона для лечения сахарного диабета, ангиопатии, пролиферативной ретинопатии, феномена «утренней зари» и нефропатии; ингибирование секреции кислоты в желудке и, более конкретно, пептических язв, кишечного или панкреатического свища, синдрома раздраженной толстой кишки, демпинг-синдрома, синдрома водянистой диареи, связанной со СПИД диареи, индуцированной химиотерапией диареи, острого или хронического панкреатита и опухолей, секретирующих желудочно-кишечные гормоны; лечение злокачественной опухоли, такой как гепатома; ингибирование ангиогенеза; лечение воспалительных нарушений, таких как артрит; ретинопатию; хроническое отторжение аллотрансплантата; ангиопластику; предотвращение кровотечения из сосудов трансплантата и гастроинтестинального кровотечения. Предпочтительно иметь в распоряжении аналог, селективный для конкретного подтипа или подтипов соматостатинового рецептора, ответственных за требуемую биологическую реакцию, таким образом, снижая взаимодействие с другими подтипами рецептора, которое может привести к нежелательным побочным эффектам.
Соматостатин (SS) и его рецепторы (SSTR1-SSTR5) экспрессируются в нормальных парафолликулярных С-клетках человека и медуллярной карциноме щитовидной железы (MTC). MTC представляет собой опухоль, происходящую из парафолликулярных C-клеток щитовидной железы, которая продуцирует кальцитонин (CT), соматостатин, а также несколько других пептидов (Moreau JP, et al., Metabolism 45 (8 Suppl 1): 24-26). Недавно Mato et al. показали, что SS и SSTR экспрессированы в MTC человека (Mato E, et al., J Clin Endocrinol Metab 83: 2417-2420). Было документировано, что SS и его аналоги индуцируют снижение в плазме уровней CT и симптоматическое улучшение у пациентов с MTC. Однако до сих пор антипролиферативная активность аналогов SS в отношении опухолевых клеток не была ясно продемонстрирована (Mahler C, et al., Clin Endocrinol 33: 261-9; Lupoli G, et al., Cancer 78: 1114-8; Smid WM, et al., Neth J Med 40: 240-243). Таким образом, разработка и оценка аналогов подтипы SSTR, селективных в отношении роста клеток MTC предоставляет подходящий способ для клинического применения. До сих пор не приводились данные, касающиеся участия в регуляции роста клеток МТС конкретных подтипов SSTR.
Сущность изобретения
Настоящее изобретение относится к открытию серии химерных аналогов соматостатина-дофамина, которые сохраняют in vivo как соматостатиновую, так и дофаминовую активность, включая некоторые из них, которые проявляют повышенную биологическую активность по сравнению с отдельными нативными аналогами соматостатина и дофамина, и к их терапевтическим применениям.
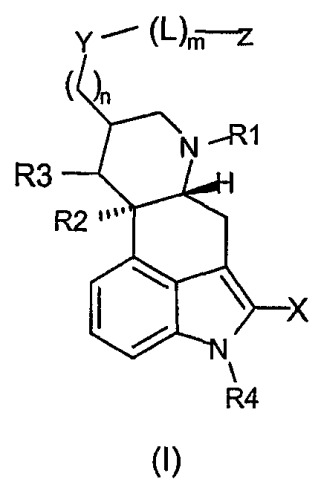
В одном из аспектов изобретение относится к химерному соединению дофамина-соматостатина формулы (I),
где:
Х представляет собой H, Cl, Br, I, F, -CN или C1-5алкил;
R1 представляет собой H, C1-4алкил, аллил, алкенил или -CN;
R2 и R3 оба независимо представляют собой H или отсутствуют, причем если R2 и R3 отсутствуют, между атомами углерода, к которым они присоединены, присутствует двойная связь;
R4 представляет собой H или -CH3;
Y представляет собой -O-, -C(O)-, -S-, -S-(CH2)s-C(O)-, -S(O)-, -S(O)2-, -SC(O)-, -OC(O)-, -N(R5)-C(O)- или -N(R6)-;
R5, R6, R7 и R8 каждый независимо представляет собой H или C1-5алкил;
R6 представляет собой H или C1-5алкил;
m представляет собой 0 или 1;
n представляет собой 0-10;
L представляет собой -(CH2)p-C(O)-, когда Y представляет собой -S-, -S(O)-, -S(O)2-, -O- или -N(R6)-;
L представляет собой -C(O)-(CR7R8)q-C(O)-, когда Y представляет собой -N(R6)-, -O- или -S-;
L представляет собой -(Doc)t-, когда Y представляет собой -C(O)-, SC(O)-, -OC(O)-, -S-(CH2)s-C(O)- или -N(R5)-C(O)-;
p представляет собой 1-10;
q представляет собой 2-4;
s представляет собой 1-10;
t представляет собой 1-10; и
Z представляет собой аналог соматостатина,
или его фармацевтически приемлемой соли.
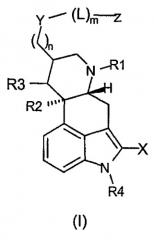
В другом аспекте изобретение относится к химерному соединению дофамина-соматостатина формулы (II),
где:
X представляет собой H, Cl, Br, I, F, -CN или C1-5алкил;
R1 представляет собой C1-4алкил, H, аллил, алкенил или -CN;
R2 и R3 оба независимо представляют собой H или отсутствуют, причем если R2 и R3 отсутствуют, между атомами углерода, к которым они присоединены, присутствует двойная связь;
R4 представляет собой H или -CH3;
R5 представляет собой C1-5алкильную группу или группу формулы -(CH2)rN(CH3)q;
Y представляет собой -O-, -C(O)-, -S-, -SC(O)-, -OC(O)-, -N(R6)-C(O)-, -N(R7)- или -N(R8)-(CH2)s-C(O)-;
R6, R7, R8, R9 и R10 каждый независимо представляет собой H или C1-5алкил;
L представляет собой -(CH2)p-C(O)-, когда Y представляет собой -S-, -O- или -N(R7)-;
L представляет собой -C(O)-(CR9R10)q-C(O)-, когда Y представляет собой -N(R7)-, -O- или -S-;
L представляет собой -(Doc)t-, где Y представляет собой -C(O)-, SC(O)-, -OC(O)-, -N(R8)-(CH2)s-C(O)- или -N(R6)-C(O)-;
m представляет собой 0 или 1;
n представляет собой 2-10;
r представляет собой 1-8;
q представляет собой 2-4;
p представляет собой 1-10;
s представляет собой 1-10;
t представляет собой 1-10; и
Z представляет собой аналог соматостатина,
или его фармацевтически приемлемой соли.
В одном из осуществлений изобретение относится к соединению формулы:
Caeg=N-(2-аминоэтил)-N-(2-цитозинил-1-оксоэтил)глицин
AEPA=4-(2-аминоэтил)-1-карбоксиметилпиперазин
или к его фармацевтически приемлемой соли.
В другом осуществлении изобретение относится к соединению формулы:
или к его фармацевтически приемлемой соли.
В одном из аспекте изобретение относится к способу индукции эффекта агониста дофаминового рецептора у нуждающегося в этом субъекта, где указанный способ включает введение указанному субъекту эффективного количества соединения формулы (I) или формулы (II), или его фармацевтически приемлемой соли. В предпочтительном осуществлении данного аспекта соединение выбирают из конкретно описываемых соединений.
В другом аспекте изобретение относится к способу индукции эффекта агониста соматостатинового рецептора у нуждающегося в этом субъекта, где указанный способ включает введение указанному субъекту эффективного количества соединения формулы (I) или формулы (II), или его фармацевтически приемлемой соли. В предпочтительном осуществлении данного аспекта соединение выбирают из конкретно описываемых соединений.
В другом аспекте изобретение относится к способу одновременной индукции эффекта агониста дофаминового рецептора и эффекта агониста соматостатинового рецептора у нуждающегося в этом субъекта, где указанный способ включает введение указанному субъекту эффективного количества соединения формулы (I) или формулы (II), или его фармацевтически приемлемой соли. В предпочтительном осуществлении данного аспекта соединение выбирают из конкретно описываемых соединений.
В другом аспекте изобретение относится к фармацевтической композиции, содержащей эффективное количество соединения формулы (I) или формулы (II), или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. В предпочтительном осуществлении данного аспекта соединение выбирают из конкретно описываемых соединений.
В другом аспекте изобретение относится к способу лечения у субъекта заболевания или состояния, причем указанный способ включает введение указанному субъекту терапевтически эффективного количества соединения формулы (I) или формулы (II), или его фармацевтически приемлемой соли, где указанное заболевание выбрано из перечня, состоящего из рака легких, глиомы, анорексии, гипотиреоза, гиперальдостеронизма, пролиферации H. pylori, акромегалии, рестеноза, болезни Крона, системного склероза, внешних и внутренних панкреатических псевдоцист и асцитов, випомы, гиперплазии островковых клеток поджелудочной железы, гиперинсулинизма, гастриномы, синдрома Золлингера-Эллисона, диарреи, связанной со СПИД диарреи, связанной с химиотерапией диарреи, склеродермы, синдрома раздраженной толстой кишки, панкреатита, обструкции тонкого кишечника, желудочно-пищеводного рефлюкса, дуоденогастрального рефлюкса, синдрома Кушинга, гонадотропиномы, гиперпаратиреоидизма, базедовой болезни, диабетической невропатии, болезни Педжета, поликистоза яичника, рака щитовидной железы, гепатомы, лейкоза, менингиомы, кахексии при злокачественной опухоли, ортостатической гипотензии, послеобеденной гипотензии, острого тревожного состояния с реакцией паники, секретирующих GH аденом, акромегалии, секретирующих TSH аденом, секретирующих пролактин аденом, инсулиномы, глюкагономы, сахарного диабета, гиперлипидемии, нечувствительности к инсулину, синдрома Тернера, ангиопатии, пролиферативной ретинопатии, феномена «восходящего солнца», нефропатии, гиперсекреции кислоты желудка, пептических язв, кишечного свища, панкреатического свища, демпинг-синдрома, синдром водянистой диареи, панкреатита, секретирующий гастроинтестинальные гормоны опухоли, ангиогенеза, артрита, отторжения аллотрансплантата, кровотечения из сосудов трансплантата, портальной гипертезии, желудочно-кишечного кровотечения, ожирения и передозировки опиоидов. В предпочтительном осуществлении данного аспекта соединение выбирают из конкретно описанных здесь соединений. В более предпочтительном осуществлении данного аспекта изобретения указанное заболевание или состояние представляет собой акромегалию.
В особенно предпочтительном осуществлении каждого из следующих способов соединение выбирают из списка соединений, состоящего из соединений от соединения A до соединения K, или из списка соединений, состоящего из соединений от примера L до примера V, как описано ниже в разделе под заголовком «Синтез химерных соединений соматостатина-дофамина».В другом аспекте изобретение относится к агонисту дофамина формулы (I) или формулы (II), приведенных выше, где аналог соматостатина «z» заменен группой, включающей -H, -OH, (C1-C6)алкокси, арилалкокси, (например, бензилом, замещенным бензилом и подобным), -NH2, -NR9R10, где R9 и R10 определены в формуле (II). В предпочтительном осуществлении данного аспекта указанный агонист дофамина выбирают из компонентов дофаминовой группы описываемых химерных соединений дофамина-соматостатина или их фармацевтически приемлемой соли. В наиболее предпочтительном осуществлении данного аспекта указанный агонист дофамина представляет собой:
или их фармацевтически приемлемую соль.
Подробное описание изобретения
Предполагается, что специалист в данной области может, основываясь на приведенном описании, применять настоящее изобретение в полнейшей степени. Поэтому подразумевается, что следующие конкретные осуществления являются сугубо иллюстративными и никоим образом не ограничивают остальной части изобретения.
Кроме иначе определенных случаев, все используемые в данном описании технические и научные термины имеют то же самое значение, которое обычно подразумевается обычным специалистом в данной области, к которой относится данное изобретение. Кроме того, все публикации, патентные заявки, патенты и другие, приведенные в данном описании источники информации, включены в данное описание во всей своей полноте посредством ссылки.
Выделены различные рецепторы соматостатина (SSTR), например, SSTR-1, SSTR-2, SSTR-3, SSTR-4 и SSTR-5. Таким образом, агонист соматостатина может быть агонистом SSTR-1, агонистом SSTR-2, агонистом SSTR-3, агонистом SSTR-4 или агонистом SSTR-5, и при этом относиться к одному или нескольким из указанных типов. Это означает, что, например, агонист рецептора соматостатина типа 2 (т.е. агонист SSTR-2) представляет собой соединение, которое имеет высокую аффинность связывания (например, Ki менее 100 нМ, или предпочтительно менее 10 нм, или более предпочтительно менее 1 нМ) с SSTR-2 (что, например, определено посредством анализа связывания рецептора, описанного ниже). Под селективным агонистом соматостатинового рецептора типа 2, например, подразумевается агонист соматостатинового рецептора типа 2, который обладает более высокой аффинностью связывания (например, более низкой Ki) с SSTR-2, чем с любым другим соматостатиновым рецептором.
В одном из осуществлений агонист SSTR-2 также представляет собой селективный агонист SSTR-2. Примеры агонистов SSTR-2, которые могут использоваться для осуществления настоящего изобретения на практике, включают в качестве неограничивающих примеров:
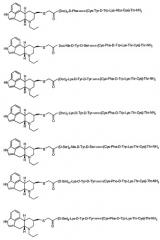
D-Nal-цикло[Cys-Tyr-D-Trp-Lys-Val-Cys]-Thr-NH2;
цикло[Tic-Tyr-D-Trp-Lys-Abu-Phe];
4-(2-гидроксиэтил)-1-пиперазинилацетил-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Abu-Cys)-Thr-NH2 и
4-(2-гидроксиэтил)-1-пиперазин-2-этансульфонил-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Abu-Cys)-Thr-NH2.
Дальнейшими примерами агонистов соматостатина являются те, что охватываются формулами, или те, что конкретно цитированы в приведенных ниже публикациях, каждая из которых включена в данное описание во всей своей полноте в качестве ссылки.
Заявка на выдачу Европейского патента №P5 164 EU (автор изобретения: G. Keri);
Van Binst, G. et al. Peptide Research 5: 8 (1992);
Horvath, A. et al. Abstract, "Conformations of Somatostatin Analogs Having Antitumor Activity", 22nd European peptide Symposium, September 13-19, 1992, Interlaken, Switzerland;
Заявка PCT №WO 91/09056 (1991);
Заявка на выдачу Европейского патента №0 363 589 A2 (1990);
Патент США №4904642 (1990);
Патент США №4871717 (1989);
Патент США №4853371 (1989);
Патент США №4725577 (1988);
Патент США №4684620 (1987);
Патент США №4650787 (1987);
Патент США №4603120 (1986);
Патент США №4585755 (1986);
Заявка на выдачу Европейского патента №0 203 031 A2 (1986);
Патент США №4522813 (1985);
Патент США №4486415 (1984);
Патент США №4485101 (1984);
Патент США №4435385 (1984);
Патент США №4395403 (1983);
Патент США №4369179 (1983);
Патент США №4360516 (1982);
Патент США №4358439 (1982);
Патент США №4328214 (1982);
Патент США №4316890 (1982);
Патент США №4310518 (1982);
Патент США №4291022 (1981);
Патент США №4238481 (1980);
Патент США №4235886 (1980);
Патент США №4224199 (1980);
Патент США №4211693 (1980);
Патент США №4190648 (1980);
Патент США №4146612 (1979);
Патент США №4133782 (1979);
Патент США №5506339 (1996);
Патент США №4261885 (1981);
Патент США №4728638 (1988);
Патент США №4282143 (1981);
Патент США №4215039 (1980);
Патент США №4209426 (1980);
Патент США №4190575 (1980);
Европейский патент №0 389 180 (1990);
Заявка на выдачу Европейского патента №0 505 680 (1982);
Заявка на выдачу Европейского патента №0 083 305 (1982);
Заявка на выдачу Европейского патента №0 030 920 (1980);
Заявка PCT №WO 88/05052 (1988);
Заявка PCT №WO 90/12811 (1990);
Заявка PCT №WO 97/01579 (1997);
Заявка PCT №WO 91/18016 (1991);
Заявка на выдачу патента Великобритании №GB 2095261 (1981); и
Заявка на выдачу патента Франции №FR 2522655 (1983).
Необходимо отметить, что для всех описываемых агонистов соматостатина каждый аминокислотный остаток представляет собой структуру -NH-C(R)H-CO-, в которой R представляет собой боковую цепь (например, CH3 для Ala). Линии между аминокислотными остатками представляют собой пептидные связи, которые соединяют аминокислоты. Также, в случае, где аминокислотный остаток оптически активен, он находится в конфигурации L-формы, которая подразумевается, если D-форма специально не обозначена. Для простоты дисульфидные связи (например, дисульфидный мостик), существующие между двумя свободными тиолами остатков Cys не показаны. Обозначения обычных аминокислот приводятся согласно рекомендациям IUPAC-IUB.
Синтез агонистов соматостатина
Способы синтеза пептидных агонистов соматостатина хорошо описаны в литературе и находятся в компетенции обычного специалиста в данной области. Например, пептиды синтезируют на амидной MBHA-смоле Rink (смола 4-(2',4'-диметоксифенил-Fmoc-аминометил)феноксиацетамидонорлейцил-MBHA) с использованием стандартного протокола твердофазного синтеза Fmoc-химии. Комплекс пептид-смола со свободной функциональной аминогруппой на N-конце затем обрабатывают соответствующим соединением, содержащим дофаминовую группу. Конечный продукт отщепляют от смолы смесью TFA/вода/триизопропилсилан (TIS).
Например, синтез H-D-Phe-Phe-Phe-D-Trp-Lys-Thr-Phe-Thr-NH2 может быть осуществлен, следуя методике, указанной в примере I заявки на выдачу Европейского патента 0 395 417 A1. Синтез агонистов соматостатина с замещенным N-концом, например, может быть осуществлен, следуя методике, указанной в публикации заявки PCT №WO 88/02756, публикации заявки PCT №WO 94/04752, и/или в заявке на выдачу Европейского патента 0 329 295.
Пептиды могут быть и были циклизованы с использованием раствора йода в смеси MeOH/вода и очищены на C18 препаративной ВЭЖХ с обращенной фазой с использованием буферов ацетонитрил-0,1% TFA/вода-0,1% TFA. Гомогенность оценивали аналитической ВЭЖХ и масс-спектрометрии, и определили, что она составляла >95% для каждого пептида.
Некоторые редкие аминокислоты приобретали у следующих торговых компаний:
Fmoc-Doc-OH и Fmoc-AEPA приобретали у Chem-Impex International, Inc. (Wood Dale, Иллинойс, США). Fmoc-Caeg(Bhoc)-OH приобретали у PerSeptive Biosystems (Framingham, Массачусетс, США). Bhoc обозначает бензгидрилоксикарбонил.
Синтез агонистов дофамина
Способы синтеза многих агонистов дофамина также хорошо описаны в литературе и находятся в компетенции обычного специалиста в данной области. Дальнейшие методики синтеза представлены следующими схемами реакций и примерами.
Синтез химерных соединений соматостатина-дофамина
Химерные соединения соматостатина могут быть синтезированы по следующим схемам реакций и примерам. Исходный продукт и промежуточные продукты соединений (I), (II) и (III), отображенные на схеме I, II и III, соответственно, коммерчески доступны или их получают по литературным источникам; Pharmazie 39, 537 (1984); Collect Czech. Chem. Commun. 33, 577 (1966); Helv. Chim. Acta 32, 1947, (1949); патент США 5097031; патент США 3901894; EP 0003667; патент США 4526892. Синтез пептидов находится в компетенции специалиста в данной области и, в любом случае, легко доступен из литературы. См., например, Stewart et al., Solid Phase Synthesis, Pierce Chemical, 2nd Ed. 1984; G.A. Grant; Synthetic peptide. WH., Freenand Co., New York, 1992; M. Bodenszky, A. Bodanszky, The Practice of Peptide Synthesis. Spring Venlag. N. Y. 1984.
Получение соединения A:
Соединение 8 (3 экв.) смешивают с H-(Doc)3-D-Phe-Cys(Acm)-Tyr(tBu)-D-Trp(Boc)-Lys(Boc)-Abu-Cys(Acm)-Thr(tBu)-амидной MBHA-смолой Rink (1 экв.), HBTU (2,9 экв.), HOBt (3,0 экв.) и DIEA (6 экв.) в DMF. Смесь встряхивают при комнатной температуре в течение 4 часов. Смолу промывают DMF и DCM и сушат при пониженном давлении досуха. Сухую смолу обрабатывают смесью TFA/TIS/вода (92/5/3, об./об.) в течение 1 ч при комнатной температуре. Раствор фильтруют и концентрируют. К концентрированному раствору добавляют холодный простой эфир. Осадок собирают и растворяют в системе растворителей вода-метанол. К раствору добавляют раствор йода в метаноле до появления бурой окраски. Затем раствор выдерживают при комнатной температуре в течение 1 часа. К раствору добавляют водный раствор Na2S2О3 до исчезновения бурой окраски. Полученный в результате раствор очищают с использованием C18 препаративной ВЭЖХ с обращенной фазой, элюируя линейным градиентом смеси буфер A (1% TFA в воде)/буфер B (1% TFA в CH3CN). Фракции проверяют аналитической ВЭЖХ. Фракции, содержащие чистое требуемое соединение, объединяют и лиофилизируют досуха. Молекулярную массу соединения измеряют, используя MS, сопряженной с источником электроспрея.
Получение соединения B:
Соединение 12, где R1 представляет собой н-пропил, (1,5 экв.) смешивают с H-D-Phe-Cys(Acm)-Tyr(tBu)-D-Trp(Boc)-Lys(Boc)-Abu-Cys(Acm)-Thr(tBu)-амидной MBHA-смолой Rink (1 экв.) и DIEA (2 экв.) в DMF. Смесь встряхивают при комнатной температуре в течение 5 часов. Смолу промывают DMF и DCM и сушат при пониженном давлении досуха. Сухую смолу обрабатывают смесью TFA/TIS/вода (92/5/3, об./об.) в течение 1 ч при комнатной температуре. Раствор фильтруют и концентрируют. К концентрированному раствору добавляют холодный простой эфир. Осадок собирают и растворяют в системе растворителей вода-метанол. К раствору добавляют раствор йода в метаноле до появления бурой окраски. Затем раствор выдерживают при комнатной температуре в течение 1 часа. К раствору добавляют водный раствор Na2S2О3 до исчезновения бурой окраски. Полученный в результате раствор очищают с использованием C18 препаративной ВЭЖХ с обращенной фазой, элюируя линейным градиентом смеси буфер A (1% TFA в воде)/буфер B (1% TFA в CH3CN). Фракции проверяют аналитической ВЭЖХ. Фракции, содержащие чистое требуемое соединение, объединяют и лиофилизируют досуха. Молекулярную массу соединения измеряют, используя MS, сопряженной с источником электроспрея.
Получение соединения C:
Соединение 11, где R1 представляет собой н-пропил, (1,5 экв.) смешивают с H-AEPA-D-Phe-Cys(Acm)-Tyr(tBu)-D-Trp(Boc)-Lys(Boc)-Abu-Cys(Acm)-Thr(tBu)-амидной MBHA-смолой Rink (1 экв.) и DIEA (2 экв.) в DMF. Смесь встряхивают при комнатной температуре в течение 5 часов. Смолу промывают DMF и DCM и сушат при пониженном давлении досуха. Сухую смолу обрабатывают смесью TFA/TIS/вода (92/5/3, об./об.) в течение 1 ч при комнатной температуре. Раствор фильтруют и концентрируют. К концентрированному раствору добавляют холодный простой эфир. Осадок собирают и растворяют в системе растворителей вода-метанол. К раствору добавляют раствор йода в метаноле до появления бурой окраски. Затем раствор выдерживают при комнатной температуре в течение 1 часа. К раствору добавляют водный раствор Na2S2О3 до исчезновения бурой окраски. Полученный в результате раствор очищают с использованием C18 препаративной ВЭЖХ с обращенной фазой, элюируя линейным градиентом смеси буфер A (1% TFA в воде)/буфер B (1% TFA в CH3CN). Фракции проверяют аналитической ВЭЖХ. Фракции, содержащие чистое требуемое соединение, объединяют и лиофилизируют досуха. Молекулярную массу соединения измеряют, используя MS, сопряженной с источником электроспрея.
Получение соединения D:
Соединение 25 (3 экв.) смешивают с H-Doc-D-Phe-Cys(Acm)-Tyr(tBu)-D-Trp(Boc)-Lys(Boc)-Abu-Cys(Acm)-Thr(tBu)-амидной MBHA-смолой Rink (1 экв.), HBTU (2,9 экв.), HOBt (3,0 экв.) и DIEA (6 экв.) в DMF. Смесь встряхивают при комнатной температуре в течение 4 часов. Смолу промывают DMF и DCM и сушат при пониженном давлении досуха. Сухую смолу обрабатывают смесью TFA/TIS/вода (92/5/3, об./об.) в течение 1 ч при комнатной температуре. Раствор фильтруют и концентрируют. К нему добавляют холодный простой эфир, осадок собирают и растворяют в системе растворителей вода-метанол. К раствору добавляют раствор йода в метаноле до появления бурой окраски. Затем раствор выдерживают при комнатной температуре в течение 1 часа. К раствору добавляют водный раствор Na2S2О3 до исчезновения бурой окраски. Полученный в результате раствор очищают с использованием C18 препаративной ВЭЖХ с обращенной фазой, элюируя линейным градиентом смеси буфер A (1% TFA в воде)/буфер B (1% TFA в CH3CN). Фракции проверяют аналитической ВЭЖХ. Фракции, содержащие чистое требуемое соединение, объединяют и лиофилизируют досуха. Молекулярную массу соединения измеряют, используя MS, сопряженной с источником электроспрея.
Получение соединения Е:
Соединение 26 (3 экв.) смешивают с H-(D-Ser(tBu))5-Lys(Boc)-D-Tyr(tBu)-D-Tyr(tBu)-Cys(Acm)-Tyr(tBu)-D-Trp(Boc)-Lys(Boc)-Val-Cys(Acm)-Trp(Boc)-амидной MBHA-смолой Rink (1 экв.), HBTU (2,9 экв.), HOBt (3,0 экв.) и DIEA (6 экв.) в DMF. Смесь встряхивают при комнатной температуре в течение 4 часов. Смолу промывают DMF и DCM и сушат при пониженном давлении досуха. Сухую смолу обрабатывают смесью TFA/TIS/вода (92/5/3, об./об.) в течение 1 ч при комнатной температуре. Раствор фильтруют и концентрируют. К концентрированному раствору добавляют холодный простой эфир. Осадок собирают и растворяют в системе растворителей вода-метанол. К раствору добавляют раствор йода в метаноле до появления бурой окраски. Затем раствор выдерживают при комнатной температуре в течение 1 часа. К раствору добавляют водный раствор Na2S2О3 до исчезновения бурой окраски. Полученный в результате раствор очищают с использованием C18 препаративной ВЭЖХ с обращенной фазой, элюируя линейным градиентом буфер A (1% TFA в воде)/буфер B (1% TFA в CH3CN). Фракции проверяют аналитической ВЭЖХ. Фракции, содержащие чистое требуемое соединение, объединяют и лиофилизируют досуха. Молекулярную массу соединения измеряют, используя MS, сопряженной с источником электроспрея.
Получение соединения F:
Этил [6-метил-8β-эрголинилметил]тиоацетат
К раствору дигидролизергола (240 мг) в 10 мл пиридина добавляли 250 мкл метансульфонилхлорида. После перемешивания при комнатной температуре в течение 2 часов, реакционную смесь выливали в 100 мл воды, экстрагировали хлороформом (2×20 мл). Органический слой промывали водой, затем сушили над MgSO4 и удаляли растворитель в вакууме досуха с получением 140 мг бледно-коричневого твердого ве