Способ и промежуточные продукты для получения пиридазиноновых антидиабетических средств
Иллюстрации
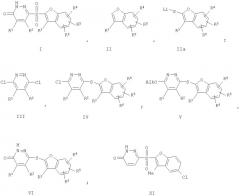
Показать всеНастоящее изобретение относится к способу получения соединения формулы I, где R1 и R2 независимо друг от друга представляют собой водород или метил; и R3, R4, R5 и R6 независимо друг от друга представляют собой Н, галоген, формил, (С1-С6)алкил, необязательно замещенный атомами фтора в количестве до трех, (С1-С6)алкокси, необязательно замещенный атомами фтора в количестве до трех, (С1-С6)алкоксикарбонил, (С1-С6)алкиленилоксикарбонил, (С1-С4)алкокси-(С1-С4)алкил, (С1-С4)алкилкарбониламидо, (С3-С7)циклоалкилкарбониламидо, фенилкарбониламидо, бензил, фенил или нафтил, где бензил, фенил и нафтил необязательно независимо друг от друга замещены заместителями в количестве до двух, независимо выбранными из галогена, (С1-С6)алкила, необязательно замещенного атомами фтора в количестве до трех, (С1-С6)алкокси, необязательно замещенного атомами фтора в количестве до трех, и (С1-С4)алкокси-(С1-С4)алкила. Предложенный способ включает последовательные стадии: а) взаимодействие соединения формулы II, где R3, R4, R5 и R6 независимо определены, как указано выше, с литийорганическим соединением в присутствии источника серы в первом реакционном инертном растворителе с образованием реакционноспособного промежуточного соединения IIa; b) взаимодействие указанного реакционноспособного промежуточного соединения IIa с соединением формулы III с образованием соединения формулы IV; с) взаимодействие указанного соединения формулы IV со щелочным (С1-С2)алкоксидом в (C1-С2)алканоле с образованием производного простого эфира формулы V, где Alk является (C1-С2)алкилом; d) взаимодействие указанного соединения формулы V с минеральной кислотой с образованием соединения формулы VI; и е) окисление соединения формулы VI во втором реакционном инертном растворителе с образованием соединения формулы I. Полученные пиридазиноновые соединения являются ингибиторами альдозоредуктазы и применимы при профилактике и/или лечении осложнений диабета, таких как диабетическая невропатия, диабетическая ретинопатия, диабетическая нефропатия, диабетическая кардиомиопатия, диабетическая микроангиопатия и диабетическая макроангиопатия у млекопитающих. Изобретение относится также и к новым промежуточным соединениям формулы IV, применимым при получении указанных ингибиторов альдозоредуктазы, к способу получения соединения формулы IV и способу получения предпочтительного пиридазинового соединения формулы IX. 4 н. и 6 з.п. ф-лы.
Реферат
Настоящее изобретение относится к способу получения сульфонилпиридазиноновых ингибиторов альдозоредуктазы. Настоящее изобретение относится также к новым промежуточным соединениям, используемым в способе получения указанных ингибиторов альдозоредуктазы. Соответственно, соединения, полученные способом согласно изобретению, снижают уровни сорбита и, следовательно, снижают уровни фруктозы и находят применение при лечении и/или профилактике осложнений диабета, таких как диабетическая невропатия, диабетическая ретинопатия, диабетическая нефропатия, диабетическая кардиомиопатия, диабетическая микроангиопатия и диабетическая макроангиопатия у млекопитающих.
Фермент альдозоредуктаза вовлечен в регуляцию снижения альдоз, таких как глюкоза и галактоза, и их соответствующих полиолов, таких как сорбит и галактит. Сульфонилпиридазиноновые соединения формулы I согласно изобретению, пролекарства таких соединений и фармацевтически приемлемые соли таких соединений и пролекарств применимы в качестве ингибиторов альдозоредуктазы при лечении и профилактике осложнений диабета у людей и других млекопитающих, связанных с повышенными уровнями полиола в некоторых тканях (например, в нервной ткани, почках, хрусталиках глаза и ретинальной ткани).
Заявка на патент США № 60/280051, находящаяся на предварительном рассмотрении и включенная в данное описание в качестве ссылки, раскрывает соединения формулы
где: А, R1, R2 и R3 являются такими, как они определены в данном описании.
Данное изобретение относится к способу получения соединений формулы
где R1 и R2 независимо друг от друга представляют собой водород или метил; и R3, R4, R5 и R6 независимо друг от друга представляют собой Н, галоген, формил, (С1-С6)алкил, необязательно замещенный атомами фтора в количестве до трех, (C1-C6)алкокси, необязательно замещенный атомами фтора в количестве до трех, (С1-С6)алкоксикарбонил, (С1-С6)алкиленилоксикарбонил, (С1-С4)алкокси-(С1-С4)алкил, (С1-С4)алкилкарбониламидо, (С3-С7)циклоалкилкарбониламидо, фенилкарбониламидо, бензил, фенил или нафтил, где бензил, фенил и нафтил необязательно независимо друг от друга замещены заместителями в количестве до двух, независимо выбранными из галогена, (С1-С6)алкила, необязательно замещенного атомами фтора в количестве до трех, (С1-С6)алкокси, необязательно замещенного атомами фтора в количестве до трех, и (С1-С4)алкокси-(С1-С4)алкила.
включающему последовательные стадии:
а) взаимодействие соединения формулы
где: каждый из R3, R4, R5 и R6 независимо определен, как указано выше, с литийорганическим соединением в присутствии источника серы в первом реакционном инертном растворителе с образованием реакционноспособного промежуточного соединения
в) взаимодействие указанного реакционноспособного промежуточного соединения IIa с соединением формулы
с образованием соединения формулы
с) взаимодействие указанного соединения формулы IV со щелочным (С1-С2)алкоксидом в (С1-С2)алканоле с образованием производного простого эфира формулы
где Alk является (С1-С2)алкилом;
d) взаимодействие указанного соединения формулы V с минеральной кислотой с образованием соединения формулы
и
е) окисление соединения формулы VI во втором реакционном инертном растворителе с образованием соединения формулы I.
В предпочтительном способе данного изобретения стадию (с) и стадию (d) осуществляют вместе in situ. В дополнительном предпочтительном способе данного изобретения на стадии (а) указанное литийорганическое соединение представляет собой н-бутиллитий, первый реакционный инертный растворитель представляет собой тетрагидрофуран и дополнительным источником серы является S8; на стадии (с) указанный щелочной (С1-С2)алкоксид представляет собой метоксид натрия и указанный (С1-С2)алканол представляет собой метанол; и на стадии (d) соединение формулы VI окисляется комплексом мочевина - пероксид водорода в присутствии трифторуксусного ангидрида и второй реакционный инертный растворитель представляет собой тетрагидрофуран.
В еще одном предпочтительном способе данного изобретения R3, R4, R5 и R6 независимо друг от друга представляют собой водород, метил, метокси, хлор, фтор, этил, 4-фторфенил, трифторметил, изопропил или фенил. В другом предпочтительном способе данного изобретения R1, R2, R4 и R5 независимо друг от друга представляют собой водород; R3 является 3-метилом и R6 является 5-хлором.
Изобретение относится также к соединениям формулы
и к их фармацевтически приемлемым солям, где R1 и R2 независимо друг от друга представляют собой водород или метил; и R3, R4, R5 и R6 независимо друг от друга представляют собой Н, галоген, формил, (C1-C6)алкил, необязательно замещенный атомами фтора в количестве до трех, (C1-C6) алкокси, необязательно замещенный атомами фтора в количестве до трех, (C1-С6)алкоксикарбонил, (C1-C6)алкиленилоксикарбонил, (C1-C4)алкокси-(C1-C4) алкил, (C1-C4) алкилкарбониламидо, (С3-С7)циклоалкилкарбониламидо, фенилкарбониламидо, бензил, фенил или нафтил, где бензил, фенил и нафтил необязательно независимо друг от друга замещены заместителями в количестве до двух, независимо выбранными из галогена, (C1-С6)алкила, необязательно замещенного атомами фтора в количестве до трех, (C1-C6)алкокси, необязательно замещенного атомами фтора в количестве до трех, и (C1-C4)алкокси-(С1-С4)алкила.
Предпочтительная группа соединений формулы IV данного изобретения представляет собой соединения, обозначенные как группа А, и их фармацевтически приемлемые соли, где R3, R4, R5 и R6 независимо друг от друга представляют собой водород, метил, метокси, хлор, фтор, этил, 4-фторфенил, трифторметил, изопропил или фенил.
Предпочтительное соединение данного изобретения представляет собой соединение, где R1, R2, R4 и R5 независимо друг от друга представляют собой водород; R3 представляет собой 3-метил и R6 представляет собой 5-хлор, со структурной формулой
Данное изобретение относится также к способу получения соединения вышеуказанной формулы IV, где R1 и R2 независимо друг от друга представляют собой водород или метил; и R3, R4, R5 и R6 независимо друг от друга представляют собой Н, галоген, формил, (С1-С6)алкил, необязательно замещенный атомами фтора в количестве до трех, (C1-C6)алкокси, необязательно замещенный атомами фтора в количестве до трех, (С1-С6)алкоксикарбонил, (С1-С6)алкиленилоксикарбонил, (С1-С4)алкокси-(С1-С4)алкил, (С1-С4)алкилкарбониламидо, (С3-С7)циклоалкилкарбониламидо, фенилкарбониламидо, бензил, фенил или нафтил, где бензил, фенил и нафтил необязательно независимо друг от друга замещены заместителями в количестве до двух, независимо выбранными из галогена, (C1-С6)алкила, необязательно замещенного атомами фтора в количестве до трех, (C1-C6) алкокси, необязательно замещенного атомами фтора в количестве до трех, и (C1-C4) алкокси-(C1-С4)алкила;
включающему последовательные стадии:
а) взаимодействие соединения формулы II, где R3, R4, R5 и R6 независимо друг от друга определены, как указано выше, с литийорганическим соединением в присутствии источника серы в реакционном инертном растворителе с образованием реакционноспособного промежуточного соединения формулы IIa; и
в) взаимодействие указанного реакционноспособного промежуточного соединения IIa с соединением формулы III с образованием соединения формулы IV.
В данном способе предпочтительно литийорганическое соединение представляет собой н-бутиллитий, указанный реакционный инертный растворитель представляет собой тетрагидрофуран и источник серы является S8. В особенности предпочтительно R3, R4, R5 и R6 независимо друг от друга представляют собой водород, метокси, хлор, фтор, этил, 4-фторфенил, трифторметил, изопропил или фенил. Еще более предпочтительно R1, R2, R4 и R5 независимо друг от друга представляют собой водород; R3 представляет собой 3-метил и R6 представляет собой 5-хлор.
Данное изобретение относится также к способу получения соединения формулы
включающему последовательные стадии:
а) взаимодействие соединения формулы
с н-бутиллитием в присутствии S8 в тетрагидрофуране с образованием реакционноспособного промежуточного соединения
в) взаимодействие указанного реакционноспособного промежуточного соединения XIIa с соединением формулы
с образованием соединения формулы
с) взаимодействие соединения формулы XIV c метоксидом натрия в метаноле с образованием соединения формулы
d) взаимодействие указанного соединения формулы XV с концентрированной хлористо-водородной кислотой с образованием соединения формулы
е) окисление указанного соединения формулы XVI комплексом пероксид водорода - мочевина в присутствии трифторуксусного ангидрида в тетрагидрофуране с образованием соединения формулы XI. В особенности предпочтительно, чтобы стадия (с) и стадия (d) осуществлялись in situ.
Предложенное изобретение включает также меченые изотопами соединения, которые идентичны соединениям, соответствующим формуле IV, но в действительности один или более атомов водорода замещены атомом, имеющим атомную массу или массовое число, отличающиеся от атомной массы или массового числа, встречающихся в природе. Примеры изотопов, которые могут быть включены в соединения изобретения, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, такие как 2Н, 3Н, 13С, 14С, 15N, 18О, 17О, 31Р, 32Р, 35S, 18F и 36Cl соответственно. Соединения формулы IV настоящего изобретения, их пролекарства и фармацевтически приемлемые соли указанных соединений или пролекарств, которые содержат вышеназванные изотопы и/или другие изотопы других атомов, входят в объем притязаний данного изобретения. Некоторые меченые изотопами соединения настоящего изобретения, например такие, в которые включены радиоактивные изотопы, такие как 3Н или 14С, применимы в анализах распределения лекарственного вещества и/или субстрата в ткани. Тритированные, т. е. 3Н и углерод-14, т.е. 14С, изотопы являются в особенности предпочтительны вследствие простоты их получения и обнаружения. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2Н, может дать определенные терапевтические преимущества вследствие большей метаболической устойчивости, например за счет увеличения периода полураспада in vivo, или вследствие уменьшения требований к схеме приема лекарственного средства, и, следовательно, может быть предпочтительным при некоторых обстоятельствах. Меченые изотопами соединения формулы IV данного изобретения и их пролекарства могут быть обычно получены согласно приведенным схемам реакции и/или представленным ниже примерам, путем замещения легкодоступного меченого изотопом реагента на реагент, не меченый изотопом. Данное изобретение включает также способы данного изобретения, в которых используются меченые изотопами соединения, раскрытые в данном описании.
Термин «галоген» означает хлор, бром, иод или фтор.
Термин «алкил» означает насыщенный углеводород с прямой или разветвленной цепью или разветвленный насыщенный углеводород. Примеры таких алкильных групп (предполагается, что обозначенная длина охватывает конкретный пример) представляют собой метил, этил, пропил, изопропил, бутил, втор-бутил, трет.-бутил, пентил, изопентил, неопентил, трет.-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, гексил, изогексил, гептил и октил.
Термин «алкокси» означает насыщенный алкил с прямой цепью или насыщенный алкил с разветвленной цепью, связанный посредством атома кислорода. Примеры таких алкоксильных групп (предполагается, что обозначенная длина охватывает конкретный пример) представляют собой метоксильную, этоксильную, пропоксильную, изопропоксильную, бутоксильную, изобутоксильную и трет.-бутоксильную группу. Термин «алкоксид» означает насыщенный алкил с прямой цепью или насыщенный алкил с разветвленной цепью, имеющий отрицательный заряд в кислороде. Примеры таких алкоксидных групп (предполагается, что обозначенная длина охватывает конкретный пример) представляют собой метоксид, этоксид, пропоксид, изопропоксид, бутоксид, изобутоксид и трет.-бутоксид.
Понятие «фармацевтически приемлемые соли» относится к фармацевтически приемлемой кислотно-аддитивной соли. Понятие «фармацевтически приемлемые кислотно-аддитивные соли» включает, но без ограничения, такие соли, как хлористоводородная, бромистоводородная, сульфатная, гидросульфатная, фосфатная, гидрофосфатная, дигидрофосфатная, ацетатная, сукцинатная, цитратная, метансульфонатная (мезилатная) и п-толуолсульфонатная (тозилатная) соли. В особенности предпочтительно соль представляет собой натриевую соль.
Фармацевтически приемлемые кислотно-аддитивные соли соединений данного изобретения могут быть легко получены взаимодействием свободной основной формы указанных соединений с соответствующей кислотой. Если соль является солью одноосновной кислоты (например, гидрохлорид, гидробромид, п-толуолсульфонат, ацетат), водородной формой двухосновной кислоты (например, гидросульфат, сукцинат) или диводородной формой трехосновной кислоты (например, дигидрофосфат, цитрат), используется по меньшей мере один молярный эквивалент и обычно молярный избыток кислоты. Однако если требуются такие соли, как сульфат, полусукцинат, гидрофосфат или фосфат, будут обычно использоваться соответствующие точные химические эквиваленты кислоты. Свободное основание и кислоту обычно объединяют в сорастворителе, из которого осаждается желаемая соль, или она может быть выделена концентрированием и/или добавлением осадителя. Они могут быть дополнительно очищены кристаллизацией из (С1-С6)спиртовых растворителей, таких как метанол, этанол или изопропанол, или из кетоновых растворителей, таких как ацетон, метилэтилкетон или метилизобутилкетон.
Использованные в описании понятия «реакционный инертный растворитель» и «инертный растворитель» относятся к растворителю или смеси растворителей, которые не взаимодействуют с исходными соединениями, регентами, промежуточными соединениями или продуктами и таким образом не оказывают неблагоприятного действия на выход целевого продукта.
Использованное в данном описании понятие «реакционноспособное промежуточное соединение» относится к соединению, которое образуется и не выделяется во время хода реакции. Реакционноспособное промежуточное соединение обычно представляет собой соединение, которое обычно не выделяется и которое «гасится» добавлением другого реагента, взаимодействующего с реакционноспособной частью реакционноспособного промежуточного соединения.
Термин «in situ», использованный в данном описании, указывает, что две стадии осуществляются в одном реакционном сосуде без выделения промежуточного соединения, которое, в случае необходимости, может быть выделено.
Гидраты и сольваты соединений также охватываются данным изобретением.
Специалистам в области химии также понятно, что некоторые соединения формулы I согласно изобретению могут находиться в таутомерной форме, т.е. два изомера находятся в быстроустанавливаемом равновесии друг с другом. Обычным примером таутомерии является кето-енольная таутомерия, т.е.
Примеры соединений, которые могут существовать в виде таутомеров, включают гидроксипиридины, гидроксипиримидины и гидроксихинолины. Специалистам в данной области, в частности, понятно, что пиридазиноны настоящего изобретения могут существовать в виде двух отдельных таутомеров, например:
В данной заявке таутомерные формы таких соединений обычно изображают и называют как пиридазинон. Однако специалистам в данной области понятно, что такие соединения могут быть также изображены и/или названы гидроксипиридазин. Специалистам понятны также другие примеры. Все такие таутомеры и их смеси включены в соединения, полученные способом данного изобретения.
Всякий раз, когда показана структура циклического радикала со связью, находящейся за пределами кольца и направленной внутрь кольца, специалистам в данной области понятно, что связь может быть присоединена к любому атому в кольце в доступном для связывания месте. Если циклический радикал представляет собой бициклический или трициклический радикал, связь может быть присоединена к любому атому в любом из колец в доступном для связывания месте. Так например,
охватывает любой или все из следующих радикалов:
Другие особенности и преимущества раскрываются в описании и формуле изобретения предлагаемого изобретения.
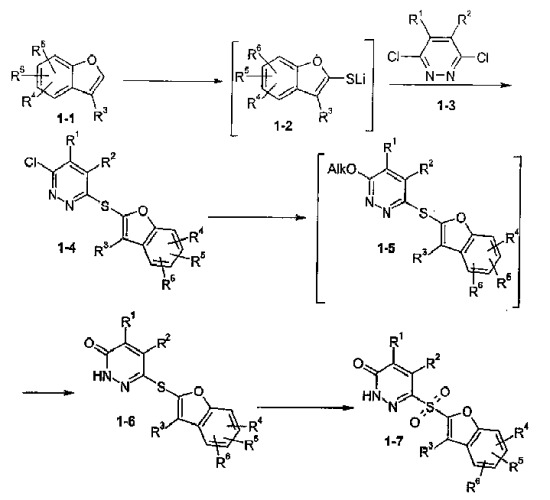
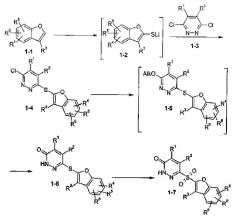
Соединения формулы IV (1-4 на схеме I) данного изобретения представляют собой промежуточные продукты синтеза сильнодействующих в отношении альдодозоредуктазы соединений формулы I. Известно, что соединение формулы I применимы при лечении осложнений диабета. Способ данного изобретения показан на схеме 1. Соединения формулы 1-4 данного изобретения обычно получают, как показано на схеме.
Схема 1
Как показано на схеме 1, соединение формулы 1-4 получают следующим образом.
К раствору соединения формулы 1-1 в реакционном инертном растворителе добавляют литийорганическое основание, такое как н-бутиллитий. Подходящие реакционные инертные растворители включают эфирные растворители, такие как диоксан, диэтиловый эфир и тетрагидрофуран. Другие подходящие литийорганические основания включают метиллитий, трет-бутиллитий и т.д. Реакционная смесь перемешивается при температуре от около -78°С до около 0°С в течение периода времени от около пяти минут до около пяти часов. Реакцию предпочтительно следует осуществлять в тетрагидрофуране при температуре около -40°С в течение одного часа. Затем образуют литийорганический промежуточный продукт 1-2 добавлением источника серы, такого как порошок серы (S8). Реакционная смесь перемешивается при температуре от около -78°С до около 0°С в течение периода времени от около одной минуты до около пяти часов и предпочтительно при температуре около -40°С в течение около пяти минут. Реакционная смесь нагревается до температуры от около -20°С примерно до комнатной температуры и предпочтительно до около 0°С в течение периода времени от около пяти минут до около одного часа и предпочтительно в течение около 30 минут. Добавляют раствор соединения формулы 1-3 в реакционном инертном растворителе, указанном выше, предпочтительно в тетрагидрофуране, и образовавшуюся смесь перемешивают при температуре от -20°С примерно до комнатной температуры и предпочтительно при 0°С. Реакционная смесь нагревается до комнатной температуры в течение периода времени от около одного часа до около пяти часов и предпочтительно в течение около двух часов. Затем реакционная смесь перемешивается при комнатной температуре предпочтительно в течение периода времени от одного до пяти часов и наиболее предпочтительно в течение одного часа. Желаемое соединение выделяют из реакционной смеси, следуя методике, описанной ниже в примере 1, или в соответствии с другими методиками, хорошо известными специалистам в данной области.
Как показано на схеме 1, соединение формулы 1-6 получают следующим образом. Соединение 1-4 растворяют в реакционном инертном растворителе, таком как (С1-С2)алканол, такой как метанол или этанол, и обрабатывают (С1-С1)алкоксидом, таким как метоксид натрия или этоксид натрия при температуре от около 40°С примерно до температуры перегонки раствора в течение периода времени от около трех часов до около двенадцати часов. Предпочтительно используют метоксид натрия в метаноле при температуре от около 50°С в течение около пяти часов. При указанных условиях образуется промежуточное соединение формулы 1-5, где Alk представляет собой (С1-С2)алкил, которое затем обрабатывают минеральной кислотой, предпочтительно концентрированной HCl, при температуре от около 40°С примерно до температуры перегонки в течение периода времени от около 8 часов до около 20 часов. Предпочтительно осуществляют кипячение с обратным холодильником реакционной смеси в течение около пятнадцати часов. Соединение формулы 1-6 выделяют из реакционной смеси, следуя методике, представленной ниже в примере 2, или в соответствии с другими методиками, хорошо известными специалистам в данной области.
Как показано на схеме 1, соединение формулы 1-7 получают следующим образом. Соединение формулы 1-6 растворяют в реакционной инертном растворителе, предпочтительно эфирном растворителе, таком так тетрагидрофуран, диэтиловый эфир или диоксан, и обрабатывают окислителем. Окислитель может представлять собой любой реагент, который способен окислять сульфанильную группу до сульфонильной группы, такой как пероксид водорода, мета-хлорпербензойная кислота и другие реагенты такого рода, хорошо известные специалистам в данной области. Предпочтительно используют комплекс мочевина - пероксид водорода, причем специалистам в данной области понятно, что в данном случае желательно использовать в реакции активирующий агент, такой как трифторуксусный ангидрид. Реакцию осуществляют в реакционном инертном растворителе, таком как тетрагидрофуран, диоксан или диэтиловый эфир, и предпочтительно в тетрагидрофуране. Реакцию осуществляют при температуре от около 0°С до около 35°С при нагревании примерно до комнатной температуры в течение периода времени от около тридцати минут до около пяти часов. Предпочтительно осуществляют реакцию при температуре от около 0°С до около 25°С и нагревании до комнатной температуры в течение около двух часов. Соединение формулы 1-7 выделяют из реакционной смеси, следуя методике, представленной ниже в примере 3, или в соответствии с другими методиками, хорошо известными специалистам в данной области.
Исходные соединения и реагенты для получения вышеуказанных соединений являются легкодоступными или могут быть легко синтезированы специалистами в данной области с использованием традиционных методов органического синтеза. Так, например, многие из соединений, использованных в данном описании, относятся к соединениям, встречающимся в природе, или получены из таких соединений, и представляют большой научный интерес и в таких соединениях имеется коммерческая потребность, многие такие соединения коммерчески доступны, или о них известно из литературы, или легко могут быть получены из других обычно доступных веществ методами, о которых сообщалось в литературе. В конкретном примере 5-хлор-3-метилбензофуран может быть получен в соответствии с методами, хорошо известными специалистами в данной области, или может быть приобретен у фирмы Amrutanjan (42-45, Luz Church Road, Mylapore, Chennai 600 004) или EMS Dottikon (CH-5606 Dottikon, Switzerland). 3,6-Дихлорпиридазин может быть получен известными методами или приобретен у фирмы Aldrich (P.O.Box 355, Milwauree, WI, 53201).
Все журнальные статьи, научные ссылки, патенты и опубликованные заявки на патенты, цитированные в данном описании, в полном объеме включены в настоящее описание в качестве ссылок.
ОБЩИЕ ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДИКИ
Температуру плавления определяли на приборе Thomas-Hoover капиллярным методом и не корректировали. Масс-спектр низкого разрешения получали при условиях термораспыления (TS) на масс-спектрометре Trio 1000 Fizons (в настоящее время Micromass), (Micromass Inc., Beverly, Massachusetts), при условиях химической ионизации (CI) на лучевом масс-спектрометре частиц Hewlett Packard 5989A (Hewlett Packard Co., Palo Alto, California) или при условиях химической ионизации, включающих атмосферное давление (APCI), на спектрометре Platform II Fisons (в настоящее время Micromass).
Пример 1
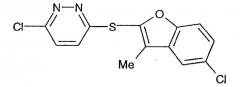
3-Хлор-6-(5-хлор-3-метилбензофуран-2-илсульфанил)пиридазин
К раствору 5-хлор-3-метилбензофурана (18 г, 108 ммоль, 1 экв.) в тетрагидрофуране (125 мл) при -40°С добавляли через делительную воронку Н-BuLi (47,7 мл, 119 ммоль, 1,1 экв). Реакционная смесь перемешивалась при -40°С в течение 1 часа и затем добавляли порошок серы (3,46 г, 108 ммоль, 1 экв). После перемешивания при -40°С в течение 5 минут реакционная смесь нагревалась до 0°С в течение 30 минут. Добавляли раствор 3,6-дихлорпиридазина (48,3 г, 324 ммоль, 3 экв) в тетрагидрофуране (50 мл) и полученная смесь перемешивалась при 0°С и нагревании до комнатной температуры в течение 2 часов. Затем реакционная смесь перемешивалась при комнатной температуре в течение еще одного часа. Реакционную смесь концентрировали до минимального объема и к остатку добавляли этанол (100 мл, примерно три объема) и воду (100 мл, примерно три объема). Смесь гранулировали перемешиванием в течение ночи. Твердые частицы собирали фильтрацией и повторно репульпировали в этаноле (270 мл, примерно восемь объемов) с получением целевого соединения, указанного в заголовке примера 1, в виде не совсем белого порошка (29,1 г, 87%).
Пример 2
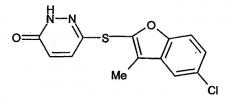
6-(5-Хлор-3-метилбензофуран-2-илсульфанил)-2Н-пиридазин-3-он
К суспензии 3-хлор-6-(5-хлор-3-метилбензофуран-2-илсульфанил) пиридазина (соединение, указанное в заголовке примера 1) в метаноле (500 мл, 6,1 об.) добавляли метоксид натрия (299 мл, 1,31 моль, 5 экв). Полученная смесь нагревалась при 50°С в течение пяти часов с получением 3-(5-хлор-3-метилбензофуран-2-илсульфанил)-6-метоксипиридазина, который не выделяли.
Реакционную смесь охлаждали до комнатной температуры и добавляли концентрированную хлористоводородную кислоту (12 н, 329 мл, 3,95 моль, 15 экв). Реакционную смесь кипятили с обратным холодильником в течение 15 минут и затем охлаждали до комнатной температуры. К суспензии добавляли воду (400 мл) и смесь охлаждали до 0°С в течение 30 минут.
Твердые частицы собирали фильтрацией, сушили в вакууме и повторно репульпировали в дихлорметане (600 мл, 8 об.) и изопропиловом эфире (150 мл, 2 об.) с получением целевого соединения примера 2 (71 г, 92%) в виде не совсем белого твердого вещества.
Пример 3
6-(5-Хлор-3-метилбензофуран-2-сульфонил)-2Н-пиридазин-3-он
К суспензии 6-(5-хлор-3-метилбензофуран-2-илсульфанил)-пиридазин-3-ола (соединение, указанное в заголовке примера 2, 10 г, 34,1 ммоль, 1 экв.) и комплексу мочевина - пероксид водорода (UHP, 19,3 г, 205 ммоль, 6 экв.) в тетрагидрофуране (150 мл, 15 об.) при 0°С добавляли трифторуксусный ангидрид (TFAA, 31,4 мл, 222 ммоль, 6,5 экв). TFAA добавляли со скоростью, поддерживающей температуру ниже 25°С. После завершения добавления реакционная смесь нагревалась до комнатной температуры в течение 2 часов. Добавляли воду (200 мл, 20 об.) и суспензия охлаждалась до 0°С. Твердые частицы собирали фильтрацией и сушили в вакууме с получением за два сбора целевого соединения примера 3 (8,78 г, 79%) в виде бледно-желтого твердого вещества.
1. Способ получения соединения формулы
где R1 и R2 независимо друг от друга представляют собой водород или метил; и R3, R4, R5 и R6 независимо друг от друга представляют собой Н, галоген, формил, (С1-С6)алкил, необязательно замещенный атомами фтора в количестве до трех, (С1-С6)алкокси, необязательно замещенный атомами фтора в количестве до трех, (С1-С6)алкоксикарбонил, (C1-С6)алкиленилоксикарбонил, (С1-С4)алкокси-(С1-С4)алкил, (С1-С4)алкилкарбониламидо, (С3-С7)никлоалкилкарбониламидо, фенилкарбониламидо, бензил, фенил или нафтил, где бензил, фенил и нафтил необязательно независимо друг от друга замещены заместителями в количестве до двух, независимо выбранными из галогена, (С1-С6)алкила, необязательно замещенного атомами фтора в количестве до трех, (С1-С6)алкокси, необязательно замещенного атомами фтора в количестве до трех, и (С1-С4)алкокси-(С1-С4)алкила,
включающий последовательные стадии:
а) взаимодействие соединения формулы
где R3, R4, R5 и R6 независимо определены, как указано выше, с литийорганическим соединением в присутствии источника серы в первом реакционном инертном растворителе с образованием реакционноспособного промежуточного соединения
в) взаимодействие указанного реакционноспособного промежуточного соединения IIa с соединением формулы
с образованием соединения формулы
с) взаимодействие указанного соединения формулы IV со щелочным (С1-С2)алкоксидом в (С1-С2)алканоле с образованием производного простого эфира формулы
где Alk является (С1-С2)алкилом;
d) взаимодействие указанного соединения формулы V с минеральной кислотой с образованием соединения формулы
и
e) окисление соединения формулы VI во втором реакционном инертном растворителе с образованием соединения формулы I.
2. Способ по п.1, отличающийся тем, что на стадии (а) литийорганическое соединение представляет собой н-бутиллитий, первый реакционный инертный растворитель представляет собой тетрагидрофуран и источником серы является S8; на стадии (с) щелочной (С1-С2)алкоксид представляет собой метоксид натрия и (С1-С2)алканол представляет собой метанол; и на стадии (d) указанное соединение формулы VI окисляют комплексом мочевина-пероксид водорода в присутствии трифторуксусного ангидрида и второй реакционный инертный растворитель представляет собой тетрагидрофуран, и где стадию (с) и стадию (d) осуществляют in situ.
3. Способ по п.2, отличающийся тем, что R3, R4, R5 и R6 независимо друг от друга представляют собой водород, метил, метокси, хлор, фтор, этил, 4-фторфенил, трифторметил, изопропил или фенил.
4. Соединение формулы
или его фармацевтически приемлемая соль, где R1 и R2 независимо друг от друга представляют собой водород или метил; и R3, R4, R5 и R6 независимо друг от друга представляют собой Н, галоген, формил, (С1-С6)алкил, необязательно замещенный атомами фтора в количестве до трех, (С1-С6)алкокси, необязательно замещенный атомами фтора в количестве до трех, (С1-С6)алкоксикарбонил, (С1-С6)алкиленилоксикарбонил, (С1-С4)алкокси-(С1-С4)алкил, (С1-С4)алкилкарбониламидо, (С3-С7)циклоалкилкарбониламидо, фенилкарбониламидо, бензил, фенил или нафтил, где бензил, фенил и нафтил необязательно независимо друг от друга замещены заместителями в количестве до двух, независимо выбранными из галогена, (С1-С6)алкила, необязательно замещенного атомами фтора в количестве до трех, (С1-С6)алкокси, необязательно замещенного атомами фтора в количестве до трех, и (С1-С4)алкокси-(С1-С4)алкила.
5. Соединение по п.4 или его фармацевтически приемлемая соль, в котором каждый из R1, R2, R4 и R5 представляет собой водород; R3 представляет собой 3-метил и R6 представляет собой 5-хлор, имеет структуру
6. Способ получения соединения формулы
где R1 и R2 независимо друг от друга представляют собой водород или метил; и R3, R5, R5 и R6 независимо друг от друга представляют собой Н, галоген, формил, (С1-С6)алкил, необязательно замещенный атомами фтора в количестве до трех, (С1-С6)алкокси, необязательно замещенный атомами фтора в количестве до трех, (С1-С6)алкоксикарбонил, (C1-С6)алкиленилоксикарбонил, (С1-С4)алкокси-(С1-С4)алкил, (С1-С4)алкилкарбониламидо, (С3-С7)циклоалкилкарбониламидо, фенилкарбониламидо, бензил, фенил или нафтил, где бензил, фенил и нафтил необязательно независимо замещены заместителями в количестве до двух, независимо выбранными из галогена, (С1-С6)алкила, необязательно замещенного атомами фтора в количестве до трех, (С1-С6)алкокси, необязательно замещенного атомами фтора в количестве до трех, и (С1-С4)алкокси-(С1-С4)алкила,
включающий последовательные стадии:
а) взаимодействие соединения формулы
где R3, R4, R5 и R6 независимо друг от друга определены, как указано выше, с литийорганическим соединением в присутствии источника серы в реакционном инертном растворителе с образованием реакционноспособного промежуточного соединения формулы
в) взаимодействие указанного реакционноспособного промежуточного соединения IIa с соединением формулы
с образованием соединения формулы IV.
7. Способ по п.6, отличающийся тем, что литийорганичесское соединение представляет собой н-бутиллитий, указанный реакционный инертный растворитель представляет собой тетрагидрофуран и источником серы является S8.
8. Способ по п.7, отличающийся тем, что R3, R4, R5 и R6 независимо друг от друга представляют собой водород, метил, метокси, хлор, фтор, этил, 4-фторфенил, трифторметил, изопропил или фенил.
9. Способ получения соединения формулы
включающий последовательные стадии:
а) взаимодействие соединения формулы
с н-бутиллитием в присутствии S8 в тетрагидрофуране с образованием реакционноспособного промежуточного соединения
в) взаимодействие указанного реакционноспособного промежуточного соединения XIIa с соединением формулы
с образованием соединения формулы