Антибактериальные гетеробициклические замещенные фенилоксазолидиноны
Иллюстрации
Показать всеИзобретение относится к бициклическим гетероциклическим замещенным фенилоксазолидинонам, которые представляют собой соединения формулы I:
где: R выбирают из группы, состоящей из ОН, O-гетероарила, N3, OSO2R'', -NR'''R'''', или
где: (ii) R'' представляет неразветвленный или разветвленный алкил, содержащий вплоть до 5 атомов углерода; и (iii) R''' и R'''' независимо выбирают из группы, состоящей из Н, -CO2-R1, -CO-R1, -CS-R1 и -SO2-R4, где R1 выбирают из группы, состоящей из циклоалкила, содержащего от 3 до 6 атомов углерода и неразветвленного или разветвленного алкила, содержащего вплоть до 6 атомов углерода; R4 выбирают из неразветвленного или разветвленного алкила, содержащего вплоть до 4 атомов углерода; и R4a представляет CN или NO2; R4b представляет SR4c, амино, NHR4c или NR4cR4d; R4c и R4d независимо выбирают из Н или алкила; Х представляет от 0 до 4 членов, независимо выбранных из группы, состоящей из галогена; и Y представляет радикал формулы II или III:
где R5, R6, R7 и R8 независимо представляют Н или R5 и R6 и/или R7 и R8 вместе образуют оксогруппу; R9 и R10 независимо представляют Н; А, В, С и D выбирают из С и N с образованием фенильного кольца или 5-6 членного гетероароматического кольца, причем указанное гетероароматическое кольцо содержит от одного до четырех членов, выбранных из группы, состоящей из N; Z выбирают из алкила, гетероарила, содержащего N; и m представляет 0 или 1. Эти соединения полезны в качестве антибактериальных агентов и могут быть использованы для лечения субъекта, состояние которого вызвано бактериальной инфекцией или вклад в которое вносит бактериальная инфекция, вызываемая S.aureus и Е.Faecium. 4 н. и 41 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к области соединений фенилоксазолидинона, обладающих антибактериальной активностью против грамположительных и грамотрицательных бактерий, содержащих их фармацевтические композиции, и к способам лечения бактериальных инфекций с помощью этих соединений.
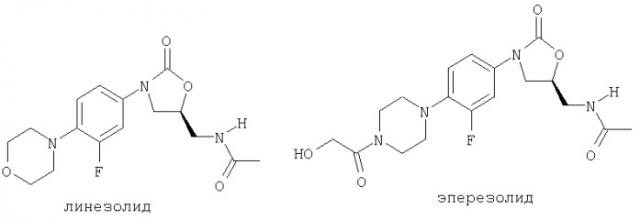
В последние двадцать лет оксазолидиноны были определены как новый класс антибактериальных агентов, которые обладают активностью против различных грамположительных организмов, устойчивых ко множеству лекарственных препаратов. Особенно проблематичные патогены включают устойчивые к метициллину Staphylococcus aureus (MRSA), устойчивые к промежуточным гликопептидам Staphylococcus aureus (GISA), устойчивые к ванкомицину enterocci (VRE) и устойчивые к пенициллину и цефалоспорину Streptococcus pneumoniae. Как класс, оксазолидиноны демонстрируют уникальный механизм действия. Исследования показали, что эти соединения селективно связываются с 50S рибосомной субъединицей и ингибируют бактериальную трансляцию в начальной фазе синтеза белков. Членами класса оксазолидинонов являются линезолид (см. WO 95/07271) и эперезолид.
Патент США №5792765, выданный Riedl с сотр., раскрывает ряд замещенных оксазолидинонов (цианогуанидин, цианоамидины и амидины), которые можно использовать в качестве антибактериальных лекарственных препаратов.
В патенте США №5910504, выданном Hutchinson, раскрыт ряд фенилоксазолидинонов с замещенными гетероароматическими кольцами, включая индолилзамещенные соединения, которые можно использовать в качестве антибактериальных агентов.
В WO 98/54161 (Hester с сотр.) раскрыты амиды, тиоамиды, мочевины и тиомочевины, которые являются антибактериальными агентами.
В WO 95/07271 (Barbachyn с сотр.) раскрыты оксазиновые и тиазиноные производные оксазолидинона, такие как линезолид и его аналоги, которые можно использовать в качестве противомикробных агентов и которые эффективны против ряда патогенов человека и животных, включая грамположительные аэробные бактерии, такие как устойчивые ко многим лекарствам стафилококки, стрептококки и энтерококки, а также анаэробные организмы, такие как Bacteroldes spp. и Clostndia spp. виды, и кислотоустойчивые организмы, такие как Mycobactenum tuberculosis, Mycobacterium avium и Mycobacterium spp.
В WO 93/09103 (Barbachyn с сотр.) раскрыты замещенные арил- и гетероарилфенилоксазолидиноны, которые можно использовать в качестве антибактериальных агентов.
Настоящее изобретение относится к соединениям фенилоксазолидинона формулы I:
где:
R выбирают из группы, состоящей из ОН, N3, OR', O-арила, O-гетероарила, OSO2R'', -NR'''R'''', или
где:
(i) R' представляет неразветвленный или разветвленный ацил, содержащий вплоть до 6 атомов углерода, или бензил;
(ii) R'' представляет неразветвленный или разветвленный алкил, содержащий вплоть до 5 атомов углерода, фенил или толил; и
(iii) R''' и R'''' независимо выбирают из группы, состоящей из Н, циклоалкила, содержащего от 3 до 6 атомов углерода, фенила или трет-бутоксикарбонила, флуоренилоксикарбонила, бензилоксикарбонила, неразветвленного или разветвленного алкила, содержащего вплоть до 6 атомов углерода, который необязательно замещен циано- или алкоксикарбонилом, содержащим вплоть до 4 атомов углерода, -CO2-R1, -CO-R1, -CO-SR1, -CS-R1, Р(О)(OR2)(OR3) и -SO2-R4, где
R1 выбирают из группы, состоящей из Н, циклоалкила, содержащего от 3 до 6 атомов углерода, трифторметила или фенила бензила или ацила, содержащего вплоть до 5 атомов углерода, неразветвпенного или разветвленного алкила, содержащего вплоть до 6 атомов углерода, причем указанный алкил необязательно замещен неразветвленным или разветвленным алкоксикарбонилом, содержащим вплоть до 5 атомов углерода, ОН, циано, вплоть до 3 атомов галогенов и -NR5R6, где R5 и R6 одинаковы или различны, и их выбирают из Н, фенила или неразветвленного или разветвленного алкила, содержащего вплоть до 4 атомов углерода;
R2 и R3 одинаковы или различны и их выбирают из водорода или неразветвленного или разветвленного алкила, содержащего вплоть до 4 атомов углерода; и
R4 выбирают из неразветвленного или разветвленного алкила, содержащего вплоть до 4 атомов углерода или фенила; и
R4a представляет CN, COR4c, COOR4c, CONHR4c, CO-NR4cR4d, SO2R4с, SO2NHR4c, SO2-NR4c R4d или NO2;
R4b представляет Н, алкил, OR4c, SR4c, амино, NHR4c, NR4cR4d, (C1-8) алкиларил или моно-, ди-, три- и пергало(C1-8)-алкил;
R4с и R4d независимо выбирают из Н, алкила, арила или в случае любой NR4cR4d группы R4c и R4d, взятые вместе с атомом азота, к которому они присоединены, образуют незамещенную или замещенную группу пирролидинила, пиперидинила или морфолинила;
Х представляет от 0 до 4 членов, независимо выбранных из группы, состоящей из галогена, ОН, меркапто, нитро, гало-C1-8-алкила, C1-8 алкокси, тио-С1-8алкила, C1-8 алкиламино, ди(С1-8-алкил) амино, формила, карбокси, алкоксикарбонила, C1-8 алкил-СО-O-, C1-8 алкил-CO-NH-, карбоксамида, арила, замещенного арила, гетероарила, замещенного гетероарила, CN, амина, С3-6-циклоалкила, С1-8алкила, необязательно замещенного одним или более из членов, выбранных из группы, состоящей из F, Cl, ОН, С1-8алкокси и C1-8 ацилокси; и
Y представляет радикал формулы II или III:
где
R5, R6, R7 и R8 независимо представляют Н, алкил, CN, нитро, С1-8алкил, гало-С1-8алкил, формил, карбокси, алкоксикарбонил, карбоксамид, арил, замещенный арил, гетероарил, замещенный гетероарил или R5 и R6 и/или R7 и R8 вместе образуют оксогруппу;
R9 и R10 независимо представляют Н, галоген, алкил, ОН, CN, меркапто, нитро, C1-8алкил, гало-С1-8алкил, C1-8алкокси, тио-С1-8алкил, амино, C1-8алкиламино, ди(C1-8алкил) амино, формил, карбокси, алкоксикарбонил, C1-8-алкил-СО-О-, C1-8-алкил-CO-NH-, карбоксамид, арил, замещенный арил, гетероарил, замещенный гетероарил или амин;
А, В, С и D выбирают из С, S, О и N с образованием любого 5-10 членного ароматического или гетероароматического кольца, причем указанное гетероароматическое кольцо содержит от одного до четырех членов, выбранных из группы, состоящей из S, О и N;
Z выбирают из галогенов, алкила, арила, замещенного арила, гетероарила, замещенного гетероарила, CN, CHO, СОалкила, амина (диалкиламино)алкила, где диалкиламино выбирают из диметиламина, диэтиламина, морфолинила, тиоморфолинила, пирролидинила или пиперидинила, или алкокси, или NHCO-(C1-8алкила); и
m представляет 0 или 1,
и его фармацевтически приемлемые соли и сложные эфиры.
Соединения приведенных выше формул полезны в качестве антибактериальных агентов для лечения бактериальных инфекций у человека и животных.
Настоящее изобретение относится также к способу лечения субъектов, состояния которых вызваны бактериальными инфекциями, или состояния, в которые вносят вклад бактериальные инфекции, который включает введение указанному млекопитающему терапевтически эффективное количество соединения формулы I.
Настоящее изобретение относится также к способу профилактики у субъектов состояний, вызванных бактериальными инфекциями, или состояний, в которые вносят вклад бактериальные инфекции, который включает введение указанному млекопитающему профилактически эффективной дозы фармацевтической композиции соединения формулы I.
Другие цели и преимущества станут очевидны специалистам из последующего описания.
Подробное описание изобретения
В отношении приведенных выше описаний соединений фенилоксазолидинона настоящего изобретения использованы следующие определения.
Если нет других указаний, термины "алкил", "алкенил" и "алкинил" относятся к неразветвленным или разветвленным группам, содержащим от 1 до 8 атомов углерода.
Термин "ацил" относится к органическому радикалу, содержащему определенное число атомов углерода, полученному из органической кислоты в результате удаления гидроксильной группы формулы RCO, как в случае ацетила, где R представляет СН3.
Термин "арил" означает незамещенную карбоциклическую ароматическую группу, включая (но этим не ограничиваясь) фенил, 1-или 2-нафтил и т.п. Термин "гетероарил" относится к циклическому ароматическому радикалу, содержащему от пяти до десяти атомов в кольце; где от одного до трех кольцевых атомов независимо являются гетероатомами, такими как S, О и N, а остальными атомами кольца являются атомы углерода, например пиридинильный, пиразинильный, пиримидинильный, пирролильный, пиразолильный, имидазолильный, тиазолильный, оксазолильный, изоксазолильный, тиадиазолильный, оксадиазолильный, тиенильный, фуранильный, хинолинильный или изохинолинильный радикалы и т.п.
Термин "замещенный арил" или "замещенный гетероарил" относится к арилу или гетероарилу, у которых от 1 до 3 атомов водорода независимо замещены галогеном, ОН, CN, меркапто, нитро, С1-8алкилом, гало-С1-8алкилом, C1-8алкокси, тио-С1-8алкиламином, C1-8алкиламином, ди(C1-8алкил) амино, формилом, карбокси, алкоксикарбонилом, С1-8алкил-СО-О-, С1-8алкил-СО-NH- или карбоксамидом. Кроме того, замещенный гетероарил может быть замещен монооксо, образуя в результате, например, 4-оксо-1-Н-хинолин. Замещенный гетероарил может быть также замещен замещенным арилом или вторым замещенным гетероарилом, в результате чего образуется, например, 4-фенилимидазол-1-ил или 3-пиридинил-имидазол-1-ил и т.п.
Термин "гало" или "галоген" означает фтор, хлор, бром или йод, (моно-, ди-, три-, и пер-)галоалкил означает алкильный радикал, полученный в результате независимого замещения его атомов водорода галогеном. P обозначает фосфор.
Соединения настоящего изобретения являются асимметричными в оксазолидиноновом кольце в 5-положении и таким образом существуют в виде оптических антиподов. Как таковые, все возможные оптические антиподы, энантиомеры или диастереоизомеры, образующиеся в результате дополнительных асимметричных центров, которые могут существовать в оптических антиподах, рацематах и рацемических смесях, также являются частью настоящего изобретения. Антиподы можно разделить известными специалистам способами, такими как, например, фракционная перекристаллизация диастереоизомерных солей энантиомерно чистых кислот. В другом варианте антиподы можно разделить хроматографически на колонке Pirkle.
Фраза "фармацевтически приемлемые соли" относится к солям свободных оснований, которые обладают необходимой фармакологической активностью свободного основания и не являются нежелательными ни с биологической, ни с какой-либо иной точки зрения. Эти соли можно получить из неорганических или органических кислот. Примерами неорганических кислот являются хлористоводородная кислота, азотная кислота, бромистоводородная кислота, серная кислота или фосфорная кислота. Примерами органических кислот являются уксусная кислота, пропионовая кислота, гликолевая кислота, молочная кислота, пировиноградная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, паратолуолсульфоновая кислота, метилсульфоновая кислота, салициловая кислота и т.п. Кроме того, подходящими солями являются соли органических и неорганических оснований, таких как КОН, NaOH, Са(ОН)2, Al(ОН)3, пиперидин, морфолин, этиламин, триэтиламин и т.п.
В объем настоящего изобретения включены также гидратные формы соединений, которые содержат различные количества воды, например гидратные, полугидратные и сесквигидратные формы.
Термин "субъект" включает (без ограничений) любое животное или искусственно измененное животное. В предпочтительном варианте этот термин относится к человеку.
Термин "устойчивый к лекарству" или "устойчивость к лекарству" относится к таким характеристикам микробов, как способность выживать в присутствии доступного в настоящее время антимикробного агента в его обычной эффективной концентрации.
Соединения настоящего изобретения обладают антибактериальной активностью против грамположительных и некоторых грамотрицательных бактерий. Они полезны в качестве антибактериальных агентов для лечения бактериальных инфекций у человека и животных. В частности, эти соединения обладают антибактериальной активностью против S.aureus, S.epidermidls, S.pneumoniae, E.faecalis, E.faecium, Moraxella catarrhalis и H.influenzae. Более конкретно эти соединения можно использовать против устойчивых бактерий, таких как MRSA и GISA, и они мало подвержены механизмам приобретения устойчивости. Соединения формулы I, наиболее предпочтительные для этих целей, это те соединения, в которых R принимает любое из следующих значений:
Кроме соединений формул I, которые наиболее предпочтительны для таких целей, предпочтительны соединения, в которых Y имеет следующие значения:
изоиндолон-;
(1,3-дигидро-2Н-изоиндол-2-ил)-;
(1,3-дигидро-2Н-пирроло[3,4-с]пиридин-6-ил)-;
(5,7-дигидро-6Н-пирроло[3,4-b]пиразин-6-ил)-;
(5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-ил)-;
(5,7-дигидро-6Н-пирроло[3,4-b]пиридин-6-ил)-;
(4,6-дигидро-3-метил-5Н-пирроло[3,4-d]изоксазол-5-ил)-;
(3,5-дигидро-5-метилпирроло[3,4-с]пиррол-2(1Н)-ил)-; и
(4,6-дигидро-1-метилпирроло[3,4-d]-1,2,3-триазол-5(1Н)-ил)-
Конкретные примеры соединений настоящего изобретения включают следующие:
N-[[(5S)-3-[4-(1,3-дигидро-2Н-изоиндол-2-ил)-3-фторфенил]-2-оксо-5-оксазолидинил]метил]ацетамид;
N-[[(5S)-3-[4-(1,3-дигидро-2Н-пирроло[3,4-с]пиридин-2-ил)-3-фторфенил]-2-оксо-5-оксазолидинил]метил]ацетамид;
N-[(5S)-3-[3-фтор-4-(5-оксидо-2Н-пирроло[3,4-с]пиридин-2-ил)фенил]-2-оксо-5-оксазолидинил]метил]ацетамид;
N-[[(5S)-3-[4-(5,7-дигидро-6Н-пирроло[3,4-b]пиридин-6-ил)-3-фторфенил]-2-оксо-5-оксазолидинил]метил]ацетамид;
N-[[(5S)-3-[4-(1,3-дигидро-1-оксо-2Н-изоиндол-2-ил)-3-фторфенил] -2-оксо-5-оксазолидинил]метил]ацетамид; и
(5R)-3-[4-(5,7-дигидро-6Н-пирроло[3,4-b]пиридин-6-ил)-3-фторфенил]-5-(гидроксиметил)-2-оксазолидинон.
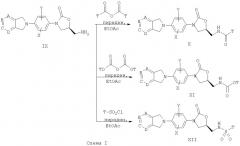
Соединения формулы I, которые являются предметом настоящего изобретения, можно получить из легко доступных исходных материалов, таких как индол (Gawley et al., J. Org. Chem., 1988, 53:5381), 6,7-дигидро-5Н-пирроло[3,4-с]пиридина и 6,7-дигидро-5Н-пирроло [3,4-b] пиридина (патент США №5371090 Petersen с сотр.) в соответствии со способами синтеза, хорошо известными специалистам. Примеры способов представлены на схемах I-V:
В соответствии со схемой I бициклические гетероциклы общей формулы IV обрабатывают замещенным производным нитробензола (L представляет соответствующую отщепляемую группу, такую как галоген или трифторметансульфонилокси) в подходящем основании и растворителе, таком как диизопропиламин и этилацетат, получая соединение замещенного нитрофенила V.
Затем производное нитробензола V восстанавливают до анилина в соответствующей реакции, например, обрабатывая SnCl2, или каталитическим гидрированием в присутствии соответствующего катализатора, такого как палладий-на-угле. Затем анилин обрабатывают бензил- или метилхлорформиатом и бикарбонатом натрия, получая соответствующее производное бензил- или метилкарбамата VI.
Затем Cbz анилин VI депротонируют, используя литиевое основание, такое как н-бутиллитий, и осуществляют взаимодействие с (R)-глицидилбутиратом, получая оксазолидинон VII. Затем гидроксиметильную группу превращают в амид, как представлено на схеме I, получая мезилат, превращая в азид VIII и восстанавливая до амина IX соответствующим способом, таким как гидрирование. В другом варианте замещение мезилата (схема II) или соответствующей отщепляемой группы, такой как тозилат или хлор, на фталимид калия и удаление фталоильной защитной группы гидразинолизом приводит к получению амина IX. Амин IX можно превратить в амид Х в реакции ацилирования, используя известные специалистам способы, такие как обработка уксусным ангидридом в присутствии основания, такого как пиридин. В другом варианте амин IX можно превратить в карбамат XI в результате обработки метилхлорформиатом и пиридином или в результате взаимодействия с сульфонилхлоридом в инертном растворителе в присутствии органического основания, такого как пиридин, получая сульфонамид XII
Для получения оксазолидинона, в котором R=О-гетероарил (XIII), оксазолидинонкарбинол VII можно превратить в соответствующий мезилат или другую подходящую отщепляемую группу и осуществить взаимодействие с HO-Het (подходящий гетероцикл, содержащий гидроксил), либо в присутствии основания, либо с HO-Het как полученного заранее алкоксида в соответствующем растворителе, например в ДМФ или в ацетонитриле (схема III)). В другом варианте можно использовать условия Митсунобу для присоединения VII к НО-гетероциклу в результате обработки трифенилфосфином или диизопропилазодикарбоксилатом (DIAD) в соответствующем растворителе, таком как ТГФ, при соответствующей температуре, предпочтительно при комнатной температуре. Условия реакции и соответствующие ссылки можно найти в WO 99/64416, Gravestock с сотр.
Креме того, обрабатывая VII подходящим ненуклеофильным основанием, например NaH, замену отщепляемой группы (LG), такой как хлор или бром, можно осуществить, используя соответствующий реакционноспособный аза-гетероцикл (LG-Het)(схема III).
Соединения строения XIV можно получить по способу, представленному на схеме IV. Амин IX можно превратить в различные функционализированные амидины в реакции с активированными иминами, где Q представляет отщепляемую группу, такую как метилтио или метокси, в подходящем растворителе без катализатора или в присутствии катализатора (такого как AgNO3) при температурах в интервале 0-110°С.
В соответствии со схемой V пирролидинон XV (полученный по способу WO96/13502) вначале подвергают взаимодействию с метокси-бис-(диметиламином) или другим активированным реагентом диметилформамида и затем нагревают в подходящем растворителе (например, в ДМФ или в бензоле), либо с замещенными амидинами с образованием пирролопиримидиноксазолидинонов, таких как XVI, либо с замещенными гидразинами с образованием пирролопиразолоксазолидинонов, таких как XVII. Получение енаминных, алкоксиметиленовых или алкоксикарбонильных производных пирролидинона XV по способу Brighty с сотр. патента США 5037834А также дает возможность доступа к таким системам.
Как представлено на схеме VI, соединения строения XIX можно получить окислением различных соединений XVIII, используя соответствующий окисляющий агент (например, диоксид марганца, пероксиукусную кислоту, DDQ или воздух) в подходящем растворителе, таком как метиленхлорид.
Оксопроизводное формулы XXII на схеме VII (X=0, Y=Н2 или Х=H2, Y=0) можно получить, осуществляя взаимодействие 1,2-арилдикарбоксальдегидов (где в XXI U=Н) с анилином XX (полученным по способу WO 96/23788) в присутствии кислот, таких как уксусная кислота, в подходящем растворителе, таком как метиленхлорид. Ди-оксопроизводные (формулы XXII, где Х=Y=0) получают в результате взаимодействия анилина XX с выбранными реагентами 1,2-арилдикарбонила с подходящими отщепляемыми группами (XXI, где U=Cl, Br и т.д.).
Определения
Все температуры даны в °С
Термин "рассол" относится к водному насыщенному раствору хлорида натрия
ДМФ обозначает N,N-диметилформамид
ТГФ обозначает тетрагидрофуран
Cbz обозначает карбобензилокси
n-BuLi обозначает н-бутиллитий
MS обозначает масс-спектр, выраженный как m/е или масса/единицу заряда
[М+Н] обозначает положительный ион соединения плюс атом водорода
Эфир обозначает диэтиловый эфир
кт обозначает комнатную температуру
Мр обозначает температуру плавления
CH2Cl2 обозначает метиленхлорид
NaOH обозначает гидроксид натрия
МеОН обозначает метанол
EtOAc обозначает этилацетат
ppt обозначает осадок
Эти соединения обладают антимикробной активностью против бактериальных патогенов, которые обладают или предполагается, что они обладают устойчивостью к лекарствам против таких патогенов, как S.aureus, S.epidermidis, S.pneumoniae, S.pyogenes, Enterococcus spp., Moraxella catarrhalis и Н.influenzae. Эти соединения особенно полезны против устойчивых к лекарствам грамположительных кокков, таких как устойчивые к метициллину S.aureus и устойчивые к ванкомицину энтерококки. Эти соединения полезны для лечения приобретенной в обществе пневмонии, респираторных инфекций верхних и нижних дыхательных путей, кожных инфекций и инфекций мягких тканей, приобретенных в больнице легочных инфекций, костных и суставных инфекций и других бактериальных инфекций.
Минимальная ингибирующая концентрация (МИК), которая является показателем антибактериальной активности in vitro, широко используется специалистами. In vitro антимикробную активность соединений настоящего изобретения определяют способом микроразбавлений бульона с последующим тестовым способом Национального комитета по лабораторным стандартам (National Committee for Laboratory Standards) (NCCLS). Этот способ раскрыт в NCCLS Document M7-A4, Vol.17, №2 "Methods for Dilution Antimicrobial Susceptibility Test for Bacteria that Grow Aerobically-Fourth Edition", который включен сюда для ссылки.
В этом способе двукратные сериальные разбавления лекарств в бульоне Mueller-Hinton с добавленным катионом добавляют в лунки планшетов для микроразбавлений. Тестовые организмы приготавливают, регулируя мутность культур в бульонах с активным ростом таким образом, чтобы конечная концентрация тестового организма после его добавления в лунки составляла примерно 5×104 культурообразующих единиц/лунку.
После инокулирования планшетов с микроразбавлениями планшеты инкубируют при 35°С в течение 16-20 час, а затем считывают показания. МИК представляет наинизшую концентрацию тестового соединения, которая полностью ингибирует рост тестового организма. Количество растущих организмов в лунках, содержащих испытываемое соединение, сравнивают с количеством организмов в лунках с контролируемым ростом (без испытываемого соединения), используемых для каждого планшета. Как видно из таблицы 1, некоторые соединения настоящего изобретения были протестированы в отношении различных патогенных бактерий, что дало интервал активностей от 1 до ≥128 мкг/мл в зависимости от тестированного организма. S.aureus OC2878 представляет MRSA и Е. faecium OC3312 представляют устойчивый к ванкомицину энтерококк.
| Таблица 1Величины МИК для некоторых соединений формулы I | |||
| Соединение № | МИК (мг/мл) для тестовых штаммов | ||
| S. aureus OC4172 | S. aureus OC2878 | Е. faecium OC3312 | |
| 1 | 2 | 2 | 2 |
| 2 | 2 | 1 | 4 |
| 3 | 0,5 | 0,25 | 0,5 |
| 4 | 1 | 0,5 | 1 |
| 5 | >32 | >32 | >32 |
| 6 | 64 | 32 | 32 |
| 7 | >32 | 8 | 16 |
| 8 | 8 | 4 | 8 |
| 9 | >32 | >32 | >32 |
| 10 | >32 | 8 | 64 |
| 11 | 2 | 1 | 2 |
| 12 | 8 | 2 | 4 |
| 13 | 2 | 1 | 2 |
| 14 | 32 | 16 | 16 |
| 15 | 2 | 2 | 2 |
| 16 | 8 | 8 | 8 |
| 17 | 4 | 2 | 2 |
| 18 | 16 | 16 | 16 |
| 19 | 8 | 4 | 8 |
| 20 | 4 | 2 | 4 |
| 21 | >64 | >64 | >64 |
| 22 | 2 | 2 | 2 |
| 23 | 8 | 8 | 8 |
| 24 | 8 | 8 | 8 |
| 25 | >64 | >128 | 32 |
| 26 | 1 | 0,5 | 1 |
| 27 | 8 | 4 | 8 |
| 28 | 0,5 | 0,5 | 0,5 |
| 29 | >32 | 8 | 16 |
| 30 | >128 | >128 | >128 |
| 31 | >16 | >16 | >16 |
| 32 | 4 | 2 | 2 |
| 33 | 32 | 32 | 32 |
| 34 | 8 | 2 | 4 |
| 35 | 0,5 | 0,25 | 2 |
| 36 | 1 | 0,5 | 1 |
| 37 | 1 | 1 | 0,5 |
| 38 | 2 | 2 | 1 |
| 39 | 1 | 2 | 1 |
| 40 | 1 | 1 | 1 |
| 41 | 2 | 2 | 2 |
| 42 | 2 | 2 | 2 |
| 43 | 1 | 1 | 1 |
| 44 | 1 | 1 | 1 |
| 45 | 4 | 4 | 4 |
| 46 | 4 | 4 | 8 |
| 47 | 32 | 16 | 32 |
| 48 | 8 | 8 | 8 |
| 49 | 16 | 4 | 8 |
Далее в настоящем изобретении предложен способ лечения бактериальных инфекций или усиления или потенциирования активности других антибактериальных агентов у субъекта, состояние которого вызвано бактериальной инфекцией или в состояние которого вносит вклад бактериальная инфекция, который включает введение животным соединения настоящего изобретения отдельно или в смеси с другим антибактериальным агентом в форме лекарства в соответствии с настоящим изобретением. Термин "лечение" и "обработка" включает одновременное, раздельное или последовательное введение фармацевтически эффективного количества соединения, содержащего одно или более из раскрытых здесь соединений, субъекту, у которого необходимо ингибировать рост бактерий. Фармацевтически эффективное количество соединения, которое используют в практике настоящего изобретения для лечения, меняется в зависимости от способа введения, возраста, веса и общего состояния подлежащего лечению субъекта и, в конечном счете, определяется врачами или ветеринарами.
Соединения настоящего изобретения можно вводить субъекту, такому как человек, любым из способов, соответствующих подлежащему лечению состоянию, причем подходящие способы включают пероральный, ректальный, назальный, наружный (включая введение за щеку и под язык), вагинальный и парэнтеральный (включая подкожный, внутримышечный, внутривенный, чрезкожный, через трахею и эпидуральный). Предпочтительный способ может меняться, например, в зависимости от состояния реципиента, а также от типа препарата и удобства введения.
Если соединения используют для указанных выше целей, их можно объединять с одним или более из фармацевтически приемлемых носителей, то есть растворителей, разбавителей и т.п., и их можно вводить перорально в таких формах, как таблетки, капсулы, диспергируемые порошки, гранулы или суспензии, содержащие, например, от около 0,5% до 5% суспендирующего агента, сиропы, содержащие, например, от около 10% до 50% сахара, и эликсиры, содержащие, например, от около 20% до 50% этанола и т.п., или парэнтерально в форме стерильных растворов или суспензий для инъекций, содержащих от около 0,5% до 5% суспендирующего агента в изотонической среде. Эти фармацевтические препараты могут содержать, например, от около 0,5% вплоть до около 90% активного ингредиента в сочетании с носителем, обычно от 5% до 60%.
Композиции для наружного применения могут иметь форму жидкостей, кремов или желе, содержащих терапевтически эффективные концентрации соединения настоящего изобретения в смеси с дерматологически приемлемым носителем.
При получении композиций в дозовой форме для перорального введения можно использовать любую из фармацевтически приемлемых сред. Твердые носители включают крахмал, лактозу, дикальцийфосфат, микрокристаллическую целлюлозу, сахарозу и каолин, тогда как жидкие носители включают стерильную воду, полиэтиленгликоли, неионные поверхностно-активные агенты и пищевые масла, такие как кукурузное, арахисовое и кунжутное масла, сообразуясь с природой активного ингредиента и желательной конкретной формой введения. С успехом можно включать адъюванты, которые обычно используют при приготовлении фармацевтических композиций, такие как вкусовые агенты, красители, консерванты и антиоксиданты и т.д., например витамин Е, аскорбиновая кислота, ВНТ и ВНА.
Предпочтительными фармацевтическими композициями с точки зрения простоты приготовления и введения являются твердые композиции, особенно таблетки и капсулы с твердым или жидким содержанием. Предпочтительно пероральное введение соединений. Эти активные соединения можно также вводить парэнтерально или внутрибрюшинно. Растворы или суспензии этих активных соединений в виде свободных оснований или фармакологически приемлемых солей можно получить в воде, соответствующим образом смешанной с поверхностно-активным агентом, таким как гидроксипропилцеллюлоза. Дисперсии можно также приготовить в глицерине, в жидких полиэтиленгликолях и их смесях в маслах. В обычных условиях хранения и использования эти препараты могут содержать консерванты для предотвращения роста микроорганизмов.
Фармацевтические формы для использования в виде инъекций включают стерильные водные растворы или дисперсии и стерильные порошки для приготовленных для немедленного введения препаратов стерильных растворов или дисперсий для инъекций. Во всех случаях форма должна быть стерильной и должна быть жидкой до такой степени, чтобы ее можно было легко вводить с помощью шприца. Она должна быть стабильной в условиях изготовления и хранения и должны быть приняты меры, предотвращающие загрязнение микроорганизмами, такими как бактерии и грибки. Носителем может быть растворитель или диспергирующая среда, содержащая, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их подходящие смеси и растительные масла.
Используемая эффективная доза активного ингредиента может меняться в зависимости от конкретного используемого соединения, способа введения и тяжести состояния, подлежащего лечению. Однако обычно удовлетворительные результаты достигаются, если соединения настоящего изобретения вводят в дневной дозе от около 0,1 мг/кг до около 400 мг/кг веса тела животного, предпочтительно вводимой в разделенных дозах от двух до четырех раз в день. Для большинства крупных млекопитающих полная дневная доза составляет от около 0,07 г до 7,0 г, предпочтительно от около 100 мг до 1000 мг. Дозовые формы, пригодные для внутреннего использования, включают от около 100 мг до 500 мг активного соединения, тщательно смешанного с твердым или жидким фармацевтически приемлемым носителем. Такой дозовый режим можно установить для обеспечения оптимальной терапевтической реакции. Например, несколько разделенных доз можно вводить ежедневно или дозу можно пропорционально уменьшить в соответствии с показаниями терапевтической ситуации.
Получение вышеуказанных фармацевтических композиций и лекарств можно осуществить любым из известных специалистам способов, например, смешивая активный ингредиент (ингредиенты) с разбавителем (разбавителями) для получения фармацевтической композиции (например, гранулята), а затем формируя композицию в виде лекарств (например, в виде таблеток).
Нижеприведенные примеры подробно раскрывают способы химического синтеза представительных соединений настоящего изобретения. Эти способы являются иллюстрациями и не следует рассматривать изобретение как ограниченное химическими реакциями и условиями, которые в них указаны. Не было предпринято попыток оптимизировать выходы, достигаемые в этих реакциях, и специалистам должно быть очевидно, что, варьируя времена реакций, температуры, растворители и/или реагенты, выходы можно увеличить.
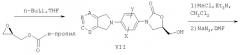
Пример 1
(5R)-3-[4-(1,3-Дигидро-1-оксо-2Н-изоиндол-2-ил)-3-фторфенил]-5-(гидроксиметил)-2-оксазолидинон
Изоиндолин синтезируют, используя способ R.Е.Gawley, S.R.Chemburkar, A.L.Smith, Т.V.Anklekar J. Org. Chem. 1983, 53, 5381.
Стадия 1:
К 3,4-дифторнитробензолу (3,02 мл, 27,3 ммоль) в этилацетате при комнатной температуре добавляют диизопропилэтиламин (5,03 мл, 28,9 ммоль), затем изоиндолин (3,50 г, 29,4 ммоль) и перемешивают в течение ночи. Образующийся желтый осадок (ppt) собирают на фильтре, промывают водой и эфиром и сушат в вакуумном термостате (30°С), получая продукт в виде твердого вещества желтого цвета (6,69 г, 95% выход). Т. плавления = 200-202°С. Масс-спектр (М+1)=327 m/z.
Стадия 2:
К вышеуказанному нитросоединению (2,62 г, 10,2 ммоль) в этаноле (100 мл) добавляют SnCl2 (9,84 г, 50,9 ммоль) и кипятят с обратным холодильником в течение 16 час. После охлаждения до комнатной температуры реакционную смесь добавляют к 10% водному раствору NaOH (300 мл) и экстрагируют СН2Cl2 (6×50 мл). Объединенные органические экстракты промывают рассолом (100 мл), сушат над Na2SO4 и концентрируют, получая 2,63 г оливково-зеленого твердого вещества (анилин), который используют без дальнейшей очистки. К этому анилину в ацетоне (150 мл) и воде (20 мл) добавляют NaHCO3 (1,84 г, 21,9 ммоль) и затем бензилхлорформиат (1,68 мл, 11,8 ммоль). После перемешивания в течение ночи смесь выливают в ледяную воду (100 мл) и полученный желто-коричневый осадок собирают на фильтре, промывают водой и сушат в вакууме, получая Cbz анилин в виде желто-коричневого твердого вещества (3,50 г, 95% выход). Т. плавления = 146-148°С. Масс-спектр (М+1)=363 m/z.
Стадия 3:
К вышеуказанному Cbz анилину (0,74 г, 2,04 ммоль) в ТГФ (10 мл) при -78°С по каплям добавляют н-BuLi (2,5 М, 0,82 мл, 2,05 ммоль). После перемешивания в течение 40 минут по каплям добавляют (R)-глицидилбутират (0,31 мл, 2,10 ммоль) в ТГФ (0,5 мл) и полученную смесь оставляют выстаиваться при комнатной температуре в течение ночи. Образовавшийся белый осадок собирают на фильтре и промывают водой и эфиром. В результате обработки на хроматографической колонке с силикагелем 25% смесью этилацетат/гексан в качестве элюента получают продукт в виде белого твердого вещества (0,58 г, 87% выход). Масс-спектр (М+1)=329 m/z.
Пример 2
(5R)-3-[4-(1,3-дигидро-1-оксо-2Н-изоиндол-2-ил)-3-фторфенил]-5-[[(метилсульфонил)окси]метил]-2-оксазолидинон
К оксазолидинонкарбинолу, полученному в примере 1 (0,58 г, 1,78 ммоль) в ДМФ (10 мл), и ацетонитрилу (10 мл) при 0°С добавляют триэтиламин (0,74 мл, 5,31 ммоль) и через 10 мин добавляют метансульфонилхлорид (0,28 мл, 3,62 ммоль). Реакционную смесь оставляют на 1 час при комнатной температуре и после этого все еще присутствует исходный материал, поэтому повторяют охлаждение и добавление триэтиламина (0,37 мл, 2,65 ммоль) и метансульфонилхлорида (0,14 мл, 1,81 ммоль). Эту смесь выливают в воду (50 мл) и экстрагируют CH2Cl2 (6×20 мл), промывают рассолом (4×10 мл), сушат над Na2SO4 и концентрируют, получая сырой продукт в виде масла коричневого цвета (0,95 g). Масс-спектр (М+1)=407 m/z.
Пример 3
(5R)-5-(азидометил)-3-[4-(1,3-дигидро-1-оксо-2Н-изоиндол-2-ил)-3-фторфенил]-2-оксазолидино
К мезилату, полученному в примере 2 (0,95 г, 1,78 ммоль) в ДМФ (25 мл), добавляют азид натрия (0,47 г, 7,23 ммоль) и нагревают при 70°С в течение 16 часов. После охлаждения до комнатной температуры добавляют воду, и полученную смесь экстрагируют этилацетатом (6×25 мл), промывают рассолом (4×10 мл), сушат над Na2SO4 и концентрируют, получая 0,48 г твердого вещества желто-коричневого цвета. Масс-спектр (М+1)=354 m/z.
Пример 4
N-[[(5S)-3-[4-(1,3-дигидро-2Н-изоиндол-2-ил)-3-фторфенил]-2-оксо-5-оксазолидинил]метил]ацетамид
Соединение 1
Азид, полученный в примере 3, в этилацетате (25 мл) помещают в склянку Паара и через нее барботируют азот в течение 15 мин, после чего добавляют 10% Pd/С (0,15 г, 0,14 ммоль) для смеси создают давление 50 пси Н2 (г) и встряхивают в течение 16 час, после чего добавляют дополнительное количество 10% Pd/C (0,15