Производные бензодиазепина и фармацевтическая композиция на их основе
Иллюстрации
Показать всеОписываются производные бензодиазепина общей формулы (I)
где R1 - водород, галоген, С1-С7алкил, С1-С7алкокси, гидрокси или С1-С7алкилтио,
R2 - -С(O)O-(С1-С7)алкил, 1,2,4-оксадиазол-3-ил или 1,2,4-оксадиазол-5-ил, циклические фрагменты которых замещены С3-С7циклоалкилом,
R3 - водород, С1-С7алкил, -(СН2)n-(С3-С7)циклоалкил, -(СН2)n-галоген,
-(СН2)n-пиридин-4-ил или -(СН2)n-фенил, причем фенильное кольцо может быть замещенным одним или двумя заместителями, выбранными из группы, включающей С1-С7алкокси, галоген, -SO2СН3, фенил, OCF3, нитро, CF3, -NR2, или означает -(СН2)n-индолил, необязательно замещенный С1-С7алкилом или С1-С7алкокси, или означает пирролидинил-5-оксо, -C(O)-NR2, -(CH2)n-OH, -(CH2)n-NR2 или -(СН2)n-бензо[1,3]диоксол,
R - водород или С1-С7алкил, а n равно 0, 1, 2 или 3,
и его фармацевтически приемлемые кислотно-аддитивные соли, за исключением следующих соединений:
этиловый эфир 9Н-имидазо[1,5-а][1,2,4]триазоло[3,4-d][1,4]бензодиазепин-10-карбоновой кислоты,
10-(3-циклопропил-1,2,4-оксадиазол-5-ил)-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин,
этиловый эфир 3-фтор-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
10-(3-циклопропил-1,2,4-оксадиазол-5-ил)-3-фтор-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин,
этиловый эфир 3-хлор-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
3-хлор-10-(3-циклопропил-1,2,4-оксадиазол-5-ил)-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин и
этиловый эфир 3 -метил-9Н-имидазо[1,5-а][1,2,4]триазоло[3,4-d][1,4]бензодиазепин-10-карбоновой кислоты, и фармацевтическая композиция, содержащая, кроме новых, и перечисленные выше исключенные соединения. Новые соединения обладают способностью селективно связываться с α5субъединицей А рецептора гамма-аминомасляной кислоты и могут быть использованы для лечения, например, болезни Альцгеймера. 2 н. и 11 з.п.ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к производным замещенного имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепина следующей формулы,
где
R1 означает водород, галоген, (низш.)алкил, (низш.)алкокси, гидрокси, циано, трифторметил, трифторметокси или (низш.)алкилтио,
R2 означает - С(O)O-(низш.)алкил, изоксазол, 1,2,4-оксадиазол-3-ил или 1,2,4-оксадиазол-5-ил, циклические фрагменты которых могут быть замещены группой (низш.)алкил, трифторметил или циклоалкил,
R3 означает водород, (низш.)алкил, -(СН2)n-циклоалкил, -(СН2)n-галоген, -(СН2)n-пиридин-4-ил или -(СН2)n-фенил, причем фенильное кольцо может быть замещенным одним или двумя заместителями, выбранными из группы, включающей (низш.)алкокси, галоген, -SO2СН3, фенил, OCF3, нитро, CF3, -NR2, или означает -(СН2)n-индолил, необязательно замещенный (низш.)алкилом или (низш.)алкокси, или означает пирролидинил-5-оксо, -C(O)-NR2, -(CH2)n-OH, -(CH2)n-NR2 или -(СН2)n-бензо[1.3]диоксол,
R означает водород или (низш.)алкил, а
n равно 0, 1, 2 или 3, и
к их фармацевтически приемлемым кислотно-аддитивным солям,
за исключением следующих соединений:
этиловый эфир 9Н-имидазо[1,5-а][1,2,4]триазоло[3,4-d][1,4]бензодиазепин-10-карбоновой кислоты,
10-(3-циклопропил-1,2,4-оксадиазол-5-ил)-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин,
этиловый эфир 3-фтор-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
10-(3-циклопропил-1,2,4-оксадиазол-5-ил)-3-фтор-9Н-имидазо[1,5-a][1,2,4]триазоло[4,3-d][1,4]бензодиазепин,
этиловый эфир 3-хлор-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
3-хлор-10-(3-циклопропил-1,2,4-оксадиазол-5-ил)-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин и
этиловый эфир 3-метил-9Н-имидазо[1,5-а][1,2,4]триазоло[3,4-d][1,4]бензодиазепин-10-карбоновой кислоты.
Вышеуказанные конкретные производные имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепина описаны ранее (Heterocycles, т.39, №2 (1994)), однако в документе отмечается, что эти соединения обладают неожиданно низким сродством к BzR (бензодиазепиновому рецептору) и, следовательно, не обладают антифобическим седативным действием. В настоящее время неожиданно установлено, что этот класс соединений обладает высоким сродством и селективностью к участкам связывания α5 субъединицы А рецептора ГАМК и эти соединения могут использоваться в качестве усилителей познавательной способности или для лечения расстройств познавательной способности, таких, как болезнь Альцгеймера.
Рецепторы главного ингибирующего нейромедиатора, гамма-аминомасляной кислоты (ГАМК), подразделяются на два основных класса: (1) А рецепторы ГАМК, которые являются членами подсемейства лиганд-активируемых ионных каналов и (2) В рецепторы ГАМК, которые являются членами семейства рецепторов, сопряженных с G-белками. А рецептор является гетеропентамерным мембранным белковым полимером, содержащим главным образом α, β и γ субъединицы.
К настоящему времени клонирована и секвенирована 21 субъединица А рецептора. Для сборки рекомбинантных А рецепторов, которые наиболее полно имитируют биохимические, электрофизиологические и фармакологические функции нативных А рецепторов, выделенных из мозга млекопитающих, необходимы три типа субъединиц (α, β и γ). Имеются веские основания полагать, что участок связывания бензодиазепина расположен между α и γ субъединицами. Среди рекомбинантных А рецепторов многие функции классического BzR типа I имитирует рецептор α1β2γ2, в то время как ионные каналы (α2β2γ2, α3β2γ2 и α5β2γ2 относятся к BzR типа II.
Установлено (McNamara, Skelton, Psychobiology, 21, 101-108), что обратный агонист β-ССМ бензодиазепинового рецептора усиливает пространственное обучение в водяном лабиринте Морриса. Однако β-CCM и другие общепринятые обратные агонисты безодиазепинового рецептора вызывают судороги или являются проконвульсантами, что препятствует их применению в качестве агентов, усиливающих познавательную способность человека. Кроме того, эти соединения не селективны в отношении субъединиц А рецептора, в то время как частично или полностью обратный агонист субъединицы α5 А рецептора ГАМК, который практически на обладает активностью в отношении участков связывания α1 и/или, α2 и/или, α3 А рецептора ГАМК, можно использовать для получения лекарственного препарата, который может применяться для усиления познавательной способности, в качестве средства, обладающего незначительной или вовсе не обладающего просудорожным действием. Кроме того, можно использовать обратные агонисты α5 А рецептора ГАМК, которые обладают некоторой активностью к участкам связывания α1 и/или, α2 и/или, α3 А рецептора ГАМК, но которые функционально селективны в отношении α5 субъединиц. Однако предпочтительны обратные агонисты, которые селективны к α5 субъединицам А рецептора ГАМК и относительно неактивны к участкам связывания α1, α2 и α3 А рецептора ГАМК.
Объектами настоящего изобретения являются соединения формулы I и фармацевтически приемлемые соли, способ получения вышеуказанных соединений, лекарственные препараты, содержащие указанные соединения, и их получение, а также применение вышеуказанных соединений при лечении и профилактике заболеваний, прежде всего заболеваний и состояний, относящихся к вышеупомянутым, или при получении соответствующих лекарственных препаратов.
Наиболее предпочтительным показанием по настоящему изобретению является болезнь Альцгеймера.
Общие термины, используемые в настоящем описании, имеют следующие значения, независимо от того, применяются ли эти термины в отдельности или в различных сочетаниях.
Термин (низш.)алкил означает алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил и т.п. Предпочтительны группы (низш.)алкил, содержащие 1-4 атома углерода.
Термин (низш.)алкокси означает группу, в которой алкильные остатки имеют значения, указанные выше, и присоединены через атом кислорода.
Термин галоген означает хлор, иод, фтор и бром.
Термин циклоалкил означает циклический алкильный радикал, содержащий от 3 до 7 атомов углерода в цикле, например циклопропил, циклопентил или циклогексил.
Термин (низш.)алкилтио означает группу -S-(С1-С7)алкил,
Термин "фармацевтически приемлемые кислотно-аддитивные соли" включает соли неорганических или органических кислот, таких как хлористоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфокислота, пара-толуолсульфокислота и т.п.
Предпочтительными являются соединения, которые имеют константу связывания (Ki) ниже 15 нМ, селективны к α5 субъединицам А рецептора ГАМК и относительно неактивны в отношении участков связывания α1, α2 и α3 А рецептора ГАМК.
Для применения в отношении вышеуказанных заболеваний предпочтительны соединения формулы I, в которой R2 означает группу -С(O)O-(низш.)алкил.
Предпочтительными являются соединения этой группы, где R3 означает водород, а R1 означает водород, метокси, метил, -SCH3 или галоген, например, следующие соединения:
этиловый эфир 3-метокси-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
этиловый эфир 3-метил-9Н-имидазо[1,5-а][1,2,4]триазоло[3,4-d][1,4]бензодиазепин-10-карбоновой кислоты,
этиловый эфир 3-бром-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
этиловый эфир 9Н-имидазо[1,5-а][1,2,4]триазоло[3,4-d][1,4]бензодиазепин-10-карбоновой кислоты,
этиловый эфир 3-фтор-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты или
этиловый эфир 3-хлор-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты.
Другими предпочтительными соединенями этой группы являются такие соединения, в которых R3 означает -СН2ОН, -(СН2)2-метилендиоксифенил, метил, -СН2-индолил, необязательно замещенный группой метокси, или -СН2-фенил, замещенный группой -SO2СН3, фенил, -OCF3, -N(CH2)2, NO2 или метокси, а R1 означает метокси, хлор или бром, например следующие соединения:
этиловый эфир 3-метокси-7-метил-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
этиловый эфир 3-метокси-7-(1Н-индол-3-илметил)-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
этиловый эфир 7-гидроксиметил-3-метокси-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
этиловый эфир 3-метокси-7-(3-метоксибензил)-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
этиловый эфир 3-метокси-7-[(7-метокси-1Н-индол-3-ил)метил]-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
этиловый эфир 3-бром-7-(1Н-индол-3-илметил)-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
этиловый эфир 3-бром-7-(3-метоксибензил)-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
этиловый эфир 7-[2-бензо[1,3]диоксол-5-ил)этил]-3-хлор-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
этиловый эфир 7-(4-метансульфонилбензил)-3-метокси-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
этиловый эфир 3-метокси-7-[(бифенил-4-ил)метил]-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
этиловый эфир 3-метокси-7-(4-трифторметоксибензил)-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][l,4]бензодиазепин-10-карбоновой кислоты,
этиловый эфир 3-хлор-7-(4-нитробензил)-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты,
этиловый эфир 7-(4-диметиламинобензил)-3-метокси-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты или
этиловый эфир 3-бром-7-(4-диметиламинобензил)-9Н-имидазо[1,5-а] [1,2,4]триазоло[4,3-d][1,4]бензодиазепин-10-карбоновой кислоты.
Другими предпочтительными соединениями для применения при лечении вышеуказанного заболевания являются такие соединения, в которых R2 означает группу 3-циклопропил-[1,2,4]оксадиазол-5-ил.
Примерами предпочтительных соединений этой группы являются такие соединения, в которых R3 означает водород, а R1 означает водород, метокси, метил, -SCH3 или галоген, например, следующие соединения:
10-(3-циклопропил-1,2,4-оксадиазол-5-ил)-3-метокси-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин,
10-(3-циклопропил-1,2,4-оксадиазол-5-ил)-3-метил-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин,
10-(3 -циклопропил-1,2,4-оксадиазол-5-ил)-3-бром-9Н-имидазо[1, 5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин,
10-(3-циклопропил-1,2,4-оксадиазол-5-ил)-3-метилсульфанил-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин,
10-(3-циклопропил-1,2,4-оксадиазол-5-ил)-9Н-имидазо[1,5-a][1,2,4]триазоло[4,3-d][1,4]бензодиазепин,
10-(3-циклопропил-1,2,4-оксадиазол-5-ил)-3-фтор-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин,
3-хлор-10-(3-циклопропил-1,2,4-оксадиазол-5-ил)-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин или
3-хлор-10-(5-циклопропил-1,2,4-оксадиазол-3-ил)-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин.
Другими предпочтительными соединениями из этой группы являются такие соединения, в которых R3 означает -СН2-индолил или -СН2-фенил, необязательно замещенный группой -N(CH3)2, a R1 означает хлор или бром, например, следующие соединения:
10-(3-циклопропил-1,2,4-оксадиазол-5-ил)-7-(4-диметиламинобензил)-3-бром-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]бензодиазепин,
3-хлор-10-(5-циклопропил-1,2,4-оксадиазол-3-ил)-7-(1Н-индол-3-илметил)-9H-имидазо[1,5-a][1,2,4]триазоло[4,3-d][1,4]бензодиазепин или
7-бензил-3-хлор-10-(5-циклопропил-1,2,4-оксадиазол-3-ил)-9Н-имидазо[1,5-a][1,2,4]триазоло[4,3-d][1,4]бензодиазепин.
Предлагаемые соединения формулы I и их фармацевтически приемлемые соли можно получить известными в данной области методами, например, описанным ниже способом, который включает
а) взаимодействие соединения формулы
с соединением формулы
с образованием соединения формулы
где заместители R1-R3 имеют значения, указанные выше, или
б) взаимодействие соединения формулы
H2NNH2
с образованием соединения формулы
и циклизацию этого соединения при взаимодействии с
R3-С(OC2H5)3 VI
с получением соединения формулы
где заместители R1-R3 имеют значения, указанные выше, или
в) модифицацию одного или более заместителей R1-R3 в соответствии со значениями, указанными выше, и
при необходимости превращение полученных соединений в фармацевтически приемлемую кислотно-аддитивную соль.
По варианту а) соединения формулы I можно получить следующим образом: соединение формулы II, например, этиловый эфир 6-хлор-8-метокси-4Н-2,5,10b-триазабензо[е]азулен-3-карбоновой кислоты или этиловый эфир 6-хлор-8-метил-4Н-2,5,10b-триазабензо[е]азулен-3-карбоновой кислоты или этиловый эфир 6-хлор-8-бром-4Н-2,5,10b-триазабензо[е]азулен-3-карбоновой кислоты обрабатывают соединением формулы III, например, формилгидразином, ацетгидразином, гидразидом индол-3-уксусной кислоты, диметиламиноацетилгидразидом или т.п. Реакцию проводят в присутствии N,N-диметил-пара-толуидина или N-этилдиизопропиламина или даже в отсутствии основания и кипятят с обратным холодильником в хлорбензоле или пара-ксилоле в течение нескольких часов.
По варианту б) соединения формулы I можно получить следущим образом: соединение формулы IV, например, этиловый эфир 6,8-дибром-4Н-2,5,10b-триазабензо[е]азулен-3-карбоновой кислоты или 6-бром-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-8-метилсульфанил-4Н-2,5,10b-триазабензо[е]азулен обрабатывают безводным раствором гидразина в пригодном растворителе, например, в ТГФ, и полученную смесь нагревают в течение нескольких часов. После охлаждения и упаривания твердое вещество можно непосредственно использовать на следующей стадии. Затем полученное твердое вещество обрабатывают соответствующим соединением формулы VI, например, триэтилортоформиатом в спирте, таком, как этанол, и смесь кипятят с обратным холодильником в течение нескольких часов.
Соль получают при комнатной температуре известными способами, которые также известны специалисту в данной области. Можно получить соли как неорганических, так и органических кислот. Примерами таких солей являются гидрохлориды, гидробромиды, сульфаты, нитраты, цитраты, ацетаты, малеаты, сукцинаты, метансульфонаты, пара-толуолсульфонаты и т.п.
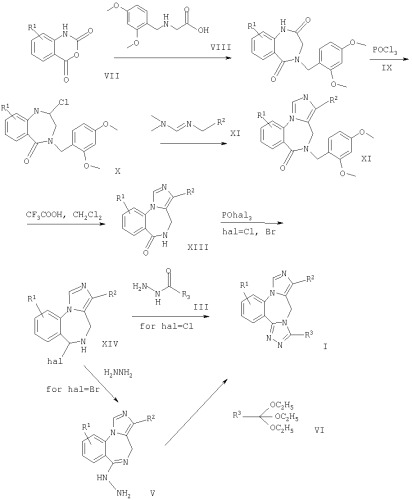
На схеме 1 более подробно показаны способы получения соединений формулы I. Исходные материалы являются известными соединениями или их можно получить известными в данной области методами, например, по схемам 2, 3 и 4.
Схема 1
Заместители, приведенные на схеме 1, имеют значения, указанные выше.
По схеме 1 соединение формулы I можно получить, как описано ниже. Соответствующее соединение формулы VII, где R1 означает замещенный 2H-3,1-бензоксазин-2,4(1Н)-дион, и (2,4-диметоксибензиламино)уксусную кислоту (VIII) суспендируют в пара-ксилоле и нагревают в атмосфере аргона в течение приблизительно 2 ч. После охлаждения до комнатной температуры происходит кристаллизация продукта. Полученное соединение формулы IX растворяют в толуоле в присутствии N,N-диметил-пара-толуидина. Затем добавляют оксихлорид фосфора, раствор нагревают и после завершения реакции выпаривают толуол. Затем полученное соединение формулы Х растворяют в ТГФ и добавляют смесь охлажденного раствора диизопропиламида лития в ТГФ и этилового эфира (Е)-(диметиламинометиленамино)уксусной кислоты или (Е/2)-N'-(3-циклопропил[1,2,4]оксадиазол-5-илметилдиметилформамидина. На следующей стадии полученное соединение формулы XII растворяют в смеси CH2Cl2 и трифторуксусной кислоты, а затем обрабатывают трифторметансульфокислотой. Полученное соединение формулы XIII очищают обычным способом. Смесь этого соединения и N,N-диметил-пара-толуидина растворяют в хлорбензоле в атмосфере аргона и при комнатной температуре добавляют оксихлорид или оксибромид фосфора и смесь кипятят с обратным холодильником. Полученное соединение формулы XIV очищают известными методами. Если в формуле XIV "hal" означает хлор, то соединение формулы I получают по реакции соединения формулы XIV, например, этилового эфира 6-хлор-8-метокси-4Н-2,5,10b-триазабензо[е]азулен-3-карбоновой кислоты, с соответствующим формилгидразином формулы III. Реакцию проводят в присутствии N,N-диметил-пара-толуидина или N-этилдиизопропиламина или даже в отсутствии основания, и кипятят с обратным холодильником в хлорбензоле или пара-ксилоле. Если в формуле XIV "hal" означает бром, то такое соединение, например, этиловый эфир 6,8-дибром-4Н-2,5,10b-триазабензо[е]азулен-3-карбоновой кислоты, обрабатывают безводным раствором гидразина и полученное в виде твердого вещества соединение формулы V непосредственно используют на последующей стадии. Наконец, соединение формулы I получают при кипячении с обратным холодильником смеси соединения формулы V с триэтилортоформиатом в этаноле.
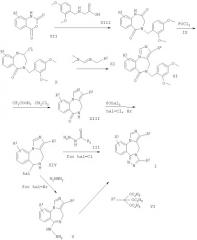
Получение исходных материалов
Схема 2
На схеме R' имеет значения, указанные выше.
Исходное соединение формулы VII получают по схеме 2. Соединение формулы XV гидрируют обычным способом с образованием соответствующей 2-аминобензойной кислоты формулы XVI. Затем полученное соединение растворяют в диоксане и обрабатывают бис(трихлорметил)карбонатом при кипячении с обратным холодильником.
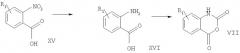
Схема 3
На схеме 3 показано получение известных исходных материалов. Способы получения этих соединений также известны или их можно получить по аналогии с известными методами. Например, N-[(3-циклопропил-1,2,4-оксадиазол-5-ил)метил]фталимид получают по реакции N-фталоилглицина в ДМФ и 1,1'-карбонилдиимидазола с последующим добавлением циклопропанкарбоксамидоксима. Затем полученный Н-[(3-циклопропил-1,2,4-оксадиазол-5-ил)метил]фталимид растворяют в 1,2-дихлорэтане и добавляют N-метилгидразин. Полученный 4-(аминометил)-3-циклопропил-1,2,4-оксадиазол обрабатывают диэтилацеталем N,N-диметилформальдегида и нагревают при приблизительно 130°С, получая необходимое исходное соединение (E/Z)-N'-(3-циклопропил[1,2,4]оксадиазол-5-илметил-N,N-диметилформамидин.
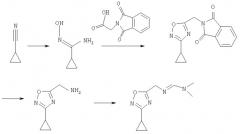
Схема 4
По схеме 4 исходное соединение этиловый эфир (Е)- (диметиламинометиленамино)уксусной кислоты получают при взаимодействий глицина с диэтилацеталем N,N-диметилформамида в этаноле.
Как указывалось выше, соединения формулы I и их фармацевтически приемлемые соли обладают ценными фармакологическими свойствами. Было установлено, что соединения по изобретению являются лигандами А рецепторов ГАМК, содержащих α5 субъединицу, и следовательно, могут применяться для лечения в тех случаях, когда необходимо стимулирование познавательной способности.
Соединения тестировали по следующей методике
Получение мембранной фракции и анализ связывания с рецептором.
Сродство соединений к подтипам А рецептора ГАМК определяли конкурентным связыванием с [3Н]флумазенилом (85 Ки/ммоль, фирма Amersham) в клетках SF9, экспрессирующих рецепторы крысы следующего состава: α1β3γ2, α2β3γ2, α3β3γ2 и α5β3γ2.
Клеточный осадок суспендировали в трис-буферном растворе Кребса (буферный раствор для анализа связывания лигандов, 4,8 мМ KCl, 1,2 мМ CaCl2, 1,2 мМ MgCl2, 120 мМ Nad, 15 мМ трис, рН 7,5), гомогенизировали в блендере Polytron в течение приблизительно 15 сек на льду и центрифугировали на центрифуге UZ при 4°С в течение 30 мин (100000 g, ротор: TFT 4594=300000 об./мин). Клеточный осадок ресуспендировали в трис-буферном растворе Кребса и гомогенизировали в блендере Polytron в течение приблизительно 15 сек на льду. Готовили аликвотные части объемом 1 мл, определяли содержание белка (по Бредфорду) и полученные аликвотные части мембранной фракции хранили при -70°С.
Анализ связывания радиоактивного лиганда проводили в 200 мкл раствора (в 96-луночных планшетах), содержащих 100 мкл клеток, [3Н]флумазенил в концентрации 1 нМ при анализе связывания с субъединицами α1, α2, α3, и 0,5 нМ при анализе связывания с субъединицами α5, и анализируемое соединение в концентрации 10-10-3×10-6 М. Неспецифическое связывание определяли при использовании 10-5 М диазепама, которое обычно составляло менее 5% от общего связывания. Образцы инкубировали до достижения равновесия при 4°С в течение 1 ч, собирали на унифильтрах GF/C (фирма Packard) фильтрованием с использованием коллектора клеток (фирма Packard), а затем промывали ледяным буферным раствором для промывки (50 мМ трис, рН 7,5). После высушивания определяли радиоактивность на фильтрах на жидкостном сцинтиляционном счетчике. Значения Ki рассчитывали по программе Excel-Fit (Microsoft) и использовали среднее значение по двум измерениям.
Соединения, описанные в примерах, испытывали по вышеописанной методике. Величины Ki для всех соединений, определенные по вытеснению [3Н]флумазенила из α5 субъединицы А рецептора ГАМК крысы, составляли 100 нМ или ниже. В предпочтительном варианте соединения по изобретению селективно связываются с α5 субъединицей по сравнению с α1, α2 и α3 субъединицами.
Данные по активности некоторых предпочтительных соединений приведены ниже в таблице.
| Таблица | ||||
| Пример № | Ki [нМ] α1 | Ki [нМ] α2 | Ki [нМ] α3 | Ki [нМ] α5 |
| 1 | 30,6 | 57,6 | 39,2 | 1,3 |
| 6 | 407,8 | 361,5 | 148,8 | 10,8 |
| 13 | 34,9 | 55,5 | 23,7 | 1,2 |
| 19 | 480,9 | 500,1 | 482,3 | 14,5 |
| 20 | 802,7 | 283,9 | 190,9 | 10,7 |
| 25 | 95,3 | 122,8 | 107,4 | 5,9 |
| 37 | 295,8 | 266,1 | 162,0 | 8,2 |
| 47 | 694,5 | 224,6 | 100,3 | 13,1 |
| 50 | 1002,9 | 409,4 | 220,1 | 14,4 |
| 54 | 64,6 | 148,0 | 108,2 | 12,9 |
| 69 | 359,8 | 308,4 | 158,1 | 7,0 |
| 61 | 67,3 | 53,0 | 18,9 | 1,3 |
| 63 | 12,5 | 10,7 | 5,6 | 0,6 |
Соединения формулы I, а также их фармацевтически приемлемые кислотно-аддитивные соли, можно использовать в качестве лекарственных средств, например, в форме лекарственных препаратов. Фармацевтические препараты можно вводить перорально, например, в форме таблеток, таблеток в оболочке, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение можно проводить ректально, например, в форме суппозиториев, или парентерально, например, а форме инъекционных растворов.
Соединения формулы I, а также их фармацевтически приемлемые кислотно-аддитивные соли, можно смешивать с фармацевтически инертными, неорганическими или органическими эксципиентами для изготовления, таблеток, таблеток в оболочке, драже и твердых желатиновых капсул. В качестве таких эксципиентов, например, для таблеток, драже и твердых желатиновых капсул, можно использовать лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т.п. Пригодными эксципиентами для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п.
Пригодными эксципиентами для приготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар, глюкоза и т.п. Пригодными эксципиентами для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.п. Пригодными эксципиентами для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.п.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизирующие, стабилизирующие, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для регуляции осмотического давления, буферные вещества, маскирующие агенты или антиоксиданты. Кроме того, они могут содержать другие терапевтически ценные вещества.
Дозировки можно варьировать в широких пределах в соответствии с индивидуальными требованиями в каждом конкретном случае. Обычно при пероральном введении достаточной является суточная доза от 10 до 1000 мг соединения общей формулы I, хотя верхний предел можно превысить в случае необходимости.
Настоящее изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Промежуточное соединение А
(2,4-Диметоксибензиламино)уксусная кислота
Это промежуточное соединение известно1 и его можно получить способами, известными в данной области техники, например, по следующей методике:
Глицин (100 г, 1,33 моля) растворяли в 1н. NaOH (1,6 л) и обрабатывали раствором 2,4-диметоксибензальдегида (200 г, 1,20 моля) в МеОН (800 мл). Полученный раствор гидрировали над 10% Pd/C (40 г) в атмосфере водорода при давлении 1,1 бар при комнатной температуре (КТ) в течение 2 ч. Катализатор отделяли фильтрованием и промывали МеОН (500 мл). Фильтрат концентрировали до приблизительно 2 л, выпаривая весь МеОН. Полученный щелочной водный раствор охлаждали льдом и подкисляли 3н. HCl (приблизительно 500 мл) до рН 4, что приводило к осаждению продукта. Твердое вещество белого цвета отделяли фильтрованием и промывали ледяной водой (200 мл). Влажные кристаллы высушивали при 60°С, сначала при 25 мбар в течение ночи, а затем при 0,1 мбар в течение 8 ч. При этом получали 232 г (85%) продукта, содержащего в качестве примеси 3% NaCl. Продукт использовали без дополнительной очистки, tпл 115°С, m/z 225 (М).
Промежуточное соединение Б
Этиловый эфир (Е)-(диметиламинометиленамино)уксусной кислоты
Это промежуточное соединение известно и его можно получить
способами, известными в данной области техники, например, по следующей методике:
Метод А
Смесь глицина (69,8 г, 0,8 моля) и диэтилацеталя М,Н-диметилформамида (69,8 мл, 4,0 моля) кипятили с обратным холодильником и образующийся этанол удаляли с использованием ловушки Дина-Старка. Продукт перегоняли, выход 108,4 г (86%). tкип.120-122°С/28 мбар.
Метод Б
Гидрохлорид этилового эфира глицина порциями растворяли в 10% водном растворе Na2CO3, полученный раствор насыщали NaCl, фильтровали и фильтрат дважды экстрагировали CH2Cl2 (400 мл). Органический слой сушили, фильтровали и осторожно упаривали. Остаток перегоняли при 45°С/18 мбар. При этом получали этиловый эфир глицина (32 г, 43%) в виде бесцветной жидкости.
Этиловый эфир глицина (35 г, 339 ммолей) растворяли в диэтилацетале N,N-диметилформамида (64 мл, 373 ммоля) и нагревали до 130°С. Этанол (приблизительно 20 мл) отгоняли с использованием ловушки Дина-Старка. Остаток перегоняли при 110 С/18 мбар, продукт получали в виде жидкости желтоватого цвета (52 г, 97%). m/z 159 (М+Н).
Промежуточное соединение В
(Е/Z)-N'-(3-Циклопропил[1,2,4]оксадиазол-5-илметил)-N,N-диметилформамидин
Стадия 1
N-[(3-Циклопропил-1,2,4-оксадиазол-5-ил)метил]фталимид
N-Фталоилглицин (90,7 г, 442 ммоля) порциями (по причине комкования) растворяли в ДМФ (500 мл). Затем порциями добавляли 1,1'-карбонилдиимида-зол (78,9 г, 486 ммолей) (внимание: выделение СО). Полученную суспензию нагревали при 80°С в течение 20 мин, а затем охлаждали до КТ, добавляли циклопропанкарбоксамидоксим и нагревали при 110°С в течение 2 ч. Раствор охлаждали до КТ, выливали в воду (4 л), перемешивали в течение 15 мин, фильтровали, (продукт на фильтре) промывали водой (400 мл) и высушивали, выход 104 г (87%). tпл 115°С, m/z 269 (М).
Стадия 2
4-(Аминометил)-3-циклопропил-1.2.4-оксадиазол
N-[(3-Циклопропил-1,2,4-оксадиазол-5-ил)метил]фталимид (104 г, 387 ммолей) растворяли в 1,2-дихлорэтане (500 мл), затем добавляли N-метилгидразин (22,4 мл, 426 ммолей) и раствор кипятили с обратным холодильником в течение 5 ч. Суспензию охлаждали льдом, осадок (2-метил-2,3-дигидрофталазин-1,4-дион) отделяли фильтрованием и промывали 1,2-дихлорэтаном (100 мл). Фильтрат упаривали, остаток перегоняли при 70°С/0,4 мбар (при температуре бани 100-150°С), выход 39,3 г (73%). m/z 139 (М).
Стадия 3
(Е/Z)-N'-(3-Циклопропил[1,2,4]оксадиазол-5-илметил)-N,N-диметилформ-амидин
4-(Аминометил)-3-циклопропил-1,2,4-оксадиазол (39,3 г, 282 ммоля) растворяли в диэтилацетале N,N-диметилформальдегида (77 мл, 451 ммоль) и нагревали при 130°С до полного упаривания образовавшегося EtOH (холодильник Хикмана). Избыток реагента удаляли перегонкой в вакууме, а затем перегоняли продукт при температуре бани 140-150°С/0,1 мбар, выход 49,3 г (90%). m/z 195(MH+).
Пример 1
Этиловый эфир 3-метокси-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d] [1,4]бензодиазепин-10-карбоновой кислоты
Стадия 1
6-Метокси-2Н-3,1-бензоксазин-2,4(1Н)-дион
Это промежуточное соединение известно и его можно получить способами, известными в данной области техники, например, по следующей методике:
2-Амино-5-метоксибензойную кислоту (19,3 г, 115 ммолей) растворяли в диоксане (200 мл), обрабатывали бис(трихлорметил)карбонатом (11,3 г, 38 ммолей) и кипятили с обратным холодильником в течение 1 ч. Суспензию охлаждали до КТ, кристаллы отделяли фильтрованием и промывали диоксаном (20 мл). Маточный раствор упаривали, остаток кристаллизовали из этилацетата, выход 20,9 г (94%). tпл 244°C (разл.), m/z 193 (М).
Стадия 2
4-(2,4-Диметоксибензил)-7-метокси-3,4-дигидро-1Н-бензо[е][1,4]диазепин-2,5-дион
6-Метокси-2Н-3,1-бензоксазин-2,4(1Н)-дион (23 г, 119 ммолей) и (2,4-диметоксибензиламино)уксусную кислоту (27 г, 120 ммолей) суспендировали в пара-ксилоле (500 мл) и кипятили с обратным холодильником (140°С) в атмосфере аргона в течение 2 ч. Горячий раствор охлаждали до КТ, при этом наблюдалась самопроизвольная кристаллизация продукта. Кристаллы отделяли фильтрованием и промывали пара-ксилолом (50 мл), выход 39 г (92%). tпл 196°С, m/z 356(М).
Стадия 3
2-Хлор-4-(2,4-диметоксибензил)-7-метокси-3,4-дигидробензо-[е][1,4]диазепин-5-он
4-(2,4-Диметоксибензил)-7-метокси-3,4-дигидро-1Н-бензо[е][1,4]диазепин-2,5-дион (23,7 г, 67 ммолей) и N,N-диметил-пара-толуидин (19,2 мл, 133 ммоля) смешивали в толуоле (200 мл) и нагревали при 100°С. Затем по каплям добавляли оксихлорид фосфора (6,7 мл, 73 ммоля) и нагревали при 100°С в течение еще 2,5 ч. Полученный раствор темно-красного цвета упаривали досуха, остаток растворяли в ТГФ (150 мл) и использовали непосредственно на следующей стадии.
Стадия 4
Этиловый эфир 5-(2,4-диметоксибензил)-8-метокси-6-оксо-5,6-дигидро-4Н-2,5,10b-триазабензо[е]азулен-3-карбоновой кислоты
Гексаметилдисилазан (48,5 мл, 66 ммолей) растворяли в ТГФ (150 мл), охлаждали в атмосфере аргона до -70°С и медленно обрабатывали 1,6 М раствором н-бутиллития в гексане (145 мл, 233 ммоля). После перемешивания при -70°С в течение 1 ч добавляли раствор этилового эфира (Е)-(диметиламино-метиленамино)уксусной кислоты (21 г, 133 ммоля) в ТГФ (50 мл) и перемешивали при -70°С в течение 1 ч. Затем при -70°С добавляли раствор 2-хлор-4-(2,4-диметоксибензил)-7-метокси-3,4-дигидробензо[е][1,4]-диазепин-5-она (24,9 г, 66 ммолей) в ТГФ (150 мл), нагревали до 10°С в течение приблизительно 1 ч и снова охлаждали до -30°С. Затем медленно при охлаждении до -30°С добавляли ледяную уксусную кислоту (38 мл, 664 ммоля), мутную суспензию нагревали до 0°С, добавляли воду (40 мл) и полученный раствор кипятили с обратным холодильником в течение 1 ч, что приводило к образованию густого осадка. Горячую суспензию разбавляли водой (450 мл), охлаждали до 30°С, фильтровали, кристаллы белого цвета на фильтре промывали ТГФ/водой (1:1, 400 мл) и сушили при 60°С/25 мбар, выход 16,7 г (56%). tпл 204°C, m/z 451 (M).
Стадия 5
Этиловый эфир 8-метокси-6-оксо-5,6-дигидро-4Н-2,5,10b-триазабензо[е]-азулен-3-карбоновой кислоты
Этиловый эфир 5-(2,4-диметоксибензил)-8-метокси-6-оксо-5,6-дигидро-4Н-2,5,10b-триазабензо[е]азулен-3-карбоновой кислоты (9,8 г, 22 ммоля) суспендировали в CH2Cl2 (50 мл), охлаждали льдом и медленно разбавляли трифторуксусной кислотой (50 мл). Полученный прозрачный раствор обрабатывали при 5°С трифторметансульфоновой кислотой (3,8 мл, 44 ммоля). Полученный раствор красного цвета перемешивали при КТ в течение 2 ч, упаривали досуха, остаток экстрагировали CH2Cl2 (500 мл), а затем двумя порциями 10% раствора NaHCO3 (500 мл). Неочищенный продукт (приблизительно 10 г) обрабатывали горячим этилацетатом (100 мл), охлаждали, кристаллы белого цвета отделяли фильтрованием (5,6 г, 85%). tпл 240°С, m/z 301 (М).
Стадия 6
Этиловый эфир 6-хлор-8-метокси-4Н-2,5,10b-триазабензо[е]азулен-3-карбоновой кислоты
Этиловый эфир 8-метокси-6-оксо-5,6-дигидро-4Н-2,5,10b-триазабензо[е]-азулен-3-карбоновой кислоты (7,5 г, 25 ммолей) и N,N-диметил-пара-толуидин (10,8 мл, 75 ммолей) смешивали в хлорбензоле (80 мл) в атмосфере аргона. Затем при КТ добавляли оксихлорид фосфора (3,4 мл, 37 ммолей) и смесь кипятили с обратным холодильником в течение 3,5 ч. Полученный раствор охлаждали до КТ, разбавляли СН2Cl2/ацетоном, 100:15, (300 мл) и непосредственно очищали экспресс-хроматографией на силикагеле (СН2Cl2/ацетон, 100:15). Продукт белого цвета перекристаллизовывали растворением в горячем этилацетате (300 мл) и концентрированием до начала осаждения (приблизительно до 100 мл), выход 7 г (88%). tпл 186°C, m/z 301 (М).
Стадия 7
Этиловый эфир 3-метокси-9Н-имидазо[1,5-а][1,2,4]триазоло[4,3-d][1,4]-бензодиазепин-10-карбоновой кислоты
Смесь этилового эфира 6-хлор-8-метокси-4Н-2,5,10b-триазабензо[е]азулен-3-карбоновой кислоты (0,1 г, 0,31 ммоля), формилгидразина (41 мг, 0,69 ммоля) и N-этилдиизопропиламина (0,054 мл, 0,31 ммоля) в хлорбензоле (1 мл) кипятили с обратным холодильником в течение 4 ч. Затем реакционную смесь экстрагировали СН2Cl2/водой, органический слой сушили и упаривали. Остаток очищали экспресс-хроматографией на силикагеле (CH2Cl2/MeOH, 30:1). tпл l97°C, m/z 325 (M).
Пример 2
Этиловый эфир 3-метил-9Н-имидазо[1,5-а][1,2,4]триазоло[3,4-d][1,4]-бензодиазепин-10-карбоновой кислоты
Стадия 1
6-Метил-2Н-3,1-бензоксазин-2,4-(1Н)-дион
Это промежуточное соединение известно и его можно получить способами, известными в данной области техники, например, по следующей методике:
Смесь 2-амино-5-метилбензойной кислоты (45,2 г, 0,30 моля) и этилхлорформиата (31,4 мл, 0,33 моля) в диоксане (250 мл) кипятили с обратным холодильником в течение 4,5 ч. После охлаждения добавляли ацетилхлорид (50 мл) и кипячение с обратным холодильником продолжали в течение еще 4 ч. После охлаждения смесь упаривали и полученное твердое вещество обрабатывали трет-бутилметиловым эфиром/гептаном (1:1, 400 мл) при кипячении с обратным холодильником в течение 1 ч. Твердое вещество отделяли фильтрованием и промывали трет-бутилметиловым эфиром/гептаном (1:1, 80 мл), выход 47,7 г (90%). m/z 177 (M).
Стадия 2
4-(2,4-Диметоксибензил)-7-метил-3,4-дигидро-1Н-бензо[е][1,4]диазепин-2,5-дион
Суспензию 6-метил-2Н-3,1-бензоксазин-2,4-(1Н)-диона (18,3 г, 103 ммоля) в пара-ксилоле (125 мл), содержащую (2,4-диметоксибензиламино)уксусную кислоту (25,6 г, 114 ммолей), кипятили с обратным холодильником (150°С) в течение 2,5 ч. После охлаждения до КТ осадок отделяли фильтрованием и промывали пара-ксилолом (2×20 мл), выход 34,1 г (97%). m/z 341 (МН+).
Стадия 3
2-Хлор-4-(2,4-диметоксибензил)-7-метил-3,4-дигидробензо[е][1,4]диазепин-5-он
4-(2,4-Диметоксибензил)-7-метил-3,4-дигидро-1Н-бензо[е][1,4]диазепин-2,5-дион (34,0 г, 100 ммолей) и N,N-диметил-пара-толуидин (28,9 мл, 200 ммолей) смешивали в толуоле (100 мл) и нагревали до 100°С. Затем по каплям добавляли оксихлорид фосфора (10,1 мл, 110 ммолей) и нагревали при 100°С в течение еще 2,5 ч. Полученный раствор темно-красного цвета непосредственно использовали на следующей стадии.
Стадия 4
Этиловый эфир 5-(2,4-диметоксибензил)-8-метил-6-оксо-5,6-дигидро-4Н-2,5,10b-триазабензо[е]азулен-3-карбоновой кислоты
Гексаметилдисилазан (68,7 мл, 330 ммолей) растворяли в ТГФ (350 мл), охлаждали в атмосфере аргона до -70°С и медленно обрабатывали 1,6 М раствором н-бутиллития в гексане (206 мл, 330 ммолей). После перемешивания при -70°С в течение 1 ч добавляли раствор этилового эфира (Е)-(диметиламино-метиленамино)уксусной кислоты (31,6 г, 200 ммолей) в ТГФ (30 мл), и перемешивали при -70°С в т