Новые субстраты концевой дезоксинуклеотидилтрансферазы
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии, биотехнологии и фармацевтической химии. Более конкретно изобретение касается новых неприродных субстратов фермента концевой дезоксинуклеотидилтрансферазы (TDT), которые могут быть использованы в качестве инструмента для введения метки по 3'-гидроксилу олигодезоксинуклеотидов и одноцепочечных ДНК. Описываются новые субстраты концевой дезоксинуклеотидилтрансферазы общей формулы I
где R является маркерной группой, выбранной из дансила, динитрофенила, флуоресцеина, флуоренилметилоксикарбонила, родамина В, тетраметилродамина, эозина, эритрозина, триоксалена, BODIPY, биотина, аурамина, псоралена, пирена, техасского красного, актиномицина D, 7-метоксикумарина, эллиптицина; Х является линкером, представляющим собой линейную углеродную цепь, которая содержит гетероатомы, такие как азот и кислород, и в качестве функциональных групп цепь может содержать карбонил и тиокарбонил. Технический результат - получены новые эффективные субстраты TDT. 2 ил., 1 табл.
Реферат
Настоящее изобретение относится к области молекулярной биологии, биотехнологии и фармацевтической химии. Более конкретно изобретение касается новых неприродных субстратов фермента концевой дезоксинуклеотидилтрансферазы (TDT), которые могут быть использованы в качестве инструмента для введения метки по 3'-гидроксилу олигодезоксинуклеотидов и одноцепочечных ДНК.
Новые субстраты представляют собой аналоги нуклеозидтрифосфатов, содержащие вместо нуклеозидной компоненты маркерные группы.
Концевая дезоксинуклеотидилтрансфераза (TDT), матрично-независимая ДНК-полимераза, играет важную роль при формировании иммунной системы человека и животных. В настоящее время TDT широко используется в молекулярной биологии. Природными субстратами этого фермента являются дезоксинуклеозидтрифосфаты. Однако ранее было показано [Arzumanov A.A., Victorova L.S., Jasko M.V. Synthesis of non-nucleoside triphosphate analogues, a new type of substrates for terminal deoxynucleotidyl transferase, Nucleosides, Nucleotides & Nucleic Acids, 2000, 19, №10-12, 1787-1793], что наличие нуклеозидного фрагмента не является обязательным для проявления субстратных свойств по отношению к TDT. Осуществлен синтез целого ряда трифосфатов, содержащих вместо нуклеозидной компоненты различные объемные заместители [Arzumanov A.A., Victorova L.S., Jasko M.V., Yesipov D.S., Krayevsky A.A. Terminal Deoxynucleotidyl Transferase Catalyzes the Reaction of DNA Phosphorylation., Nucl. Acids Res., 2000, 28, №5, 1276-1281]. Показано, что соединения такого типа являются субстратами TDT. Эффективность таких соединений как субстратов TDT зависит от структуры введенного вместо нуклеозидного фрагмента объемного заместителя и от длины и структуры линкера [A.L. Khandazhinskaya, M.V. Jasko, E.A. Shirokova, M.K. Kukhanova " New substrates of terminal deoxynucleotidyl transferase: synthesis and biological evaluation" Collection Symposium Series. 2002, v 5, p.344-347].
Введение маркерных групп в олигонуклеотиды в настоящее время широко применяется в молекулярной биологии и осуществляется путем химического введения меток или ферментативного присоединения модифицированных нуклеотидов. Несмотря на это, разработка новых методов введения маркерных групп в олигонуклеотиды остается весьма актуальной задачей. Разработанный в нашей лаборатории подход позволяет использовать нуклеозиднесодержащие субстраты TDT для введения маркерных групп в олигонуклеотиды и одноцепочечные ДНК, что является принципиально новым способом введения меток.
Перед авторами настоящего изобретения стояла задача создания новых эффективных субстратов TDT и расширения арсенала таких субстратов, что необходимо для решения задач молекулярной биологии, биотехнологии и медицины.
Настоящее изобретение позволяет получать эффективные субстраты TDT, которые представляют собой трифосфаты общей формулы I:
где R - маркерная группа;
X - линкер, представляющий собой линейную углеводородную цепь, которая может содержать двойные и/или тройные связи, ароматические циклы; гетероатомы, такие как кислород, сера, азот; при этом в качестве функциональных групп цепь может содержать гидрокси-, амино-, амидо-, карбонил-, тиокарбонил-, карбокси- и тиокарбокси- и ароматические группы.
В качестве маркерных групп могут быть использованы: дансил, динитрофенил, флуоренилметилоксикарбонил, биотин, аурамин, псорален, пирен, флуоресцеин, техасский красный, актиномицин D, BODIPY, 7-метоксикумарин, эозин, эритрозин, триоксален, родамин В, тетраметилродамин, эллиптицин и любая другая известная в качестве маркерной группа.
Соединения формулы I получают по одной из двух схем. Одна из них заключается в первоначальном получении трифосфата линкерной части молекулы с последующим введением маркерной группы. Другой подход предполагает присоединение маркерной группы к линкеру и последующее фосфорилирование.
Нами обнаружено, что соединения типа I, несущие вместо нуклеозидного фрагмента линкеры с маркерньми (репортерными или лигандными) группами, являются эффективными субстратами TDT.
Механизм ферментативной реакции с участием соединений типа I описывается следующим уравнением:
где (pdN)npdN - олигонуклеотид или однонитевая ДНК
Фиг.1 иллюстрирует субстратные свойства соединений Ia и Iб. На фиг.1 приведено разделение продуктов реакции в денатурирующем 15% полиакриламидном геле после включения соединений Ia и Iб в 3'-конец олигонуклеотида при катализе терминальной дезоксинуклеотидилтрансферазой.
Фиг.2 иллюстрирует субстратные свойства соединения Iв. На фиг.2 приведено разделение продуктов реакции в денатурирующем 15% полиакриламидном геле после включения соединения Iв в 3'-конец олигонуклеотида терминальной дезоксинуклеотидилтрансферазой.
Изобретение иллюстрируется следующими примерами.
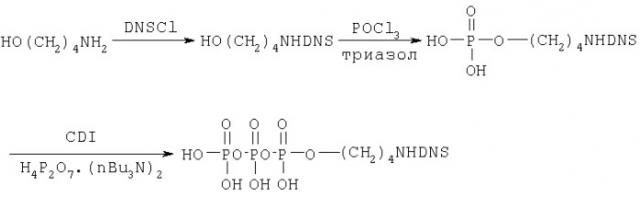
Пример 1. Получение N-(5-N,N-диметиламинонафталин-1-сульфонил)-аминобутил трифосфата (Ia).
Синтез соединения Ia осуществляли по следующей схеме:
где DNS-дансильный радикал формулы:
1.1. N-(5-N,N-диметиламинонафталин-1-сульфонил)-аминобутанол
Смесь аминобутанола (178 мг, 1 ммоль) и 5-N,N-диметиламинонафталин-1-сульфонилхлорида (135 мг, 0,5 ммоль) в 3 мл диоксана перемешивали 20 час при 20°С, затем упаривали и продукт выделяли на колонке (2×17 см) с силикагелем (Merck). Элюцию проводили порциями по 100 мл хлороформа, затем с 1, 2 и 3% МеОН в хлороформе. Продукт элюировали 4% МеОН в хлороформе, упаривали. Выход 67мг (41%).
УФ (МеОН) λmax 337 (ε 2500), λmax 250 (ε 8670), λmax 219 (ε 21700).
1Н ЯМР (CDCl3): 1,40 м (4Н, (CH2)2центр.), 2,91 м (8Н, 2СН3+CH2N), 3,50 т (2Н, J 5,9, СН2O), 5,21 т (1Н, J 5,9, NH), 7,17 д (1Н, J 7,48, Н-6), 7,53 м (2Н, Н-3+Н-7), 8,21 д (1Н, J 7,16, Н-8), 8,23 д (2Н, J 8,41, Н-4), 8,29 д (1Н, J 8,4, Н-2).
1.2. N-(5-N,N-диметиламинонафталин-1-сульфонил)аминобутиловый эфир фосфорной кислоты
К раствору 1,2,4-триазола (35 мг, 500 мкмоль) в 1 мл абс. CH3CN и триэтиламина (80 мкл, 500 мкмоль) добавляли при -10°С POCl3 (15,8 мкл, 170 мкмоль), смесь выдерживали 40 мин при -10°С и центрифугировали. Супернатант добавляли к N-(5-N,N-диметиламинонафталин-1-сульфонил)аминобутанолу (18 мг, 56,7 мкмоль), предварительно высушенного 3-кратным упариванием с абс. пиридином. Через 2 часа при 20°С смесь разбавляли водой (50 мл), выдерживали 1 час и наносили на колонку (2×9 см) с DEAE-Toyopearl 650 (Toyo Soda, Япония). Элюировали в линейном градиенте концентраций NH4НСО3 (0→0,4 М) в 10% МеОН (объем элюента 0,6 л). Фракции, содержащие продукт, упаривали, переупаривали с водой (10×10 мл), остаток лиофилизовали. Выход 11,8 мг (27 мкмоль, 47%).
УФ (вода) λmax 333 (ε 2500), λmax 245 (ε 8670), λmax 216 (ε 21700).
1Н ЯМР (D2O): 1,14 м (4Н, (СН2)2центр.), 2,87 м (2Н CH2N), 3,03 м (6Н, (СН3)2)) 3,50 м (2Н, СН2O), 7,43 д (1Н, J 7.78, Н-6), 7,58 м (2Н, Н-3+Н-7), 8,14 д (1Н, J 7,16, Н-8), 8,29 д (2Н, J 8,41, Н-4), 8,34 д (1Н, J 8,4, Н-2). 31P ЯМР (D2O) 2,1 с.
1.3. N-(5-N,N-диметиламинонафталин-1-сульфонил)-4-аминобутиловый эфир трифосфорной кислоты
К раствору триэтиламмонийной соли N-(5-N,N-диметиламинонафталин-1-сульфонил)аминобутил фосфата (15,1 мг, 25 мкмоль) в абс. ДМФ (3 мл) добавляли N,N'-карбонилдиимидазол (CDI) (32 мг, 0,2 ммоль). Реакционную смесь перемешивали 18 ч при 4°С в атмосфере аргона, затем добавляли МеОН (0,33 мл, 8 ммоль) и оставляли на 40 мин при 20°С. Реакционную смесь концентрировали до 2 мл и добавляли 0,3 М (Bu3NH)2H2P2O7 в ДМФ (0,5 мл). Реакционную смесь перемешивали 18 ч при 20°С, затем разбавляли водой до 10 мл и наносили на колонку с Dowex 50 (2×5 см) в NH4 + форме, элюировали водой. УФ-поглощающие фракции упаривали, остаток растворялили в 0,3 мл воды и нанесли на колонку с LiChroprep RP 8 (1×15 см) в 5 мМ NH4HCO3. Элюцию проводили в линейном градиенте концентраций МеОН (0→20%) в 5 мМ NH4НСО3. Фракции, содержащие целевой продукт, упаривали, переупаривали с водой (2×5 мл) и лиофилизовали. Выход 5,9 мг (9,3 мкмоль, 37%).
УФ (вода) λmax 333 (ε 2500), λmax 245 (ε 8670), λmax 216 (ε 21700).
1Н ЯМР (D2O): 1,27 м (4Н, (СН2)2центр.), 2,74 с (6Н, (СН3)2), 2,81 м (2Н CH2N), 3,59 м (2Н, CH2О), 7,29 д (1Н, J 7,78, Н-6), 7,56 м (2Н, Н-3+Н-7), 8,12 д (1Н, J 7,16, Н-8), 8,33 д (1Н, J 8,41, Н-4), 8,37 д (1Н, J 8,4, Н-2)
31Р ЯМР (D2O)-7,4 д (JPα,Pβ 19,5 Pα), -10,6 д (JPβ,Pγ 20,3 Рγ), -22,2 т (Рβ).
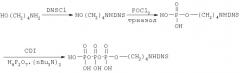
Пример 2. Получение N-[(5-N,N-диметиламинонафталин-1-сульфонил)аминогексаноил]-2-аминоэтилового эфира трифосфорной кислоты (Iб).
Синтез соединения Iб осуществляли по следующей схеме:
2.1. N-[(5-N,N-диметиламинонафталин-1-сульфонил)аминогексаноил]-2-аминоэтиловый эфир фосфорной кислоты
К раствору N-[(5-N,N-диметиламинонафталин-1-сульфонил)аминогексановой кислоты (54 мг, 0,15 ммол) в 3 мл абс. ДМФ добавляли CDI (48 мг, 0,3 ммоль). Реакционную смесь перемешивали 1 ч при 20°С, затем добавляли к раствору аминоэтилфосфата (28 мг, 0,2 ммол) в 3 мл воды и 20 мкл триэтиламина. Через 18 ч при 20°С смесь разбавляли водой (50 мл) и наносили на колонку с DEAE-Toyopearl 650 (2×9 см). Элюировали в линейном градиенте концентраций NH4HCO3 (0→0,4 М, 0,6 л) в 10% МеОН. Фракции, содержащие продукт, упаривали, переупаривали с водой (10×10 мл), остаток лиофилизовали. Выход 49,5 мг (95 мкмоль, 63%).
УФ (вода) λmax 333 (ε 2500), λmax 245 (ε 8670), λmax 216 (ε 21700).
1Н ЯМР (D2O): 0,92 м (2Н, -СН2-центр.), 1,08 м (4Н, 2(СН2)), 1,80 т (2Н, 7,5 Гц, СНзN), 2,84 с (6Н, N(CH3)2), 2,89 т (2Н, 6,53 Гц, CH2O), 3,20 т (2Н, 7,17 Гц, CH2NH), 3,26 т (2Н, 4,78 Гц, CH2О), 7,39 д (1Н, J 7,79, Н-6), 7,66 м (2Н, Н-3+Н-7), 8,22 д (1Н, J 6,54, Н-8), 8,24 д (2Н, J 8,72, Н-4), 8,47 д (1Н, J 8,72, Н-2). 31P ЯМР (D2O) 4,5 с.
2.2. N-[(5-N,N-диметиламинонафталин-1-сульфонил)аминогексаноил]-2-аминоэтиловый эфир трифосфорной кислоты
К раствору триэтиламмонийной соли 2-N-[(5-N,N-диметиламинонафталин-1-сульфонил)аминогексаноил]аминоэтил фосфата (17,2 мг, 25 мкмоль) в 3 мл абс. ДМФ добавляли карбонилдиимидазол (32 мг, 0.2 ммоль). Реакционную смесь перемешивали 18 ч при 4°С в атмосфере аргона, затем добавляли МеОН (0,33 мл, 8 ммоль) и оставляли на 40 мин при 20°С. Реакционную смесь концентрировали до 2 мл и добавляли 0,3 М раствор (Bu3NH)2H2P2O7 (0,5 мл, 150 мкмоль). Реакционную смесь перемешивали 18 ч при 20°С, затем разбавляли водой до 10 мл и наносили на колонку с Dowex 50 (2×5 см) в NH4 + форме. Вещество элюировали водой. УФ-поглощающие фракции упаривали, остаток растворяли в 0,3 мл воды и наносили на колонку с LiChroprep RP-8 (1×15 см) в 5 мМ NH4HCO3. Элюцию проводили в линейном градиенте концентраций МеОН (0→20%) в 5 мМ NH4НСО3. Фракции, содержащие целевой продукт, упаривали, соупаривали с водой (2×5 мл) и лиофилизовали. Выход 6,5 мг (9,3 мкмоль, 37%).
УФ (вода) λmax 333 (ε 2500), λmax 245 (ε 8670), λmax 216 (ε 21700).
1Н ЯМР (D2O): 0,92 м (2Н, -CH2-центр.), 1,08 м (4Н, 2(СН2)), 1,80 т (2Н, 7,47 Гц, CH2NH), 2,84 с (6Н, N(CH3)2), 2,89 т (2Н, 6,53 Гц, CH2O), 3,20 т (2Н, 7,17 Гц, CH2NH), 3,26 т (2Н, 4,78 Гц, СН2O), 7,39 д (1Н, J 7.79, Н-6), 7,66 м (2Н, Н-3+Н-7), 8,22 д (1Н, J 6,54, Н-8), 8,24 д (2Н, J 8,72, Н-4), 8,47 д (1Н, J 8,72, Н-2). 31P ЯМР (D2O) -6,4 д (JPα,Pβ 21,3 Pα), -10,3 д (JPβ,Pγ 19,3 Рγ), -21,8 т (Рβ).
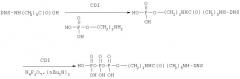
Пример 3. Получение N-[6-N-(2,4-динитрофенил)аминогексаноил]-2-аминоэтилового эфира трифосфорной кислоты (Iв)
Синтез соединения Iб осуществляли по следующей схеме:
3.1. N-[6-N-(2,4-Динитрофенил)аминогексаноил]-2-аминоэтиловый эфир фосфорной кислоты
К раствору 6-N-(2,4-динитрофенил)аминогексановой кислоты (44 мг, 0,15 ммоль) в 3 мл абс. ДМФ добавляли CDI (48 мг, 0,3 ммоль). Реакционную смесь перемешивали 1 ч при 20°С, затем добавляли к раствору аминоэтилфосфата (28 мг, 0,2 ммоль) в 3 мл воды и 20 мкл триэтиламина. Через 18ч при 20°С смесь разбавляли водой (50 мл) и наносили на колонку с DEAE-Toyopearl 650 (2×9 см), элюировали в линейном градиенте концентраций NH4НСО3 (0→0,4 М, 0,6 л) в 10% МеОН. Фракции, содержащие продукт, упаривали, переупаривали с водой (10×10 мл), остаток лиофилизовали. Выход 44,8 мг (0,1 ммоль, 67%).
УФ (вода) λmax 363 (ε 17500), λmax 265 (ε 8340).
1Н ЯМР (D2O):1,26 м (2Н, -СН2-центр), 1,51 м (4Н, 2СН2), 2,13 т (2Н, 7,16 Гц, СН2СО), 3,25 м (4Н, 2NCH2), 3,72 м (2Н, CH2OP), 6,85 д (1Н, 9,65 Гц, СН-6'), 7,97 дд (1Н, 2,18, СН-5'), 8,70 д (1Н, СН-3'). 31Р ЯМР (D2O) 2,12 с.
3.2. N-[6-N-(2,4-Динитрофенил)аминогексаноил]-2-аминоэтиловый эфир трифосфорной кислоты (Iв)
К раствору триэтиламмонийной соли 2-N-[6-N-(2,4-динитрофенил)аминогексаноил]аминоэтил фосфата (15,4 мг, 25 мкмоль) в 3 мл абс. ДМФ добавляли CDI (32 мг, 0,2 ммоль). Реакционную смесь перемешивали 18 ч при 4°С в атмосфере аргона, затем добавляли МеОН (0,33 мл, 8 ммоль) и оставляли на 40 мин при 20°С. Реакционную смесь концентрировали до 2 мл и добавляли 0,3 М раствор (Bu3NH)2H2P2O7 (0,5 мл, 150 мкмоль). Реакционную смесь перемешивали 18 ч при 20°С, затем разбавляли водой до 10 мл и наносили на колонку с Dowex 50 (2×5 см) в NH4 + форме. Вещество элюировали водой. УФ-поглощающие фракции упаривали, остаток растворяли в 0,3 мл воды и наносили на колонку с LiChroprep RP 8 (1×15 см) в 5 мМ NH4НСО3. Элюцию проводили в линейном градиенте концентраций МеОН (0→20%) в 5 мМ NH4НСО3. Фракции, содержащие целевой продукт, упаривали, соупаривали с водой (2×5 мл) и лиофилизовали. Выход 5,5 мг (8,8 мкмоль, 35%).
УФ (вода) λmax 363 (ε 17500), λmax 265 (ε 8340).
1Н ЯМР (D2O):1,28 м (2Н, -СН2-центр), 1,46 кв (2H, 6,48, -СН2-), 1,55 кв (2H, 6,48, -СН2-), 2,13 т (2H, 7,47 Гц, CH2СО), 3,27 т (1Н, 4,98, NHCH2), 3,34 т (1Н, 7,16, NHCH2), 3,88 м (2H, CH2ОР), 6,97 д (1Н, 9,65 Гц, СН-6'), 8,10 дд (1Н, 2,8, СН-5'), 8,93д(1Н,СН-3').
31Р ЯМР (D2O) -6,38 д (JPα,Pβ 21,4 Pα), -10,32 д (JPβ,Pγ 19,3 Рγ), -21,77 т (Рβ).
Пример 4. Получение N-(Флуоресцеинаминотиокарбонил)-8-амино-3,6-диоксаоктилового эфира трифосфорной кислоты (Iг).
Синтез соединения Iг осуществляли по следующей схеме:
4.1. N-(9-Флуоренилметоксикарбонил)-8-амино-3,6-диоксаоктан-1-ол
К раствору триэтиленгликоля (10 г, 66,5 ммоль) в пиридине (50 мл) прибавляли монометокситритилхлорид (2,7 г, 8,9 ммоль). Реакционную массу выдерживали 18 ч при 37°С. Продукт экстрагировали хлороформом в присутствии водного NaHCO3. Хлороформенные экстракты упаривали, остаток растворяли в пиридине (20 мл), охлаждали до 0°С и прибавляли метансульфонил хлорид (1,38 мл, 17,8 ммоль). Реакционную массу выдерживали 18 ч при 5°С, экстрагировали CCl4 в присутствии водного NaHCO3. Органические экстракты упаривали, остаток растворяли в диметилформамиде (30 мл), прибавляли NaN3 (1,16 г, 17,8 ммоль). Реакционную массу перемешивали 5 ч при 90°С, растворитель удаляли в вакууме, остаток экстрагировали CCl4 в присутствии воды. Органические экстракты упаривали, остаток растворяли в диметилформамиде (30 мл), прибавляли меркаптоэтанол (3 мл) и 25% водный аммиак (0,5 мл). Реакционную массу выдерживали 18 ч при комнатной температуре, наносили на колонку с Dowex-50 (NH4 + форма, 3×6 см), промывали колонку метанолом (50 мл), затем элюировали смесью метанола (90 мл) и 25% водного аммиака (10 мл). Растворители упаривали, остаток соупаривали с пиридином (2×20 мл), растворяли в пиридине (20 мл) и прибавляли 9-флуоренилметоксикарбонилхлорид (2,3 г, 8,9 ммоль) и выдерживали 18 ч при комнатной температуре. Реакционную массу разбавляли водным NaHCO3 и экстрагировали CCl4 (3×20 мл). Органические слои упаривали, соупаривали с толуолом (3×20 мл), прибавляли 80% водную уксусную кислоту (50 мл). Через 18 ч при комнатной температуре реакционную массу упаривали и хроматографировали на колонке (2×25 см) с силикагелем (63-100 мкм), элюировали 3% метанолом в хлороформе. Выход 440 мг (13%).
УФ (Н2O) λmax 265 (ε 17500).
1H-ЯМР (CDCl3+CD3OD): 7,76 д, 7,60 д [4Н, Н-1, 4, 5, 8 (Fmoc)], 7,39 т, 7,31 т [4Н, J 7,5, Н-2, 3, 6, 7 (Fmoc)], 4,41 д (2Н, J 6,9, CH2 (Fmoc)), 4,21 т [1Н, J 6,9, Н-9 (Fmoc)], 3,70-3,56 м (10Н, 5 CH2), 3,39 м (2Н, CH2N).
4.2. N-(9-Флуоренилметоксикарбонил)-8-амино-3,6-диоксаоктановый эфир трифосфорной кислоты
Раствор N-[(9-Флуоренилметоксикарбонил)-8-амино-3,6-диоксаоктанола (220 мг, 0,59 ммоль) в триэтилфосфате (1 мл) охлаждали до 0°С и прибавляли хлорокись фосфора (133 мкл, 1,43 ммоль). Реакционную массу выдерживали 18 ч при 5°С и при интенсивном перемешивании прибавляли смесь трибутиламина (1 мл, 4,3 ммоль) и 0,8 мМ раствора бис(трибутиламмоний)пирофосфата (3 мл, 2,4 ммоль) в диметилформамиде. Перемешивали реакционную массу 3 ч при комнатной температуре, наносили на колонку с Dowex-50 (NH4 + форма, 2×4 см), промывали колонку 50% водньм метанолом (50 мл). Растворители упаривали, хроматографировали на колонке (2×18 см) с LiChroprep RP-18 (25-40 мкм) в градиенте концентрации метанола в воде (0→20%). Выход 40 мг (11%).
УФ (H2O) λmax 265 (ε 17000).
1H-ЯМР (D2O): 7,80 д, 7,59 д [4Н, J 7,5, Н-1, 4, 5, 8 (Fmoc)], 7,41 т, 7,33 т [4Н, J 7,5, Н-2, 3, 6, 7 (Fmoc)], 4,47 м (2Н, CH2 (Fmoc)), 4,18 м [1Н, Н-9 (Fmoc)], 4,02 м (2Н, СН2OP), 3,64-3,38 м (8Н, 4 CH2), 3,11 м (2Н, CH2N). 31Р-ЯМР (D2O): -9,76 д (1P, J 19,3, Рγ), -10,49 д (IP, J 19,3, Рα), -22,49 т (1P, Pβ).
4.3. N-(Флуоресцеинаминотиокарбонил)-8-амино-3,6-диоксаоктиловый эфир трифосфорной кислоты
Растворяли N-[(9-Флуоренилметоксикарбонил)-8-амино-3,6-диоксаоктановый эфир трифосфорной кислоты (20 мг, 0,03 ммоль) в 25% водном аммиаке (5 мл). Через 16 ч при 5°С реакционную массу фильтровали, фильтрат упаривали до объема около 1 мл, приливали диметилформамид (1 мл), добавляли флуоресцеин изотиоцианат (20 мг, 0,05 ммоль) и триэтиламин (20 мкл). Перемешивали реакционную массу 18 ч при комнатной температуре, упаривали, соупаривали с водой (3×10 мл) и наносили на колонку (2×18 см) с LiChroprep RP-8 (25-40 мкм). Элюировали 0,05 М водным NH4HCO3. Выход 1 мг (5%).
УФ (Н2O, рН 9,0) λmax 492 (ε 65000).
1Н-ЯМР (D2O): 6,94 м, 7,50 м, 7,76 м, 7,92 с (9Н, флуоресцеин), 4,25 м (2Н СН2OP), 3,89 м (10Н, 5 CH2). 31Р-ЯМР (D2O): -9,84 д (1P, J 18,3, Рγ), -10,49 д (1P, J 19,3, Рα),-22,59 дд (1P, Рβ).
Пример 5. Получение N-(Родаминаминотиокарбонил)-2-аминоэтилового эфира трифосфорной кислоты (Iд).
Синтез соединения Iд осуществляли по следующей схеме:
где RdB - радикал формулы:
5.1. N-(Родаминаминотиокарбонил)-2-аминоэтиловый эфир фосфорной кислоты
Аминоэтиловый эфир фосфорной кислоты (141 мг, 1 ммоль) растворяли в диметилформамиде (5 мл), добавляли родамин В изотиоцианат (107 мг, 0,2 ммоль), метилимидазол (40 мкл) и триэтиламин (200 мкл). Перемешивали реакционную массу 18 ч при комнатной температуре, упаривали, растворяли в воде (20 мл), раствор экстрагировали CCl4 (3 мл), н.бутанолом (2×3 мл) и наносили на колонку (2,2×12 см) с DEAE-целлюлозой, элюировали 30% раствором МеОН в градиенте концентрации NH4HCO3 (0→0,2М). Целевые фракции объединяли и лиофилизовали. Выход 40 мг (20%).
УФ (Н2О) λmax 556 (ε 59000). 1H-ЯМР (D2O): 8,09 м, 7,74 м, 7,61м, 7,22 м, 7,07 м, 6,97 м, 6,62 м, 6,36 с, 6,28 с (9Н, PdB), 3,89 м (2Н, CH2O), 3,69 м (2Н, CH2N), 3,31 м (8Н, 4×СН2СН3), 0,99 м (12Н, 4×СН2СН3). 31Р-ЯМР (D2O): 2,59 с
5.2. N-(Родаминаминотиокарбонил)-2-аминоэтиловый эфир трифосфорной кислоты
N-(Родаминаминотиокарбонил)-2-аминоэтиловый эфир фосфорной кислоты (40 мг, 0,045 ммоль) растворяли в диметилформамиде (3 мл), два раза соупаривали с диметилформамидом (2×3 мл), добавляли CDI (73 мг, 0,45 ммоль). Реакционную смесь перемешивали 18 ч при 4°С в атмосфере аргона, затем добавляли МеОН (0,33 мл, 8 ммоль) и оставили на 40 мин при 20°С. Реакционную смесь сконцентрировали до 2 мл и добавляли 0,45 М (Bu3NH)2H2P2O7 в ДМФ (1,5 мл). Реакционную смесь перемешивали 18 ч при 20°С, разбавляли водой (до 20 мл), раствор экстрагировали CCl4 (3 мл), н.бутанолом (2×3 мл) и наносили на колонку (2,5×10,5 см) с DEAE-целлюлозой, элюировали 30% раствором МеОН в градиенте концентрации NH4НСО3 (0→0,3М). Целевые фракции объединяли, концентрировали в вакууме и остаток лиофилизовали. Выход 9,7 мг (27%).
УФ (Н2O) λmax 556 (ε 59000). 1H-ЯМР (D2О): 8,26 м, 7,77 м, 7,49 м, 7,41 м, 7,13 м, 6,71 м, 6,51 с, 6,40 с (9Н, PdB), 4,13 м (2Н, СН2О), 3,81 м (2Н, CH2N), 3,41 м (8Н, 4×СН2СН3), 1,1 м (12Н, 4×СН2СН3). 31Р-ЯМР (D2O): -9,3 д (1P, J 18,3, Рγ), -10,47 д (1P, J 17,3, Pα), -22,24 кв (1P, J 18,3, Pβ).
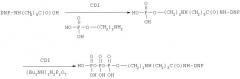
Пример 6. Получение N-(Родаминаминотиокарбонил)-4-аминобутилового эфира трифосфорной кислоты (Ie).
Синтез соединения Ie осуществляли по следующей схеме:
6.1. N-(9-Флуоренилметоксикарбонил)-4-аминобутанол
К аминобутанолу (186 мкл, 2 ммоль) приливали раствор Na2CO3 (860 мг, 8 ммоль) в воде (8 мл), прибавляли раствор 9-флуоренилметоксикарбонилхлорида (400 мг, 1,6 ммоль) в диоксане (800 мкл) и выдерживали 18 ч при комнатной температуре. Целевой продукт выпадал в осадок, его отфильтровывали и промывали водой. Выход 446 мг (93%).
УФ (Н2О) λmax 265 (ε 17500).
1H-ЯМР (D2O): 7,76 д, 7,60 д [4Н, Н-1, 4, 5, 8 (Fmoc)], 7,39 т, 7,31 т [4Н, J 7,5, Н-2, 3, 6, 7 (Fmoc)], 4,41 д (2Н, J 6,9, СН2 (Fmoc)), 4,21 т [1Н, J 6,9, H-9 (Fmoc)], 3,77 м (2Н, CH2N), 2,84 м (2Н, CH2O), 1,35-1,23 м (4Н, 2-СН2-).
6.2. N-(9-Флуоренилметоксикарбонил)-4-аминобутиловый эфир трифосфорной кислоты
Раствор (9-флуоренилметоксикарбонил)аминобутанола (220 мг, 0,59 ммоль) в триэтилфосфате (1 мл) охлаждали до до 0°С и прибавляли хлорокись фосфора (133 мкл, 1,43 ммоль). Реакционную массу выдерживали 18 ч при 5°С и при интенсивном перемешивании прибавляли смесь трибутиламина (1 мл, 4,3 ммоль) и 0,8 мМ раствора бис(трибутиламмоний)пирофосфата (3 мл, 2,4 ммоль) в диметилформамиде. Перемешивали реакционную массу 3 ч при комнатной температуре, наносили на колонку с Dowex-50 (NH4 + форма, 2×4 см), элюировали 50% водным метанолом (50 мл). Растворители удаляли в вакууме водоструйного насоса, остаток хроматографировали на колонке (2×18 см) с LiChroprep RP-18 (25-40 мкм) в градиенте концентрации метанола в воде (0→20%). Выход 40 мг (11%).
УФ (Н2O) λmax 265 (ε 17500).
1H-ЯМР (D2O): 7,74 д, 7,50 д [4Н, J 7,5, Н-1, 4, 5, 8 (Fmoc)], 7,33 т, 7,25 т [4Н, J 7,5, Н-2, 3, 6, 7 (Fmoc)], 4,39 д (2Н, J 6,9, СН2 (Fmoc)), 4,10 т [1Н, J 6,9, Н-9 (Fmoc)], 3,77 м (2Н, CH2O), 2,84 м (2Н, CH2N), 1,35-1,23 м (4Н, 2-СН2-). 31Р-ЯМР (D2O): -10,34 д (1P, J 18,3, Рγ), -10,44 д (1P, J 17,3, Рα), -22,79 кв (1P, J 18,3, Pβ).
6.3. N-(Родаминаминотиокарбонил)-4-аминобутиловый эфир трифосфорной кислоты 1е.
Растворяли N-[(9-Флуоренилметоксикарбонил)-4-аминобутиловый эфир трифосфорной кислоты (22 мг, 0,04 ммоль) в 25% водном аммиаке (5 мл). Через 16 ч при 5°С реакционную массу фильтровали, фильтрат упаривали до объема около 1 мл, приливали диметилформамид (5 мл) и триэтиламин (0,5 мл), упаривали до объема около 2 мл, добавляли родамин В изотиоцианат (43 мг, 0,08 ммоль), метилимидазол (40 мкл) и триэтиламин (80 мкл). Перемешивали реакционную массу 18 ч при комнатной температуре, упаривали, растворяли в воде (20 мл), раствор экстрагировали CCl4 (3 мл), н.бутанолом (2×3 мл) и наносили на колонку (2,5×10,5 см) с DEAE-целлюлозой, элюировали 30% раствором МеОН в градиенте концентрации NH4HCO3 (0→0,2M). Целевые фракции объединяли, концентрировали в вакууме и остаток лиофилизовали. Выход 25 мг (75%).
УФ (Н2O) λmax 556 (ε 59000).
1H-ЯМР (D2O): 7,75 м, 6,87 м, 6,54 м, 6,38 м, 6,25 м (9Н, PdB), 3,87 м (2Н, СН2О), 3,21 м (10Н, CH2N и 4×СН2СН3), 1,53 м (4Н, 2×-СН2-), 0,91 м (12Н, 4×СН2СН3). 31Р-ЯМР (D2O): -10,07 д (IP, J 18,3, Рγ), -10,34 д (IP, J 17,3, Рα), -21,94 кв (1Р, J 18,3, Рβ).
Пример 7. N-(Флуоресцеинаминотиокарбонил)-4-аминобутиловый эфир трифосфорной кислоты (1ж).
Синтез соединения 1ж осуществляли по следующей схеме:
N-(Флуоресцеинаминотиокарбонил)-4-аминобутиловый эфир трифосфорной кислоты (1ж) получали из 4-аминобутилового эфира трифосфорной кислоты по методу, описанному в примере 6 для синтеза N-(родаминаминотиокарбонил)-4-аминобутилового эфира трифосфорной кислоты (1е) с использованием флуоресцеинизотиоцианата. Выход 21 мг (71%).
УФ - Видимая: (Н2О, рН 9,0) λmax 493 нм (ε 65000). 1H-ЯМР (D2O): 6,94 м, 7,50 м, 7,76 м, 7,92 с (9Н, флуоресцеин), 3,81 м (2Н, CH2О), 2,95 м (2Н, CH2N), 1,61-1,52 м (4Н, 2-СН2-). 13Р-ЯМР (D2O): -10,22 д (IP, J 18,1, Pγ), -10,58 д (IP, J 17,1, Pα), -22,13 дд (IP, Pβ).
Пример 8. N-(Эозинаминотиокарбонил)-4-аминобутиловый эфир трифосфорной кислоты (1з).
Синтез соединения 1з осуществляли по следующей схеме:
N-[(Зозинаминотиокарбонил)-4-аминобутиловый эфир трифосфорной кислоты (1з) получали из 4-аминобутилового эфира трифосфорной кислоты по методу, описанному в примере 6 для синтеза N-(родаминаминотиокарбонил)-4-аминобутилового эфира трифосфорной кислоты (1е) с использованием эозинизотиоцианата. Выход 17 мг (53%).
УФ - Видимая: (H2O) λmax 527 нм (ε 65800). 1H-ЯМР (D2O); 8,94 д, (1Н, J 7,5), 7,55 д, (1Н, J 8,1), 7,1 с, (1Н), 7,04 с (2Н) (эозин), 3,91 м (2Н, СН2O), 2,95 м (2Н, CH2N), 1,78-1,67 м (4Н, 2×-СН2-). 13Р-ЯМР (D2O): -10,12 д (IP, J 18,2, Pγ), -10,48 д (IP, J 17,5, Pα), -22,14 дд (IP, Pβ).
Пример 9. N-(Тетраметилродаминаминотиокар6онил)-4-аминобутиловый эфир трифосфорной кислоты (1и).
Синтез соединения 1и осуществляли по следующей схеме:
N-(Тетраметилродаминаминотиокарбонил)-4-аминобутиловый эфир трифосфорной кислоты (1и) получали из 4-аминобутилового эфира трифосфорной кислоты по методу, описанному в примере 6 для синтеза N-(родаминаминотиокарбонил)-4-аминобутилового эфира трифосфорной кислоты (1е) с использованием тетраметилродаминизотиоцианата. Выход 27 мг (65%).
УФ - Видимая: (H2O) λmax 552 нм (ε 59300). 1H-ЯМР (D2O): 7,75 м, 6,87 м, 6,54 м, 6,38 м, 6,25 м (9Н, тетраметилродамин), 3,85 м (2Н, СН2О), 3,02 м (2Н, CH2N), 1,53 м (4Н, 2х-СН2-), 1,91 м (12Н, 4×-СН3). 13Р-ЯМР (D2O): -10,17 д (IP, J 18,1, Pγ), -10,42 д (IP, J 17,6, Pα), -22,09 дд (IP, Pβ).
Пример 10. N-[(6-N-Биотиниламиногексаноил)]-4-аминобутиловый эфир трифосфорной кислоты (1к).
Синтез соединения 1к осуществляли по следующей схеме:
N-[(6-N-биотиниламиногексаноил)]-4-аминобутиловый эфир трифосфорной кислоты (1к) получали получали из 4-аминобутилового эфира трифосфорной кислоты по методу, описанному в примере 6 для синтеза N-(родаминаминотиокарбонил)-4-аминобутилового эфира трифосфорной кислоты (1е) с использованием N-оксисукцинимидного эфира 6-N-биотиниламиногексановой кислоты. После проведения реакции и экстракции остаток разбавляли водой до 20 мл и наносили на колонку (2,5×4,5 см) с DEAE-целлюлозой (НСО3 -). Колонку промывали 30% МеОН (50 мл), 0,12 М NH4НСО3 в 30% МеОН (100 мл), соединение (1к) элюировали 30% раствором МеОН в 0,25 М NH4HCO3 (100 мл), концентрировали в вакууме, остаток растворяли в воде и лиофилизовали. Выход 13 мг (47%).
УФ (Н2О) λmax 195 нм (ε 2220). 1H-ЯМР (D2O): 4,25 м и 4,05 м (2Н, 2×CHNH (Bio)), 3,85 м (2Н, СН2O), 3,15 м (1H, CHS (Bio), 3,02 м (2Н, CH2N), 2,83 д (1Н, J 13,5, SCHa), 2,61 д, (1Н, J 13,5, SCHb), 2,17 т+ 2,23 т (4Н, J 7 каждый, 2×CH2СО), 1,68-1,28 м (14Н, 7×-СН2-). 13Р-ЯМР (D2O): -9,72 д (IP, J 19,1, Pγ), -10,42 д (IP, J 20,1, Рα), -21,9 дд (1Р, Рβ).
Пример 11. 4-{3-[(1,3,5,7-Тетраметил-4,4-дифторо-3а,4а-диаза-4-бораиндацен-2-ил)пропионил]}аминобутиловый эфир трифосфорной кислоты (1л).
Синтез соединения 1л осуществляли по следующей схеме:
4-{3-[(1,3,5,7-Тетраметил 4,4-дифторо-3а,4а-диаза-4-бораиндацен-2-ил)пропионил]}аминобутиловый эфир трифосфорной кислоты (1к) получали из 4-аминобутилового эфира трифосфорной кислоты по методу, описанному в примере 6 для синтеза М-(родаминаминотиокарбонил)-4-аминобутилового эфира трифосфорной кислоты (1е) с использованием N-оксисукцинимидного эфира 3-(1,3,5,7- тетраметил-4,4-дифторо-3а,4а-диаза-4-бораиндацен-2-ил) пропионовой кислоты. Выход 17 мг (47%).
УФ - Видимая: (H2O) λmax 512 нм (ε 72000). 1H-ЯМР (D2O): 7,35 с (1Н, Н-8), 6,14 с (1Н, Н-6), 3,85 м (2Н, CH2О), 2,89 м (2Н, CH2N), 2,72 т (2Н, J 8,0, -СН2СН2СО), 2,49 т (2Н, -CH2СН2СО), 2,45 с и 2,44 с (6Н, 3-СН3 и 5-СН3), 2, 23 с и 2, 25 с (6Н, 1-СН3 и 7-СН3), 1,68-1,58 м (4Н, 2×-СН2-). 13Р-ЯМР (D2O): -10,05 д (IP, J 18,3, Рγ), -10,38 д (IP, J 17,8, Pα), -22,21 дд (IP, Pβ).
Пример 12. Определение субстратной активности новых трифосфатов формулы I.
Субстратную активность определяли по методике, описанной ранее [Дяткина И.Б., фон Янта-Липинский М., Минасян Ш.Х., Куханова М.К., Краевский А.А., Чиджавадзе З.Г., Бибилашвили З.Ш., Биоорган. Химия, 1987, 13, №10, 1366-1374], сущность которой заключается в следующем. В работе использовали олигонуклеотиды разного состава и длины. Нуклеотидная последовательность некоторых олигонуклеотидов приведена ниже:
5'-32P-dCCC AGT САС GAC GT
5'-32P-dCCG ТСА АТТ ССТ GTA GTC
5'-32P-dCCG ТСА АТТ ССТ GTA GTC TCG
5'-32P олигонуклеотиды получали с помощью [γ-32P]-ATP и Т4 полинуклеотидкиназы. Реакционная смесь содержала (в объеме 20 мкл) 20 пмоль олигонуклеотида, 50 μКи [γ-32Р]-АТР, 2 ед. фермента и буфер. Реакционную смесь инкубировали в течение 30 мин при 37°С, останавливали нагреванием в течение 15 мин при 65°. Праймерный олигонуклеотид очищали на колонке с БиоГель А 1,5 М и использовали для введения по 3'-концу различных меток. Реакционная смесь в объеме 10 мкл содержала 0,02 мкМ 5'-[32Р]-олигонуклеотид, 0,2 ед. акт. TDT, 100 мМ какодилат натрия (рН 7,2), 2 мМ CoCl2, 0,1 мМ дитиотреитол и субстраты в различных концентрациях. Реакционную смесь инкубировали в течение 10 мин при 37°С. Реакцию останавливали добавлением 5 мкл формамида, содержащего 0,5 мМ ЭДТА и 0,1% фенолового синего и ксиленцианола. Продукты разделяли в 15% денатурирующем полиакриламидном геле. Гели экспонировали с рентгеновской пленкой Кодак RX. Полученные результаты представлены на фиг.1, 2 и в таблице.
На фиг.1 представлено разделение продуктов реакции в денатурирующем 15% полиакриламидном геле после включения соединений 1а и 1б в 3'-конец олигонуклеотида (1) с помощью TDT: трек 1 - положение праймерного олигонуклеотида; треки 2-4 - включение ddATP, использованного как контроль, при концентрациях 0,01, 0,1 и 1 μМ соответственно; треки 5-10 включение 1a при концентрациях 0,05, 0,1, 0,25, 0,5, 1 и 2 μМ, соответственно; треки 11-16 - включение 1б при концентрациях 0,05, 0,1, 0,25, 0,5, 1 и 2 μМ соответственно.
Фиг.2 иллюстрирует разделение продуктов реакции в денатурирующем 15% полиакриламидном геле после включения соединения 1в в 3'-конец олигонуклеотида терминальной дезоксинуклеотидил трансферазой: треки 1-3 - включение ddATP при концентрациях 0,02, 0,05 и 0,5 мкМ, соответственно; треки 4-7 - включение 1в при концентрациях 0,2, 1 и 10 мкМ соответственно.
Как видно из чертежей и данных таблицы, 50% утилизация олигонуклеотида происходит уже при концентрациях синтезированных трифосфатов 0,2-8 мкМ, что позволяет считать новые соединения эффективными субстратами TDT.
| Таблица | |||
| Соединение | R | Х | Концентрация, приводящая к 50% утилизации олигонуклеотида мкМ |
| 1a | Дансил | NH(CH2)4 | 1-5 |
| 1б | Дансил | NH(CH2)5C(O)NH(CH2)2 | 4-7 |
| 1в | Динитрофенил | NH(CH2)5C(O)NH(CH2)2 | 5-8 |
| 1r | Флуоресцеин | NHC(S)NHCH2CH2[O(CH2)2]2 | 0,2-0,8 |
| 1д | Родамин В | NH(CH2)2 | 1-3 |
| 1e | Родамин В | NH(CH2)4 | 0,6-1 |
| 1ж | Флуоресцеин | NH(CH2)4 | 1-5 |
| 1з | Эозин | NH(CH2)4 | 2-5 |
| 1и | Тетраметилродамин | NH(CH2)4 | 0,7-1 |
| 1к | Биотин | NH(CH2)5C(O)NH(CH2)4 | 0,3-0,8 |
| 1л | BODIPY | NH(CH2)4 | 2-8 |
Новые субстраты концевой дезоксинуклеотидилтрансферазы общей формулы I
где R является маркерной группой, выбранной из дансила, динитрофенила, флуоресцеина, флуоренилметилоксикарбонила, родамина В, тетраметилродамина, эозина, эритрозина, триоксалена, BODIPY, биотина, аурамина, псоралена, пирена, техасского красного, актиномицина D, 7-метоксикумарина, эллиптицина;
Х является линкером, представляющим собой линейную углеродную цепь, которая содержит гетероатомы, такие, как азот и кислород, и в качестве функциональных групп цепь может содержать карбонил и тиокарбонил.