Перфторалкилсодержащие комплексы с остатками сахаров, способы их получения
Иллюстрации
Показать всеВ заявке описаны перфторалкилсодержащие комплексы с остатками сахаров общей формулы (I)
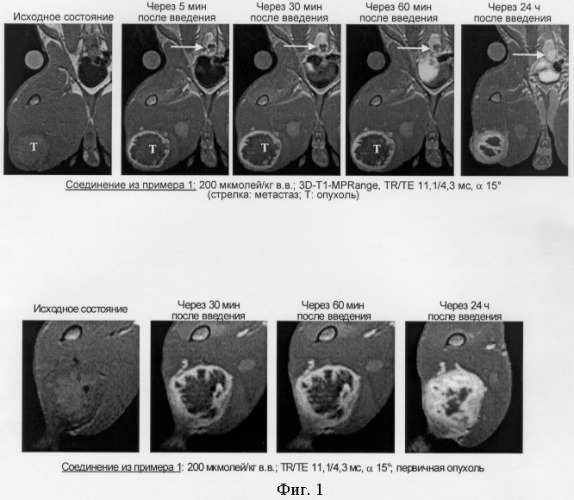
в которой R обозначает присоединенный через 1-ОН- или 1-SH-положение моно- или олигосахаридный остаток, Rf обозначает перфторированную углеродную цепь, К обозначает комплекс металла формулы II, где R1-H, или эквивалент иона металла с порядковым номером 21-29 или 58-71, при условии, что по меньшей мере два радикала R1-эквиваленты ионов металлов, R2 и R3 - независимо, Н, C1-С6алкил, бензил, фенил, U-С6Н4-О-СН2-ω- или необязательно прерванную одним атомом О, 1,2-NHCO-группами, 1,2-CONH-группами, С2-С8алкиленовую или С6-С9-С6Н4-O-группу, при этом ω обозначает место присоединения к -СО-, Y и Z представляют собой группы-линкеры, пригодные для применения при внутривенной лимфографии, для диагностики опухолей, а также для визуализации инфарктов и некрозов. 3 н. и 8 з.п.ф-лы, 1 табл., 2 ил.
Реферат
Настоящее изобретение относится к объектам, охарактеризованным в формуле изобретения, а именно, к перфторалкилсодержащим металлическим комплексам с остатками сахаров общей формулы I, к способу их получения и к их применению в ЯМР- и рентгенодиагностике, радионуклидной диагностике и лучевой терапии, в МРТ-лимфографии (МРТ = магнитно-резонансная томография), а также в качестве контрастных веществ для визуализации пулов крови. Предлагаемые в изобретении соединения наиболее пригодны для применения при внутривенной лимфографии, для диагностики опухолей и для визуализации инфарктов и некрозов.
В методах, основанных на ядерном магнитном резонансе, вторым по значению элементом после водорода является фтор, что обусловлено следующими факторами:
1) фтор обладает высокой восприимчивостью, составляющей 83% от восприимчивости водорода,
2) фтор имеет лишь один ЯМР-активный изотоп,
3) фтор характеризуется аналогичной водороду резонансной частотой, что позволяет анализировать оба элемента с помощью одной и той же аппаратуры,
4) фтор биологически инертен,
5) фтор не содержится в биологическом материале (за исключением зубов) и поэтому может применяться в качестве зонда или контрастного вещества на не создающем паразитных сигналов фоне.
Благодаря этим свойствам фтор находит самое широкое применение в диагностике, основанной на методе ядерного магнитного резонанса, например в 19F-томографии, функциональной диагностике и спектроскопии, что отражено в соответствующей патентной литературе.
Так, например, в патенте US 4639364 (на имя Mallinckrodt) были предложены трифторметансульфонамиды для применения в качестве контрастных веществ в F-томографии:
CF3SO2NH2 и
CF3SO2NH-СН2-(СНОН)4-СН2OH.
Равным образом к 19F-томографии относится и патент DE 4203254 (на имя Max-Planck-Gesellschaft), в котором предложено производное анилина приведенной ниже формулы:
.
19F-томография является объектом заявки WO 93/07907 (на имя Mallinckrodt), в которой также предложены производные фенила для применения в качестве контрастных веществ:
,
Для использования в 19F-томографии были предложены также соединения со значительно более простой структурой. Так, например, в патенте US 4586511 (на имя Children's Hospital Medical Center) описан перфтороктилбромид формулы
CF3(CF2)7-Br,
в патенте ЕР 307863 (на имя Air Products) заявлен перфтор-15-краун-5-эфир формулы
,
а в патенте US 4588279 (на имя University of Cincinnati, Children's Hospital Research Foundation) описаны перфторуглеродные соединения, такие как перфторциклононан или -октан, простые перфорированные эфиры, такие как тетрагидрофуран формулы
или простые диэфиры, такие как диэфир перфторпропиленгликоля формулы
.
Аналогичным образом для применения в 19F-томографии предназначены описанные в заявке WO 94/22368 (на имя Molecular Biosystems) соединения, например,
,
которые в качестве фторсодержащего остатка содержат перфтор-1Н,1Н-неопентильную группу.
Структуры другого типа с более широким спектром применения в диагностике представлены в патенте US 5362478 (на имя VIVORX), в котором заявлена предназначенная для использования в томографии комбинация фторуглерод/полимерная оболочка. Согласно этому патенту предлагается применять перфторнонан и сывороточный альбумин человека. Подобная комбинация, как было установлено, позволяет, кроме того, использовать атом фтора в качестве зонда для локального измерения температуры и для определения парциального давления кислорода.
Перфторуглероды, предназначенные для определения содержания кислорода, описаны также в патенте US 4586511.
В патенте DE 4008179 (на имя Schering) предлагается использовать фторсодержащие бензолсульфонамиды в качестве рН-зондов:
.
Для применения в ЯМР-диагностике в качестве повышающих контрастность веществ предназначены также соединения, содержащие атомы йода и фтора и описанные, например, в заявках WO 94/05335 и WO 94/22368 (обе на имя Molecular Biosystems):
Для применения в 19F-томографии предназначена также комбинация фтор-парамагнитный ион металла, при этом речь идет о комплексах с открытой цепью, в качестве примера которых в заявке WO 94/22368 (на имя Molecular Biosystems) названы соединения формулы
а в ЕР 292306 (на имя TERUMO Kabushiki Kaisha) указаны соединения формулы
, ,
,
а также о циклических соединениях, описанных в ЕР 628316 (на имя TERUMO Kabushiki Kaisha):
,
, .
Для ЯМР-спектроскопических измерений температуры в DE 4317588 (на имя Schering) было предложено также использовать следующую комбинацию из атома фтора и редкоземельного элемента:
где Ln обозначает редкоземельный элемент La, Pr, Dy или Eu.
Если в соединениях, содержащих фтор и йод, между обоими ядрами взаимодействие не происходит, то в соединениях, содержащих фтор и парамагнитные центры (радикалы, ионы металлов), происходит достаточно интенсивное взаимодействие, которое проявляется в сокращении времени релаксации ядра фтора. Степень проявления такого эффекта зависит от числа неспаренных электронов иона металла (Gd3+>Mn2+>Fe3+>Cu2+) и от расстояния между парамагнитным ионом и 19F-атомом.
Чем больше число неспаренных электронов иона металла и чем ближе они расположены к фтору, тем существеннее сокращается время релаксации ядра фтора.
Сокращение времени релаксации в функции удаленности от парамагнитного иона наблюдается у всех ядер с нечетным спиновым числом, в том числе и у протона, и поэтому гадолиниевые соединения находят широкое применение в качестве контрастных веществ в ЯМР-томографии (Magnevist®, Prohance®, Omniscan®, Dotarem®).
При 1Н-МР-томографии, однако, определяют время релаксации T1 или Т2 протонов, т.е. прежде всего протонов воды, а не время релаксации ядер фтора и используют полученные данные для визуализации. Количественной мерой, характеризующей сокращение времени релаксации T1, является релаксационность, выражаемая в л/ммоль·с. Для сокращения времени релаксации с успехом применяют комплексы парамагнитных ионов. В нижеследующей таблице приводятся данные о релаксационности некоторых коммерчески доступных препаратов:
| T1 - релаксационность в воде [л/ммоль-с, 39°С, 0,47 Тл] | T1 - релаксационность в плазме [л/ммоль-с, 39°С, 0,47 Тл] | |
| Magnevist® | 3,8 | 4,8 |
| Dotarem® | 3,5 | 4,3 |
| Omniscan® | 3,8 | 4,4 |
| Prohance® | 3,7 | 4,9 |
В этих соединениях происходит только взаимодействие между протонами и ионом гадолиния. Выявленная для указанных контрастных веществ релаксационность в воде составляет примерно 4 л/ммоль-с.
Таким образом, при МР-томографии с успехом могут применяться и фторсодержащие соединения, предназначенные для 19F-томографии, где используется сокращенное время релаксации ядра фтора, и не содержащие фтор соединения, у которых определяют время релаксации протонов воды.
Неожиданный эффект, связанный с введением перфторуглеродсодержащего остатка в парамагнитное контрастное вещество, т.е. эффект, связанный с приданием соединениям, которые использовали в методах протонной визуализации, свойств тех соединений, которые до настоящего времени рассматривались как пригодные только для применения в методах визуализации, основанных на использовании фтора, проявляется также в быстром возрастании релаксационности протонов воды. В результате этот показатель достигает значений, составляющих 10-50 л/ммоль-с, тогда как аналогичные значения у некоторых коммерчески доступных продуктов составляют, как следует из вышеприведенной таблицы, от 3,5 до 3,8 л/ммоль-с.
Из заявки DE 19603033.1 уже известны перфторалкилсодержащие комплексы металлов. Однако возможности применения этих соединений ограничены, поскольку во многих случаях они не позволяют достичь удовлетворительных результатов. С учетом этого в настоящее время, как и прежде, сохраняется необходимость в контрастных веществах, предназначенных для визуализации злокачественных опухолей, лимфатических узлов и некротических тканей.
Злокачественные опухоли часто метастазируют в регионарные лимфатические узлы, причем этот процесс может также охватывать несколько уровней лимфоузлов. Так, в частности, метастазы в лимфатические узлы были обнаружены примерно у 50-69% всех пациентов со злокачественными опухолями (см. Elke, Lymphographie, Radiologische Diagnostik in Klinik und Praxis, под ред. Frommhold, Stender, Thurn, том IV, изд-во Thieme Verlag, Stuttgart, 7-е изд., 1984, сс.434-496). Возможность диагностики метастазирования в лимфатические узлы имеет важное значение для терапии онкологических заболеваний и прогнозирования их развития. Современные методы визуализации (компьютерная томография, ультразвуковое исследование и магнитно-резонансная томография) не позволяют с достаточно высокой точностью и надежностью распознавать лимфогенное метастазирование злокачественных опухолей, поскольку в большинстве подобных случаев в качестве критериев соответствующего диагноза могут использоваться только размеры лимфатического узла. В результате такие методы просто не позволяют отличить небольшие метастазы в не увеличенных лимфатических узлах (<2 см) от гиперплазии лимфоузлов, не пораженных злокачественной опухолью (см. Steinkamp и др., Sonographie und Kernspintomographie: Differentialdiagnostik von reaktiver Lymphknotenvergrö Berung und Lymphknotenmetastasen am Hals, Radiol. diagn. 33 (1992), c.158).
С учетом этого представляется целесообразным обеспечить при применении специфических контрастных веществ возможность дифференцировать лимфатические узлы, пораженные метастазами, и гиперпластические лимфатические узлы.
В качестве примера известного инвазивного метода визуализации можно назвать прямую лимфорентгенографию (инъекция масляной суспензии контрастного вещества в подготовленный соответствующим образом лимфатический сосуд), которая, однако, в настоящее время используется лишь в редких случаях и которая позволяет визуализировать только некоторые пути оттока лимфы.
В экспериментах, проводимых на животных, используют также декстраны с флуоресцентной меткой с целью обеспечить после их интерстициального введения возможность наблюдения оттока лимфы. Все метки, используемые после их интерстициального/внутрикожного введения для визуализации лимфатических протоков и лимфатических узлов, представляют собой вещества в виде твердых частиц ("макрочастицы", например эмульсии и суспензии нанокристаллов) либо крупные полимеры (см. также WO 90/14846). Однако все известные в настоящее время из литературы композиции вследствие их недостаточной местной и системной переносимости, равно как и их малой подвижности в лимфе, обусловливающей неудовлетворительную эффективность диагностики, все еще остаются не оптимальными для применения в непрямой лимфографии.
Поскольку визуализация лимфатических узлов имеет важное значение для раннего обнаружения метастазов у онкологических больных, существует необходимость в лимфоспецифичных композициях контрастных веществ, которые позволяли бы своевременно и надежно диагностировать соответствующие изменения в лимфатической системе. Для достижения требуемого эффекта при использовании контрастных веществ целесообразно обеспечить не только их предельно высокую концентрацию в лимфе и высокую стабильность, но и максимально равномерное накапливание в лимфе в нескольких уровнях лимфатической системы, что имеет важное для постановки точного диагноза значение. Вместе с тем контрастное вещество должно быстро и полностью выводиться из организма с целью минимизировать его отрицательное воздействие на весь организм в целом. Действие контрастного вещества должно начинать проявляться по возможности уже через несколько часов после его введения, что является важным условием в радиологической практике. Столь же важным требованием, предъявляемым к контрастным веществам, является их хорошая переносимость.
Не менее актуальна и потребность в лимфоспецифичных контрастных веществах, которые позволяли бы за один сеанс диагностического исследования визуализировать и первичную опухоль, и возможное ее метастазирование в лимфатические узлы.
Еще одной из важных задач медицины являются обнаружение, локализация и наблюдение за некрозами и инфарктами. Так, в частности, инфаркт миокарда является не стационарным, а динамическим процессом, длящимся в течение продолжительного промежутка времени (от нескольких недель до нескольких месяцев). Это сердечно-сосудистое заболевание протекает примерно в три стадии, которые невозможно четко разграничить, поскольку они накладываются одна на другую, соответственно плавно переходят одна в другую. Длительность первой стадии, на которой происходит развитие инфаркта миокарда, составляет примерно первые 24 часа после его начала, в течение которых разрушение ткани распространяется подобно ударной волне (аналогично явлению волнового фронта) от субэндокарда к миокарду. Вторая стадия, на которой развитие инфаркта как такового уже закончилось, включает стабилизацию области, в которой в процессе заживления пораженной инфарктом ткани происходит образование волокон (фиброз). Третья стадия, которая соответствует полному заживлению затронутой инфарктом ткани, начинается после замены всей разрушенной ткани фиброзной рубцовой тканью. В этот период происходит активная реструктуризация.
На сегодняшний день не существует ни одного метода, который позволял бы с высокой точностью и надежностью диагностировать текущую фазу инфаркта миокарда у живого пациента. Для оценки же инфаркта миокарда решающее значение имеет информация о том, насколько велика доля утраченной при инфаркте ткани и в каком именно месте, поскольку от этой информации зависит тип терапии.
Инфаркты, как известно, поражают не только миокард, но и другие ткани, прежде всего головной мозг.
Если затронутая инфарктом ткань в некоторой степени поддается заживлению, то при некрозе, т.е. при локально ограниченном омертвении ткани, можно лишь предотвратить или по меньшей мере смягчить его вредные последствия для остального организма. Возникновение некрозов может быть обусловлено самыми различными причинами и, в частности, травмами, воздействием химикалиев, дефицитом кислорода или же облучением. Аналогично инфаркту наличие информации о степени и типе некроза имеет важное значение для выбора последующих врачебных мер.
С учетом этого уже достаточно давно предпринимались попытки повысить эффективность локализации, т.е. определения местонахождения, инфарктов и некрозов за счет применения контрастных веществ при неинвазивных методах, таких как сцинтиграфия или ЯМР-томография. При этом большое число опубликованных работ посвящено экспериментальным исследованиям по использованию порфиринов для визуализации некрозов. Однако полученные в ходе подобных исследований результаты носят противоречивый характер. Так, в частности, в работе Winkelman и Hoyes, опубликованной в Nature, 200 (1967), с.903, говорится о селективном накоплении марганец-5,10,15,20-тетракис(4-сульфонатофенил)порфирина (ТФПС) в некротической области опухоли.
В отличие от этого в работе Lyon и др. (Magn. Res. Med. 4 (1987), с.24) говорится о том наблюдавшемся этими авторами эффекте, что марганец-ТФПС распределяется по существу по всему организму, а именно, накапливается в почках, печени, опухоли и лишь незначительно в мышечных тканях. Особый интерес при этом представляет тот факт, что концентрация указанного вещества в опухоли достигает максимума только на 4-й день после введения, и то лишь после повышения дозы с 0,12 ммоль/кг до 0,2 ммоль/кг. Поэтому авторами делается также вывод о неспецифическом накоплении ТФПС в опухолевой ткани. В работе Bockhurst и др., опубликованной в Acta Neurochir. 60 (1994, дополн.), с.347, вновь говорится о селективном связывании Mn-ТФПС с опухолевыми клетками.
В свою очередь по результатам исследований, проводившихся Foster и др. (J. Nucl. Med. 26 (1985), с.756), было установлено, что 111In-5,10,15,20-тетракис(4-N-метилпиридиний)порфирин (ТМПиП) накапливается не в некротической области, а в окружающих ее живых краевых слоях. На основании этого можно было бы сделать очевидный вывод о наличии взаимодействия между порфирином и тканью, что, однако, не обязательно соответствует действительности.
В работе Ni и др., опубликованной в Circulation, т.90, №4, часть 2, с.1468, Реферат №2512 (1994), сообщалось о возможности визуализации затронутых инфарктом областей с помощью марганец-тетрафенилпорфирина (Mn-ТФП) и гадолиний-мезопорфирина (Gd-МП). Согласно заявке WO 95/31219 оба этих вещества использовались для визуализации инфарктов и некрозов. В этой заявке, авторами которой являются Marchal и Ni, говорится (см. пример 3), что при использовании соединения Gd-МП содержание металла в пораженной инфарктом почке находилось на том же уровне, что и в неинфарцированном органе, тогда как в миокарде содержание металла в инфарцированной ткани (см. пример 1) в девять раз превышало его содержание в неинфарцированной ткани. Неожиданным является при этом тот факт, что при МРТ соотношение между интенсивностью сигнала, формируемого инфарцированной тканью, и интенсивностью сигнала, формируемого здоровой тканью, в обоих случаях находилось на сравнительно высоком уровне и составляло 2,10 и 2,19 соответственно. Другие металлопорфирины описаны в заявке DE 19835082 (на имя Schering AG).
Порфирины обладают тенденцией накапливаться в коже, что приводит к ее фотосенсибилизации. Подобная сенсибилизация может сохраняться в течение нескольких дней, а иногда и в течение нескольких недель. В этом заключается нежелательный побочный эффект, проявляющийся при применении порфиринов в качестве диагностикумов. Помимо этого порфирины имеют лишь исключительно низкий терапевтический индекс, поскольку, например, в случае Mn-ТФПС его действие проявляется только при его использовании в дозе 0,2 ммоль/кг, тогда как его летальная доза ЛД50 составляет уже 0,5 ммоль/кг.
Другие контрастные вещества, не являющиеся производными порфиринового каркаса и предназначенные для визуализации некрозов и инфарктов, описаны в заявках DE 19744003 (на имя Schering AG), DE 19744004 (на имя Schering AG) и WO 99/17809 (на имя EPIX). Однако до настоящего времени все еще нет соединений, которые можно было бы достаточно эффективно применять в качестве контрастных веществ для визуализации инфарктов и некрозов.
Исходя из вышеизложенного, в основу настоящего изобретения была положена задача предложить контрастные вещества, которые были бы пригодны для применения прежде всего в МРТ-лимфографии, а также для диагностики опухолей и визуализации некрозов и инфарктов.
Указанная задача решается согласно изобретению с помощью перфторалкилсодержащих комплексов с остатками сахаров общей формулы I
в которой
R обозначает присоединенный через 1-ОН- или 1-SH-положение моно- или олигосахаридный остаток,
Rf обозначает перфторированную, прямую или разветвленную углеродную цепь формулы -СnF2nЕ, где
Е представляет собой концевой атом фтора, хлора, брома, йода или водорода, а
n обозначает числа 4-30,
К обозначает металлический комплекс общей формулы II
,
в которой
R1 представляет собой атом водорода или эквивалент иона металла порядкового номера 21-29, 31-33, 37-39, 42-44, 49 или 57-83, при условии, что по меньшей мере два радикала R1 обозначают эквиваленты ионов металлов,
R2 и R3 независимо друг от друга обозначают водород, С1-С7алкил, бензил, фенил, -СН2ОН или -СН2ОСН3 и
U представляет собой -С6Н4-O-СН2-ω-, -(СН2)1-5-ω-, фениленовую группу,-СН2-NHCO-СН2-СН(СН2СООН)-С6Н4-ω-, -С6Н4-(ОСН2СН2)0-1-N(СН2СООН)-СН2-ω- или необязательно прерванную одним или несколькими атомами кислорода, 1-3 -NHCO-группами, 1-3 -CONH-группами и/или замещенную 1-3 -(СН2)0-5СООН-группами С1-С12алкиленовую или С7-С12-С6Н4-O-группу, при этом ω обозначает место присоединения к -СО-, или общей формулы III
,
в которой
R1 имеет вышеуказанные значения,
R4 обозначает водород или указанный для R1 эквивалент иона металла и
U1 обозначает -С6Н4-O-СН2-ω-, где ω обозначает место присоединения к -СО-,
или общей формулы IV
,
в которой R1 и R2 имеют указанные выше значения,
или общей формулы VA или VB
,
,
в которых R1 имеет указанные выше значения,
или общей формулы VI
,
в которой R1 имеет указанные выше значения,
или общей формулы VII
,
в которой
R1 имеет указанные выше значения, а
U1 обозначает -C6H4-O-CH2-ω-, где ω обозначает место присоединения к -СО-,
или общей формулы VIII
,
в которой R1 имеет указанные выше значения,
при этом необязательно присутствующие в остатке К свободные кислотные группы необязательно могут быть представлены в виде солей органических и/или неорганических оснований или аминокислот либо в виде амидов аминокислот,
G в том случае, если К обозначает металлические комплексы формул II-VII, представляет собой по меньшей мере трехкратно функционализованный остаток, выбранный из следующих остатков a)-j):
(a)
,
(b)
,
(c)
(d)
,
(e)
,
(f)
,
(g)
,
(h)
,
(i)
,
(j)
, и
G в том случае, если К обозначает металлический комплекс формулы VIII, представляет собой по меньшей мере трехкартно функционализованный остаток, выбранный из остатков k) и l):
(k)
,
(l)
,
при этом α обозначает место присоединения G к комплексу К, β обозначает место присоединения G к остатку Y, а γ обозначает место присоединения G к остатку Z,
Y обозначает -СН2-, δ-(СН2)nСО-β (где n=1-5), δ-СН2-СНОН-СО-β или δ-СН(СНОН-СН2OH)-СНОН-СНОН-СО-β, где δ обозначает место присоединения к остатку сахара R, а β обозначает место присоединения к остатку G,
Z обозначает группу
,
γ-COCH2-N(C2H5)-SO2-ε,
γ-COCH2-O-(CH2)2-SO2-ε,
или
γ-NHCH2CH2-O-CH2CH2-ε,
где γ обозначает место присоединения Z к остатку G, а ε обозначает место присоединения Z к перфторированному остатку Rf,
l, m независимо друг от друга обозначают целые числа 1 или 2 и
р обозначает целые числа от 1 до 4.
Если предлагаемое в изобретении соединение предназначено для его применения при ЯМР-диагностике, то ион металла формирующей сигнал группы должен быть парамагнитным. К подобным ионам относятся прежде всего двух- и трехвалентные ионы элементов порядковых номеров 21-29, 42, 44 и 58-70. В качестве примера пригодных для применения в указанных целях ионов можно назвать ионы хрома(III), железа(II), кобальта(II), никеля(II), меди(II), празеодима(III), неодима(III), самария(III) и иттербия(III). Наиболее предпочтительны при этом с учетом их высокого магнитного момента ионы гадолиния(III), тербия(III), диспрозия(III), гольмия(III), эрбия(III), железа(III) и марганца(II).
Для применения предлагаемых в изобретении соединений в медицинской радиологии (радиоизотопная диагностика и лучевая терапия) ион металла должен быть радиоактивным. Для применения в этих целях пригодны, например, радиоизотопы элементов с порядковыми номерами 27, 29, 31-33, 37-39, 43, 49, 62, 64, 70, 75 и 77. Предпочтительны при этом технеций, галлий, индий, рений и иттрий.
Если предлагаемое в изобретении соединение предназначено для его применения при рентгенодиагностике, то в качестве иона металла предпочтительно использовать элемент с более высоким порядковым номером с целью обеспечить достаточно высокую степень поглощения рентгеновских лучей. Было установлено, что для этой цели пригодны диагностические средства, содержащие физиологически совместимую комплексную соль с ионами металлов порядковых номеров 25, 26 и 39, а также 57-83. Предпочтительны при этом ионы марганца(II), железа(II), железа(III), празеодима(III), неодима(III), самария(III), гадолиния(III), иттербия(III) или висмута(III), прежде всего ионы диспрозия(III) и иттрия(III).
Присутствующие при определенных условиях в R1 кислотные атомы водорода, т.е. атомы, которые не замещены центральным ионом, необязательно могут быть полностью или частично заменены на катионы неорганических и/или органических оснований или аминокислот либо амидов аминокислот. В качестве примера приемлемых неорганических катионов можно назвать ион лития, ион калия, ион кальция и прежде всего ион натрия. Приемлемыми катионами органических оснований являются, в частности, таковые первичных, вторичных или третичных аминов, таких, например, как этаноламин, диэтаноламин, морфолин, глюкамин, N,N-диметилглюкамин и прежде всего N-метилглюкамин. В качестве примера приемлемых катионов аминокислот можно назвать катионы лизина, аргинина и орнитина, а также амиды в остальном кислых или нейтральных аминокислот.
К наиболее предпочтительным соединениям общей формулы I относятся соединения, содержащие макроцикл К общей формулы II.
Остаток U в металлическом комплексе К предпочтительно обозначает -СН2-или -С6Н4-O-СН2-ω-, где ω представляет собой место присоединения к -СО-.
Указанные в качестве значений R2 и R3 алкильные группы в макроцикле общей формулы II могут иметь прямую или разветвленную цепь. При этом в качестве примеров можно назвать метил, этил, пропил, изопропил, н-бутил, 1-метилпропил, 2-метилпропил, н-пентил, 1-метилбутил, 2-метилбутил, 3- метилбутил, 1,2-диметилпропил. Предпочтительно R2 и R3 независимо друг от друга обозначают водород или С1-С4алкил. В одном из особо предпочтительных вариантов R2 обозначает метил, а R3 обозначает водород.
Указанная в качестве значения R2 или R3 бензильная группа или фенильная группа в макроцикле К общей формулы II может быть также замещена в кольце.
Остаток R в общей формуле I обозначает присоединенный через 1-ОН- или 1-SH-положение моно- или олигосахаридный остаток либо остаток тиосахара, причем в этом случае согласно изобретению речь может также идти о дезоксисахарах, которые вместо одной или более ОН-групп содержат Н-атом. В одном из предпочтительных вариантов осуществления изобретения R обозначает моносахаридный остаток с 5 или 6 С-атомами, предпочтительно глюкозу, маннозу, галактозу, рибозу, арабинозу или ксилозу либо их дезоксисахара, такие, например, как 6-дезоксигалактоза (фукоза) или 6-дезоксиманноза (рамноза), либо их тиосахара, при этом наиболее предпочтительны глюкоза, манноза и галактоза.
Среди предлагаемых в изобретении соединений общей формулы I предпочтительны далее соединения, в которых Rf обозначает -CnF2n+1. При этом n предпочтительно обозначает числа от 4 до 15. Наиболее предпочтительны остатки -C4F9, -C6F13, -C8F17, -С12F25 и -С14F29, а также остатки рассмотренных в примерах соединений.
По меньшей мере трехкратно функционализованный остаток G в общей формуле I, который является "скелетом", в одном из предпочтительных вариантов осуществления изобретения обозначает остаток лизина (а) или (b).
Y и Z представляют собой указанный для общей формулы I линкер, при этом независимо друг от друга Z предпочтительно обозначает группу
,
а Y предпочтительно обозначает группу δ-СН2СО-β.
Способ получения перфторалкилсодержащих комплексов с остатками сахаров общей формулы I
,
в которой К обозначает один из металлических комплексов общих формул II-VII, G представляет собой одну из групп формул a)-j), a Y, Z, R, Rf, m, p и l имеют указанные выше значения, заключается в том, что карбоновую кислоту общей формулы IIa
,
в которой R5 обозначает эквивалент иона металла с порядковым номером 21-29, 31-33, 37-39, 42-44, 49 или 57-83 или карбоксизащитную группу, а R2, R3 и U имеют указанные выше значения, или карбоновую кислоту общей формулы IIIa
,
в которой R4, R5 и U1 имеют указанные выше значения, или карбоновую кислоту общей формулы IVa
,
в которой R5 и R2 имеют указанные выше значения, или карбоновую кислоту общей формулы Va или Vb
,,
где R5 имеет указанные выше значения, или карбоновую кислоту общей формулы VIa
в которой R5 имеет указанные выше значения, или карбоновую кислоту общей формулы VIIa
,
в которой R5 и U1 имеют указанные выше значения, необязательно в активированной форме, подвергают по известной методике взаимодействию в условиях реакции сочетания с амином общей формулы IX
,
в которой G обозначает одну из групп формул a)-j), a R, Rf, Y, Z, m и р имеют указанные выше значения, и затем при необходимости отщепляют присутствующие при определенных условиях защитные группы с получением в результате комплекса металла общей формулы I либо, если R5 представляет собой защитную группу, после отщепления таких защитных групп на следующей стадии подвергают взаимодействию по известной методике по меньшей мере с одним оксидом металла или солью металла с порядковым номером 21-29, 31-33, 37-39, 42-44, 49 или 57-83, после чего при необходимости присутствующие при определенных условиях кислотные атомы водорода замещают катионами неорганических и/или органических оснований, аминокислот или амидов аминокислот.
Способ получения предлагаемых в изобретении соединений общей формулы I, в которой К обозначает комплекс металла общей формулы VIII, а G представляет собой группу формулы к) или l), заключается в том, что амин общей формулы VIIIa
,
в которой R5 обозначает эквивалент иона металла порядкового номера 21-29, 31-33, 37-39, 42-44, 49 или 57-83 или карбоксизащитную группу, подвергают по известной методике взаимодействию в условиях реакции сочетания с необязательно активированной карбоновой кислотой общей формулы Х
,
в которой G обозначает группу формулы k) или l), а R, Rf, Y, Z, m и р имеют указанные выше значения, и затем при необходимости отщепляют присутствующие при определенных условиях защитные группы с получением в результате комплекса металла общей формулы I либо, если R5 представляет собой защитную группу, после отщепления таких защитных групп на следующей стадии подвергают взаимодействию по известной методике по меньшей мере с одним оксидом металла или солью металла с порядковым номером 21-29, 31-33, 37-39, 42-44, 49 или 57-83, после чего при необходимости присутствующие при определенных условиях кислотные атомы водорода замещают катионами неорганических и/или органических оснований, аминокислот или амидов аминокислот.
Используемые в описанных выше реакциях карбоновые кислоты общих формул IIa-VIIa либо являются известными соединениями, либо их получают по описанным в примерах методам. Так, в частности, способ получения карбоновых кислот общей формулы IIa известен из DE 19652386. Карбоновые кислоты общей формулы IIIa можно получать аналогично примеру 3, приведенному ниже в настоящем описании. Способ получения карбоновых кислот общей формулы IVa описан в DE 19728954.
Предшественником соединений общей формулы VA является N3-(2,6-диоксоморфолиноэтил)-N6-(этоксикарбонилметил)-3,6-диазапробковая кислота, которая описана в ЕР 263059.
Соединения общей формулы VB являются производными изомерной диэтилентриаминпентауксусной кислоты (ДТПК), которая присоединена через находящуюся у центрального N-атома уксусную кислоту. Эта ДТПК описана в DE 19507819 и DE 19508058.
Соединения общей формулы VI являются производными N-(карбоксиметил)-N-[2-(2,6-диоксо-4-морфолинил)этил]глицина, способ получения которого описан в J. Am. Oil. Chem. Soc., 59 (2) (1982), сс.104-107.
Соединения общей формулы VII являются производными 1-(4-карбоксиметоксибензил)этилендиаминтетрауксусной кислоты, которая описана в патенте US 4622420.
Получение аминов общей формулы IX и карбоновых кислот общей формулы Х подробно описано в примерах, приведенных ниже в настоящем описании, и поэтому указанные соединения можно получать аналогично рассмотренным в этих примерах методам. Амин общей формулы VIIIa является известным исходным соединением.
Используемые в качестве исходных веществ пербензилированные сахарные кислоты можно получать аналогично методу, описанному у Lockhoff в Angew. Chem., 110, №24 (1998), сс.3634 и далее. Так, например, 1-O-уксусную кислоту получают из пербензилглюкозы в две стадии, а именно, через трихлорацетимидат и взаимодействие с этиловым эфиром гидроксиуксусной кислоты, при катализе с помощью BF3 в ТГФ с последующим омылением с помощью NaOH в МеОН/ТГФ.
В одном из предпочтительных вариантов используемые в качестве исходных веществ пербензилированные сахарные кислоты можно также получать растворением пербензилированного 1-ОН-сахара в не смешивающемся с водой органическом растворителе с последующим взаимодействием с алкилирующим агентом общей формулы XI
,
где Nu представляет собой нуклеофоб, L обозначает -(СН2)n (где n=1-5), -СН2-СНОН-, -СН(СНОН-СН2OH)-СНОН-СНОН-, a Sg представляет собой защитную группу, в присутствии основания и необязательно межфазного катализатора. Алкилирующий агент общей формулы XI может содержать в качестве нуклеофоба, например, -Cl, -Br, -J, -OTs, -OMs, -OSO2CF3, -OSO2C4F9 или -OSO2C8F17. Под защитной группой подразумевается обычно используемая в подобных целях кислотозащитная группа. Такие защитные гр