Ненуклеозидные ингибиторы обратной транскриптазы, фармацевтическая композиция, содержащая их, их применение при изготовлении лекарственных средств для лечения вич-1, промежуточные для их получения
Иллюстрации
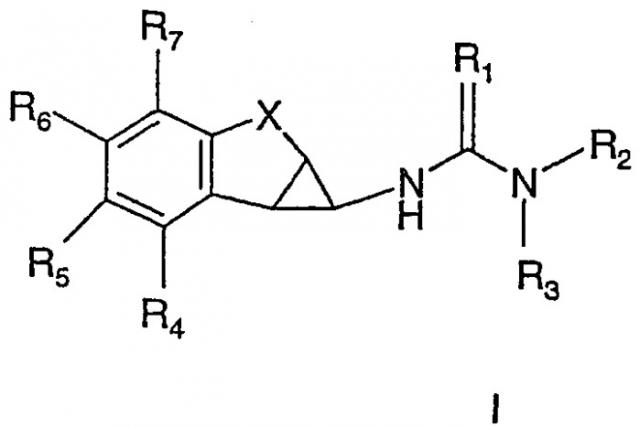
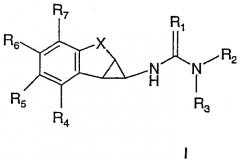
Показать всеИзобретение относится к новым ненуклеозидным ингибиторам обратной транскриптазы формулы I:
где R1 представляет О, S; R2 представляет необязательно замещенный, азотсодержащий гетероцикл, в котором азот расположен в положении 2 относительно связи с (тио)мочевиной; R3 представляет Н, C1-С3алкил, R4-R7 независимо выбраны из Н, C1-С6алкила, С2-С6алкенила, С2-С6алкинила, галогенС1-С6алкила, C1-С6алканоила, галогенС1-С6алканоила, C1-С6алкокси, галогенС1-С6алкокси, гидрокси-С1-С6алкила, циано, галогена, гидрокси; Х представляет -(CHR8)n-D(CHR8)m-; D представляет -О- или -S-; R8 представляет Н, n и m представляют независимо 0, 1 или 2; и его фармацевтически приемлемым солям. Изобретение относится также к фармацевтической композиции на основе этих соединений, обладающей ингибирующей активностью в отношении обратной транскриптазы ВИЧ-1, а также к применению этих соединений при изготовлении лекарственных средств для лечения ВИЧ-1 и промежуточным соединениям. 6 н. и 39 з.п. ф-лы, 1 табл.
Реферат
Область техники
Данное изобретение относится к ненуклеозидным ингибиторам обратной транскриптазы, активным против ВИЧ-1 и обладающим улучшенной устойчивостью и фармакокинетическим профилем. Изобретение также относится к новым промежуточным соединениям в синтезе таких соединений и использованию данных соединений в антивирусных способах и композициях.
Предпосылки изобретения
Ненуклеозидные ингибиторы обратной транскриптазы (non nucleoside reverse transcriptase ingibitors (NNRTI)) связываются с аллостерическим участком на обратной транскриптазе и представляют важную разработку в арсенале лекарственных средств против ВИЧ, в частности ВИЧ-1. Международная патентная заявка WO 93/03022 раскрывает NNRTI на основе тиомочевины, которые позже были обозначены «PETT» (фенилэтилтиазолилтиомочевина) соединениями в J.Med.Chem. 39 6 1329-1335 (1995) и J.Med.Chem. 39 21 4261-4274 (1996). Международные патентные заявки №№ WO 99/47501, WO 00/39095, WO 00/56736, WO 00/78315 и WO 00/78721 описывают производные тиомочевины РЕТТ, которые, как заявлено в этих документах, были оптимизированы против сложного RT-связывающего "кармана".
Международная патентная заявка № WO 95/06034 и J.Med.Chem. 42 4150-4160 (1999) раскрывает соединения мочевины, являющиеся изостерами РЕТТ NNRTI. Международная патентная заявка № WO 99/36406 раскрывает NNRTI соединения, представляющие собой соединения мочевины со свободно стоящим циклопропильным мостиком, где фенильное левое крыло обязательно содержит функциональную 6-гидроксигруппу, и Международная патентная заявка № WO 00/47561 раскрывает пролекарства таких соединений.
Несмотря на то, что NNRTI на основе мочевины и тиомочевины, раскрытые в приведенных выше документах, активны против обратной транскриптазы, в особенности обратной транскриптазы ВИЧ-1, природа вируса ВИЧ с его чрезмерной потерей репликативной точности и, вследствие этого, тенденцией к быстрому развитию резистентности, диктует необходимость дальнейшей разработки антиретровирусных средств с повышенным антивирусным действием против проблемных, устойчивых к лекарственным средствам мутантов, особенно по положениям 100, 103 и/или 181 RT.
Кроме того, современные схемы терапевтического лечения ВИЧ-инфекций, обозначенные HAART (высокоактивная антиретровирусная терапия (Highly Active Anti Retroviral Therapy)), предполагают введение антивирусных средств в виде комбинаций трех или более антивирусных средств различных классов, при этом такие комбинации вводят в течение продолжительных периодов времени, если не в течение жизни. HAART требует от пациента приема лекарственных средств по сложной схеме, при этом иногда предусматривается ежедневный прием большого количества таблеток в разное время суток, в некоторых случаях до, а в некоторых случаях после приема пищи. Таким образом, необходимы антиретровирусные препараты, допускающие большую гибкость в дозировании для удовлетворения потребностей пациента.
Краткое описание изобретения
В соответствии с первым аспектом изобретения представлены соединения формулы I
где
R1 представляет O, S;
R2 представляет необязательно замещенный, азотсодержащий гетероцикл, в котором азот расположен в положении 2 относительно связи с (тио)мочевиной;
R3 представляет H, C1-C3алкил;
R4-R7 независимо выбраны из H, С1-C6алкила, С2-C6алкенила, С2-C6алкинила, галогенС1-C6алкила, С1-C6алканоила, галогенС1-C6алканоила, С1-C6алкокси, галогенС1-C6алкокси, С1-C6алкилокси-С1-C6алкила, галогенС1-C6алкилокси-С1-C6алкила, гидрокси-С1-C6алкила, амино-С1-C6алкила, карбокси-С1-C6алкила, циано-С1-C6алкила, амино, карбокси, карбамоила, циано, галогена, гидрокси, кето и т.п.;
X представляет -(CH2)n-D-(CH2)m-;
D представляет -NR8-, -O-, -S-, -S(=О)- или -S(=O)2-;
R8 представляет H, С1-C3алкил;
n и m представляют независимо 0 или 1,
и их фармацевтически приемлемые соли и пролекарства.
В данном случае предпочтительным значением для R1 является О, т.е. производное мочевины, хотя очень важным вариантом также является случай, когда R1 представляет S (т.е. производное тиомочевины).
Представленные значения для R2 включают тиазолил, пиридил, пиримидил, пиразинил, пиридазинил, пирролил, имидазолил, индолил, триазолил, тетразолил, пиперидил, пиперазинил и конденсированные кольца, такие как бензотиазолил, бензопиридил, бензодиазолил, бензимидазолил, хинолил, пуринил и подобные, при этом любая из указанных групп может быть необязательно замещена.
Предпочтительные значения R2 включают пирид-2-ил и тиазол-2-ил.
Необязательные заместители для R2 могут включать до трех заместителей, таких как С1-C6алкил, С1-C6алкокси, С2-C6алкенил, С2-C8алкинил, С2-C8алкенокси, С1-C6алкоксиС1-C6алкил, С1-C6алканоил, галогенС1-C6алкил, С1-C4алканоилокси, С1-C4алкилтио, амино (включая С1-C3алкилзамещенную аминогруппу), карбокси, карбамоил, циано, галоген, гидрокси, аминометил, карбоксиметил, гидроксиметил, нитро, арил (такой как фенил, пиррол-1-ил, тетразол-5-ил, триазол-4-ил, пиридил, пиримидил, пиразинил, имидазолил, индолил, пиперидил, пиперазинил и подобные), замещенный (как определено в данном описании) арил или -SO2Q, или -C(=O)Q, где Q представляет С1-C6алкил, галогензамещенный С1-C6алкил, арил (как определено в данном описании), замещенный (как определено в данном описании) арил или амино. Гетероатомы в R2 могут быть превращены в производные, например, с С1-C6алкилом, оксо и подобным. Необязательный заместитель R2 может быть в орто- или мета-положении относительно связи с (тио)мочевинной функциональной группой, но предпочтительным является пара-положение.
Предпочтительные необязательные заместители при R2 включают этинил, фенокси, пирид-1-ил, циклопропил, фенил, галогензамещенный фенил (особенно пара- и мета- хлор- и фторфенил) и диметиламино. Наиболее предпочтительные заместители R2 включают галоген (F, Br, Cl и I) и циано. Предпочтительные галогеновые группы включают Cl.
В данном случае предпочтительным значением для R3 является H.
R4, предпочтительно, представляет водород, галоген или гидрокси, особенно фтор.
R5, предпочтительно, представляет галоген, С1-C3алкилкарбонил, С1-C3алкилокси или Н, особенно фтор и наиболее предпочтительно Н.
R6, предпочтительно, представляет водород, галоген, С1-C3алкилокси, С1-C3алкилкарбонил, циано или этинил, особенно метокси или фтор и наиболее предпочтительно Н.
R7, предпочтительно, представляет водород, галоген, С1-C3алкилокси или С1-C3алкилкарбонил, наиболее предпочтительно фтор.
R5 и R6, предпочтительно, представляют Н, и R4 иR7, предпочтительно, представляют галоген, наиболее предпочтительно оба представляют фтор.
Предпочтительно, D представляет -O-, n равно 0, m равно 1, R1 представляет О, R2 представляет замещенный пирид-2-ил и R3 представляет Н. Альтернативное предпочтительное воплощение охватывает соединения, в которых D представляет -O-, n равно 0, m равно 1, R1 представляет S, R2 представляет замещенный пирид-2-ил и R3 представляет Н.
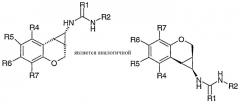
Соединения формулы I могут быть введены в виде рацемической смеси, но предпочтительно промежуточный циклопропильный фрагмент, (тио)мочевинная функциональная группа, Х и фенильное кольцо (обозначенное ниже Y) являются, по меньшей мере, на 75%, такими как до примерно 90%, энантиомерно чистыми по отношению к конформации:
Предпочтительные оптические изомеры соединений формулы I показывают отрицательную величину оптического вращения. Такие изомеры, например, когда Х представляет -О-СН2-, как правило, элюируются менее быстро из хиральной хроматографической колонки, например, хиральной AGP 150 x 10 мм, 5 мкм; Crom Tech LTD Colomn, скорость потока 4 мл/мин, подвижная фаза 89% об. 10 мМ НОАс/NH4OAc в ацетонитриле. На основании предварительного рентгеновского кристаллографического анализа самой предпочтительной конфигурацией оказалась:
В данном случае предпочтительным значением для D является -O-. Подходящие значения для n и m включают 1:0 и 1:1. Предпочтительные значения n:m включают 0:2 и особенно 0:1, то есть хромановое производное. Особенно предпочтительные соединения имеют стереохимию, соответствующую (1S,1aR,7bR)-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-илу. В целях ясности, следует заметить, что структура
Выражение С1-Cnалкил, где n равно 3, 6, 7 и т.д., или низший алкил включает такие группы, как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, н-пентил, н-гексил, 3-метилпентил и подобные. Термин галоген относится к хлору, брому, фтору и иоду, особенно к фтору. С1-Cnалкокси относится к группам, таким как метокси, этокси, пропокси, трет-бутокси и подобным. С2-Cnалкенил относится к группам, таким как винил, 1-пропен-2-ил, 1-бутен-4-ил, 1-пентен-5-ил, 1-бутен-1-ил и подобным. С1-Cnалкилтио включает метилтио, этилтио, трет-бутилтио и подобные. С1-Cnалканоилокси включает ацетокси, пропионокси, формилокси, бутирилокси и подобные. С2-Cnалкенокси включает этенилокси, пропенилокси, изобутоксиэтенил и подобные. ГалогенС1-Cnалкил (включая сложные заместители, содержащие такую группу, как галогенС1-Cnалкилокси) включает алкилы, как определено в данном описании, замещенные 1-3 раза галогеном, включая трифторметил, 2-дихлорэтил, 3,3-дифторпропил и подобные. Термин амин включает такие группы, как NH2, NHMe, N(Me)2, которые могут быть необязательно замещены галогеном, С1-C7ацилокси, С1-C6алкилом, С1-C6алкокси, нитро, карбокси, карбамоилом, карбамоилокси, циано, метилсульфониламино и т.п. Карбокси, карбоксиметил и карбамоил включают соответствующие фармацевтически приемлемые С1-C6алкиловые и ариловые сложные эфиры.
Пролекарства соединений формулы I представляют собой те соединения, которые после введения пациенту высвобождают in vivo соединения формулы I. Типичными пролекарствами являются фармацевтически приемлемые простые эфиры и, особенно, сложные эфиры (включая эфиры фосфорной кислоты), где любой из R4-R7 или необязательный заместитель для R2 представляет функциональную гидроксигруппу, фармацевтически приемлемые амиды или карбаматы, где любой из заместителей R2 или R4-R7 представляет функциональную группу амина, или фармацевтически приемлемые сложные эфиры, где заместитель R2 или R4-R7 представляет функциональную карбоксигруппу.
Соединения формулы I могут образовывать соли, которые представляют дополнительный аспект данного изобретения. Подходящие фармацевтически приемлемые соли соединений формулы I включают соли органических кислот, особенно карбоновых кислот, включая, но не ограничиваясь ими, ацетат, трифторацетат, лактат, глюконат, цитрат, тартрат, малеат, малат, пантотенат, изетионат, адипат, альгинат, аспартат, бензоат, бутират, диглюконат, циклопентанат, глюкогептанат, глицерофосфат, оксалат, гептаноат, гексаноат, фумарат, никотинат, пальмоат, пектинат, 3-фенилпропионат, пикрат, пивалат, проприонат, тартрат, лактобионат, пивалат, камфорат, ундеканоат и сукцинат, соли органических сульфоновых кислот, такие как метансульфонат, этансульфонат, 2-гидроксиэтансульфонат, камфорсульфонат, 2-нафталинсульфонат, бензолсульфонат, п-хлорбензолсульфонат и п-толуолсульфонат; и соли неорганических кислот, такие как гидрохлорид, гидробромид, гидроиодид, сульфат, бисульфат, гемисульфат, тиоцианат, персульфат, соли фосфорной и сульфоновой кислот.
Гидроксизащитная группа, как используемая в данном описании, относится к заместителю, который защищает гидроксильные группы от нежелательных реакций в процессе синтеза, например, -О-защитные группы, раскрытые в Greene, "Protective Groups in Organic Synthesis" (John Wiley & Sons, New York (1981)). Гидроксизащитные группы включают замещенные простые метиловые эфиры, например, метоксиметиловый, бензилоксиметиловый, 2-метоксиэтоксиметиловый, 2-(триметилсилил)этоксиметиловый, трет-бутиловый и другие простые низшие алкиловые эфиры, такие как изопропиловый, этиловый и особенно метиловый, бензиловый и трифенилметиловый; тетрагидропираниловые эфиры; замещенные простые этиловые эфиры, например, 2,2,2-трихлорэтиловый; простые силиловые эфиры, например, триметилсилиловый, трет-бутилдиметилсилиловый и трет-бутилдифенилсилиловый; и сложные эфиры, полученные взаимодействием гидроксильной группы с карбоновой кислотой, например, ацетат, пропионат, бензоат и подобные.
Изобретение также предлагает фармацевтические композиции, содержащие соединения данного изобретения и их фармацевтически приемлемые носители или разбавители. Дополнительные аспекты изобретения предлагают способы ингибирования ВИЧ, включающие введение соединения формулы I субъекту, страдающему или подверженному ВИЧ-1. ВИЧ-1 может включать мутант, устойчивый к лекарственным средствам, такой как штамм ВИЧ, включающий мутации при 100, 103 и/или 181 положениях, особенно K103N.
Изобретение также охватывает применение соединений формулы I в терапии, такой как изготовление лекарственных средств для лечения ВИЧ-инфекций.
При лечении состояний, вызванных ВИЧ, соединения формулы I предпочтительно вводят в количестве, которое необходимо для достижения уровня в плазме примерно 100-5000 нМ, такого как 300-2000 нМ. Это соответствует дозировке, в зависимости от биодоступности композиции, порядка 0,01-10 мг/кг/день, предпочтительно 0,1-2 мг/кг/день. Обычная доза для нормального взрослого пациента составляет примерно 0,05-5 г в день, предпочтительно 0,1-2 г, например, 500-750 мг, от одной до четырех единичных доз в день. Как и со всеми фармацевтическими средствами, доза будет изменяться в зависимости от веса и метаболизма пациента, а также от тяжести инфекции, и может быть необходимость приспособить ее к сопутствующей терапии.
В соответствии с обычной практикой применения ингибиторов ВИЧ является выгодным совместное введение одного-трех дополнительных антивирусных препаратов для получения синергических ответных реакций и для обеспечения дополнительной сопротивляемости. Такие дополнительные антивирусные препараты могут включать AZT, ddl, ddC, D4T, 3TC, DAPD, аловудин, абакавир, адефовир, адефовир дипивоксил, бис-POC-PMPA, GW420 867X, фоскарнет, гидроксимочевину, Hoechst-Bayer HBY 097, ефавиренз, тровирдин, каправирин, невирапин, делавиридин, типранавир, емтрицитабин, PFA, H2G (омацикловир), MIV-606 (валомацикловир стеарат), TMC-126, TMC-125, TMC-120, ефавиренз, DMP-450, ловирид, ритонавир (включая калетру), лопинавир, саквинавир, лазинавир, индинавир, ампренавир, ампренавирфосфат, нелфинавир и подобные, обычно в молярных соотношениях, отражающих их относительную активность и биодоступность. Главным образом, такое соотношение будет порядка 25:1 до 1:25, относительно соединения формулы I, но может быть ниже, например, в случае антагонистов цитохрома, таких как ритонавир.
Соединения изобретения обычно получают следующим образом:
Схема 1
(а) DPPA, Et3N, толуол; (b) замещенный 2-аминопиридин; (с) водный раствор HCl, диоксан; (d) замещенный 2-пиридилизотиоцианат.
Соединения общей формулы (I), где R1 представляет О (мочевина) или S (тиомочевина), R2 представляет, например, 5-замещенный пирид-2-ил и R3 представляет Н, получают способами, показанными на схеме 1. Циклопропанкарбоновую кислоту 1-Схема-1 превращают в ацилазид и нагревают до 120°С, чтобы индуцировать перегруппировку Курциуса (Curtius) и получить изоцианат 2-Схема-1. Мочевину 3-Схема-1 получают реакцией сочетания изоцианата с подходящим образом замещенным 2-аминопиридином. Гидролиз изоцианата, как на стадии (с), приводящий к циклопропиламину 4-Схема-1, с последующей реакцией с 2-пиридилизотиоцианатом дает тиомочевину 5-Схема-1. Изотиоцианат может быть получен из необязательно замещенного на кольце 2-аминопиридина известными способами, такими как обработка тиофосгеном или тиокарбонилдиимидазолом. R3 варианты формулы I получают, соответственно, используя подходящим образом аминзамещенный амино-R2, т.е. 2-(N-метиламино)пиридин, для R3 в виде метила. Многие 2-аминопиридины являются коммерчески доступными, а другие описаны в литературе, например те, которые показаны на схеме 2. Соединения, где R1=S, альтернативно могут быть получены из изотиоцианата, соответствующего 2-Схема-2, или из амина 3-Схема-2 и амино-R2 в сочетании с RC(=S)R', оба, как описано в № WO 9303022. Хотя схема 1 проиллюстрирована с использованием замещенного пиридила, совершенно очевидно, что могут быть использованы соответствующие сочетания для других R2 вариантов, такие как необязательно замещенный тиазолил, пиразинил, бензотиазолил, пиримидинил и т.д.
Схема 2
(а) фенол, NaH, ДМФ; (b) 10% Pd/C, H2 1 атм, EtOH; (с) PdCl2(PPh3)2, триметилсилилацетилен, CuI, диизопропиламин; (d) фторид трет-бутиламмония.
Замещение брома в 5-бром-2-нитропиридине феноксигруппой с последующим восстановлением нитрогруппы дает 2-амино-5-феноксипиридин. Сочетание Соногашира (Sonogashira) 2-амино-5-иодопиридина с концевым алкином SiMe3C≡CH в присутствии каталитических количеств дихлорида бис(трифенилфосфин)палладия и иодида меди, как на стадии (с), дает 2-амино-5-(2-триметилсилилэтинил)пиридин. Удаление силильной группы при помощи TBAF приводит к 2-амино-5-этинилпиридину, который может быть подвергнут реакции сочетания, как описано на схеме 1. Альтернативно, обработка TBAF может быть проведена с мочевиной 3-Схема-1 или тиомочевиной 5-Схема-1, где R10 представляет -С≡CSiMe3, для преобразования R10 в С≡СН.
Схема 3
(а) этилдиазоацетат, катализатор, CH2Cl2; (b) хроматография и затем кипячение с обратным холодильником с LiOH, H2O, MeOH; (с) кипячение с обратным холодильником с LiOH, H2O, MeOH и затем хроматография; (d) комнатная температура, NaOH, H2O, MeOH и затем кипячение с обратным холодильником с LiOH, H2O, MeOH.
Соединения общей формулы (I), где R1 представляет О (мочевина) или S (тиомочевина), R2 представляет, например, 5-замещенный пирид-2-ил, R3 представляет Н, Х представляет -D-CH2, и где циклопропильный фрагмент имеет относительную конфигурацию
получают способами, показанными на схеме 3. Циклопропанирование двойной связи в хромене 1-Схема-3 этилдиазоацетатом катализируется солями меди или родия(II), такими как CuI, (CuOTf)2-бензол, и Rh2(OAc)4, в растворителях, таких как дихлорметан, 1,2-дихлорэтан или хлороформ. Реакция дает диастереомерную смесь этиловых эфиров циклопропанкарбоновой кислоты 2-Схема-3 с относительной конфигурацией для всех цис-изомеров и 3-Схема-3 для их транс-изомеров. Разделение колоночной хроматографией цис- и транс-диастереомеров может быть выполнено на данной стадии с последующим гидролизом выделенного 2-Схема-3, например, кипячением с обратным холодильником в водном метанольном растворе LiOH с получением рацемической смеси всех цис-изомеров циклопропанкарбоновой кислоты 4-Схема-3, как описано на стадии (b). Альтернативно, диастереомерная смесь этиловых эфиров может быть подвергнута гидролизу и разделению, проводимому на смеси циклопропанкарбоновых кислот, с выделением всего цис-изомерного продукта, как на стадии (с). Стадия (d) включает выделение цис-этилового сложного эфира 2-Схема-3, который также может быть получен селективным гидролизом транс-соединения 3-Схема-3 при низких температурах, например, обработкой водным метанольным раствором NaOH при температуре окружающей среды. Выделенный цис-этиловый эфир затем может быть гидролизован обычным способом до циклопропанкарбоновой кислоты 4-Схема-3. Циклопропанкарбоновую кислоту подвергают обработке способами, как показано на схеме 1, до получения мочевины или тиомочевины 5-Схема-3. Хромены 1-Схема-3 получают способами, показанными на схемах 4, 5 и 6.
Хотя схема 3 проиллюстрирована вариантом с D=O, должно быть понятно, что возможны соответствующие манипуляции с D=S, S=O; S(=O)2 и D=NR8 вариантами. Когда R8 представляет Н, азот обычно является защищенным традиционной защитной группой вторичного амина, такой как описано в Greene & Wuts, Protective Groups in Organic Synthesis 2nd ed, Wiley NY (1991).
Схема 4
(а) 3-бромпропин, К2СО3, ацетон; (b) N,N-диэтиланилин или PEG-200, 225°С.
Схема 4 описывает получение хроменов, включая многие из коммерчески доступных дизамещенных фенолов, таких как те, у которых замещение в бензольном кольце представляет собой следующее: R4 и R7 представляют галоген; R4 и R6 представляют галоген; R5 и R7 представляют галоген; R4 представляет галоген и R7 представляет С1-3алкилкарбонил; и R4 представляет гидрокси, в то время как R5 представляет С1-3алкилкарбонил. Реакция доступного дизамещенного фенола 1-Схема-4 с 3-бромпропином в присутствии основания, такого как К2СО3 в ацетоне или NaH в ДМФ, приводит к нуклеофильному замещению галогенида с получением простого эфира 2-Схема-4. Замыкание кольца может быть осуществлено нагреванием эфира в N,N-диметиланилине или полиэтиленгликоле с получением хромена 3-Схема-4.
Схема 5
(a) NaBH4, EtOH; (b) п-толуолсульфоновая кислота, толуол, кипячение с обратным холодильником.
Схема 5 описывает получение хроменов, используемых в качестве исходного вещества на схеме 3, из соответствующим образом замещенных хроманонов, которые являются легко доступными из коммерчески доступных хроманонов, например таких, у которых одно из положений в R4-R7 замещено галогеном или С1-3алкокси. Преобразование карбонильной группы в 4-хроманон 1а-Схема-5 и до соответствующего спирта при помощи подходящего восстанавливающего агента, такого как боргидрид натрия в этаноле, дает 2-Схема-5. Кипячение с обратным холодильником спирта с небольшими количествами кислоты, такой как п-TsOH в толуоле, вызывает дегидратацию 2-Схема-5 до желаемого хромена 1-Схема-3. Соответствующие манипуляции возможны для других вариантов D. Например, соответствующий 2Н-1-бензотиопиран легко может быть получен из коммерчески доступных (замещенных) тиохроман-4-онов реакцией с восстановителем, таким как гидрид металла, например, литийалюмогидрид, в органическом растворителе, таком как эфир, с последующей дегидратацией, такой как кипячение с обратным холодильником с кислотой, например, кислым сульфатом калия или подобной.
Схема 6
(а) аллилбромид, К2СО3, ацетон; (b) Ph3PCH3Br, NaH, ТГФ; (с) Cl2[Pcy3]2Ru=CHPh, CH2Cl2; (d) Ph3P+CH=CH2Br-, DBU.
Хромены для использования в качестве исходного материала на схеме 3 получают из замещенных о-гидроксибензальдегидов, как проиллюстрировано способами схемы 6. Реакция 1-Схема-6 с аллилбромидом в присутствии основания, такого как К2СО3 в ацетоне, приводит в результате к нуклеофильному замещению галогенида с получением простого эфира 2-Схема-6. Посредством реакции Виттинга (Witting) альдегидную группу превращают в олефин и получают 3-Схема-6. Пара концевых двойных связей может подвергаться внутримолекулярному обмену при помощи обработки катализатором, таким как катализатор Грабба (Grubb) на основе комплекса рутения, на стадии (с) с получением хромена. Альтернативно, 1-Схема-6 может быть циклизован непосредственно, как показано на стадии (d) в описании к схеме выше.
Схема 7
(а) Pd(O), DPPP, Et3N, (CH3)3SiC≡CH; (b) Pd(O), бутилвиниловый эфир, ДМФ; (с) Pd(O), Zn(CN)2, ДМФ; (d) NaOH, H2O, MeOH. Катализируемая Pd(O) реакция сочетания трифлата 1-Схема-7 приводит к замещению трифторметансульфонилоксигруппы и введению других заместителей при R6. Таким образом, схема 7 представляет собой получение синтезированных промежуточных соединений для использования в схеме 3 для получения мочевины или тиомочевины 5-Схема-3, где R6 представляет циано, этинил или С1-3алкилкарбонил.
Схема 8
(a) BuLi/ZnCl2, ТГФ; Pd(OAc)2, BrCH=CHCOOEt; DIBAL
(b) TsNHN=CHCOCl; PhNMe2, NEt3, CH2Cl2
(c) Rh2(5-R-MEPY)4, абс. дегазированный дихлорметан
(d) 30% HBr, AcOH
(e) NaOH, H2O(f) NaOH; CO2; I-PrI/ДМСО
(g) iPrOH, HCl; DEAD, PPh3, ТГФ
(h) NaOH, MeOH:H2O
(i) 1. BBr3, CH2Cl2 2. CH3CN 3. NaOH, вода
(j) 1. BuLi/ZnCl2, ТГФ; Pd(OAc) 2. соединение 9-Схема-8 3. реагент Джонса (Jones) (хромовая кислота, серная кислота в ацетоне).
Удобные пути получения соединений, в которых Х представляет -СН2-О-, показаны на схеме 8, где Ra и Rb представляют необязательные заместители R4-R7, которые являются подходящим образом защищенными, в случае необходимости, подходящими защитными группами, и Rс представляет сложный низший алкиловый эфир. Необязательно замещенный фенол 1-Схема-8, который является гидроксизащищенным защитной группой, такой как метил, МОМ и подобными, подвергают взаимодействию с основанием, таким как BuLi или подобным, в растворителе, таком как ТГФ или подобный, и превращают в соль цинка при добавлении хлорида цинка или подобного. Катализатор, такой как Pd(OAc)2 или подобный, добавляют вместе с активированным акрилатом, таким как низший алкил-цис-3-галогенакрилат, например, BrCH=CHCOOEt или подобный. Реакционную смесь охлаждают и порциями добавляют восстановитель, такой как DIBAL или подобный, и реакцию гасят с получением на выходе 2-Схема-8. Гидразон, такой как п-толуолсульфонилгидразон или хлорангидрид глиоксиловой кислоты или подобный, и основание, такое как N,N-диметиланилин или подобное, добавляют в растворитель, такой как CH2Cl2 или подобный, с последующим добавлением другого основания, такого как Et3N или подобного, с получением 3-Схема-8. Продукт реакции растворяют в растворителе, таком как дихлорметан или подобный, который является предпочтительно дегазированным. Добавляют хиральный катализатор Дойла (Doyle), такой как Rh2(5-R-MEPy)4 (US 5175311, доступный от Aldrich или Johnson Matthey) или подобный, с получением 4-Схема-8 в большом энантиомерном избытке, например, более чем 80%, предпочтительно, более чем 90% ее. Предпочтительно, данное соединение сначала подвергают взаимодействию с BBr3 в дихлорметане с последующим добавлением к реакционной смеси ацетонитрила и в конце добавляют гидроксид натрия с получением 6-Схема-8. Альтернативно, продукт (4-Схема-8) подвергают реакции раскрытия кольца в присутствии электрофила, предпочтительно HBr или подобного, в сочетании с кислотой, такой как АсОН или подобной. В кислых условиях происходит спонтанное закрытие кольца с образованием хроменона 5-Схема-8. В случае, когда воздействие осуществляют в основных условиях, таких как NaOH или подобные, хроменон перегруппировывается с образованием хроменциклопропилкарбоновой кислоты 6-Схема-8. Альтернативно, соединение 4-Схема-8, например, в случае, если фенольная защитная группа представляет собой МОМ, взаимодействие может быть осуществлено в основных условиях, таких как NaOH в присутствии диоксида углерода и низшего алкилгалогенида, такого как iPrI, в растворителе, таком как ДМСО, что приводит к открытию лактона и получению сложного алкилового эфира 7-Схема-8. Замещение гидроксизащитной группы и замыкание кольца свободным гидроксиметильным фрагментом имеет место в кислых условиях, таких как iPrOH/HCl или подобное, с последующей обработкой DEAD; PPh3 в органическом растворителе, таком как ТГФ или подобный.
Альтернативно, при другом подходе, соединение 1-Схема-8 подвергают взаимодействию с BuLi и превращают в соль цинка. Данную соль подвергают взаимодействию с циклопропилиодидом, 9-Схема-8, по реакции, катализируемой палладием, с получением после реакции с реагентом Джонса (Jones) соединения 4-Схема-8. Эту карбоновую кислоту, в свою очередь, превращают в изоцианат, как показано на схеме 1, а затем в гетероарилмочевину или гетероарилтиомочевину формулы I.
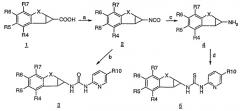
Следующий аспект изобретения предлагает новые промежуточные соединения, используемые в описанных выше способах получения соединения формулы I. Предпочтительная группа промежуточных соединений включает соединения формулы II:
где Х и R4-R7 являются такими, как определено выше, и R11 представляет -C(O)OR12, где R12 представляет Н или карбоксизащитную группу, такую как сложный низший алкиловый эфир; -NCO, -NCS или амин, такой как NH2. Предпочтительная подгруппа соединений формулы II имеет формулу III:
где R4 и R7 представляют независимо галоген, наиболее предпочтительно фтор, и R11 представляет -СООН, ее сложный низший алкиловый эфир, изоцианат, изотиоцианат или амино.
Следующая группа предпочтительных промежуточных соединений включает соединения формулы IV
где R4-R7 являются такими, как определено выше, PG представляет гидроксизащитную группу и PG* представляет гидроксизащитную группу или вместе со смежным атомом О обозначает функциональную кетогруппу.
Предпочтительной подгруппой соединений формулы IV являются соединения формулы V:
где R4 и R7 независимо представляют галоген, наиболее предпочтительно фтор, PG представляет низший алкил, такой как изопропил, этил и, наиболее предпочтительно, метил, и PG* представляет низший алкил, такой как изопропил, этил, и наиболее предпочтительно, метил, или вместе со смежным атомом О обозначает кетогруппу.
Еще одна группа предпочтительных промежуточных соединений включает соединения формулы VI:
где R4-R7 являются такими, как определено выше, PG представляет гидроксизащитную группу и R13 представляет Н, их сложный эфир или гидроксизащитную группу. Предпочтительная подгруппа в формуле VI имеет формулу VII:
где R4 и R7 представляют независимо галоген, предпочтительно фтор, PG представляет низший алкил, такой как изопропил, этил и наиболее предпочтительно метил, и R12 представляет Н или -С(=О)СН=N=N.
Предпочтительные соединения формулы I включают
цис-1-(5-цианопиридин-2-ил)-3-(1,1a,2,7b-тетрагидроциклопропа[c|хромен-1-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(1,1a,3,7b-тетрагидро-2-оксациклопропа[a]нафталин-1-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(7-гидрокси-6-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(6-ацетил-7-гидрокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(7-фтор-4-метокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(7-фтор-4-хлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(5-хлорпиридин-2-ил)-3-(4-хлор-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(5-бромпиридин-2-ил)-3-(4-хлор-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(5-циано-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(5-этинил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(5-ацетил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевину,
цис-1-(5-метокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(N-ацетил-1,1a,3,7b-тетрагидро-2-оксациклопропа[a]хинолин-1-ил))мочевину,
цис-1-(5-циано-3-метилпиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-этинилпиридин-2-ил)мочевину,
цис-1-(5-бромпиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-феноксипиридин-2-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)тиомочевину,
1-(6-хлор-5-цианопиридин-2-ил)-3-(5,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
1-(5-цианопиридин-2-ил)-3-(5,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(4-бром-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевину,
цис-1-(4-бром-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(6-хлор-5-цианопиридин-2-ил)мочевину,
цис-1-(4-бром-6-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевину,
цис-1-(4-бром-6-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(6-хлор-5-цианопиридин-2-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(6-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-N-[1a,6b-дигидро-1H-бензо[b]циклопропа[d]тиен-1-ил]-N'-(5-циано-2-пиридинил)мочевину,
N-[(1S,1aR,7bR) или (1R,1aS,7bS)-1,1a,2,7b-тетрагидроциклопропа[c][1]бензотиопиран-1-ил]-N'-(5-циано-2-пиридинил)мочевину,
цис-N-(5-бром-2-пиридинил)-N'-(7-хлор-4-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-N-(7-хлор-4-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-N'-(5-хлор-2-пиридинил)мочевину,
цис-N-(7-хлор-4-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-N'-(5-циано-2-пиридинил)мочевину,
цис-N-(5-фенокси-2-пиридинил)-N'-(4,7-дихлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-N-(5-бром-2-пиридинил)-N'-(4,7-дихлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-N-(5-хлор-2-пиридинил)-N'-(4,7-дихлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-N-(5-циано-2-пиридинил)-N'-(4,7-дихлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
N-[(1S,1aR,7bR)-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(5-фтор-2-пиридинил)мочевину,
N-[(1S,1aR,7bR)-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(5-иод-2-пиридинил)мочевину,
N-[(1S,1aR,7bR)-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(3-изоксазолил)мочевину,
N-[(1S,1aR,7bR)-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-[4-(4-хлорфенил)-1,3-тиазол-2-ил]мочевину,
N-[(1S,1aR,7bR)-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(6-фтор-1,3-бензотиазол-2-ил)мочевину,
N-[(1S,1aR,7bR)-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(4-пиримидинил)мочевину,
N-[(1S,1aR,7bR)-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(2-пиразинил)мочевину,
N-[(1S,1aR,7bR)-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(5-циклопропил-1Н-пиразол-3-ил)мочевину
и их фармацевтически приемлемые соли, особенно энантиомерно обогащенные, например, более чем 80% по массе, предпочтительно >90%, а именно >97% ее, или чистые препараты, включающие (-)энантиомер.
Особо предпочтительные соединения, таким образом, включают
(-)-цис-1-(5-цианопиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
(-)-цис-1-(5-хлорпиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину; или
(-)-цис-1-(5-цианопиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)тиомочевину;
(-)-цис-1-(5-фторпиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
(-)-цис-1-(5-фторпиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)тиомочевину;
и их фармацевтически приемлемые соли.
Несмотря на то, что возможно введение активного агента отдельно, предпочтительно чтобы он присутствовал как часть фармацевтической композиции. Такая композиция содержит определенный выше активный агент вместе с одним или более приемлемыми носителями или эксципиентами и необязательно другими терапевтическими ингредиентами. Носитель(и) должен быть приемлемым в смысле его совместимости с другими ингредиентами композиции и безвредным для реципиента.
Композиции включают композиции, подходя