Гидрофильный фармацевтический препарат, содержащий натеглинид
Иллюстрации
Показать всеГидрофильная гипогликемическая фармацевтическая композиция включает кристаллы натеглинида В-типа в качестве активного ингредиента. Композиция имеет краевой угол поверхности к воде 111 градусов или менее. Указанный краевой угол создается введением в композицию, по меньшей мере, одного гидрофильного вещества, выбранного из групп, состоящих из гидрофильных полимеров, поверхностно-активных веществ, сахаров и сахароспиртов. Настоящее изобретение обеспечивает легкость получения композиции, ее высокую растворимость и достаточно быстрое высвобождение натеглинида. 2 н. и 11 з.п. ф-лы, 8 ил., 4 табл.
Реферат
Предпосылки к созданию изобретения
Данное изобретение имеет отношение к созданию препарата, содержащего в качестве активного ингредиента натеглинид, который используют как супрессор глюкозы крови. Точнее, данное изобретение относится к созданию гидрофильного фармацевтического препарата, содержащего кристаллы натеглинида В-типа.
Известно, что натеглинид [название соединения: N-(транс-4-изопропилциклогексанкарбонил)-D-фенилаланин] при пероральном введении оказывает превосходный снижающий глюкозу крови эффект и используется как терапевтическое средство для лечения диабета (Японская публикация № Hei 4-15221). Для проявления потенциальных лечебных свойств натеглинида, характеризующегося быстрым эффектом и короткой продолжительностью действия, указанное лекарственное средство должно обладать свойством немедленно высвобождаться. Однако поскольку натеглинид является лекарственным средством, плохо растворимым в воде, поэтому препарат, характеризующийся способностью быстро высвобождаться, не может быть получен посредством общепринятых способов приготовления лекарственного средства, были предложены препараты, которые содержали гидроксипропилцеллюлозу с низкой степенью замещения (выкладка Японской патентной заявки № Hei 10-194969).
С другой стороны, известно, что натеглинид имеет кристаллические полиморфы, а среди них кристаллы Н-типа представляют собой наиболее стабильную кристаллическую форму (патент Японии №2508949). Хотя с точки зрения стабильности кристаллы В-типа являются менее стабильными, чем кристаллы Н-типа, первые оказываются лучше последних с точки зрения легкости их получения, и, следовательно, в настоящее время имеется возможность применять указанные кристаллы В-типа.
В этой связи препарат, в котором использованы кристаллы Н-типа согласно способу, описанному в выкладке Японской патентной заявки № Hei 10-194969, характеризуется достаточной способностью быстро высвобождаться, однако если препарат был получен с использованием кристаллов В-типа, то есть кристаллов полустабильного типа, тогда невозможно получить препарат, обладающий способностью быстро высвобождаться на таком же уровне, как препараты, содержащие кристаллы Н-типа. Кроме того, если композиции были получены с кристаллами В-типа и добавлением к ним целого ряда наполнителей, возникали проблемы, заключающиеся в том, что в зависимости от типов добавок порошкообразные вещества осаждались на аппаратах и тому подобном для смешивания и прессования их, и поэтому требовалось длительное время для промывания аппаратов после работы.
Описание изобретения
Цель данного изобретения заключается в создании препарата, характеризующегося способностью достаточно быстро высвобождаться и высокой степенью растворения, используя кристаллы натеглинида В-типа.
Другой аспект данного изобретения относится к способам, посредством которых, используя кристаллы натеглинида В-типа, легко может быть получен препарат, характеризующийся подходящими свойствами быстро высвобождаться и быстро растворяться.
Установлено, что если таблетки, имеющие плоскую и гладкую поверхность, получали, используя тип кристаллов натеглинида В-типа и кристаллов натеглинида Н-типа, и определяли краевой угол посредством сбрасывания капель воды на соответствующую поверхность указанных таблеток, краевой угол поверхности таблеток, содержащих кристаллы В-типа, к воде составлял 95 градусов и на поверхность таблеток, содержащих кристаллы Н-типа, к воде составляет 85 градусов, показывая, что кристаллы В-типа являются более гидрофобными, чем кристаллы Н-типа. Учитывая эти данные, при рассмотрении различных способов приготовления препарата с использованием кристаллов В-типа пришли к заключению, что можно получить препарат, характеризующийся способностью достаточно быстро высвобождаться и хорошо растворяться, при котором краевой угол его поверхности к воде оказывался 111 градусов или менее, и завершить данное изобретение.
Таким образом, в данном изобретении представляют гидрофильный фармацевтический препарат, содержащий натеглинид, который включает кристаллы натеглинида В-типа в качестве активного ингредиента и имеет краевой угол его поверхности к воде не более 111 градусов.
Кроме того, в данном изобретении представляют способы получения гидрофильного фармацевтического препарата, содержащего натеглинид, включающие технологию приготовления препарата посредством добавления гидрофильного вещества(в) к композиции исходных веществ, содержащей кристаллы натеглинада В-типа в качестве активного ингредиента, так, чтобы краевой угол поверхности названого препарата к воде оказался 111 градусов или менее.
Краткое описание чертежей
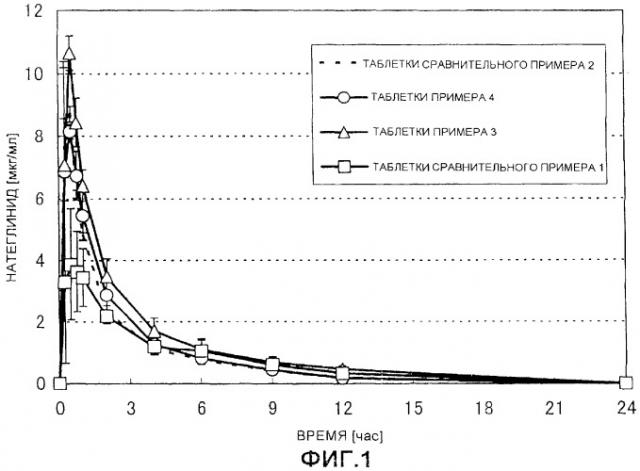
На фиг.1 представлен профиль концентрации натеглинида в плазме, когда таблетки натеглинида вводили гончим собакам за 5 минут до кормления: Среднее значение +/-SE; n=3.
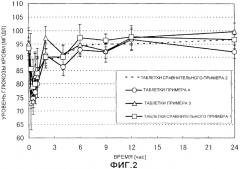
На фиг.2 представлен профиль уровня глюкозы крови, когда таблетки натеглинида вводили гончим собакам за 5 минут до кормления: Среднее значение +/-SE; n=3.
На фиг.3 представлен график DSC таблеток по примеру 1 до хранения в алюминиевом пакете при 40°С и 75% RH (относительной влажности) в течение 6 месяцев.
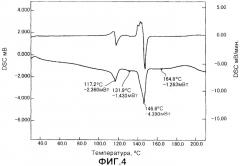
На фиг.4 представлен график DSC таблеток согласно примеру 1 после хранения в алюминиевом пакете при 40°С и 75% RH в течение 6 месяцев.
На фиг.5 представлен график DSC таблеток согласно примеру 3 до хранения в алюминиевом пакете при 40°С и 75% RH в течение 6 месяцев.
На фиг.6 представлен график DSC таблеток по примеру 3 после хранения в алюминиевом пакете при 40°С и 75% RH в течение 6 месяцев.
На фиг.7 представлен график DSC таблеток согласно примеру 4 до хранения в алюминиевом пакете при 40°С и 75% RH в течение 6 месяцев.
На фиг.8 представлен график DSC таблеток согласно примеру 4 после хранения в алюминиевом пакете при 40°С и 75% RH в течение 6 месяцев.
Наилучший способ выполнения изобретения
Препарат согласно данному изобретению представляет собой препарат, полученный введением в состав кристаллов натеглинида В-типа таким образом, чтобы краевой угол поверхности полученной композиции препарата к воде оказался 111 градусов или менее. В случае препарата, включающего кристаллы натеглинида В-типа, когда указанный краевой угол составляет 111 градусов или менее, можно получить препарат, содержащий кристаллы натеглинида В-типа, обладающий свойством быстро высвобождаться и хорошо растворяться. Предпочтительно, если указанный краевой угол составляет 100 градусов или менее, более предпочтительно 90 градусов или менее, может быть получен фармацевтический препарат, характеризующийся большей способностью быстро высвобождаться и более высокой способностью растворяться.
Кроме того, с практической точки зрения, возможно, лучше, когда указанный краевой угол составляет 30 градусов или более.
Используемый в описании термин "краевой угол к воде" означает угол, при котором капли воды, опускающиеся на поверхность композиций препарата, таких как таблетки и тому подобные, контактируют с указанной поверхностью, угол, который можно использовать как показатель гидрофильной природы. Например, такой краевой угол измеряют по образованию 1 мкл капли чистой воды (MILLI-Q; MILLIPORE Co.) на кончике иглы (SNSO 52/026; сделанной из нержавеющей стали, внутренний диаметр 0,26 мм, внешний диаметр 0,52 мм; HAMILTON Co.) и оценке краевого угла при 60 м секунду после того, как капля попадет на поверхность таблетки, используя устройство для измерения краевого угла (тип-OCA; Data Physics Co.). Если поверхность таблетки имеет искривление, такой краевой угол измеряют посредством коррекции этого искривления к прямой линии за время, в течение которого проводят анализ. Обычно краевой угол измеряют при комнатной температуре.
Что касается препаратов, которые не являются таблетками, краевые углы можно измерять после формования порошков, гранул, полутвердых веществ и тому подобного, содержащихся в таких препаратах. Например, в случае капсул их краевой угол может быть определен посредством удаления содержимого капсул и прессования 200 мг содержимого в таблетку, имеющую диаметр 8 мм и толщину 3,50 мм и имеющую плоскую и ровную поверхность.
Применяемые в изобретении кристаллы натеглинида В-типа могут быть получены растворением натеглинида, синтезированного различными способами, как описано в Японской патентной публикации № Hei 4-15221 и патенте Японии №2508949, в смеси этанол/вода или ацетон/вода, охлаждением полученного раствора до 5°С для осаждения кристаллов, отделением и высушиванием полученных кристаллов. Полученные таким образом кристаллы В-типа имеют точку плавления 129-130°С, а рентгенограмма, инфракрасный спектр поглощения и график DSC кристаллических порошков описаны в вышеуказанных Японских патентных документах.
В отношении фармацевтического препарата, содержащего кристаллы натеглинида В-типа в качестве активного ингредиента, намерение получить такой препарат, имеющий поверхностный краевой угол с водой 111 градусов или менее, может быть осуществлено, например, добавлением гидрофильного вещества(в) в композицию.
Под вышеупомянутым термином "гидрофильное вещество" подразумевают фармацевтически приемлемое вещество, такое как органические материалы, содержащие гидрофильную группу(ы), или неорганические соли, которые обладают значительной способностью взаимодействовать с водой и высокой аффинностью к воде. Примеры гидрофильных групп включают гидроксильную группу, карбоксильную группу, аминогруппу, группу пирролидона и тому подобные.
В изобретении гидрофильное вещество представляет собой вещество, имеющее соотношение неорганический/органический 0,3 или более, предпочтительно 0,7 или более, то есть соотношение неорганический/органический, определенное в Yoshio Kouda, "Organic Basic Concept - Fundament and Application - (Yuuki Gainennzu Kiso to Ouyou)" Sankyo Publisher (1984); Fujita and Masami Akatsuka, "Systematic Organic Qualitative Analysis (Keitouteki Yuuki Teisei Bunnseki) (Mixture Edition)", Fuma Shobou (1974); Yoshihiko Kuroki, "Dyeing Theoretical Chemistry (Sensyoku Riron Kagaku)", Maki Shoten (1966); Mitsuhiko Tobita and Yasuzou Uchida, "Fine Chemicals", Maruzen (1982); Hiroo Inoue, Satoshi Uehara and Mamoru Nango, "Methods for Separating Organic Compounds (Yuukikagoubutu Bunrihou)", Shoukabou (1990); и в тому подобном.
Конкретные примеры включают гидрофильные полимеры, имеющие молекулярную массу 500 или более, такие как поливинилпирролидон и его производные, поливиниловый спирт и его производные, производные полисахаридов, производные простых полиэфиров и тому подобное; анионные поверхностно-активные вещества, такие как карбоновые кислоты, сложные эфиры серной кислоты, сложные эфиры фосфорной кислоты и тому подобные; неионные поверхностно-активные вещества, такие как простые эфиры, сложные эфиры и тому подобные; сахара, такие как олигосахариды, моносахариды и тому подобные; сахароспирты, такие как маннит, ксилит, эритрит, сорбит, трегалоза, мальтит и тому подобные; и соли. Из них гидрофильные полимеры, анионные поверхностно-активные вещества, неионные поверхностно-активные вещества и сахароспирты являются предпочтительными и, в частности, предпочтительными являются маннит, поливинилпирролидон, лактоза (особенно, моногидрат), лаурилсульфат натрия, полисорбат и тому подобные. Также предпочтительной является комбинация гидрофильных полимеров и сахароспиртов.
Вводимые в состав количества указанных гидрофильных веществ относительно кристаллов натеглинида В-типа изменяются в зависимости от типа гидрофильных веществ. Например, в случае гидрофильных полимеров их можно применять в количествах, 1,2-кратных или более, предпочтительно 1,5-кратных или более, более предпочтительно 2-кратных или более к содержанию кристаллов натеглинида В-типа (на основе массы). Кроме того, с практической точки зрения предпочтительно использовать такие полимеры в 100-кратном или менее количестве. В случае поверхностно-активных веществ их количества могут быть доведены до 1% или более от содержания натеглинида. В этом случае с практической точки зрения также оказывается предпочтительным использовать такие поверхностно-активные вещества в 20-кратных или менее количествах.
Для достижения цели изобретения, кроме добавления к кристаллам указанных гидрофильных веществ, композиция препарата может быть покрыта пленкой или покрыта сахаром, при изготовлении гидрофильных фармацевтических препаратов, содержащих натеглинид, имеющих краевой угол к воде 111 градусов или менее, в виде таблеток, покрытых пленкой или сахаром.
Если гидрофильные фармацевтические препараты, содержащие натеглинид, должны быть покрыты пленкой, в качестве веществ, покрывающих пленкой, можно применять гидрофильные полимеры, такие как производные поливинилпирролидона, производные поливинилового спирта, производные полисахаридов, производные простых полиэфиров и тому подобные; или поверхностно-активные вещества. В таком случае оказывается предпочтительным использовать полиэтиленгликоль (молекулярная масса 1000-20000), гидроксипропилметилцеллюлозу 2910, поливинилпирролидон К90, полисорбат 80 и тому подобное. Также, если гидрофильные фармацевтические препараты, содержащие натеглинид, должны быть покрыты сахаром, можно применять олигосахариды, моносахариды или сахароспирты. Соотношение используемых покрывающих пленкой материалов в пленочном покрытии или сахара, используемого как покрывающее сахаром вещество, изменяется в зависимости от типа покрывающих пленкой веществ или сахаров, но соотношения должны составлять 30% или менее от массы препаратов, которые покрывают.
В случаях таблеток, покрытых пленкой, или таблеток, покрытых сахаром, предпочтительным является то, что таблетки, которые должны иметь покрытие, также содержат гидрофильное вещество(а) и имеют краевой угол к воде 111 градусов или менее.
Согласно данному изобретению гидрофильные фармацевтические препараты, содержащие натеглинид, дополнительно могут содержать наполнители и/или разбавители и тому подобное. Конкретные примеры включают легкий кремниевый ангидрид, стеарат магния, тальк, окись титана, гидроксипропилцеллюлозу, микрокристаллическую целлюлозу, вторичный кислый фосфат кальция, кукурузный крахмал и тому подобное.
Полученные таким образом препараты, содержащие кристаллы натеглинида В-типа, являются фармацевтическими препаратами, которые демонстрируют превосходное немедленное высвобождение и хорошее растворение и могут полностью проявлять особенности препаратов натеглинида - быстрый эффект и короткую продолжительность действия. Кроме того, если получают фармацевтические препараты, имеющие вышеуказанные свойства согласно изобретению, добавление гидрофильного вещества(в), которое делает возможным получать такие препараты, имеющие краевой угол к воде 111 градусов или менее, предпочтительно 100 градусов или менее, более предпочтительно 90 градусов или менее, в составляющие исходные вещества, содержащие кристаллы натеглинида В-типа, может значительно улучшить применимость, так как неочищенные смеси и тому подобные меньше осаждаются на производственной аппаратуре и, следовательно, легко осуществлять отмывание аппаратуры.
Следующие примеры и сравнительные примеры далее проиллюстрируют изобретение. Представленные примеры проиллюстрируют предпочтительные аспекты согласно изобретению, которые никоим образом не ограничивают изобретение.
Пример 1
После достаточного перемешивания 375 г кристаллов натеглинида В-типа, 262,5 г маннита, 75 г легкого кремниевого ангидрида и 750 г кросповидона, используя высокоскоростной перемешивающий гранулятор (тип High Speed Mixer 10Jd; Freund Sangyo K.K.), к полученной смеси добавляли 15 г гидроксипропилцеллюлозы, растворенной в 1170 г очищенной воды, а затем проводили высокоскоростное гранулирование с перемешиванием. Полученные гранулы корректировали по размеру и высушивали, затем добавляли 22,5 г стеарата магния и прессовали в 1500 г таблеток, имеющих диаметр 7 мм и вес 120 мг, которые содержали 30 мг кристаллов натеглинида В-типа. На полученные таблетки наносили распылением 235 г покрывающего раствора, состоящего из 8 г гидроксипропилметилцеллюлозы, 1,5 г полиэтиленгликоля 6000, 2,4 г талька, 0,5 г окиси титана и 87,6 г очищенной воды, чтобы получить 1529 г покрытых таблеток. Определяли краевой угол полученных покрытых таблеток, и краевой угол составлял 87 градусов. Способность растворяться в растворе №2, применяемом в тесте на дезинтеграцию согласно Фармакопее Японии, оценивали в соответствии со способом "лопастного перемешивания" согласно Фармакопее Японии (тестируемая жидкость 500 мл: 50 оборотов/минуту) и наблюдали 100% растворение за 30 минут.
Пример 2
После достаточного перемешивания 375 г кристаллов натеглинида В-типа, 637,5 г моногидрата лактозы и 450 г гидроксипропилцеллюлозы с низким замещением (LH-31; Shinetsu Kagaku Kougyo K.K.), используя высокоскоростной перемешивающий гранулятор (тип High Speed Mixer 10JD; Freund Sangyo K.K.), к полученной смеси добавляли 15 г гидроксипропилцеллюлозы, растворенной в 1020 г очищенной воды, а затем проводили высокоскоростное гранулирование с перемешиванием. Полученные гранулы корректировали по размеру и высушивали, затем добавляли 22,5 г стеарата магния и прессовали, чтобы получить 1500 г таблеток, имеющих диаметр 7 мм и вес 120 мг, которые содержали 30 мг кристаллов натеглинида В-типа. Определяли краевой угол полученных таблеток, и краевой угол составлял 111 градусов. Способность растворяться в растворе №2, примененном в тесте на дезинтеграцию согласно Фармакопее Японии, оценивали в соответствии со способом "лопастного перемешивания" согласно Фармакопее Японии (тестируемая жидкость 500 мл: 50 оборотов/минуту) и наблюдали 76% растворения за 30 минут.
Пример 3
На 1500 г таблеток, полученных в соответствии с примером 2, наносили распылением 235 г покрывающего раствора, состоящего из 8 г гидроксипропилметилцеллюлозы, 1,5 г полиэтиленгликоля 6000, 2,4 г талька, 0,5 г окиси титана и 87,6 г очищенной воды, чтобы получить 1529 г покрытых таблеток. Определяли краевой угол полученных покрытых таблеток, и краевой угол составлял 76 градусов. Способность растворяться в растворе №2, используемом в тесте на дезинтеграцию согласно Фармакопее Японии, оценивали в соответствии со способом "лопастного перемешивания" согласно Фармакопее Японии (тестируемая жидкость 500 мл: 50 оборотов/минуту) и наблюдали 86% растворения за 30 минут.
Пример 4
После смешивания 250 г кристаллов натеглинида В-типа, 225 г микрокристаллической целлюлозы, 500 г кросповидона и 10 г гидроксипропилцеллюлозы, используя смеситель V-типа, осуществляли сухую компрессионную грануляцию, используя роликовый компактор (WP-90; Turbo Kougyo K.K.) и корректировку размера, чтобы получить гранулы 850 мкм или меньше. К полученным гранулам добавляли 15 г стеарата магния и прессовали, чтобы получить 1000 г таблеток, имеющих вес 120 мг (натеглинид: 30 мг). На полученные таблетки наносили распылением покрывающий раствор, состоящий из 8 г гидроксипропилметилцеллюлозы, 1,5 г полиэтиленгликоля 6000, 2,4 г талька, 0,5 г окиси титана и 87,6 г очищенной воды с тем, чтобы 1,5 мг гидроксипропилметилцеллюлозы было нанесено на одну таблетку для получения покрытых таблеток. Краевой угол покрытых таблеток составлял 75 градусов. Способность растворяться в растворе №2, используемом в тесте на дезинтеграцию согласно Фармакопее Японии, оценивали в соответствии со способом "лопастного перемешивания" согласно Фармакопее Японии (тестируемая жидкость 500 мл: 50 оборотов/минуту) и наблюдали 99% растворения за 30 минут.
Сравнительный пример 1
После достаточного перемешивания 375 г кристаллов натеглинида В-типа, 780,8 г лактозы, 321,8 г кукурузного крахмала и 15 г гидроксипропилцеллюлозы, используя высокоскоростной перемешивающий гранулятор (тип High Speed Mixer 10JD; Furointo Sangyou K.K.), к полученной смеси добавляли 310 г очищенной воды, а затем проводили высокоскоростное гранулирование с перемешиванием. Полученные гранулы корректировали по размеру и высушивали, затем добавляли 22,7 г стеарата магния и прессовали, чтобы получить 1515 г таблеток, имеющих диаметр 7 мм и вес 121 мг, которые содержали 30 мг кристаллов натеглинида В-типа. Определяли краевой угол полученных таблеток, и краевой угол составлял 115 градусов. Способность растворяться в растворе №2, применяемом в тесте на дезинтеграцию согласно Фармакопее Японии, оценивали в соответствии со способом "лопастного перемешивания" согласно Фармакопее Японии (тестируемая жидкость 500 мл: 50 оборотов/минуту) и наблюдали менее 75% растворения за 30 минут.
Экспериментальный пример 1
После того как в примере 1, примере 2 и сравнительном примере 1 осуществляли высокоскоростную грануляцию с перемешиванием, сравнивали отмываемость производственной машины (тип High Speed Mixer 10JD; Freund Sangyo K.K.). После удаления гранул из производственной машины сравнивали легкость смывания осадков с поверхности стен производственной машины, когда льющуюся воду направляли на осадки. Полученные результаты в соответствии со следующими тремя уровнями оценки представлены в таблице 1, в которой © означает, что осадки были хорошо смыты; O - осадки смыты; X - осадки смыты с трудом.
| Таблица 1 | |||
| Пример 1 | Пример 2 | Сравнительный пример 1 | |
| Краевой угол | 102* | 111 | 115 |
| Легкость смывания | © | O | X |
| *Определяли краевой угол таблеток до покрытия в примере 1. |
Как видно из таблицы 1, при более низкой величине краевого угла полученных гранул в воде смывание становится легче.
Сравнительный пример 2
Таблетки с ядром 7 мм φ - 9R2r (весом 120 мг) получали с кристаллами натеглинида Н-типа в соответствии с примером 1 выкладки Японской патентной заявки № Hei 10-194969, а затем на полученные таблетки наносили распылением покрывающий раствор, состоящий из 8 г гидроксипропилметилцеллюлозы, 1,5 г полиэтиленгликоля 6000, 2,4 г талька, 0,5 г окиси титана и 87,6 г очищенной воды с тем, чтобы 1,5 мг гидроксипропилметилцеллюлозы было нанесено на одну таблетку, чтобы получить покрытые таблетки.
Пример 5: Оценка перорального всасывания с использованием гончих собак
Оценивали профиль концентрации натеглинида в плазме, профиль уровня глюкозы крови, фармакокинетические параметры и наибольший диапазон снижения уровня глюкозы крови, когда таблетки, полученные в примерах 3 и 4 и сравнительных примерах 1 и 2, вводили гончим собакам за 5 минут до кормления. Результаты представлены на фиг.1 и 2 и в таблицах 2 и 3.
Обнаружено, что таблетки, имеющие небольшой краевой угол (таблетки, полученные в примерах 3 и 4), показали Смакс, AUC, Тмакс и наибольший диапазон снижения уровня глюкозы крови, которые оказались равными или выше, чем аналогичные показатели контрольных таблеток, полученные в сравнительном примере 2. С другой стороны, наблюдали сниженную Смакс и пролонгированное Тмакс в таблетках, имеющих большой краевой угол (таблетки, полученные в сравнительном примере 1).
| Таблица 2Фармакокинетические параметры, полученные когда таблетки натеглинида вводили гончим собакам за 5 минут до кормления (n=3) | |||
| AUC [мкг/мл·ч] | Смакс [мкг/мл] | Тмакс [ч] | |
| Таблетки сравнительного примера 2 | 18,93 | 8,76 | 0,42 |
| Таблетки примера 4 | 20,36 | 9,03 | 0,50 |
| Таблетки примера 3 | 27,55 | 11,23 | 0,42 |
| Таблетки сравнительного примера 1 | 17,43 | 4,35 | 0,75 |
| Таблица 3Наивысший диапазон снижения уровня глюкозы крови (уровень глюкозы крови непосредственно перед введением - наиболее низкий уровень глюкозы крови) [мг/дл] | |
| Наивысший диапазон снижения уровня глюкозы крови [мг/дл] | |
| Таблетки сравнительного примера 2 | 23 |
| Таблетки примера 4 | 21 |
| Таблетки примера 3 | 21 |
| Таблетки сравнительного примера 1 | 14 |
Пример 6: Оценка стабильности при хранении таблеток некристаллического (аморфного) натеглинида
Таблетки, полученные согласно примеру 1, таблетки, полученные согласно примеру 3, и таблетки, полученные согласно примеру 4, соответственно упаковывали в алюминиевый пакет и хранили при 40°С и 75% RH в течение 6 месяцев. Результаты, определенные относительно способности растворяться в 500 мл раствора №2, применяемого в тесте на дезинтеграцию согласно Фармакопее Японии, используя способ "лопастного перемешивания" согласно 13-й Фармакопее Японии (50 оборотов/минуту; через 30 минут), представлены в таблице 4 и на графиках DSC на фиг.3-8 соответственно.
До и после хранения не наблюдали никаких изменений как в степенях растворения, так и конфигурациях DSC. Можно сказать, что 3 типа полученных таблеток являются препаратами, характеризующимися хорошей стабильностью при хранении.
| Таблица 4Сравнение степени растворения до и после хранения | ||
| Таблетки | Средняя степень элюции [%] | |
| Начальная | 40°С, 75%, 6 М | |
| Таблетки примера 3 | 100 | 95 |
| Таблетки примера 4 | 99 | 94 |
| Таблетки примера 1 | 100 | 100 |
Как указано выше, согласно данному изобретению препарат, характеризующийся высокой растворимостью, может быть получен даже, когда использовали кристаллы натеглинида В-типа, которые могут быть легко получены, но которые с трудом растворяются в воде. Кроме того, осадок неочищенной смеси, содержащей натеглинид, на различных аппаратах, используемых для производства такого препарата, характеризующегося высокой способностью растворяться, оказывается небольшим и, следовательно, эти аппараты можно легко отмыть и повторно использовать.
1. Гидрофильная гипогликемическая фармацевтическая композиция, содержащая натеглинид, включающий кристаллы натеглинида В-типа в качестве активного ингредиента и дополнительно включающая гидрофильное вещество(а), выбранное из групп, состоящих из гидрофильных полимеров, поверхностно-активных веществ, сахаров и сахароспиртов, имеющая краевой угол поверхности указанной композиции к воде 111° или менее.
2. Композиция, содержащая натеглинид, по п.1, в которой указанный краевой угол составляет 100° или менее.
3. Композиция, содержащая натеглинид, по п.1, в которой указанный краевой угол составляет 90° или менее.
4. Композиция, содержащая натеглинид, по п.1, в которой указанное гидрофильное вещество(а) является гидрофильным полимером.
5. Композиция, содержащая натеглинид, по п.1, в которой указанное гидрофильное вещество(а) является анионным или неионным поверхностно-активным веществом.
6. Композиция, содержащая натеглинид, по п.1, в которой указанное гидрофильное вещество(а) является сахароспиртом.
7. Композиция, содержащая натеглинид, по п.1, в которой указанное гидрофильное вещество(а) является комбинацией гидрофильного полимера и сахароспирта.
8. Композиция, содержащая натеглинид, по п.1, которая представляет собой покрытую пленкой таблетку или покрытую сахаром таблетку.
9. Способ получения гидрофильной гипогликемической фармацевтической композиции, содержащей кристаллы натеглинида В-типа, который включает изготовление композиции добавлением гидрофильного вещества(в), выбранного из групп, состоящих из гидрофильных полимеров, поверхностно-активных веществ, сахаров, сахароспиртов, к исходным веществам композиции, содержащей кристаллы натеглинида В-типа в качестве активного ингредиента, с тем чтобы краевой угол поверхности указанной композиции к воде оказался 111° или менее.
10. Способ по п.9, в котором указанное гидрофильное вещество(а) выбрано из группы, состоящей из гидрофильных полимеров.
11. Способ по п.9, в котором указанное гидрофильное вещество(а) является сахароспиртом.
12. Способ по п.9, в котором указанное гидрофильное вещество(а) является комбинацией гидрофильного полимера и сахароспирта.
13. Способ по п.9, который дополнительно включает нанесение пленки или сахара на поверхность указанной композиции для образования покрытой пленкой таблетки или покрытой сахаром таблетки.