Днк, кодирующая новый пептид rg1
Иллюстрации
Показать всеИзобретение относится к области медицины и биотехнологии и касается антител, специфически связывающихся с новыми человеческими полипептидами внеклеточного матрикса, обозначенными как RG1, иммуноконъюгата, включающего эти антитела, а также способа избирательного разрушения клетки, способа лечения рака предстательной железы и способа диагностики рака предстательной железы и метастазов у пациентов с раком предстательной железы. Преимущество изобретения заключается в разработке нового подхода для лечения рака предстательной железы. 7 н. и 20 з.п. ф-лы, 7 ил.
Реферат
Настоящее изобретение притязает на эффект предварительной заявки на патент US №60/172370, поданной 16 декабря 1999 г., которая полностью включена в настоящее описание в качестве ссылки.
Область техники изобретения
Изобретение относится, в частности, к новым полинуклеотидам и полипептидам; вариантам и производным полинуклеотидов и полипептидов; способам получения полинуклеотидов и полипептидов и их вариантов и производных; антителам к полипептидам, их вариантам и производным; и к применению полинуклеотидов, полипептидов, вариантов, производных и антител. В частности, согласно этим и другим объектам изобретение относится к новым полипептидам человеческого внеклеточного матрикса (обозначенным как RG1), полинуклеотидам, которые кодируют эти полипептиды, антителам к этим полипептидам и антисмысловым полинуклеотидам, которые блокируют экспрессию RG1.
Предпосылки создания изобретения
Рак предстательной железы представляет собой часто встречающееся у мужчин заболевание, которое обнаруживают примерно у одной трети мужчин старше 45 лет. Имеются данные, что причина заболевания может иметь как генетическую основу, так и обусловливаться факторами, связанными с окружающей средой, причем, в большинстве случаев заболевание, вероятно, является результатом обеих причин. Изучение семейного рака позволило предположить, что генетическая предрасположенность играет роль примерно у 5-10% всех больных, страдающих раком предстательной железы, и примерно у 45% мужчин моложе 55 лет.
Имеются доказательства того, что рак предстательной железы развивается в виде болезни, включающей несколько стадий, причем одним из ранних нарушений является простатическая интраэпителиальная неоплазия (ПИН). Ранние стадии болезни зависят от андрогена, а поздние стадии не зависят от гормонов. Пролиферативное заболевание предстательной железы, известное как доброкачественная гиперплазия, часто обнаруживают в клинических условиях, но оно, вероятно, не является одной из стадий развития рака. Однако оно часто связано с раком предстательной железы. Рак предстательной железы часто является многолокусным, как правило, он медленно развивается и является гетерогенным. На поздних стадиях рака часто образуются метастазы в лимфатических узлах и костной ткани.
Рак предстательной железы, как правило, диагностируют при физическом обследовании и по уровням в сыворотке антигена предстательной железы (PSA). При локализованной болезни в качестве лечения используют радикальную простатэктомию. Лечение развившегося метастатического заболевания в настоящее время осуществляют путем удаления из организма андрогена с помощью орхиэктомии или лечения с использованием GnRF (гонадопропин-рилизинг-фактор) или с помощью антиандрогенной терапии. Однако развившееся заболевание практически всегда становится устойчивым к действию гормонов, и оно не поддается лечению. Кроме того, известны серьезные побочные воздействия, связанные как с радикальной простатэктомией, так и с лечением, основанным на удалении из организма андрогена. Они включают высокий риск возникновения инконтиненции и импотенции, связанных с радикальной простатэктомией, и переломы костей и остеопороз, связанные с лечением, основанным на удалении из организма андрогена.
Таким образом, существует большая потребность в развитии новых терапевтических подходов к лечению рака предстательной железы как на ранних, так и на поздних стадиях развития. Также существует необходимость в разработке новых диагностических агентов, в частности агентов, позволяющих различать стадии болезни, поскольку это в значительной степени определяет выбор лечения. Например, если болезнь распространяется за пределы предстательной железы и метастазирует в лимфатические узлы, то радикальная простатэктомия не показана, поскольку она не оказывает воздействия на развитие болезни, но может привести к серьезным нежелательным побочным действиям. Агент, с помощью которого можно обнаружить метастазы in vivo, имеет очень важное значение.
При раке предстательной железы выявлены изменения экспрессии специфических протеинов, включая аномальную экспрессию р53 на последней стадии рака предстательной железы, пониженные уровни рецепторов TGF-β, пониженные уровни Е-кадхерина, С-Cam (молекула клеточной адгезии) и некоторых интегринов. Экспрессия онкогена bcl-2 резко повышается на последней стадии развития не зависящих от андрогена опухолей, и прогноз для пациентов, у которых экспрессируются повышенные уровни bcl-2, является весьма плохим. В то время как указанные выше изменения экспрессии генов хорошо описаны во многих публикациях, не были выявлены никакие изменения экспрессии, являющиеся причиной заболевания. Отсюда следует важность идентификации новых протеинов, экспрессия которых связана с присутствием или развитием опухолей предстательной железы, которые могут служить в качестве молекулярных мишеней для диагностики и терапии рака предстательной железы.
В настоящем описании представлен новый гомолог суперсемейства протеинов внеклеточного матрикса. Этот гомолог, а именно RG1, экспрессируется в ткани предстательной железы, и в опухолях предстательной железы может наблюдаться его сверхэкспрессия.
Внеклеточный матрикс представляет собой сложную сеть коллагена и эластина, погруженную в вязкоупругую основу, состоящую из протеогликанов и гликопротеинов. Матрикс представляет собой трехмерный поддерживающий каркас, который разделяет тканевые компартменты, опосредует соединение клеток и определяет архитектуру ткани (Bissel и др., J. Theor. Biol., 99: 31-68, 1982; Carlson и др., Proc. Natl. Acad. Sci. USA, 78: 2403-2406, 1981). Матрикс действует подобно макромолекулярному фильтру (Hay E.D., Cell Biology of Extracellular Matrix, New York, Plenum Press, 1982), а также влияет на дифференцировку, митогенез и морфогенез клеток (Gospodarowiczs D., Cancer Res., 38: 4155-4171, 1978). Биохимические взаимодействия между нормальными клетками и матриксом при неоплазии могут изменяться и это может влиять на пролиферацию опухоли. Опухолевые клетки могут взаимодействовать с матриксом различными путями. Во-первых, опухолевые клетки могут прикрепляться к матриксу посредством специфичных для плазменной мембраны рецепторов (Terranova и др., Cancer Res., 42: 2265-2269, 1982). Во-вторых, каскадом ферментов, которые присущи опухолевой клетке и хозяину, опосредуется разложение матрикса (Eisen и др., Bioch. Biophys. Acta, 151: 637-645, 1968). В-третьих, в дифференцированных областях опухолей опухолевые клетки могут синтезировать и накапливать матрикс или индуцировать у клеток-хозяев способность накапливать избыточный матрикс (Brownstein и др., Cancer, 40: 2979-2986, 1977).
RG1 имеет гомологию с суперсемейством протеинов внеклеточного матрикса, кодируемыми генами Mindin/F-spondin (Миндин/F-спондин). Общим для семейства генов является наличие двух консервативных доменов спондина, т.е. FS1 и FS2, вблизи N-конца и по меньшей мере одного повтора тромбоспондина типа 1 (TSR1) на С-конце (Shimeld S.M., Mol. Biol. Evol., 15(9): 1218-1223, 1998). TSR-мотив впервые был обнаружен в протеинах внеклеточного матрикса позвоночных (Bornstein P., J. Cell Biol., 130: 503-506, 1995), а затем был выявлен в некоторых других протеинах внеклеточного матрикса. Существует ряд доказательств того, что TSR опосредуют клеточную адгезию и играют решающую роль в генезе опухолей. Например, было установлено, что содержащие TSR протеолитические фрагменты тромбоспондина и синтетические пептиды, имеющие последовательности, соответствующие области TSR тромбоспондина, усиливают адгезию и метастазирование опухолевых клеток (Prater и др., J. Cell Biol., 112: 1031-1040, 1991; Tuszynski и Nicosia, BioEssays, 18: 71-76, 1996), обладают антиангиогенной активностью (Tolsma и др., J. Cell Biol., 122: 497-511, 1993) и ингибируют агрегацию тромбоцитов и метастазирование меланом (Tuszynski и др., J. Cell Biol., 116: 209-217, 1992).
К настоящему времени обнаружены представители этого суперсемейства, включающие ген Caenorthabditis elegans, один ген Drosophila и множество генов позвоночных. У С. elegans ген F.10E7.4 кодирует 5 TSR помимо FS1- и FS2-доменов (Higashijima и др., Dev. Biol., 192: 211-227, 1997). У Drosophila представитель семейства, обозначенный как М-спондин (mspo), содержит FS1- и FS2-домены и один TSR (Umemiya и др., Dev. Biol., 186: 165-176, 1997). Ген М-спондина кодирует секретируемый протеин, локализованный в местах прикрепления мышц, и, вероятно, выполняет функцию протеина внеклеточного матрикса, который поддерживает соединение мышца-аподема. Представители семейства, обнаруженные у позвоночных, включают гены, выделенные из полосатой перцины (Миндин1 и Миндин2, F-спондин1 и F-спондин2), крысиный F-спондин, F-спондин Xenopus и крысиный Миндин. Миндин1 и Миндин 2 весьма похожи и имеют генную структуру, аналогичную гену М-спондина Drosophila. Гены Миндин1 и Миндин2 оба кодируют один TSR помимо FS1- и FS2-доменов (Higashijima и др., Dev. Biol., 192: 211-227, 1997). Все гены, такие как F-спондин 1 и Р-спондин2 полосатой перцины, крысиный F-спондин (Klar и др., Cell, 69: 95-110, 1992) и F-спондин Xenopus (Altaba и др., Proc. Natl. Acad. Sci. USA, 90: 8268-8272, 1992), имеют сходную структуру, кодируют 6 копий TSR помимо FS1- и FS2-доменов. У позвоночных животных суперсемейство Миндин/F-спондин можно разделить на 2 группы: гены, обладающие значительным сходством с исходными крысиными генами F-спондина и Миндина, и гены, обладающие значительным сходством с геном М-спонднна Drosophila. У позвоночных как гены Миндина, так и гены F-спондина, кодируют протеины, которые главным образом экспрессируются вентральной пластинкой нервной трубки в процессе эмбрионального развития.
В настоящее время один ген, родственный гену F-спондина, т.е. AmphiF-спондин, был выделен из ланцетника Amphioxus (Shimeld S.M., Mol. Biol. Evol., 15(9): 1218-1223, 1998). На основе молекулярных филогенетических данных установлено, что AmphiF-спондин является близким аналогом определенной подгруппы генов типа F-спондина позвоночных, которые кодируют шесть TSR. AmphiF-спондин кодирует три TSR и два повтора фибронектина типа III, один из которых в значительной степени идентичен повтору фибронектина типа III из Deleted in Colorectal Cancer (DCC). Экспрессия протеина обнаружена в большей части центральной нервной системы и не ограничена средней линией, как это известно для протеинов Миндина и F-спондина позвоночных.
Эти данные позволяют предположить, что протеины внеклеточного матрикса, такие как новый протеин RG1, который является гомологом суперсемейства Миндина/F-спондина, могут оказаться перспективными агентами для диагностики рака и терапевтического вмешательства.
Краткое изложение сущности изобретения
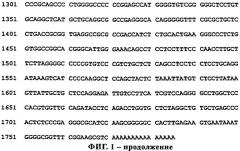
Настоящее изобретение относится к уникальной полинуклеотидной последовательности, которая кодирует новый протеин, обозначенный как RG1. Полипептиды RG1 обладают гомологией с крысиным протеином внеклеточного матрикса миндином. Он содержит гидрофобную сигнальную последовательность на N-конце, два домена спондина (FS1- и FS2) и повтор тромбоспондина типа 1 на С-конце. RG1 на 89,7% аналогичен крысиному миндину. Полинуклеотидная последовательность, обозначенная в настоящем описании как rg1 и представленная на фиг.1 (SEQ ID NO:1), кодирует аминокислотную последовательность RG1, которая приведена на фиг.2 (SEQ ID NO:2).
Таким образом, объектом настоящего изобретения являются полипептиды, которые среди прочего идентифицированы в качестве новых протеинов, имеющих гомологию с семейством протеинов внеклеточного матрикса типа миндин, что подтверждено сравнительным анализом аминокислотной последовательности, приведенной на фиг.2 (SEQ ID NO:2), и известных аминокислотных последовательностей других протеинов внеклеточного матрикса.
Еще одним объектом изобретения являются полинуклеотиды, которые кодируют такие полипептиды, в частности, полинуклеотиды, которые кодируют полипептид, обозначенный в контексте настоящего описания как RG1.
В соответствии с этим объектом изобретение относится к выделенным полинуклеотидам, которые кодируют RG1, включая мРНК, кДНК, а также в дополнительных вариантах этого объекта к их вариантам, аналогам или производным, включая их фрагменты, включая фрагменты вариантов, аналогов и производных, которые обладают ценными биологическими, диагностическими, клиническими или терапевтическими свойствами.
Особенно предпочтительными вариантами этого объекта являются встречающиеся в естественных условиях аллельные варианты полинуклеотидов, которые кодируют варианты полипептида, обозначенного в контексте настоящего описания как RG1.
Таким образом, объектом изобретения являются новые человеческие полипептиды, обозначенные в контексте настоящего описания как RG1, а также их варианты и производные, включая варианты и производные фрагментов, и их аналоги, пригодные с биологической, диагностической или терапевтической точек зрения.
Одним из наиболее предпочтительных вариантов этого объекта изобретения являются варианты RG1, кодируемые встречающимися в естественных условиях аллельными вариантами полинуклеотида rg1.
И еще одним объектом изобретения является способ получения вышеуказанных полипептидов, фрагментов полипептидов, вариантов и производных, фрагментов вариантов и производных и их аналогов. Согласно предпочтительному варианту этого объекта изобретение относится к способам получения вышеуказанных пептидов RG1, который предусматривает культивирование клеток-хозяев, обладающих способностью экспрессировать включенный в них кодирующий RG1 полинуклеотид экзогенного происхождения в условиях, предназначенных для экспрессии человеческого RG1 в хозяине, и затем выделение экспрессированного полипептида.
Следующим объектом изобретения являются продукты, композиции, процессы и методы, с помощью которых вышеуказанные полипептиды и полинуклеотиды применяют среди прочего для исследовательских, биологических, клинических и терапевтических целей.
Определенными предпочтительными вариантами этого объекта изобретения являются продукты, композиции, процессы и методы, предназначенные среди прочего для оценки экспрессии RG1 в клетках путем обнаружения полипептидов RG1 или кодирующей RG1 мРНК; и оценки генетических вариаций и аномалий, таких как дефекты, в генах rg1.
Определенными предпочтительными вариантами этого и других объектов являются зонды, которые гибридизуются с последовательностями rg1.
И еще одним объектом изобретения являются антитела, обладающие высокой селективностью в отношении полипептидов RG1 или их фрагментов и которые можно применять в методе диагностики и/или обнаружения экспрессии RG1, которая может быть связана с раком предстательной железы. Согласно определенным предпочтительным вариантам этого объекта изобретения антитела метят таким образом, чтобы получить сигнал, который можно обнаружить. Особенно предпочтительными являются антитела, меченные с помощью радиоактивного изотопа, фермента, хромофора или флуоресцирующего агента.
И еще одним объектом изобретения являются антитела, конъюгированные с терапевтическим агентом, с целью введения в клетки in vitro, в клетки ex vivo и в клетки in vivo или в многоклеточный организм. В этом плане особенно предпочтительными являются терапевтические агенты, обладающие цитотоксическим действием. Согласно определенным предпочтительным вариантам такие конъюгированные антитела вводят больным людям для лечения болезненного состояния, для которого характерны активность или экспрессия RG1, такого как рак предстательной железы.
И еще одним объектом изобретения являются пептиды и антиидиотипические антитела, которые можно применять для стимулирования иммунного ответа.
Следующим объектом изобретения являются рибозимы и полинуклеотиды, комплементарные полинуклеотидам rg1 (т.е. антисмысловые полинуклеотиды), предназначенные для введения в клетки in vitro, в клетки ех vivo и в клетки in vivo или в многоклеточный организм. В этом плане особенно предпочтительным является введение больным людям антисмысловых молекул с целью лечения болезненного состояния, такого как рак предстательной железы или доброкачественная гиперплазия предстательной железы, которое облегчается при снижении уровня активности RG1.
Другие объекты, особенности, преимущества и аспекты настоящего изобретения станут очевидными специалистам в данной области из приведенного ниже описания. Однако следует понимать, что приведенное ниже описание и конкретные примеры, в которых представлены предпочтительные варианты осуществления изобретения, даны только с целью иллюстрации. Без ограничения сущности и объема изобретения могут быть внесены различные изменения и модификации, которые станут очевидны специалистам в данной области после ознакомления с приведенным ниже описанием и другими разделами изобретения.
Краткое описание чертежей
Фиг.1: Полинуклеотидная последовательность rg1 (SEQ ID NO:1), которая кодирует биологически или иммунологически активную форму RG1.
Фиг.2: Выведенная аминокислотная последовательность RG1 (SEQ ID NO:2) с доменами F-спондина (подчеркнуты простой линией) и доменом тромбоспондина (подчеркнут двойной линией).
Фиг.3: Сравнительный анализ аминокилотных последовательностей RG1 и крысиного миндина. Последовательность RG1 приведена сверху.
Фиг.4: Полинуклеотидная и выведенная аминокислотная последовательности RG1.
Фиг.5: Экспрессия мРНК rg1 в тканях человека, оцененная с помощью ПЦР на основе Taqman-метода. Из тканей человека, как опухолевых, так и здоровых, выделяли РНК стандартными методами. Праймеры и зонд для обнаружения экспрессии мРНК rg1 конструировали с помощью программы Perkin Elmer's Primer Express и синтезировали с помощью Synthetic Genetics. мРНК rg1 была обнаружена в тканях предстательной железы человека. Существенно более низкий уровень экспрессии мРНК rg1 выявлен в других тканях, например, печени.
Фиг.6: Очистка нативного протеина RG1, секретируемого клетками линии LNCap. Для обнаружения нативного протеина RG1, секретируемого клетками линии LNCap, осуществляли анализ методом Вестерн-блоттинга с использованием антисыворотки, полученной путем иммунизации синтетической пептидной последовательностью RG1 (ЗС, SEQ ID NO:10; см. пример 4). На чертеже представлены фракции, элюированные при осуществлении хроматографии на Q-сефарозе концентрированной кондиционированной среды для клеток линии LNCap: (L) - загрузка колонки, (F) - разгонка в колонке, (1-12) - фракции, элюированные с помощью солевого градиента. Предсказанная молекулярная масса RG1 составляет ˜36 кД, однако установлено, что для протеина RG1, экспрессия которого происходила в бактериальных клетках, в ВНК (клетки почки детеныша хомяка) и в клетках линии LNCap, во всех случаях миграция на ПААГ соответствовала ˜45 кДа (L, фракции 6-9).
Фиг.7: Иммуногистохимическое окрашивание с целью обнаружения экспрессии RG1 в тканях предстательной железы человека. Ткань предстательной железы получали из отделения урологии медицинской школы Стэнфордского университета (Urology Department at Stanford University School of Medicine). Окрашивание осуществляли с помощью набора Vector ABC-AP (АК5002). Визуализацию окрашивания осуществляли с помощью набора Vector Red substrate (SK-5100), а контрастное окрашивание проводили с помощью гематоксилина. Результаты свидетельствуют о выраженном окрашивании перилуминальной мембраны в железистых образованиях.
Подробное описание изобретения
Определения
В описании, примерах и прилагаемой формуле изобретения, если не указано иное, следующие понятия имеют указанные ниже значения:
Понятие "RG1" обозначает полипептид, имеющий аминокислотную последовательность, представленную на фиг.2 (SEQ ID NO:2); его варианты, аналоги, производные и фрагменты и фрагменты вариантов, аналогов и производных. Понятия "фрагмент", "производное" и "аналог" по отношению к полипептиду, представленному на фиг.2 (SEQ ID NO:2), обозначают полипептид, который в значительной степени сохраняет биологическую и/или иммунологическую активность, присущую полипептиду, представленному на фиг.2 (SEQ ID NO:2).
Понятие "rg1" обозначает полинуклеотид, имеющий последовательность, представленную на фиг.1 (SEQ ID NO:1), и полинуклеотиды, кодирующие полипептиды, которые имеют аминокислотную последовательность RG1, представленную на фиг.2 (SEQ ID NO:2); и полинуклеотиды, кодирующие варианты, аналоги, производные и фрагменты RG1 и фрагменты вариантов, аналогов и производных. Понятие "rg1" также обозначает полинуклеотиды, включающие РНК, а также полинуклеотиды, комплементарные полинуклеотидам, которые кодируют полипептидную последовательность, представленную на фиг.2 (SEQ ID NO:2).
Понятие "полинуклеотид(ы)" в целом относится к любому полирибонуклеотиду или полидезоксирибонуклеотиду, который может представлять собой немодифицированную РНК или ДНК или модифицированную РНК или ДНК. Так, например, в контексте настоящего описания понятие полинуклеотид обозначает среди прочего одно- и двухцепочечную ДНК, ДНК, представляющую собой смесь одно- и двухцепочечных участков, одно- и двухцепочечную РНК и РНК, которая представляет собой смесь одно- и двухцепочечных участков, гибридные молекулы, включающие ДНК и РНК, которые могут быть одноцепочечными или более часто двухцепочечными или представляют собой смесь одно- и двухцепочечных участков. Кроме того, в контексте настоящего описания полинуклеотиды обозначают трехцепочечные области, содержащие РНК или ДНК или и РНК и ДНК. В таких областях цепи могут состоять из одних и тех же молекул или из различных молекул. Области могут включать все, т.е. одну или несколько молекул, однако обычно область включает только несколько молекул. Одна из молекул трехспиральной области часто представляет собой олигонуклеотид.
В контексте настоящего описания понятие "полинуклеотид" включает ДНК или РНК, как описано выше, которые содержат одно или несколько модифицированных оснований. Так, под указанное понятие "полинуклеотиды" подпадают ДНК и РНК, каркасы которых модифицированы с целью придания стабильности или по иным причинам. Кроме того, под понятие "полинуклеотиды" подпадают ДНК и РНК, которые включают необычные основания, такие как инозин, или модифицированные основания, такие как меченные с помощью трития основания, причем, два указанных примера не ограничивают объем изобретения.
Подразумевается, что в ДНК и РНК можно вводить широкое разнообразие модификаций, известных специалистам в данной области, с целью придания им ценных свойств. В контексте настоящего описания под понятие "полинуклеотид" подпадают такие химически, ферментативно или метаболически модифицированные формы полинуклеотидов, а также химические формы ДНК и РНК, характерные для вирусов и клеток, включая среди прочего простые и сложные клетки.
Понятие "полипептиды" в контексте настоящего описания включает все описанные ниже полипептиды. Основная структура полипетидов хорошо известна в данной области и описана в очень большом количестве учебников и других публикаций. В этом контексте используемое в данном описании понятие относится к любому пептиду или протеину, которые содержат 2 или более аминокислот, соединенных друг с другом в виде линейной цепи с помощью пептидных связей. В контексте настоящего описания понятие относится как к полипептидам с короткой цепью, которые обычно в данной области называют, например, пептидами, олигопептидами и олигомерами, так и к полипептидам с более длинной цепью, которые, как правило, в данной области называют протеинами и которые включают много типов.
Подразумевается, что полипептиды часто включают аминокислоты, отличные от 20 аминокислот, обычно обозначаемых как 20 встречающихся в естественных условиях аминокислот, и что многие аминокислоты в данном полипептиде, включая концевые аминокислоты, можно модифицировать либо с помощью естественных процессов, таких как гликозилирование и другие посттрансляционные модификации, либо с помощью методов химической модификации, хорошо известных в данной области. Даже обычные модификации, происходящие в полипептидах в естественных условиях, являются слишком многочисленными, для того чтобы перечислить их полностью в данном описании, но они подробно описаны в основных учебниках и в более подробных монографиях, также в обширной научной литературе и хорошо известны специалистам в данной области. Среди известных модификаций, которые могут присутствовать в полипептидах по настоящему изобретению, с целью иллюстрации можно указать некоторые, в том числе ацетилирование, ацилирование, АДФ-рибозилирование, амидирование, ковалентное присоединение флавина, ковалентное присоединение фрагмента гема, ковалентное присоединение полинуклеотида или производного полинуклеотида, ковалентное присоединение липида или производного липида, ковалентное присоединение фосфотидилинозитола, поперечное связывание, циклизацию, образование дисульфидного мостика, деметилирование, образование ковалентных поперечных связей, образование цистина, образование пироглутамата, формилирование, гамма-карбоксилирование, гликирование, гликозилирование, образование GPI-якоря, гидроксилирование, йодинирование, метилирование, миристоилирование, окисление, протеолетический процессинг, фосфорилирование, пренилирование, рацемизацию, селеноилирование, сульфирование, опосредованное транспортной РНК добавление аминокислот к протеинам, такое как аргинилирование и убикитинирование.
Такие модификации хорошо известны специалистам в данной области и подробно описаны в научной литературе. Некоторые наиболее распространенные модификации, такие как гликозилирование, присоединение липидов, сульфирование, гамма-карбоксилирование остатков глутаминовой кислоты, гидроксилирование и АТФ-рибозилирование, описаны, например, в большом количестве известных учебников, например, у I.E.Creighton, Proteins-Structure and Molecular Properties, 2-е изд., W.H.Freeman and Company, New York, 1993. Этому предмету посвящены многие обширные обзоры, такие, например, как представленные Wold F. в: Posttranslational Covalent Modification of Proteins, ред. В.С.Johnson, Academic Press, New York, стр.1-12, 1983; Seifter и др., Meth. Enzymol. 182: 626-646, 1990 и Rattan и др.. Protein Synthesis: Posttranslational Modifications and Aging, Ann. N.Y. Acad. Sci. 663: 48-62, 1992.
Как это хорошо известно и указано выше, подразумевается, что полипептиды не всегда явяются полностью линейными. Например, полипептиды могут быть разветвленными в результате убикитинизации, и они могут быть кольцевыми и иметь разветвления, как правило в результате посттрансляционных процессингов, включая встречающиеся в естественных условиях случаи процессинга и случаи, являющиеся результатом манипуляций человека, которые не происходят в естественных условиях, или не иметь разветвлений. Кольцевые, разветвленные и разветвленные кольцевые полипептиды могут быть синтезированы с помощью нетрансляционных встречающихся в естественых условиях процессов, а также только путем синтеза.
Модификации могут затрагивать любые области полипептида, включая каркас пептида, аминокислотные боковые цепи и N- или С-концы. Как правило блокада в полипептиде амино- или карбоксильной группы или обеих этих групп путем ковалентных модификаций является обычной для встречающихся в естественных условиях и синтетических полипептидов, и такие модификации могут также присутствовать в полипептидах по настоящему изобретению. Например, аминоконцевой остаток полипептидов, полученных в Е.coli, до протеолитического процессинга почти всегда представляет собой N-формилметионин.
Модификации, которые могут иметь место в полипептиде, часто зависят от того, каким образом он получен. Для полипептидов, полученных, например, в результате экспрессии клонированного гена в хозяине, природа и степень модификаций в большой части определяются способностью клетки-хозяина к посттранляционной модификации и наличием сигналов модификации в аминокислотой последовательности полипептида. Например, как хорошо известно, гликозилирование часто не имеет место в бактериях-хозяевах, таких как Е.coli. Таким образом, когда требуется гликозилирование, полипептид необходимо экспрессировать в хозяине, для которого характерно гликозилирование, как правило, в эукариотической клетке. В клетках насекомых часто происходят такие же посттранляционные процессы гликозилирования, что и в клетках млекопитающих, и по этой причине были разработаны системы экспрессии, на основе клеток насекомых, которые применяли для эффективной экспрессии протеинов млекопитающих, имеющих среди прочего естественные схемы гликозилирования. Аналогичные соображения применимы к другим модификациям.
Подразумевается, что один и тот же тип модификации может присутствовать в такой же или в другой степени в нескольких областях данного полипептида. Кроме того, данный полипептид может включать много типов модификаций.
В целом, в контексте настоящего описания понятие полипепитид включает все такие модификации, в частности модификации, которые присутствуют в полипептидах, синтезированных путем экспрессии полинуклеотида в клетке-хозяине.
Понятие "полинуклеотид, кодирующий полипептид" в контексте настоящего описания включает полинуклеотиды, которые содержат последовательность, кодирующую полипептид по настоящему изобретению, в частности полипептид RG1, имеющий аминокислотную последовательность, приведенную на фиг.2 (SEQ ID NO:2). Понятие включает полинуклеотиды, которые содержат одну непрерывную область или прерывистые области, кодирующие полипептид (например, прерванные интронами), в сочетании с другими областями.
Понятие "биологически активный" относится к структурным, регуляторным или биохимическим функциям встречающегося в естественных условиях полипептида RG1.
Понятие "иммуннологическая активность" обозначает способность встречающегося в естественных условиях рекомбинантного или синтетического RG1 или любого его фрагмента вызывать специфический иммунный ответ у соответствующих животных или в клетках и связываться со специфическими антителами.
Понятие "олигонуклеотид(ы)" относится к относительно коротким полинуклеотидам. Часто понятие относится к одноцепочечным дезоксирибонуклеотидам, но оно также может относиться как к одно-, так и к двухцепочечным рибонуклеотидам, гибридам РНК:ДНК и среди прочего к двухцепочечным ДНК. Олигонуклеотиды, такие как олигонуклеотидные зонды, представляющие собой одноцепочечную ДНК, часто синтезируют химическими методами, например, с помощью автоматических синтезаторов олигонуклеотидов. Однако олигонуклеотиды также можно получать с помощью различных других методов, включая методы in vitro, основанные на применении рекомбинантной ДНК, и с помощью экспрессии ДНК в клетках и организмах. Понятия "олигонуклеотиды" или "олигомеры" или полинуклеотидный "фрагмент", "участок" или "сегмент" относятся к полинуклеотидной последовательности, состоящей по меньшей мере из 10 нуклеотидов и максимум примерно из 60 нуклеотидов, предпочтительно примерно из 15-30 нуклеотидов и наиболее предпочтительно примерно из 20-25 нуклеотидов.
Понятие "встречающийся в естественных условиях RG1" относится к RG1, который продуцируется человеческими клетками, которые не были получены с помощью генетической инженерии, и включает различные формы RG1, образовавшиеся в результате посттрасляционных модификаций полипептида, включая (но не ограничиваясь ими) ацетилирование, карбоксилирование, гликозилирование, фосфорилирование, присоединение липидов (липидацию), ацилирование и расщепление.
Понятие "вариант(ы)" полинуклеотидов или полипептидов в контексте настоящего описания обозначает полинуклеотиды или полипептиды, которые отличаются от полинуклеотида или полипептида, с которым проводится сравнение (эталонного) соответственно. Такие варианты описаны более детально ниже и в других разделах настоящего описания.
(1) Полинуклеотид, который отличается по нуклеотидной последовательности от другого эталонного полинуклеотида. Как правило, различия ограничены тем, что эталонная полинуклеотидная последовательность и последовательность варианта весьма схожи в целом и во многих областях идентичны.
Как будет описано ниже, замены в полинуклеотидной последовательности варианта могут быть молчащими. Это означает, что они могут не изменять аминокислотные последовательности, кодируемые полинуклеотидом. Если изменения ограничены молчащими заменами, то вариант этого типа может кодировать полипептид с такой же аминокислотной последовательностью, что эталонный полинуклеотид. Как будет описано ниже, замены в полинуклеотидной последовательности варианта могут изменять аминокислотную последовательность полипептида, кодируемого эталонным полинуклеотидом. Такие замены в полинуклеотиде могут привести к аминокислотным заменам, добавлениям, делециям, слияниям и усечениям в полипептиде, кодируемом эталонным полинуклеотидом, что будет пояснено ниже.
(2) Полипептид, который отличается по аминокислотной последовательности от другого эталонного полипептида. Как правило, различия ограничены тем, что эталонные последовательности и вариант весьма схожи в целом и во многих областях идентичны. Вариант и эталонный полипептид могут отличаться наличием в аминокислотной последовательности одной или нескольких замен, добавлений, делеций, слияний и усечений, которые могут присутствовать в любой комбинации. Рекомбинантные варианты, кодирующие одинаковые или аналогичные полипептиды, могут быть получены с помощью синтеза или отобраны на основе "избыточности" (вырожденности) генетического кода. Различные замены кодонов, такие как молчащие замены, которые образуют различные сайты рестрикции, можно вводить с целью оптимизации клонирования в плазмидном или вирусном векторе или экспрессии в конкретной прокариотической или эукариотической системе. Также можно создавать мутации с целью изменения свойств полипептида, изменения аффинностей в отношения связывания лигандов, межцепочечных аффинностей или деградации полипептида, или интенсивности круговорота.
Понятие "аллельный вариант" обозначает альтернативную форму полинуклеотида rg1. Аллели образуются в результате мутации, т.е. изменения полинуклеотидой последовательности, и обычно продуцируют измененные мРНК или полинуклеотиды, структура или функция которых может быть изменена или не изменена. Любой конкретный ген может не иметь вообще, иметь одну или несколько аллельных форм. Общие обусловленные мутациями изменения, которые приводят к получению аллелей, обычно связывают с встречающимися в естественных условиях делециями, добавлениями или заменами нуклеотидов. Каждый из этих типов изменений может встречаться по отдельности или в сочетании друг с другом, один или несколько раз в данной последовательности.
Понятие "производное" относится к полинуклеотидам или полипептидам, выведенным из встречающихся в естественных условиях rg1 или RG1 соответственно, путем химических модификаций, таких как убикитинизация, введение метки (например, с использованием радиоактивных изотопов, различных ферментативных модификаций), ПЭГилирования (дериватизация с помощью полиэтиленгликоля (ПЭГ)) или путем инсерции или замены аминокислот, таких как орнитин (или замены нуклеотидов, которые кодируют такие аминокислоты), которые в норме не встречаются в человеческих протеинах.
Понятие "делеция" обозначает изменение либо полинуклеотидной, либо аминокислотной последовательностей, в результате которого происходит удаление одного или нескольких полинуклеотидов или аминокислотных остатков соответственно.
Понятие "инсерция" или "добавление" обозначает изменение либо полинуклеотидной, либо аминокислотной последовательностей, которое приводит к добавлению одного или нескольких полинуклеотидов или аминокислотных остатков соответственно по сравнению со встречающимися в естественных условиях полинуклеотидной или аминокислотной последовательностью.
"Замена" приводит к замещению одного или нескольких полинуклеотидов или аминокислотных остатков другими полинуклеотидами или аминокислотами соответственно.
Предпочтительно аминокислотные замены представляют собой результат замены одной аминокислоты на другую аминокислоту, которая имеет аналогичные структурные и/или химические свойства, например, замены лейцина на изолейцин или валин, аспартата на глутамат, или треонина на серин, т.е. представляют собой консервативные замены аминокислот. Инсерции или делеции, как правило, затрагивают примерно 1-5 аминокислот. Допустимость вариации можно определять экспериментально путем систематического осуществления инсерции, делеций или замен аминокислот в полипептиде с помощью методов рекомбинантной ДНК и анализа активности полученных рекомбин