Ингибиторы вич-интегразы и содержащие их фармацевтические композиции
Иллюстрации
Показать всеНастоящее изобретение относится к ингибированию вируса иммунодефицита человека (ВИЧ), который идентифицирован как этиологический агент, ответственный за синдром приобретенного иммунодефицита (СПИД), смертельного заболевания, характеризующегося разрушением иммунной системы и неспособностью предотвратить угрозу жизни, из-за неспособности противостоять инфекциям. В данном изобретении предлагаются ингибиторы интегразы, представленные формулой I,
где соответствующие значения радикалов указаны в описании. Цель настоящего изобретения заключается в обеспечении получения фармацевтической композиции, полезную для ингибирования ВИЧ интегразы, которая включает терапевтически эффективное количество соединения формулы I, включая их фармацевтичеки приемлемые соли и, сольваты и фармацевтически приемлемый носитель. 10 н. и 6 з.п. ф-лы.
Реферат
Уровень техники
Вирус иммунодефицита человека (ВИЧ) был идентифицирован как этиологический агент, ответственный за синдром приобретенного иммунодефицита (СПИД), смертельного заболевания, характеризующегося разрушением иммунной системы и неспособностью предотвратить угрозу жизни, из-за неспособности противостоять инфекциям. Статистические данные (UNAIDS: Report on Global HIV/AIDS Epidemic, December 1998), показывают, что в целом около 33 миллионов людей во всем мире инфицированы указанным вирусом. В дополнение к большому числу уже инфицированных индивидуумов, вирус продолжает распространяться. Проводимые в 1998 году оценки показывают, что за год добавилось около 6 миллионов новых инфицированных больных. В том же году было зафиксировано приблизительно 2.5 миллиона смертельных случаев, связанных с ВИЧ-инфекцией и СПИДом.
В настоящее время существует множество доступных противовирусных препаратов, способных противодействовать инфекции. Эти препараты могут быть разделены на три класса, основываясь на вирусном белке, который является их мишенью, а также на способе их действия. В частности, секвинавир, индинавир, ритонавир, нелфинавир и ампренавир являются конкурентноспособньми ингибиторами аспартиловой протеазы, экспрессируемой ВИЧ. Зидовудин, диданозин, ставудин, ламивудин, залситабин и абакавир являются ингибиторами обратной нуклеозидной транскриптазы, которые ведут себя как миметики субстрата, которые останавливают синтез вирусной кДНК. Ингибиторы обратной ненуклеозидной транскриптазы, неварипин, делаваридин и эфавиренц ингибируют синтез вирусной кДНК через неконкурентный (или неконкурентоспособный) механизм. Использование этих препаратов является эффективным лишь для понижения вирусной репликации. Эффект является только временным, поскольку вирус легко вырабатывает устойчивость ко всем известным агентам. Однако комбинированная терапия доказала свою высокую эффективность как для ослабления вируса, так и для подавления появления устойчивости у множества пациентов. В США, где комбинированная терапия широко применяется, количество связанных с ВИЧ смертельных случаев уменьшилось (Palella, F.J.; Delany, К.М.; Moorman, А.С; Loveless, М.О.; Furher, J.; Satten, G.A.; Aschman, D.J.; Holmberg, S.D. N. Engl J. Med. 1998, 338, 853).
К сожалению, не все пациенты являются восприимчивыми, и большое число неудач подводит эту терапию. В действительности, приблизительно 30-50% пациентов в конечном счете не воспринимают комбинированную терапию. Неудачи в лечении в большинстве случаев вызваны появлением вирусной устойчивости. Вирусная устойчивость в свою очередь вызвана быстрым оборотом ВИЧ-I при проявлении инфекции в сочетании с высокой скоростью вирусных мутаций. При этих обстоятельствах неполная вирусная супрессия, вызванная недостаточной активностью лекарственного средства, недостаточный отклик на множество сложных лекарственных средств, так же как и внутренние фармакологические барьеры при взаимодействии, формируют обоснованную основу для появления возражений. Недавно полученные многочисленные данные предполагают, что низкоуровневая репликация продолжается, даже когда уровни вирусной плазмы опускаются ниже обнаруживаемых уровней (<50 копий/мл) (Carpenter, С.С.J.; Cooper, D.A.; Fischl, M.A.; Garil, J.M.; Gazzard, В.G.; Hammer, S.M.; Hirsch, М.S.; Jacobsen, D.M.; Katzenstein, D.A.; Montaner, J.S.; Richman, D.D.; Saag, M.S.; Schecter, M.; Schoolery, R.Т.; Thompson, M.A.; Vella, S.; Yeni, P.G.; Volberding, P.A. JAMA 2000, 283, 381). Ясно, что имеется потребность в новых антивирусных агентах, мишенью которых, предпочтительно, являются другие вирусные ферменты, для того чтобы уменьшить коэффициент устойчивости и подавить в дальнейшем репликацию вируса.
ВИЧ экспрессирует три фермента: обратную транскриптазу, аспартильную протеазу и интегразу, все они являются потенциальными противовирусными мишенями для разработки препаратов для лечения СПИДа. Однако интеграза является единственным вирусным ферментом, не являющимся мишенью для современной терапии. Фермент интегразы ответственен за встраивание вирусной кДНК в геном клетки хозяина, что является критической стадией в жизненном цикле вируса. Есть множество отдельных стадий, включаемых в этот процесс, включая обработку вирусной кДНК удалением двух оснований с каждого из 3'-концов и объединением углубленных концов ДНК хозяина. Исследование показало, что в отсутствии функционального фермента интегразы ВИЧ не заразен. Поэтому, ингибитор интегразы был бы полезен в качестве лекарственного средства для лечения СПИДа и ВИЧ-инфекции.
Сообщалось о множестве ингибиторов фермента. Они включают ингибиторы на основе нуклеотида, известные связующие ДНК, катехолы и гидразидсодержащие производные (Neamati, N.; Sunder, S.; Pommier, Y., Drug Disc. Today, 1997, 2, 487). Однако результатом этих публикаций является отсутствие клинически активного соединения. Таким образом, необходимой является разработка клинически активного ингибитора фермента интегразы ВИЧ.
Сущность изобретения
Настоящее изобретение относится к соединениям формулы I или фармацевтически приемлемым солям или к их сольватам.
где R1 представляет собой
-арил,
-С1-C6алкиларил, или
когда R1 является незамещенным или независимо замещенным 1-3 R3;
каждый R3 независимо выбирают из
-Н,
-галогена,
-CN,
-С1-C6алкила,
-OR4,
-С1-C10алкил-O-R4,
-CO2R5,
-С1-C10алкил-CO2R5,
-N(R6)(R7),
-С1-C10алкил-N(R6)(R7) или
-С1-C6галогеналкила;
R2 представляет собой
-С1-C10алкил,
-С1-C6алкиларил,
-С1-C5алкил-O-гетероарил,
-С1-C10алкил-OR4,
-С1-C10алкил-CO2R5,
-С1-C10алкил-N(R6)(R7) или
-С1-C10алкил-CON(R6)(R7);
каждый R4 независимо выбран из
-С1-C6алкила,
-С3-C6циклоалкила или
-С1-C9алкил-N(R6)(R7);
каждый R5 независимо выбран из
-Н или
-С1-C6алкила;
каждый R6 независимо выбран из
-Н,
-С1-C6алкила,
-арила,
-гетероарила,
-С1-C6алкиларила,
-С1-C6алкилгетероарила,
-С(O)-С1-C6алкила или
-С1-C6алкил-CO2R5;
каждый R7 независимо выбран из
-Н,
-С1-C6алкила,
-арила или
-гетероарила;
R11 представляет собой -Н;
R12 представляет собой -С1-C6алкил;
R13 представляет собой -С1-C6алкил,
В1 выбран из группы, состоящей из
n имеет значение 0, 1 или 2;
или его фармацевтически приемлемая соль или сольват.
Другое воплощение изобретения включает фармацевтическую композицию, полезную для ингибирования ВИЧ интегразы, которая включает терапевтически эффективное количество одного или большего количества соединений формулы I, включая их фармацевтически приемлемые соли, сольваты и фармацевтически приемлемый носитель.
Детальное описание изобретения
В настоящем изобретении, если не определено иное, используют следующие определения.
Число в нижнем индексе после символа "С" определяет количество атомов углерода, которое может содержать отдельная группа. Например, "C1-С6" означает заместитель, содержащий от одного до шести атомов углерода.
Термин "алкил" означает насыщенную прямую цепь или разветвленный одновалентный углеводородный радикал, имеющий установленное количество атомов углерода. Примеры таких алкильных радикалов включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил и, где указаны, более высокие гомологи и изомеры такие как н-пентил, н-гексил, 2-метилпентил и им подобные. Галогеналкил относится к алкильному радикалу, который является замещенным одним или более радикалами галогена, такой как трифторметил.
Термин "циклоалкил" означает неароматическое 3-6 членное кольцо. Примеры включают циклопропил, циклобутил, циклопентил и циклогексил.
Галоген означает хлор, бром, иод или фтор.
"Арил" означает ароматический углеводород, имеющий от шести до четырнадцати атомов углерода; примеры включают пентил и нафтил, инденил, азуленил, фторенил и антраценил.
Термин "гетероциклический радикал" относится к радикалам, производным от моноциклического насыщенного гетероциклического ядра, имеющего 3-6 атомов, содержащего 1-3 гетероатомов, выбранных из атома азота, кислорода или серы. Гетероциклические радикалы включают, например, пиперидинил, пиперазинил, пирролидинил и морфолинил.
"Гетероарил" означает пяти- или шестичленное ароматическое кольцо, содержащее, по крайней мере, от одного и до четырех неуглеродных атомов, выбранных из атомов кислорода, серы и азота. Примеры гетероарила включают 2-фурил, 3-фурил, 2-пиридил, 3-пиридил, 4-пиридил, пиразинил, 2-тиенил, 3-тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, 1,2,3-оксадиазолил, 1,2,3-триазолил, 1,3,4-тиадиазолил, пиридазинил, пиримидинил, 1,3,5-триазинил и 1,3,5-тритианил.
В предпочтительном воплощении изобретения, соединения настоящего изобретения, которые являются полезными для лечения СПИДа имеют структурную формулу II.
В формуле II, R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 являются теми, как определены для формулы I, В2 имеет значения как определено в формуле Ia.
В еще другом воплощении настоящего изобретения, соединения, имеющие структурную формулу III, как следует ниже, являются предпочтительными химическими промежуточными соединениями, из которых получены соединения или фармацевтически приемлемые соли, сольваты или пролекарства, полезные для лечения СПИДа. Более того, соединения формулы III являются полезными сами по себе, в качестве пролекарств и могут быть введены в качестве пролекарства пациенту, в виде соединения или в форме фармацевтической композиции.
В формуле III, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12 и R13 являются теми, как определены для формулы I.
В более предпочтительном воплощении соединения настоящего изобретения имеют структурную формулу IV
где каждый R14 независимо выбран из
-CN,
-Н или
-галогена;
R15 представляет собой
-СН2С(O)Н(СН3)2 или
-C1-C2алкил; и
В2 является тем, как определено для формулы Ia.
Благодоря кислотному остатку, где применимо, соединение формулы I образует соли путем добавления фармацевтически приемлемого основания. Такие аддитивно-основные соли включают соли, полученные из неорганических оснований, которые включают, например, соли щелочного металла (например, натрия и калия), соли щелочноземельного металла (например, кальция и магния), алюминиевые соли и соли аммония. Кроме того, соответствующие аддитивно-основные соли включают соли физиологически приемлемых органических оснований, таких как триметиламин, триэтиламин, тетрагидрооксазин, пиридин, пиперидин, пиколин, дициклогексиламин, N,N-дибензилэтилендиамин, 2-гидроксиэтиламин, бис-(2-гидроксиэтил)амин, три-(2-гидроксиэтил)амин, прокаин, дибензилпиперидин, N-бензилфенэтиламин, дигидроабиетиламин, N,N'-бисгидроабиетиламин, глюкамин, N-метилглюкамин, коллидин, хинин, хинолин, этилендиамин, орнитин, холин, N,N'-бензилфенэтиламин, хлорпрокаин, диэтаноламин, диэтиламин, пиперазин, трис(гидроксиметил)аминометан и гидроксид тетраметиламмония и аминоосновные добавки, такие как лизин, аргинин и N-метилглютамин. Эти соли могут быть получены с помощью способов, известных среднему специалисту.
Соли аминогруппы могут также содержать четвертичные соли аммония, в которых азот аминокислоты имеет при себе соответствующую органическую группу, такую как алкильная, алкенильная, алкинильная или арилалкильный компонент.
Соединения формулы I, которые являются замещенными основной группой, могут существовать как соли, образованные через введение кислоты. Кислотно-аддитивные соли образуются из соединения формулы I и фармацевтически приемлемой неорганической кислоты, включая, но не ограничиваясь соляной, бромистоводородной, йодистоводородной, серной, фосфорной или органической кислоты, такой как п-толуолсульфоновая, метансульфоновая, уксусная, бензойная, лимонная, малоновая, фумаровая, малеиновая, щавелевая, янтарная, сульфаминовая или винная. Таким образом, примеры таких фармацевтически приемлемых солей включают хлорид, бромид, иодид, сульфат, фосфат, метансульфонат, цитрат, ацетат, малонат, фумарат, сульфамат и тартрат.
Конкретные соединения формулы I и их соли могут также существовать в виде сольватов с водой, например гидраты или с органическими растворителями, такими как метанол, этанол или ацетонитрил, чтобы образовать, соответственно, метилат, этилат или ацетонитрилат. Настоящее изобретение включает каждый сольват и его смеси.
Настоящее изобретение также включает фармацевтически приемлемые пролекарства соединений формулы I. Пролекарства представляют собой производные соединений по изобретению, которые имеют химически или метаболически расщепляемые группы и превращаются с помощью сольволиза или в физиологических условиях в соединения по изобретению, которые являются фармацевтически активными in vivo. Пролекарство соединения структурной формулы I может быть получено обычным способом с помощью функциональных групп соединений, таких как амино, гидрокси или карбоксигруппа. Пролекарство в виде производного часто обеспечивает преимущества в растворимости, совместимости с тканью или в контролируемом высвобождении в организме млекопитающего (смотри, Bundgaard, H., Design Prodrags, pp.7-9, 21-24, Elsevier, Amsterdam, 1985). Пролекарства включают производные кислот хорошо известные средним специалистам в данной области, такие как, например, сложные эфиры, полученные путем взаимодействия исходного кислотного соединения с соответствующим спиртом или амиды, полученные взаимодействием исходного кислотного соединения с соответствующим амином. Сложные алифатические или ароматические эфиры, производные от кислотных боковых групп соединений по настоящему изобретению, являются предпочтительными пролекарствами. В некоторых случаях желательно получать эфирные пролекарства по двум группам, такие как (ацилокси) алкилсложные эфиры или (алкоксикарбонил)окси)алкилсложные эфиры. Примеры пролекарств соединений настоящего изобретения включают соединения 1-А, 2-А, 3-С, 4-В, 5-В, 6-С, 7-С, 8-С, 9-С, 10-А, U-C, 12-С, 13-С, 14-С, 15-С, 16-С, 17-С, 18-С, 19-С, 20-С, 21-С, 22-А, 22-В, 23-С, 25-С, 26-С, 27-С, 28-С, 29, 30-С, 31-С, 32-D, 32-Е, 33, 34-С, 35-С, 36, 37-D, 38-61.
Кроме того, соединение структурной формула I или соль, сольват или его пролекарство могут демонстрировать полиморфизм. Настоящее изобретение также содержит любую такую полиморфную форму.
Конкретные соединения структурной формулы I могут содержать один или более хиральных центров и существовать в различных оптически активных формах. Когда соединения структурной формулы I содержат один хиральный центр, соединения существуют в двух энантиомерных формах. Настоящее изобретение включает оба энантиомера и смеси энантиомеров, такие как рацемические смеси. Энантиомеры могут быть разделены с помощью способов, известных среднему специалисту, например, путем образования диастереомерных солей, которые могут быть разделены путем кристаллизации, газожидкостной или жидкостной хроматографии, селективного взаимодействия одного энантиомера с энантиомерспецифическим реагентом. Должно иметься в виду, что там, где желательный энантиомер преобразован в другую химическую структурную форму путем разделения, должна быть проведена дополнительная стадия образования желательной энантиомерной формы. Альтернативно, отдельные энантиомеры могут быть синтезированы путем асимметричного синтеза, используя оптически активные реактивы, подложки, катализаторы или растворители или преобразованием одного энантиомера в другой асимметричным превращением.
Определенные соединения структурной формула I могут также существовать в различных устойчивых конформационных формах, которые могут быть разделимыми. Торционная асимметрия вследствие ограниченного вращения вокруг асимметричной простой связи, например из-за пространственного затруднения или напряжения кольца, может разрешить разделение различных конформеров. Настоящее изобретение включает каждый конформационный изомер соединений структурной формулы I и их смесей.
Некоторые соединения структурной формулы I могут существовать в форме цвиттер-иона и настоящее изобретение включают каждую цвиттер-ионную форму соединений структурной формулы I и ее смесей.
Соединения настоящего изобретения могут также существовать как таутомеры; поэтому настоящее изобретение также включает все таутомерные формы.
Соединения формулы Ia являются полезными в ингибировании ВИЧ интегразы, профилактике или лечении инфекции вируса человеческого иммунодефицита и лечении последующих патологических состояний, таких как СПИД или ARC. Лечение включает введение пациенту, нуждающемуся в таком лечении, соединения формулы Ia или фармацевтически приемлемой соли, сольвата или его пролекарства или фармацевтической композиции, содержащей фармацевтический носитель и терапевтически эффективное количество соединения по настоящему изобретению или фармацевтически приемлемой соли, сольвата или его пролекарства.
Средний специалист может оценить, что лечение распространяется как на профилактику, так и на лечение указанных инфекций или симптомов. Таким образом включается первоначальное лечение до- и поствоздействие вируса. Кроме того, способ по настоящему изобретению может применяться в соединении с другими анти-ВИЧ агентами (ВИЧ ингибиторы протеазы, ингибиторы нуклеозидной обратной транскриптазы, ингибиторы ненуклеозидной обратной транскриптазы и ВИЧ-внесенные ингибиторы), иммуномодуляторами, противоинфекционными и/или вакцинами.
Соединения по настоящему изобретению также полезны при подготовке и выполнении тестов в пробирках для анализа противовирусных соединений. Кроме того, соединения полезны в установлении или определении связанного сайта других противовирусных соединений к ВИЧ интегразе, например, путем конкурентного ингибирования.
Соединения по настоящему изобретению могут вводиться перорально, парентерально (включая подкожные инъекции, внутривенную, внутримышечную, интрастернальную инъекцию или инфузную методику), с помощью распылительной ингаляции или ректально, в виде единичных дозированных составов, содержащих обычные нетоксичные фармацевтически приемлемые носители, адъюванты и связующие вещества.
Настоящее изобретение также обеспечивает получение фармацевтической композиции для использования в описанной выше терапевтической методике. Фармацевтическая композиция настоящего изобретения включает эффективное количество соединения формулы I в соединении с фармацевтически приемлемым носителем, наполнителем или эксиципиентом и разбавителем.
Активный ингредиент в таких составах включает от 0.1 процента до 99.9 процента от массы состава. Термин "фармацевтически приемлемый" означает, что носитель, разбавитель или эксиципиент должны быть совместимы с другими ингредиентами соединения и не вредны его реципиенту.
Фармацевтические композиции могут быть получены в соответствии с известными методиками, использующими известные и легко получаемые ингредиенты. Такие композиции настоящего изобретения могут быть разработаны, чтобы обеспечить быстрое, устойчивое или замедленное введение активного ингредиента после введения пациенту в соответствии с применяемыми процедурами, известными среднему специалисту. При получении композиций активный ингредиент обычно смешивают с носителем или разбавляют носителем или заключают в носитель, который может быть в форме капсулы, пакетика, бумаги или другой емкости. Когда носитель является разбавителем, то он может быть твердым веществом, полутвердым или жидким материалом, который действует как связующее средство, инертным наполнителем или питательной средой для активного ингредиента. Таким образом, композиции могут быть в форме таблеток, пилюль, порошков, шариков, таблеток, пакетиков, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (как твердое вещество или в жидкой среде), мягких и твердых капсул желатина, свеч, стерильно впрыскиваемых растворов, стерильно упакованных порошков и им подобные.
Соединения могут быть введены различными путями, включая оральный, ректальный, травсдермальный, подкожный, внутривенный, внутримышечный и интраназальный путь.
При оральном введении указанные композиции получают в соответствии с методиками, известными в данной области, как фармацевтический состав. Для орального введения соединение обычно формируют с эксиципиентами, такими как связующие, наполнители, смазки, разбавители, разрыхлители и т.п. как известно в данной области.
Для парентерального введения соединение формулируют в фармацевтически приемлемые нетоксичные, парентерально-приемлемые разбавители или растворители, такие как маннитол, 1,3-бутандиол, вода, 5-процентная декстроза, раствор Рингера или изотонический раствор хлористого натрия или соответствующие дисперсионные или увлажняющие и суспендирующие агенты, такие как стерильные, мягкие, нелетучие масла, включая синтетическое моно- или диглицериды и жирные кислоты, включая олеиновую кислоту.
Соединение по настоящему изобретению или его соль или сольват могут быть применены в дозированном составе, содержащем дозу, находящуюся приблизительно между 0.1 мг и приблизительно 1000 мг, или больше, в соответствии с конкретной методикой лечения. Пример дозированного состава включает 5 мг соединения настоящего изобретения в стерильной стеклянной ампуле, емкостью 10 мл. Другой пример дозированного состава включает около 10 мг соединения настоящего изобретения в виде фармацевтически приемлемой соли в 20 мл изотонического соляного раствора, содержащегося в стерильной ампуле.
Соединения могут быть введены пациентам в пределах дозы от 1 до 100 мг/кг на массу тела отдельными дозами. Пределы одной из предпочтительных доз составляют от 1 до 20 мг/кг на массу тела орально отдельными дозами. Тем не менее понятно, что индивидуальный уровень дозы и повторяемость применения доз для любого индивидуального пациента могут быть различны и зависят от различных факторов, включая активность конретно назначенного соединения, метаболическую стабильность и продолжительность действия указанного соединения, пути введения, возраста, массы тела, состояния здоровья, пола, питания, способа и времени введения, интенсивности выделения, комбинации лекарственных средств, серьезности индивидуального состояния и общей терапии, которой подвергается пациент.
Общие способы, полезные для синтеза соединений, воплощенных в настоящем изобретении, показаны ниже. Приготовления, показанные ниже, раскрыты ради иллюстрации и не предназначены, чтобы интерпретироваться как ограничение процессов получения соединений любыми другими способами.
Средним специалистам понятно, что существует множество способов получения соединений по настоящему изобретению, как предусмотрено структурной формулой I. Соединение структурной формулы I может быть получено с помощью процессов, которые включают способы, известные средним специалистам для производства структурно аналогичных соединений или новых способов, раскрытых в настоящем изобретении. Процесс получения соединения структурной формулы I (или его фармацевтически приемлемой соли) и новых промежуточных соединений для производства соединения формулы I, как определено выше, обеспечивает дальнейшие особенности изобретения, и они иллюстрируются в следующих процедурах, в которых общие значения радикалов являются теми, как определено выше, если иное не определено. Должно быть понятно, что это может быть предпочтительно или необходимо, чтобы получить соединение формулы I, в которой функциональная группа защищена, используя пригодную защитную группу, последующим удалением ее, чтобы обеспечить получение соединения формулы I.
Таким образом, обеспечивают процесс получения соединения формулы I (или его фармацевтически приемлемой соли), как его обеспечивают в любом из описаний, которые выбраны из любого из описанных в примерах, включая нижеследующие.
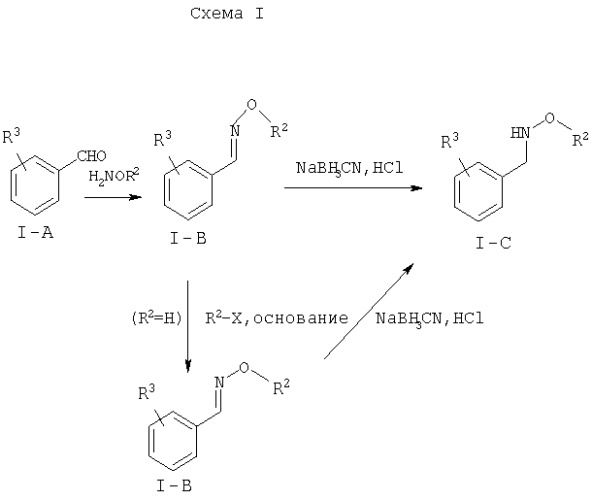
Схемы I и II иллюстрируют синтез коммерчески недоступных N-,O-дизамещенных гидроксиламинов I-C и II-С. На схеме I бензальдегид I-A, замещенный 1-3 R3 группами, конденсируют с гидроксиламином или O-замещенным производным гидроксиламина. Когда гидроксильная группа незамещена (R2=Н), это положение может функционировать через нуклеофильную атаку на соответствующий замещенный R2-X электрофил (X=Cl, Br, I, -OTs, -OMs или -OTf). Средним специалистам понятно, что эта реакция может быть осуществлена различными способами. Полученный оксим I-B может быть легко превращен в соответствующий N-,O-дизамещенный гидроксиламин, используя цианборгидрид натрия или родственный восстановитель, такой как триэтилсилан в кислотных условиях. На схеме II, O-замещенный гидроксиламин ацилируют Вос-ангидридом, чтобы образовать промежуточное соединение II-А.
Он может реагировать с соответствующим замещенным R1CH2-X электрофилом (X=Cl, Br, I, -OTs, -OMs или -OTf) в основных условиях, что дает на выходе Вос-замещенный N-, O-дизамещенный гидроксиламин II-B. Вос-защитную группу удаляют, что дает на выходе N-, O-дизамещенный гидроксиламин II-C. Средним специалистам понятно, что другие защитные группы или агенты ацилирования могут быть использованы вместо Вос-группы, чтобы эффективно обеспечить то же самое преобразование.
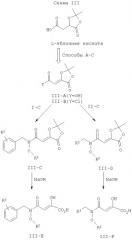
Как показано на схеме III, N-, O-дизамещенные гидроксиламины затем конденсируют с диоксоланом IIIA или III-В, используя обычную химию образования амидной связи. Синтез диоксоланов III-А и III-B описан в экспериментальной части. Полученные промежуточные соединения III-C и III-D омыляют с помощью NaOH или LiOH, что дает на выходе ингибиторы интегразы III-Е и III-F.
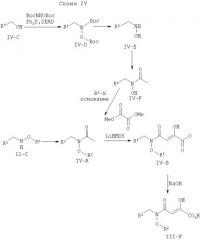
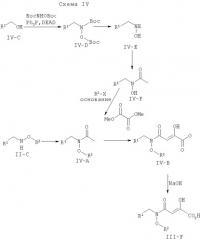
Альтернативные способы синтеза, полезные для производства соединений, описанных в настоящим изобретении, демонстрируются на схеме IV. Ацилированный N,O-дизамещенный гидроксиламин IV-A может быть синтезирован вначале непосредственно из II-С, синтезированного, как показано ранее, или с помощью различных путей, которые исходят из соединения IV-C. Соединение IV-C может взаимодействовать с N,O-бис-Вос-гидроксиламином, что дает на выходе промежуточное соединение IV-D. После удаления Вос-защитных групп его ацилируют с помощью ацетилхлорида или хлорангидрида уксусной кислоты при обычных условиях образования амидной связи, с получением IV-F. Гидроксильная группа затем функционирует через нуклеофильное замещение соответствующим активированным R2-X (X=Cl, Br, I, -OTs, -OMs или OTf), с получением на выходе соединения IV-A. Это промежуточное соединение конденсируют с диметилоксалатом, осуществляемым с помощью реакции Кляйзена, используя бис(триметилсилил)амид лития. Сложный эфир IV-В омыляют, используя NaOH или LiOH, что дает на выходе ингибиторы интегразы III-F.
Изходя из промежуточного соединения 20-С. Схема V иллюстрирует синтез соединений 20, 22-А, 22-В, 22 и 24.
На схеме VI соединение 22-A превращают в соответствующий хлорангидрид кислоты, соединение 38-А, используя оксалилхлорид. Он последовательно взаимодействует с амином VI-A, используя соответствующий основной катализатор, что дает на выходе промежуточное соединение VI-B, Это промежуточное соединение гидролизуют в щелочных условиях (LiOH), чтобы получить ингибиторы VI-C.
Примеры
Следующие конкретные примеры иллюстрируют синтез соединений по настоящему изобретению, и они не должны быть рассмотрены как ограничивающие изобретение во всей его полноте. Способы могут быть адаптированы к изменениям для того, чтобы получить соединения, охватываемые настоящим изобретением, но специально не приведенные. В дальнейшем, различные способы получения тех же самых соединений в несколько отличных способах, также будет очевидны для среднего специалиста.
В примерах, все температуры, как понимается, находятся в диапазоне ста градусов по Цельсию (С), если иное не установлено. Спектральные характеристики ядерного магнитного резонанса (ЯМР) соотносят к химическим сдвигам (δ), выраженным в частях на миллион (ppm) по отношению к тетраметилсилану (ТМС), как исходному эталону. Соответствующая область, определенная для различных сдвигов при приведении данных в протонном ЯМР, соответствует количеству атомов водорода в конкретной группе в молекуле. Природа сдвигов как мультиплетность обозначена как широкий (уширенный синглет) (bs или br s), уширенный дуплет (bd или br d), уширенный триплет (bt или br t), уширенный квартет (bq или br q), синглет (s), мультиплет (m), дуплет (d), квартет (q), триплет (t), дуплет дуплета (dd), дуплет триплета (dt) и дуплет квартета (dq). Растворители, используемые для получения ЯМР спектра, являются ацетоном-d6 (дейтерированный ацетон), ДМСО-d6 (пердейтерированный диметилсульфоксид), D2O (дейтерированная вода), CDCl3 (дейтерированный хлороформ) и другие условные дейтерированные растворители.
Сокращения, использованные в настоящем изобретении, представляют собой условные сокращения, широко используемые в данной области. Некоторыми из них являются: calcd (рассчитанный); ДМСО (диметилсульфоксид); EtOAc (этилацетат); ВЭЖХ (высокоэффективная жидкостная хроматография); LC/MS (жидкостная хроматография, массспектроскопия); LDA (диизопропиламид лития); LiHMDS (бис(триметилсилил)амид лития); SiO2 (силикагель); ТГФ (тетрагидрофуран), ТФК (трифторуксусная кислота), Me (метил), Et (этил), Ph (фенил), tBuOK (трет-бутоксид калия), NaOMe (метоксид натрия), NaOEt (этоксид натрия); Boc (трет-бутоксикарбонил) и DEAD (диэтилазодикарбоксилат).
Способ А
Соединение A-I: (S)-(+)-2,2-Диметил-5-оксо-1,3-диоксолан-4-уксусная кислота, трет-бутилдифенилсилиловый эфир
Раствор (S)-(+)-2,2-диметил-5-оксо-1,3-диоксолан-4-уксусная кислота (2.08 г, 11.9 ммоль) в сухом дихлорметане (20 мл) нагревают с триэтиламином (1.83 мл, 13.1 ммоль), затем добавляют по каплям в течение более 5 минут раствор трет-бутилхлордифенилсилана (3.44 г, 12.5 ммоль) в дихлорметане (5 мл). Через 3 часа при температуре 22°С реакционную смесь разбавляют толуолом (250 мл), промывают водой, насыщают бикарбонатом натрия, рассолом и сушат над сульфатом магния. Выпаривание растворителя при пониженном давлении и хроматография остатка на силикагеле (4×12 см), используя смесь толуола и этилацетата (0-2%) в качестве элюента дает 4.90 г (99% выход) желаемого продукта в виде прозрачного масла. 1H ЯМР (400 МГц, CDCl3) δ: 1.13 (с, 9), 1.58 (с, 3), 3.05 (м, 2), 4.79 (дд, 1, J=4,7), 7.4-7.8 (м, 10).
Соединение А-2: 4-Бром-2,2-диметил-5-оксо-1,3-диоксолан-4-уксусная кислота, трет-бутилдифенилсилиловый эфир
Раствор (S)-(+)-2,2-диметил-5-оксо-1,3-диоксолан-4-уксусная кислота, трет-бутилдифенилсилилового эфира (21.65 г, 52.4 ммоль) в четыреххлористом углероде (160 мл) нагревают с N-бромсукцинимидом (9.35 г, 52.4 ммоль) и 2,2'-азобисизобутиронитрилом (200 мг) и полученную смесь нагревают при температуре кипения с обратным холодильником (температура бани составляет 85°С) при облучении электрической лампой, мощностью 500 ватт. Через 10 минут реакционную смесь охлаждают и сукцинимид отфильтровывают. Растворитель выпаривают в вакууме, что дает желаемый бромид в виде масла светло-желтого цвета (˜26 г), которое используют непосредственно на следующей стадии. 1Н ЯМР (400 МГц, CDCl3) δ: 1.12 (с, 9), 1.41 (с, 3), 1.80 (с, 3), 3.80 (м, 2), 7.3-7.7 (м, 10).
Соединение А-3: (Z)-2,2-Диметил-5-(трет-бутилдифенилсилилоксикарбонилметилен)-1,3-диоксолан-4-он
Раствор трет-бутилдифенилсилилового эфира 4-бром-2,2-диметил-5-оксо-1,3-диоксолан-4-уксусной кислоты (-26 г, 52.4 ммоль) в сухом тетрагидрофуране (160 мл) охлаждают до температуры 0°С и обрабатывают по каплям в течение более 5 минут 1,8-диазабицикло [5,4,0]ундек-7-еном (12.7 г, 78.8 ммоль) и полученную смесь перемешивают при температуре 5°С в течение 1.5 часов. Образованное твердое вещество отфильтровывают и промывают небольшим количеством тетрагидрофурана. Фильтрат используют как таковой на следующей стадии.
Альтернативно реакционная смесь может быть разбавлена толуолом, промыта водой, насыщенным раствором бикарбоната натрия, рассолом и высушена (сульфат магния). Выпаривание растворителя дает масло, которые хроматографируют на силикагеле, используя смесь толуола и этилацетата (0-2%) в качестве элюента. Названный сложный эфир получают в виде масла с 30-50% выходом. 1Н ЯМР (400 МГц, CDCl3) δ: 1.16 (с, 9), 1.76 (с, 6), 5.97 (с, 1), 7.4-7.8 (м, 10).
Соединение III-А: (2,2-Диметил-5-оксо-[1,3]диоксолан-4-илиден)-уксусная кислота
Раствор чистого (Z)-2,2 диметил-5-(трет-бутилдифенилсилилоксикарбонилметилен)-1,3-диоксолан-4-она (2.80 г, 6.82 ммоль) в тетрагидрофуране (40 мл) нагревают при температуре 22°С с уксусной кислотой (2 мл), затем добавляют 6.8 мл 1 М раствора тетрабутиламмония фторида в тетрагидрофуране. Через 15 минут при температуре 22°С реакционную смесь разбавляют этилацетатом, промывают водой, рассолом и сушат (сульфат магния). Растворитель концентрируют при пониженном давлении и остаток растирают в порошок с толуолом, что дает 1.00 г (85% выход) названного соединения в виде кристаллического продукта белого цвета: температура плавления 203-204°С (разложение). IR(KBr)v макс (см-1):1805, 1707 и 1662. 1Н ЯМР (400 МГц, CDCl3) δ: 1.78 (с, 6), 5.89 (с, 1). Вычислено для C7H8O5: С, 48.84; Н, 4.68; Найдено: С, 48.84; Н, 4.65.
Получение (2,2-Диметил-5-оксо-[1,3]диоксолан-4-илиден)-уксусная кислота из сырого продукта А-3
Раствор сырого (г)-2,2-диметил-5-(трет-бутилдипентилсилилоксикарбонилметилен)-1,3-диоксолан-4-она (52.4 ммоль) в тетрагидрофуране (200 мл) нагревают с уксусной кислотой (13 мл), затем с 50 мл 1 М раствором фторида тетрабутиламмония в тетрагидрофуране. Через 15 минут при температуре 22°С реакционную смесь отфильтровывают и фильтрат концентрируют в вакууме. Измельченный в порошок с толуолом остаток дает 6.3 г (70% выход для трех стадий) желаемого продукта в виде твердого вещества белого цвета (>95% чистота при 1Н ЯМР).
Способ В
Соединение B-I: (+)-2,2-Диметил-5-оксо-1,3-диоколан-4-уксусная кислота, трет-бутилдиметилсилиловый эфир
Раствор (S)-(+)-2,2-диметил-5-оксо-1,3-диоксолан-4-уксусная кислота (13.20 г, 75.8 ммоль) в N,N-диметилформамиде (25 мл) нагревают при температуре 22°С с имидазолом (10.56 г, 0.155 ммоль), затем трет-бутилдиметилсилилхлоридом (12.0 г, 79.6 ммоль) и полученную смесь перемешивают при температуре 22°С в течение 18 часов. Реакционную смесь затем разбавляют толуолом (500 мл), промывают водой (трижды), насыщенным раствором бикарбоната натрия и рассолом. После высушивания (сульфат магния), растворитель выпаривают при пониженном давлении, что дает масло. Перегонка в вакууме дает 20.9 г (96% выход) желаемого продукта в виде прозрачного масла: точка кипения 80-90°С / 0.1 Торр (1 Торр=1 мм рт. столба) (перегонка из колбы в колбу, температура воздушной бани соответствует температуре окружающей среды). 1Н ЯМР (400 МГц, CDCl3) δ: 0.33 (с, 3), 0.36 (с, 3), 1.00 (с, 9), 1.11 (с, 3), 1.37 (с, 3), 2.72 (м, 2), 4.35 (дд, J=4,6).
Соединение В-2: 4-Бром-2,2-диметил-5-оксо-1,3-диоксолан-4-уксусная кислота, трет-бутилдиметилсилиловый эфир
Раствор (S)-(+)-2,2-диметил-5-оксо-1,3-диоксолан-4-уксусная кислота, трет-бутилдиметилсилилового эфира (20.9 г, 72.4 ммоль) в четыреххлористом углероде (200 мл) нагревают с N-бромсукцинимидом (14.18 г, 79.6 ммоль) и 2,2'-азоби