Производные пиримидина и фармацевтическая композиция
Иллюстрации
Показать всеИзобретение относится к производным пиримидина общей формулы I и их фармацевтически приемлемым кислотно-аддитивным солям, обладающим свойствами антагонистов рецептора нейрокинина-1 (NK). Соединения могут найти применение при лечении, например, воспалительных заболеваний, ревматоидного артрита, астмы, доброкачественной гиперплазии предстательной железы, болезни Альцгеймера и др. В общей формуле I
R1 означает низший алкил, низший алкоксил, пиридинил, пиримидинил, фенил, -S-низший алкил, -S(O)2-низший алкил, -N(R)-(CH2)n-N(R)2, -O-(CH2)n-N(R)2, -N(R)2 или циклический третичный амин в виде группы которая может содержать один дополнительный гетероатом, выбранный из N, О или S, и где эта группа может быть связана с пиримидиновым кольцом мостиком -O(CH2)n-; R2 означает водород, низший алкил, низший алкоксил, галоген или трифторметил; R3/R3' означают независимо друг от друга водород или низший алкил; R4 означает независимо от любого другого галоген, трифторметил или низший алкоксил; R5 означает водород или низший алкил; R означает независимо от любого другого водород или низший алкил; Х означает -C(O)N(R)- или -N(R)C(O)-; Y означает -О-; n означает 1, 2, 3 или 4 и m означает 0, 1 или 2. Изобретение также относится к фармацевтической композиции, содержащей одно или несколько соединений по любому из пп.1-19 и фармацевтически приемлемые наполнители. 2 н. и 19 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к соединениям общей формулы
где R1 означает низший алкил, низший алкоксил, пиридинил, пиримидинил, фенил, -S-(низш.)алкил, -S(O)2-(низш.)алкил, -N(R)-(CH2)n-N(R)2, -O-(CH2)n-N(R)2, -N(R)2 или циклический третичный амин в виде группы
которая может содержать один дополнительный гетероатом, выбранный из N, О или S, и где эта группа может быть связана с пиримидиновым кольцом мостиком -O(СН2)n-;
R2 означает водород, низший алкил, низший алкоксил, галоген или трифторметил;
R3/R3' означают независимо друг от друга водород или низший алкил;
R4 означает независимо от любого другого галоген, трифторметил или низший алкоксил;
R5 означает водород или низший алкил;
R означает независимо от любого другого водород или низший алкил;
Х означает -C(O)N(R)- или -N(R)C(O)-;
Y означает -О-;
n означает 1, 2, 3 или 4 и
m означает 0, 1 или 2,
и к их фарацевтически приемлемым кислотно-аддитивным солям.
Соединения формулы I и их соли характеризуются ценными терапевтическими свойствами. Неожиданно было обнаружено, что соединения по настоящему изобретению являются антагонистами рецептора нейрокинина-1 (NK-1, вещество Р). Вещество Р является встречающимся в природе ундекапептидом, относящимся к тахикининовому семейству пептидов, последние так называют из-за их быстрого сократительного воздействия на ткань внесосудистой гладкой мускулатуры. Рецептором для вещества Р является член сверхсемейства связанных с G-белком рецепторов.
Нейропептидный рецептор для вещества Р (NK-1) широко распространен повсюду в нервной системе млекопитающих (в особенности, в мозге и спинномозговых ганглиях), в системе кровообращения и в периферических тканях (особенно в двенадцатиперстной кишке и тощей кишке) и вовлечен в регуляцию ряда различных биологических процессов.
Центральное и периферическое действия тахикининового вещества Р млекопитающих связаны с многочисленными воспалительными состояниями, включая мигрень, ревматоидный артрит, астму и воспалительное заболевание кишечника, а также посредничество в рвотном рефлексе и модуляцию нарушений центральной нервной системы (ЦНС), как, например, болезнь Паркинсона (Neurosci. Res., 1996, 7, 187-214), тревога (Can. J. Phys., 1997, 75, 612-621) и депрессия (Science, 1998, 281, 1640-1645).
Свидетельства полезности антагонистов рецептора тахикинина при боли, головной боли, особенно мигрени, болезни Альцгеймера, множественном склерозе, ослаблении синдрома отмены морфина, сердечно-сосудистых изменениях, отеках, как, например, отеки, вызванные термическим ожогом, при хронических воспалительных заболеваниях, как, например, ревматоидный артрит, астме/повышенной бронхиальной реактивности и других респираторных заболеваниях, включая аллергический ринит, при воспалительных заболеваниях кишок, включая язвенный колит и болезнь Крона, при повреждении глаз и воспалительных заболеваниях глаз рассмотрены в статье "Рецептор тахикинина и антагонисты рецептора тахикинина", J. Auton. Pharmacol, 13, 23-93, 1993.
Кроме того, антагонисты рецептора нейрокинина-1 разрабатываются для лечения ряда физиологических нарушений, связанных с избытком или дисбалансом тахикинина, в частности вещества Р. Примеры состояний, в которые вовлечено вещество Р, включают нарушения центральной нервной системы, как, например, тревога, депрессия и психоз (международные заявки на патенты WO 95/16679, WO 95/18124, WO 95/23798).
Антагонисты рецептора нейрокинина-1 далее полезны для лечения укачивания и для лечения индуцированной рвоты.
В дополнение к этому, в журнале "The New England Journal of Medicine", том 340, №3, стр. 190-195, 1999, описано ослабление вызванной цисплатином рвоты с помощью селективного антагониста рецептора нейрокинина-1.
Далее в патенте США US 5972938 описывается способ лечения психоиммунологического или психосоматического нарушения при введении антагониста рецептора тахикинина, как, например, антагонист рецептора NK-1.
Пригодность антагонистов рецептора нейрокинина-1 для лечения некоторых форм недержания мочи также описывается в журнале "Neuropeptides", 32(1), 1-49 (1998), и в "Eur. J. Pharmacol.", 383(3), 297-303 (1999).
В журнале "Life Sci" (2000), 67(9), 985-10001, описывается, что астроциты экспрессируют функциональные рецепторы к многочисленным нейромедиаторам, включая вещество Р, которое является важным раздражителем для реактивных астроцитов в развитии ЦНС, инфекции и травм. В случае опухолей мозга злокачественные нейроглиальные клетки, происходящие из астроцитов, инициируются тахикининами с помощью рецепторов NK-1 с целью высвобождения растворимых медиаторов и повышения скорости их пролиферации. Поэтому селективные антагонисты рецептора NK-1 могут быть полезны в качестве терапевтического подхода к лечению злокачественных глиом при лечении рака.
В журнале "Nature" (Лондон) (2000), 405(6783), 180-183, описывается, что мыши с генетическим нарушением рецептора NK-1 обнаруживают потерю полезных свойств морфина. Соответственно, антагонисты рецептора NK-1 могут быть полезны при лечении синдромов отмены лекарств, к которым развилось привыкание, как, например, опиаты и никотин, и для уменьшения злоупотребления ими/пристрастия к ним.
Показано, что антагонисты рецептора NK-1 оказывают также полезный эффект при терапии травматического повреждения мозга (устное сообщение профессора Ниммо на Международной конференции по тахикинину в 2000 г. в Ла Гранд Мотте, Франция, 17-20 октября 2000, под названием "Антагонисты рецептора нейрокинина-1 (NK-1) улучшают неврологический результат после травматического повреждения мозга" (авторы: A.J.Nimmo, C.J.Benett, X.Hu, I.Cernak, R.Vink).
Соединения по настоящему изобретению также пригодны для лечения доброкачественной гиперплазии предстательной железы (ВРН), заболевания, которое широко распространено у пожилых мужчин. ВРН может быть прогрессирующей и приводить к задержке мочи, инфекциям, камням в мочевом пузыре и к почечной недостаточности. Об этом показании сообщено в европейском патенте ЕР 01109853.0.
Соединения формулы I также могут быть использованы в виде их пролекарств, например, в виде их N-окисей. Пролекарства могут добавить к достоинствам представленных соединений преимущества в адсорбции, фармакокинетике в распределении и транспорте к мозге.
Объектами настоящего изобретения являются соединения формулы I и их фармацевтически приемлемые соли, получение вышеупомянутых соединений, содержащие их лекарственные средства и их приготовление, а также применение вышеуказанных соединений для борьбы с заболеваниями или предупреждения заболеваний, особенно заболеваний и нарушений такого типа, на которые ссылались ранее, или для приготовления соответствующих лекарственных средств.
Термин "низший алкил", как он используется в контексте, означает насыщенную алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и им подобные. Предпочтительными представляющими низший алкил группами являются группы с 1-4 углеродными атомами.
Термин "галоген" означает хлор, иод, фтор и бром.
Термин "низший алкоксил" означает группу, в которой алкильный остаток является таким, как указано выше, и который присоединен через атом кислорода.
Термин "циклический третичный амин" означает пяти- или шестичленный гетероцикл, в котором один атом азота всегда соединен с пиримидиновым кольцом и который может дополнительно содержать атомы азота, кислорода или серы, например пирролидинил, имидазолидинил, пиразолидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, тиоморфолин-1,1-диоксо или тиоморфолин-1-оксо.
Термин "фармацевтически приемлемые кислотно-аддитивные соли" охватывает соли с неорганическими или органическими кислотами, как, например, соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфокислота, п-толуолсульфокислота и им подобные.
Наиболее предпочтительными показаниями согласно настоящему изобретению являются такие, которые включают нарушения центральной нервной системы, например, лечение или предупреждение некоторых депрессивных нарушений или рвоты путем введения антагонистов рецептора NK-1. Серьезный приступ депрессии определен как период, как минимум, в две недели, в течение которых большинство дней и почти каждый день имеет место или депрессивное настроение, или потеря интереса ко всему, больной ни в чем не находит удовольствия или теряет интерес к любой деятельности.
Предпочтительны соединения формулы I, где Х означает -С(O)N(СН3)- и Y означает -О-. Примерами предпочтительных соединений этой группы являются такие, где R1 является циклическим третичным амином, например следующие соединения:
(3,5-бис(трифторметил)бензил)метиламид 2-(4-метилпиперазин-1-ил)-4-о-толилоксипиримидин-5-карбоновой кислоты,
(3,5-бис(трифторметил)бензил)метиламид 2-пиперазин-1-ил-4-о-толилоксипиримидин-5-карбоновой кислоты или
(3,5-бис(трифторметил)бензил)метиламид 4-(2-хлорфенокси)-2-(4-метилпиперазин-1-ил)пиримидин-5-карбоновой кислоты.
Другими предпочтительными соединениями вышеупомянутой группы являются такие, где R1 означает -O-(СН2)n-циклический третичный амин или группу -O-(CH2)-NR2. Такими соединениями являются следующие:
(3,5-бис(трифторметил)бензил)метиламид 2-(2-морфолин-4-илэтокси)-4-о-толилоксипиримидин-5-карбоновой кислоты или
(3,5-бис(трифторметил)бензил)метиламид 2-(2-диметиламиноэтокси)-4-о-толилоксипиримидин-5-карбоновой кислоты.
Далее предпочтительны соединения формулы I, в которых Х означает -N(СН3)С(O)- и Y означает -О-. Примерами предпочтительных соединений этой группы являются такие, где R1 означает -S-(низший)алкил, например следующие соединения:
2-(3,5-бис(трифторметил)фенил)-N-метил-N-(2-метилсульфанил-4-о-толилоксипиримидин-5-ил)изобутирамид,
2-(3,5-бис(трифторметил)фенил)-N-[4-(4-фторфенокси)-2-метилсульфанилпиримидин-5-ил]-N-метилизобутирамид или
2-(3,5-бис(трифторметил)фенил)-N-[4-(2-хлорфенокси)-2-метилсульфанилпиримидин-5-ил]-N-метилизобутирамид.
Другими предпочтительными соединениями вышеуказанной группы являются такие, где R1 означает циклический третичный амин, например следующие соединения:
2-(3,5-бис(трифторметил)фенил)-N-метил-N-(2-морфолин-4-ил-4-о-толилоксипиримидин-5-ил)изобутирамид,
2-(3,5-бис(трифторметил)фенил)-N-метил-N-[2-(4-метилпиперазин-1-ил)-4-о-толилоксипиримидин-5-ил]изобутирамид,
2-(3,5-бис(трифторметил)фенил)-N-метил-N-(2-пиперазин-1-ил-4-о-толилоксипиримидин-5-ил)изобутирамид,
2-(3,5-бис(трифторметил)фенил)-N-[4-(4-фторфенокси)-2-(4-метилпиперазин-1-ил)пиримидин-5-ил]-N-метилизобутирамид,
2-(3,5-бис(трифторметил)фенил)-N-[4-(4-фторфенокси)-2-пиперазин-1-илпиримидин-5-ил]-N-метилизобутирамид,
2-(3,5-бис(трифторметил)фенил)-N-[4-(2-хлорфенокси)-2-морфолин-4-илпиримидин-5-ил]-N-метилизобутирамид,
2-(3,5-бис(трифторметил)фенил)-N-[4-(2-хлорфенокси)-2-(4-метилпиперазин-1-ил)пиримидин-5-ил]-N-метилизобутирамид или
2-(3,5-бис(трифторметил)фенил)-N-[4-(2-хлорфенокси)-2-пиперазин-1-илпиримидин-5-ил]-N-метилизобутирамид.
Предпочтительными соединениями этой группы являются, кроме того, те, в которых R1 означает -N(R)(CH2)nNR2, например следующие соединения:
2-(3,5-бис(трифторметил)фенил)-N-[2-(2-диметиламиноэтиламино)-4-о-толилоксипиримидин-5-ил]-N-метилизобутирамид или
2-(3,5-бис(трифторметил)фенил)-N-[2-(2-диметиламиноэтиламино)-4-(4-фторфенокси)пиримидин-5-ил]-N-метилизобутирамид.
Далее предпочтительными соединениями этой группы являются те, в которых R1 означает -O(СН2)n-циклический третичный амин или группу -O(CH2)nNR2, например следующие соединения:
2-(3,5-бис(трифторметил)фенил)-N-метил-N-[2-(2-морфолин-4-илэтокси)-4-о-толилоксипиримидин-5-ил]изобутирамид,
2-(3,5-бис(трифторметил)фенил)-N-[4-(2-хлорфенокси)-2-(2-морфолин-4-илэтокси)-пиримидин-5-ил]-N-метилизобутирамид,
2-(3,5-бис(трифторметил)фенил)-N-[2-(2-диметиламиноэтокси)-4-o-толилоксипиримидин-5-ил]-N-метилизобутирамид,
2-(3,5-бис(трифторметил)фенил)-N-[2-(3-диметиламинопропокси)-4-о-толилоксипиримидин-5-ил]-N-метилизобутирамид,
2-(3,5-бис(трифторметил)фенил)-N-[2-(2-диметиламиноэтокси)-4-(4-фторфенокси)пиримидин-5-ил]-N-метилизобутирамид,
2-(3,5-бис(трифторметил)фенил)-N-[2-(3-диметиламинопропокси)-4-(4-фторфенокси)пиримидин-5-ил]-N-метилизобутирамид,
2-(3,5-бис(трифторметил)фенил)-N-[2-(2-диметиламиноэтокси)-4-(2-хлорфенокси)пиримидин-5-ил]-N-метилизобутирамид или
2-(3,5-бис(трифторметил)фенил)-N-[2-(3-диметиламинопропокси)-4-(2-хлорфенокси)пиримидин-5-ил]-N-метилизобутирамид.
Представленные соединения формулы I и их фармацевтически приемлемые соли могут быть получены способами, известными в данной области, например способами, описанными ниже, такой способ включает
а) взаимодействие соединения формулы
с соединением формулы
для получения соединения формулы
где Y, R1, R2, R3, R3', R4, R и m имеют приведенные выше значения, или
б) взаимодействие соединения формулы
с соединением формулы
для получения соединения формулы
где Y, R1, R2, R3, R3', R4, R и m имеют приведенные выше значения, или
в) заимодействие соединения формулы
с соединением формулы
для получения соединения формулы
где hal означает Cl, Br или I и Y, R1, R2, R3, R3', R4, R и m имеют приведенные выше значения, или
г) заимодействие соединения формулы
с соединением формулы
для получения соединения формулы
где Y, R1, R2, R3, R3', R4, R и m имеют приведенные выше значения, или
д) алкилирование соединения формулы
или
в соединение формулы
или
где Y, R1, R2, R3, R3', R4, R и m имеют приведенные выше значения, или
е) превращение соединения формулы
в соединение формулы
где X, Y, R1, R2, R3, R3', R4 и m имеют приведенные выше значения, или
ж) взаимодействие соединения формулы
с соответствующим циклическим или нециклическим амином для получения соединения формулы
или с соответствующим спиртом для получения соединения формулы
где Y, X, R1, R2, R3, R3', R4 и m имеют приведенные выше значения, А означает -N(R)-(CH2)n-N(R)2, -N(R)2 или циклический третичный амин формулы
В означает низший алкоксил, -O-(CH2)n-N(R)2 или
и R5 является таким, как описано выше, или
з) модификацию одного или нескольких заместителей R1, R2, R3, R3', R4 или R в рамках приведенных выше обозначений, и
если желательно, превращение полученного соединения в фармацевтически приемлемую кислотно-аддитивную соль.
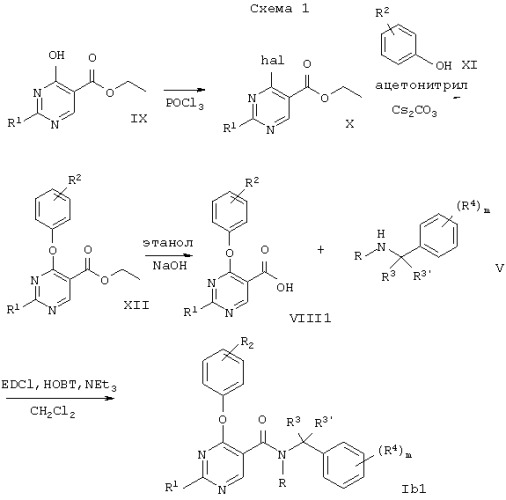
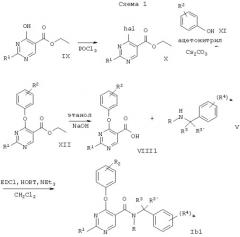
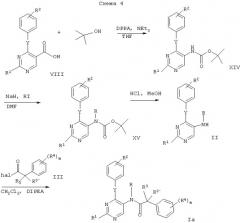
В соответствии с вариантом а) способа прибавляют N-этилдиизопропиламин (DIPEA) к смеси соединения формулы II и соединения формулы III в дихлорметане и смесь перемешивают при температуре в диапазоне 25-40°С. Желаемое соединение формулы Ia выделяют после очистки с высокими выходами.
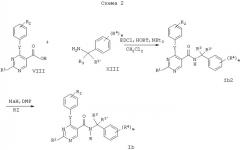
В варианте б) способа описывается реакция соединения формулы IV с соединением формулы V для получения соединения формулы Ib. Реакцию проводят обычным способом, например, в растворителе, подобном толуолу, в присутствии триэтиламина. Смесь кипятят с обратным холодильником около 1 часа.
В соответствии с вариантом в) способа получают соединение формулы Ib. Эту реакцию осуществляют с N-этилдиизопропиламином, который прибавляют к смеси соединения формулы VI и соединения формулы VII в дихлорметане.
Другой способ получения соединения формулы Ib описывается в варианте г) способа. Соединение формулы VIII обрабатывают общепринятым способом соединением формулы V в присутствии 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI) и гидрата 1-гидроксибензотриазола (НОВТ), и триэтиламина.
Соединения формул Ia или Ib могут быть получены при алкилировании -NH-связующей группы соответствующим низшим алкилиодидом обычным способом в присутствии гидрида натрия в диметилформамиде (ДМФА) согласно варианту д) способа.
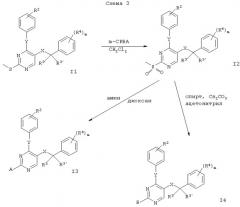
Согласно варианту е) способа соединение формулы I-1 обрабатывают м-хлорнадбензойной кислотой (m-СРВА) в дихлорметане для получения соединения формулы I-2. Кроме того, это соединение может быть затем обработано соответствующим циклическим амином, как, например, морфолин, пиперазин или метилпиперазин, для получения соответствующего соединения формулы I-3 или соответствующим спиртом, как, например, 2-диметиламиноэтанол или N-(2-гидроксиэтил)морфолин, для получения соответствующего соединения формулы I-4 согласно варианту ж) способа.
Образование солей осуществляется при комнатной температуре в соответствии со способами, которые известны сами по себе и которые знакомы любому специалисту в данной области. Рассматриваются не только соли с неорганическими кислотами, но также соли с органическими кислотами. Примерами таких солей являются гидрохлориды, гидробромиды, сульфаты, нитраты, цитраты, ацетаты, малеаты, соли янтарной кислоты, соли метансульфокислоты, п-толуолсульфокислоты и им подобные.
Приведенные ниже схемы 1-4 описывают способы получения соединений формулы I более подробно. Исходными веществами являются известные соединения или они могут быть получены согласно известным в данной области способам.
В схемах использованы следующие сокращения:
DIPEAN-этилдиизопропиламин
EDCI-1-(3-диметиламинопропил)-3-этилкарбодиимид
НОВТ-гидрат 1-гидроксибензотриазола
DMF-диметилформамид (ДМФА)
m-СРВА-м-хлорнадбензойная кислота
DPPA-дифенилфосфорилазид
R1, R2, R3, R3' и R4 имеют приведенные выше значения и R является низшим алкилом.
R1, R2, R3, R3', R4 иY имеют приведенные выше значения и R является низшим алкилом.
R2, R3, R3', R4, X, Y и m имеют приведенные выше значения, А означает -N(R)-(CH2)n-N(R)2, -N(R)2 или циклический третичный амин формулы
В означает низший алкоксил, -O-(CH2)n-N(R)2 или
и R5 является таким, как описано выше.
R, R1, R2, R3, R3', R4, Y и m имеют приведенные выше значения.
Как указывалось ранее, соединения формулы I и их фармацевтически используемые аддитивные соли обладают ценными фармакологическими свойствами. Было обнаружено, что соединения по настоящему изобретению являются антагонистами рецептора нейрокинина-1 (NK-1, вещество Р).
Соединения подвергались исследованиям в соответствии с приведенными ниже тестами.
Сродство исследуемых соединений к рецептору NK-1 оценивали на рецепторах человеческого NK-1 в клетках яичника китайского хомячка, инфицированных рецептором человеческого NK-1 (при использовании системы экспрессии вируса Semliki) и радиоактивно меченных [3Н]веществом Р (конечная концентрация 0,6 нМ). Опыты по связыванию проводили в буфере HEPES (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота) (50 мМ, рН 7,4), содержащем бычий сывороточный альбумин (БСА) (0,04%), лейпептин (8 мкг/мл), MnCI2 (3 мМ) и фосфорамидон (2 мкМ). Пробы для изучения связывания состояли из 250 мкл суспезии мембраны (1,25×105 клеток/пробирка для анализа), 0,125 мкл буфера с замещающим агентом и 125 мкл [3H]вещества Р. Кривые замещения строили при, как минимум, семи концентрациях соединения. Пробирки с пробами инкубировали 60 минут при комнатной температуре, после чего содержимое пробирок быстро фильтровали под вакуумом через GF/C-фильтры, предварительно вымоченные в течение 60 минут с полиэтиленимином (0,3%) с промывками (2х2 мл) буфером HEPES (50 мМ, рН 7,4). Удерживающуюся на фильтрах радиоактивность измеряли с помощью сцинтилляционного счетчика. Все анализы трижды повторялись в, как минимум, двух различных экспериментах.
Сродство к рецептору NK-1, выраженное как рКi (отрицательный логарифм константы ингибирования), находится для описанных соединений в пределах 6,00-9,38.
Примеры значений pKi для таких соединений приведены в таблице.
| Пример № | pKi |
| 1 | 7,38 |
| 4 | 8,54 |
| 7 | 8,33 |
| 11 | 6,77 |
| 15 | 7,55 |
| 19 | 6,71 |
| 23 | 7,01 |
| 29 | 6,50 |
| 39 | 7,79 |
| 44 | 7.70 |
| 49 | 9,04 |
| 52 | 9,10 |
| 63 | 8,02 |
| 73 | 7,49 |
Соединения формулы I, а также их фармацевтически приемлемые кислотно-аддитивные соли могут быть использованы в качестве лекарственных средств, например, в виде фармацевтических препаратов. Фармацевтические препараты могут быть применены перорально, например, в виде таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Введение препаратов может быть, однако, осуществлено через прямую кишку, например, в виде суппозиториев или парентерально, например, в виде инъекционных растворов.
Соединения формулы I и их фармацевтически приемлемые кислотно-аддитивные соли могут быть подвергнуты обработке вместе с фармацевтически инертными неорганическими или органическими наполнителями для приготовления таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. Лактоза, кукурузный крахмал или их производные, тальк, стеариновая кислота или ее соли и т.д. могут быть применены в качестве таких наполнителей, например, для таблеток, драже и твердых желатиновых капсул.
Подходящими наполнителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.д.
Подходящими наполнителями для приготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.д.
Подходящими наполнителями для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.д.
Подходящими наполнителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.д.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие средства, эмульгаторы, подсластители, красители, корригенты, соли для изменения осмотического давления, буферы, маскировочные средства или антиоксид анты. Они также могут содержать еще другие терапевтически ценные вещества.
Дозировка может варьироваться в широких пределах и, конечно, будет соответствовать индивидуальным требованиям в каждом отдельном случае. Обычно в случае перорального введения дневная доза примерно от 10 до 1000 мг на человека соединения общей формулы I должна быть подходящей, хотя в случае необходимости верхний предел может быть также превышен.
Следующие примеры иллюстрируют настоящее изобретение, не ограничивая его. Все температуры приведены в градусах по Цельсию.
Пример 1
(3,5-Бис(трифторметил)бензил)метиламид 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты
а) Этиловый эфир 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты
К раствору 5,40 г (23,31 ммоля) этилового эфира 4-хлор-2-метилсульфанилпиримидин-5-карбоновой кислоты в 150 мл ацетонитрила прибавляли 3,26 г (30,17 ммолей) о-крезола и 30,25 г (92,83 ммоля) Cs2СО3 и реакционную смесь перемешивали 14 часов при комнатной температуре. Суспензию выливали в смесь льда и воды и дважды экстрагировали хлористым метиленом. Объединенные органические фазы сушили (сульфатом натрия), фильтровали и упаривали, получали 7,0 г (99%) этилового эфира 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты, который непосредственно использовали на следующей стадии.
б) 2-Метилсульфанил-4-о-толилоксипиримидин-5-кар6оновая кислота
К раствору 7,0 г (23,0 ммоля) этилового эфира 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты в 50 мл этанола прибавляли раствор 1,37 г (34,50 ммоля) гидроокиси натрия в 30 мл воды и полученную в результате смесь перемешивали 1 час при комнатной температуре. Доводили рН раствора до 1 с помощью 25%-ной соляной кислоты. Смесь дважды экстрагировали хлористым метиленом. Объединенные органические фазы сушили (сульфатом натрия), фильтровали и упаривали. Полученное в результате твердое вещество дважды растирали с 10 мл диизопропилового эфира, отфильтровывали и сушили, получали 3,00 г (47%) 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты в виде бесцветного твердого вещества, масс-спектр (МС) при ионизации электронным распылением с образованием отрицательных ионов (ISN): 257,1 (М-Н)-.
в) (3,5-Бис(трифторметил)бензил)метиламид 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты
К раствору 1,0 г (3,62 ммоля) 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты в 60 мл хлористого метилена прибавляли 1,0 мл (7,24 ммолей) триэтиламина, 0,554 г (3,62 ммоля) 1-гидроксибензотриазола и 0,69 г (3,62 ммоля) гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида, 1,11 г (4,34 ммоля) (3,5-бис(трифторметил)бензил)метиламина. Реакционную смесь перемешивали 16 часов. Реакционную смесь разбавляли 20 мл хлористого метилена, промывали 50 мл 0,5 н. соляной кислоты и 50 мл воды. Водные слои подвергали обратному экстрагированию 50 мл хлористого метилена. Объединенные органические слои сушили (MgSO4), фильтровали и упаривали. Остаток очищали с помощью хроматографии (SiO2, CH2Cl2/MeOH 40:1), получали 1,80 г (96%) (3,5-бис(трифторметил)бензил)метиламида 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты в виде бесцветного пенообразного вещества, МС с ионизацией электронным ударом (EI): 515 (М+).
Пример 2
(3,5-Бис(трифторметил)бензил)метиламид 2-метансульфонил-4-о-толилоксипиримидин-5-карбоновой кислоты
К раствору 1,70 г (3,30 ммоля) (3,5-бис(трифторметил)бензил)метиламида 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты в 70 мл хлористого метилена прибавляли при 5°С 2,03 г (8,24 ммолей) 3-хлорнадбензойной кислоты (70%) и реакционную смесь перемешивали 2 часа при комнатной температуре. После прибавления 150 мл насыщенного раствора бикарбоната натрия слои разделяли, органическую фазу промывали насыщенным раствором бикарбоната натрия, сушили (сульфатом натрия), фильтровали и упаривали. Остаток очищали с помощью хроматографии (SiO2, СН2Cl2/этилацетат 9:1), получали 1,50 г (83%) (3,5-бис-(трифторметил)бензил)метиламида 2-метансульфонил-4-о-толилоксипиримидин-5-карбоновой кислоты в виде бесцветного твердого вещества, МС при ионизации электронным распылением с образованием положительных ионов (ISP): 548,1 (М+Н)+.
Пример 3
(3,5-Бис(трифторметил)бензил)метиламид 2-морфолин-4-ил-4-о-толилоксипиримидин-5-карбоновой кислоты
К раствору 0,2 г (0,37 ммоля) (3,5-бис(трифторметил)бензил)метиламида 2-метансульфонил-4-о-толилоксипиримидин-5-карбоновой кислоты в 10 мл диоксана прибавляли 0,08 мл (0,91 ммоля) морфолина. Реакционную смесь перемешивали 16 часов. После выпаривания растворителя остаток распределяли между 50 мл хлористого метилена и 50 мл воды. Водный слой экстрагировали 50 мл хлористого метилена, объединенные органические слои сушили (сульфатом магния), фильтровали и упаривали. Остаток очищали с помощью хроматографии (SiO2, CH2Cl2/MeOH 40:1), получали 0,18 г (88%) (3,5-бис(трифторметил)бензил)метиламида 2-морфолин-4-ил-4-о-толилоксипиримидин-5-карбоновой кислоты в виде бесцветного масла, МС (ISP): 555,2 (М+Н)+.
Пример 4
(3,5-Бис(трифторметил)бензил)метиламид 2-(4-метилпиперазин-1-ил)-4-о-толилоксипиримидин-5-карбоновой кислоты
К раствору 0,25 г (0,46 ммоля) (3,5-бис(трифторметил)бензил)метиламида 2-метансульфонил-4-о-толилоксипиримидин-5-карбоновой кислоты в 10 мл диоксана прибавляли 0,12 мл (1,14 ммоля) 1-метилпиперазина. Реакционную смесь перемешивали 16 часов. После выпаривания растворителя остаток распределяли между 50 мл хлористого метилена и 50 мл воды. Водный слой экстрагировали 50 мл хлористого метилена, объединенные органические слои сушили (сульфатом магния), фильтровали и упаривали. Остаток очищали с помощью хроматографии (SiO2, CH2Cl2/МеОН/NH4ОН 140:10:1), получали 0,2 г (77%) (3,5-бис(трифторметил)бензил)метиламида 2-(4-метилпиперазин-1-ил)-4-о-толилоксипиримидин-5-карбоновой кислоты в виде бесцветного пенообразного вещества, МС (ISP): 563,3 (М+Н)+.
Пример 5
(3,5-Бис(трифторметил)бензил)метиламид 2-пиперазин-1-ил-4-о-толилоксипиримидин-5-карбоновой кислоты
К раствору 0,32 г (0,58 ммоля) (3,5-бис(трифторметил)бензил)метиламида 2-метансульфонил-4-о-толилоксипиримидин-5-карбоновой кислоты в 10 мл диоксана прибавляли 0,125 г (1,46 ммоля) пиперазина. Реакционную смесь перемешивали 16 часов. После выпаривания растворителя остаток распределяли между 50 мл хлористого метилена и 50 мл воды. Водный слой экстрагировали 50 мл хлористого метилена, объединенные органические слои сушили (сульфатом магния), фильтровали и упаривали. Остаток очищали с помощью хроматографии (SiO2, CH2Cl2/MeOH/NH4OH 110:10:1), получали 0,25 г (77%) (3,5-бис(трифторметил)бензил)метиламида 2-пиперазин-1-ил-4-о-толилоксипиримидин-5-карбоновой кислоты в виде бесцветного пенообразного вещества, МС (ISP): 554,2 (M+Н)+.
Пример 6
(3,5-Бис(трифторметил)бензил)метиламид 2-(2-диметиламиноэтиламино)-4-о-толилоксипиримидин-5-карбоновой кислоты
К раствору 0,25 г (0,46 ммоля) (3,5-бис(трифторметил)бензил)метиламида 2-метансульфонил-4-о-толилоксипиримидин-5-карбоновой кислоты в 10 мл диоксана прибавляли 0,125 мл (1,14 ммоля) 2-диметиламиноэтиламина. Реакционную смесь перемешивали 16 часов. После выпаривания растворителя остаток распределяли между 50 мл хлористого метилена и 50 мл воды. Водный слой экстрагировали 50 мл хлористого метилена, объединенные органические слои сушили (сульфатом магния), фильтровали и упаривали. Остаток очищали с помощью хроматографии (SiO2, CH2Cl2/МеОН/NH4ОН 140:10:1), получали 0,15 г (59%) (3,5-бис(трифторметил)бензил)метиламида 2-(2-диметиламиноэтиламино)-4-о-толилоксипиримидин-5-карбоновой кислоты в виде бесцветного пенообразного вещества, МС (ISP): 556,2 (М+Н)+.
Пример 7
(3,5-Бис(трифторметил)бензил)метиламид 2-(2-морфолин-4-илэтокси)-4-о-толилоксипиримидин-5-карбоновой кислоты
К раствору 0,2 г (0,37 ммоля) (3,5-бис(трифторметил)бензил)метиламида 2-метансульфонил-4-о-толилоксипиримидин-5-карбоновой кислоты в 10 мл ацетонитрила прибавляли 0,066 мл (0,55 ммоля) N-(2-гидроксиэтил)морфолина и 0,595 г (1,83 ммоля) Cs2СО3. Реакционную смесь перемешивали 16 часов. После выпаривания растворителя остаток распределяли между 50 мл хлористого метилена и 50 мл воды. Водный слой экстрагировали 50 мл хлористого метилена, объединенные органические слои сушили (сульфатом магния), фильтровали и упаривали. Остаток очищали с помощью хроматографии (SiO2, CH2Cl2/MeOH/NH4OH 140:10:1), получали 0,12 г (54%) (3,5-бис(трифторметил)бензил)метиламида 2-(2-морфолин-4-илэтокси)-4-о-толилоксипиримидин-5-карбоновой кислоты в виде бесцветного пенообразного вещества, МС (ISP): 599,1 (М+Н)+.
Пример 8
(3,5-Бис(трифторметил)бензил)метиламид 2-(2-диметиламиноэтокси)-4-о-толилоксипиримидин-5-карбоновой кислоты
К раствору 0,25 г (0,46 ммоля) (3,5-бис(трифторметил)бензил)метиламида 2-метансульфонил-4-о-толилоксипиримидин-5-карбоновой кислоты в 10 мл ацетонитрила прибавляли 0,069 мл (0,68 ммоля) 2-диметиламиноэтанола и 0,743 г (2,28 ммоля) Cs2CO3. Реакционную смесь перемешивали 16 часов. После выпаривания растворителя остаток распределяли между 50 мл хлористого метилена и 50 мл воды. Водный слой экстрагировали 50 мл хлористого метилена, объединенные органические слои сушили (сульфатом магния), фильтровали и упаривали. Остаток очищали с помощью хроматографии (SiO2, CH2Cl2/MeOH/NH4OH 140:10:1), получали 0,15 г (59%) (3,5-бис(трифторметил)бензил)метиламида 2-(2-диметиламиноэтокси)-4-о-толилоксипиримидин-5-карбоновой кислоты в виде масла светло-желтого цвета, МС (ISP): 557,3 (М+Н)+.
Пример 9
(3,5-Диметоксибензил)метиламид 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты
Способом, аналогичным описанному в примере 1в), из 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты и (3,5-диметоксибензил)метиламина получали (3,5-диметоксибензил)метиламид 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты в виде бесцветного масла, МС (EI): 439,1 (М+).
Пример 10
(3,5-Диметоксибензил)метиламид 2-метансульфонил-4-о-толилоксипиримидин-5-карбоновой кислоты
Способом, аналогичным описанному в примере 2, из (3,5-диметоксибензил)метиламида 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты и 3-хлорнадбензойной кислоты получали (3,5-диметоксибензил)метиламид 2-метансульфонил-4-о-толилоксипиримидин-5-карбоновой кислоты в виде бесцветного пенообразного вещества, МС (ISP): 472,1 (М+H)+.
Пример 11
(3,5-Диметоксибензил)метиламид 2-(4-метилпиперазин-1-ил)-4-о-толилоксипиримидин-5-карбоновой кислоты
Способом, аналогичным описанному в примере 4, из (3,5-диметоксибензил)метиламида 2-метансульфонил-4-о-толилоксипиримидин-5-карбоновой кислоты и 1-метилпиперазина получали (3,5-диметоксибензил)метиламид 2-(4-метилпиперазин-1-ил)-4-о-толилоксипиримидин-5-карбоновой кислоты в виде бесцветного пенообразного вещества, МС (ISP): 492,3 (М+Н)+.
Пример 12
(3,5-Диметоксибензил)метиламид 2-(2-диметиламиноэтокси)-4-о-толилоксипиримидин-5-карбоновой кислоты
Способом, аналогичным описанному в примере 8, из (3,5-диметоксибензил)метиламида 2-метансульфонил-4-о-толилоксипиримидин-5-карбоновой кислоты и 2-диметиламиноэтанола получали (3,5-диметоксибензил)метиламид 2-(2-диметиламиноэтокси)-4-о-толилоксипиримидин-5-карбоновой кислоты в виде бесцветного масла, МС (ISP): 481,4 (M+H)+.
Пример 13
(3,5-Диметилбензил)метиламид 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты
Способом, аналогичным описанному в примере 1в), из 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты и (3,5-диметилбензил)метиламина получали (3,5-диметилбензил)метиламид 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты в виде бесцветного масла, МС (ISP): 408,3 (М+Н)+.
Пример 14
(3,5-Диметилбензил)метиламид 2-метансульфонил-4-о-толилоксипиримидин-5-карбоновой кислоты
Способом, аналогичным описанному в примере 2, из (3,5-диметилбензил)метиламида 2-метилсульфанил-4-о-толилоксипиримидин-5-карбоновой кислоты и 3-хлорнадбензойной кислоты получали (3,5-диметилбензил)метиламид 2-метансульфонил-4-о-толилоксипиримидин-5-карбоновой кислоты в виде бесцветного пенообразного вещества, МС (ISP): 440,4 (М+Н)+.
Пример 15
(3,5-Диметилбензил)метиламид 2-(4-метилпиперазин-1-ил)-4-о-толилоксипиримидин-5-карбоновой кислоты
Способом, аналогичным описанному в примере 4, из (3,5-диметилбензил)метиламида 2-метансульфонил-4-о-толилоксипиримидин-5-карбоновой кислоты и 1-метилпиперазина получали (3,5-диметилбензил)метиламид 2-(4-метилпиперазин-1-ил)-4-о-толилоксипиримидин-5-карбоновой кислоты в виде пенообразного вещества белого цвета, МС (ISP): 460,5 (М+Н)+.
Прим