Фармацевтическая композиция с пролонгированным высвобождением, независимым от ионной силы
Иллюстрации
Показать всеИзобретение относится к медицине и описывает фармацевтическую композицию гидрофильной гельобразующей матрицы, содержащую одно или более активных веществ и имеющую пролонгированное высвобождение указанного одного или более активных веществ при воздействии жидкостей желудочно-кишечного тракта, отличающуюся тем, что указанная фармацевтическая композиция содержит гидроксипропилметилцеллюлозу (ГПМЦ) высокой или средней вязкости и гидроксиэтилцеллюлозу (ГЭЦ) высокой или средней вязкости в соотношении ГПМЦ/ГЭЦ=1/0,85-1/1,2 и необязательно ГПМЦ низкой вязкости в соотношении ГПМЦ высокой или средней вязкости/ГПМЦ низкой вязкости=1/0,01-1/0,2. Данная композиция по существу не зависит от ионной силы растворяющей среды, характерной как норма для жидкости в желудочно-кишечном тракте, даже когда композиция не содержит покрывающей оболочки. 2 н. и 10 з.п. ф-лы, 4 табл.
Реферат
Настоящее изобретение относится к фармацевтической композиции с по существу пролонгированным характером высвобождения, который не зависит от ионной силы растворяющей среды, например жидкости желудочно-кишечного тракта. Пролонгированное высвобождение достигается в течение периода времени до 16 часов. Дозированная форма объединяет одно или более активных веществ со смесью носителей на основе гидрофильных полимеров, что приводят к получению композиции с гелеобразующим матриксом.
Гидрофильные композиции с гелеобразующим матриксом представляют собой хорошо известные дозированные формы для контроля профиля растворения активных веществ. Механизм, посредством которого высвобождается активное вещество, запускается с момента гидратации поверхности дозированной формы с образованием гелевой структуры. Одновременно активное вещество на поверхности композиции растворяется в растворяющей среде. В стационарной фазе растворяющая среда непрерывно проникает в гелевую структуру и гель расширяется. Активное вещество растворяется в растворяющей среде и переходит на внешний слой геля. При этом происходит эрозия внешних слоев геля. В конце уровни высвобождения падают, вызванные сниженным концентрационным градиентом активного вещества в композиции и проникшей растворяющей средой. Указанный механизм описан в уровне техники (например, Manford Robinson, The Theory of Practice of Industrial Pharmacy, 2nd edition. Chapter 14: "Sustained Action Dosage Forms").
Гидрофильные полимеры, используемые в описанных выше композициях, представляют собой по большей части полисахаридные носители, такие как производные целлюлозы - гидроксипропилметилцеллюлозу (ГПМЦ), гидроксипропилцеллюлозу (ГПЦ), гидроксиэтилцеллюлозу (ГЭЦ), натрийкарбоксиметилцеллюлозу (Na-КМЦ) или сочетания указанных производных целлюлозы.
Композиции указанного типа описаны в различных патентах и заявках на патент, например, в документах US 4871548 и ЕР-А-0923934.
В US 4871548 раскрывается дозированная форма с контролируемым высвобождением, включающая активное соединение и смесь, по меньшей мере, простого эфира целлюлозы с низкой вязкостью и простого эфира целлюлозы с высокой вязкостью. В ЕР-А-0923934 раскрывается композиция цефактора и цефалексина на основе матрицы с модифицированным высвобождением, включающая 5-35% смеси гидрофильных полимеров различной природы, причем указанные гидрофильные полимеры включают от примерно 0,1 мас.% до примерно 20 мас.% гидроксипропилметилцеллюлозы со средней вязкостью и от примерно 0,1 мас.% до примерно 20 мас.% гидроксипропилцеллюлозы с низкой вязкостью.
Хотя указанные выше композиции описаны в целом как композиции с пролонгированным высвобождением, указанное пролонгированное высвобождение имеет место лишь тогда, когда концентрация солей, ионная сила, в растворяющей среде является низкой. Скорость высвобождения активного вещества из указанной выше композиции может по существу зависеть от ионной силы. Высокая ионная сила может даже приводить к так называемому демпингу дозы. В таком случае все количество активного вещества высвобождается в очень короткое время, что может приводить к нежелательным и даже опасным высоким уровням активного вещества в крови. Высокая ионная сила зачастую возникает сразу после принятия пищи. Поскольку пациенты часто проводят лечение сразу после приема пищи, имеется высокий риск того, что композиции, зависимые от ионной силы, могу привести к нежелательно быстрому высвобождению активного вещества вместо требуемого пролонгированного высвобождения.
В WO 98/47491 описана композиция с пролонгированным высвобождением, в которой контроль высвобождения активного вещества основан на сочетании двух так называемых "мягких" полимеров, имеющих противоположные характеристики смачиваемости, так что один демонстрирует более сильную тенденцию в сторону гидрофобности, тогда как другой демонстрирует более сильную тенденцию в сторону гидрофильности. В указанной композиции демпинг дозы может быть предотвращен только посредством нанесения энтеросолюбильного покрытия.
Целью настоящего изобретения является создание композиции с пролонгированным высвобождением, которая по существу не зависит от ионной силы растворяющей среды, характерной как норма для жидкости в желудочно-кишечном тракте, даже когда композиция не содержит покрывающей оболочки. Для специалистов в данной области техники очевидно, что композиция должна также удовлетворять существующим физическим и фармацевтическим требованиям в данной области, таким как хорошие свойства текучести порошка в процессе таблетирования, прочность на раздавливание прессованных таблеток, составляющая, по меньшей мере, 30 Н, разрушения ниже 1% при сжимающем усилии от 10 до 40 кН, равномерность содержимого и достаточная стабильность. Кроме того, необходимо, чтобы композиция могла быть получена с использованием обычных процедур изготовления композиции и соответствующего оборудования так, чтобы не требовалось крупных капиталовложений.
Указанная цель может быть достигнута согласно настоящему изобретению за счет создания фармацевтической композиции гидрофильной гелеобразующей матрицы, имеющей пролонгированный профиль высвобождения одного или более активных веществ при воздействии жидкостей желудочно-кишечного тракта, причем указанное высвобождение является по существу независимым от ионной силы.
Пролонгированное высвобождение определяется как (постепенное) высвобождение активного вещества из дозированной формы в течение 45 минут или более. Указанный период начинается обычно с момента введения дозированной формы или от начала теста на растворение in vitro (с момента введения дозированной формы в растворяющую среду).
Под термином "по существу независимый от ионной силы" следует понимать, что профиль скорости высвобождения активного вещества меняется незначительно (согласно определению, данному в Основной Главе 711 Фармакопеи США (General Chapter 711: Physical Tests and Determinations in USP 24 (±10% от заявленной на этикетке величины))), когда ионная сила (I) варьирует от 0,05 до 0,45 моль/л. Ионная сила (I) определяется по формуле I=1/2∑i 2, где с обозначает концентрацию различных ионов в растворе, и zi -соответствующие им величины зарядов (Handbook of Chemistry and Physics 71st edition, David R. Lide ed., page 2-18, Boston, CRC Press Inc., 1990-1991).
Хотя для достижения независимости от ионной силы нанесение покрытия является несущественным, композицию необязательно покрывают материалом покрытия с целью достижения другого желательного эффекта, такого как маскировка вкуса или придание цвета. Подходящие материалы покрытия известны в данной области и включают, например, ГПМЦ, акриловые материалы, этилцеллюлозу (см., например, Graham Cole ed., Pharmaceutical Coating Technology, London, Taylor & Francis Ltd., 1995).
Гидрофильная гельобразующая матрица имеет форму таблеток или лекарственную форму в виде множества частиц и предпочтительно включает смесь, по меньшей мере, двух гидрофильных простых эфиров целлюлозы с высокой вязкостью. Хотя присутствие гидрофильного простого эфира целлюлозы, такого как этилцеллюлоза, обычно не будет оказывать вредного эффекта на высвобождающие свойства настоящей композиции, предпочтительно не содержится значительных количеств указанного гидрофобного простого эфира целлюлозы. При этом под "значительным количеством гидрофобного простого эфира целлюлозы" следует понимать количество, большее, чем 20% от общего веса гель-образующих полимеров.
Простые эфиры целлюлозы известны в технике и доступны в виде соединений фармацевтической степени чистоты и с различными средними значениями молекулярных масс, что приводит к различным уровням вязкости растворов таких целлюлозных эфиров. Для целей настоящей патентной заявки гидрофильные полимеры могут быть охарактеризованы по величине их вязкости в 2 мас.% водном растворе как соединения с низкой вязкостью (менее чем примерно 1000 мПа·с, средней вязкости (от примерно 1000 мПа·с до примерно 10000 мПа·с) и с высокой вязкостью (более, чем примерно 10000 мПа·с).
Гидрофильные полимеры гидроксипропилметилцеллюлозы (ГПМЦ), которые могут использоваться согласно настоящему изобретению, доступны с различными значениями вязкости от компании Dow Chemical Co. под торговыми марками Methocel® и от компании Shin Etsu под торговой маркой Metolose®.
Примерами полимеров с низкой вязкостью являются Methocel Е5®, Methocel E-15LV®, Methocel E50LV®, Methocel K100LV® и Methocel F50LV®, для которых 2% водные растворы при 25°С имеют вязкости 5, 15, 50, 100 и 500 мПа·с соответственно.
Примерами ГПМЦ со средней вязкостью являются Methocel E4M® и Methocel K4M, 2% водные растворы которых при 25°С имеют вязкость, равную 4000 мПа·с.
Примерами ГПМЦ с высокой вязкостью являются Methocel K15M® и Methocel K100M®, 2% водные растворы которых при 25°С имеют вязкости, равные 15000 мПа·с и 100000 мПа·с.
Гидрофильные гидроксиэтилцеллюлозные полимеры (ГЭЦ), которые могут использоваться согласно настоящему изобретению, доступны в виде продуктов с различной вязкостью от компании AQUALON под торговой маркой Natrosol® и от компании Amerchol Corporation под торговой маркой Cellosize®.
Примерами полимеров с низкой вязкостью являются Natrosol L® и Natrosol J®, для которых 2% водные растворы при 25°C имеют вязкости 10 мПа·с и 20 мПа·с соответственно.
Примерами полимеров со средней вязкостью являются Natrosol G® и Natrosol К®, 2% водные растворы которых при 25°С имеют значения вязкости, равные 200 мПа·с и 1500 мПа·с соответственно.
Примерами полимеров с высокой вязкостью являются Natrosol М® и Natrosol HH®, 2% водные растворы которых при 25°С имеют вязкости, равные 4000 мПа·с и 90000 мПа·с соответственно.
В предпочтительном варианте осуществления настоящего изобретения композиция содержит смесь гидроксипропилметилцеллюлозы (ГПМЦ) высокой или средней вязкости и гидроксиэтилцеллюлозы (ГЭЦ) высокой или средней вязкости. Соотношение между ГПМЦ высокой или средней вязкости и ГЭЦ высокой или средней вязкости составляет от 1:0,85 до 1:1,2, предпочтительно от 1:0,9 до 1:1,1, еще более предпочтительно от 1:0,95 до 1:1,05 и, наиболее предпочтительно, составляет 1:1. Композиция необязательно может содержать ГПМЦ низкой вязкости. В указанном случае соотношение между ГПМЦ высокой или средней вязкости и ГПМЦ низкой вязкости находится в диапазоне от 1:0,01 до 1:0,2 и предпочтительно в диапазоне от 1:0,01 до 1:0,1 и еще более предпочтительно в диапазоне от 1:0,02 до 1:0,05.
Неожиданно было обнаружено, что композиции, имеющие указанный выше состав, могут использоваться для изготовления таблеток, которые демонстрируют скорость высвобождения, независимую от ионной силы в диапазоне значений, характерных для жидкостей желудочно-кишечного тракта. Указанный нормальный диапазон составляет от 0,17 до 0,35 моль/л.
Кроме независимости от ионной силы принцип контроля высвобождения настоящей композиции является также по существу независимым от рН в диапазоне значений от рН 1,3 до рН 7,4. Это означает, что на скорость высвобождения активного вещества не влияет рН в тех случаях, когда высвобождение активного вещества не ограничено растворимостью активного вещества, т.е. разница в значениях уровня высвобождения (в %) в данный момент времени меньше 20% от заявленного на этикетке значения (см. Chapter Dissolution Specifications (page 1080-81) in FIP Guidelines for Dissolution Testing of Solid Oral Products (Final Draft, 1995), Drug Information Journal 1996, Vol 30,1071-84) в общем диапазоне значений рН от 1,3 до 7,4.
Композиция согласно настоящему изобретению из-за ее оптимальных свойств, как композиции с пролонгированным высвобождением может использоваться при лечении большой группы заболеваний, в тех случаях, когда желательны свойства пролонгированного высвобождения. Примерами активных веществ, которые могут использоваться для составления композиции с пролонгированным высвобождением, являются активные вещества, которые применяются при лечении болезней ЦНС, включая шизофрению, эпизодические приступы страха (ЭПС), такие как обсессивно-компульсивное расстройство (ОКР), посттравматическое стрессовое расстройство (ПТСС), фобии и панические расстройства, большая депрессия, биполярное расстройство, болезнь Паркинсона, общее беспокойство, аутизм, делирий, множественный склероз, болезнь деменция Альцгеймера и другие нейродегенератавные заболевания, тяжелую олигофрению и дискинезию, такие как болезнь Хантингтона или болезнь Туретта, анорексию, булимию, удар, адикция/зависимость/пристрастие, расстройство сна, эпилепсию, мигрень, недостаточность внимания/гиперактивность (НВГ); сердечно-сосудистых заболеваний, включая сердечную недостаточность, стенокардию, аритмии, инфаркт миокарда, гипертрофию сердца, гипотензию, гипертензию, например, эссенциальную гипертензию, почечную гипертензию или легочную гипертензию, тромбоз, артериосклероз, церебральный вазоспазм, субарахноидальную геморрагию, церебральную ишемию, церебральный инфаркт, болезнь периферических сосудов, болезнь Рейно, заболевания почек, например, почечную недостаточность; дислипидемии; ожирения; рвоты; расстройств желудочно-кишечного тракта, включая синдром раздраженной толстой кишки (СРТК), воспаление кишечника (ВК), гастроэзофагеальный рефлюкс (ГЭФР), расстройства перистальтики и состояния, связанные с задержкой опорожнения желудка, такие как послеоперативный или диабетический гастропарез, и диабет, язвы, например, язвы желудка; диареи; других заболеваний, включая гинекологические болезни, остеопороз; воспалений; инфекций, таких как бактериальные, грибковые, протозойные и вирусные инфекции, в частности, инфекции, вызванные ВИЧ-1 или ВИЧ-2; болевого синдрома; рака; повреждений, вызванных химиотерапией; инвазии опухоли; иммунных заболеваний; задержки мочи; астмы; аллергий; артрита, доброкачественной гипертрофии простаты; эндотоксинового шока; сепсиса; осложнения сахарного диабета.
Предпочтительные для введения в состав композиции активные вещества представляют собой такие вещества, которые используются при лечении заболеваний ЦНС, такие как флувоксамин (5-метокси-1-[4-(трифторметил)фенил]-1-пентанон О-(2-аминоэтил)оксим или флезиноксан ((+)-бензамид, N-[2-[4-[(2R)-2,3-дигидро-2-(гидроксиметил)-1,4-бензодиоксин-5-ил]-1-пиперазинил]этил]-4-фтор), при лечении сердечно-сосудистых заболеваний, такие как тедизамил (N,N'-дициклопропилметил-9,9-тетраметилен-3,7-диазабицикло[3.3.1]нонан) или пропанолол или активные вещества, которые используются при лечении гинекологических заболеваний, например, в гормонзаместительной терапии, такие как дидрогестерон, эстрадиол или конъюгированные эстрогены. Настоящее изобретение особенно полезно для составления композиции активного вещества флезиноксана, особенно в виде его моногидрохлорида ((+)-бензамид, N-[2-[4-[(2R)-2,3-дигидро-2-(гидроксиметил)-1,4-бензодиоксин-5-ил]-1-пиперазинил]этил]-4-фтормоногидрохлорида), описанного в ЕР 0138280 и ЕР 307061, а также тедизамила, предпочтительно в виде его сесквифумарата (N,N'-дициклопропилметил-9,9-тетраметилен-3,7-диазабицикло[3.3.1]нонана 1,5-гидрофумарата), описанного в ЕР 0550383.
Настоящее изобретение относится также к способу получения описанной выше композиции, отличающемуся тем, что
(1) ядро прессуют из смеси, содержащей одно или более активных веществ, и смеси, по меньшей мере, двух простых гидрофильных эфиров целлюлозы высокой или средней вязкости, получая по существу независимое от ионной силы и пролонгированное по существу нулевого порядка высвобождение активных веществ; и
(2) необязательно на ядро наносят покрытие.
Ингредиенты: ГПМЦ, ГЭЦ, активное вещество, пигментную смесь и глидант смешивают в подходящем смесителе. Указанную порошковую смесь перемешивают со стеарилфумаратом натрия в подходящем смесителе.
Активные вещества могут быть добавлены в виде предварительного гранулята к порошковой смеси, используемой для прессования. Альтернативно порошковая смесь для таблетирования может быть получена в процессе перемешивания, после чего проводят процедуру (влажного или сухого) гранулирования.
Смесь ингредиентов прессуют в таблетки на коммерчески доступном оборудовании (например, Courtoy® RO) с использованием агентов регулирования текучести, таких как коллоидный кремнезем, и лубрикантов, таких как тальк, стеарилфумарат натрия или стеарат магния. Количество гидрофильных целлюлоз в полной композиции варьирует от 15 до 99,5%, тогда как количество активных веществ варьирует от 0,1 до 80%. Количество агента регулирования текучести и лубриканта фиксируется для улучшения текучих свойств порошка и предотвращения прилипания порошка к стенкам, красителю или штампам. Количество глиданта варьирует от 0,05 до 5% и предпочтительно составляет примерно 0,2%. Количество лубриканта варьирует от 0,05 до 5% и предпочтительно составляет примерно 0,4%. По коммерческим причинам порошковая смесь может быть окрашена смесью пигментов в концентрации от 0,1 до 10%. Типичные пигментные смеси доступны, например, от компании COLORCON® в виде Opadry®.
Все публикации, включая, но не ограничиваясь ими, патенты и заявки на патент, цитированные в настоящем описании, включены в него в качестве ссылки в той мере, в которой каждая отдельная публикация специфически и конкретно указана для включения в полном виде в качестве ссылки.
Приведенные ниже примеры даны лишь для дополнительной иллюстрации изобретения, и следовательно, указанные примеры не следует рассматривать как ограничивающие каким-либо образом объем настоящего изобретения.
Пример 1. Получение композиции, независимой от ионной силы.
Пример 1a. Основная процедура получения
Первый коллоидный кремнезем пропускают через сито. Указанное сито содержит предпочтительно ячейки размером от 0,40 до 0,595 мм. Активное вещество смешивают с гидрофильными целлюлозами, коллоидным кремнеземом, смесью пигментов и при желании маннитом в подходящем смесителе. Указанный смеситель представляет собой предпочтительно смеситель с высоким сдвигом, в котором гранулят находится в отдельном положении. Стеарилфумарат натрия пропускают через сито. Указанное сито содержит предпочтительно ячейки размером от 0,40 до 0,595 мм. Порошковую смесь прессуют в таблетки с желательными параметрами. Оборудование для прессования представляет собой, предпочтительно, вращающееся устройство, подобное оборудованию от компании Korsch and Courtoy. Необязательно таблетки могут быть покрыты водорастворимыми целлюлозами или производными целлюлозы подобно этилцеллюлозе или акрилатам в виде водных суспензий или органических растворов. Процесс нанесения покрытия предпочтительно проводят с использованием перфорированного барабана или по технологии псевдоожиженного слоя.
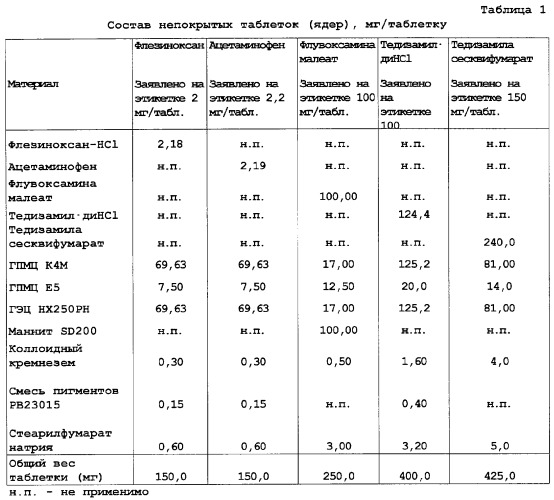
| Таблица 2Свойства нескольких композиций | |||||
| Свойство таблетки | Флезиноксан | Ацетаминофен | Флувоксамина малеат | Тедизамил·диHCl | Тедизамила сесквифумарат |
| Заявлено на этикетке 2 мг/табл. | Заявлено на этикетке 2,2 мг/табл. | Заявлено на этикетке 100 мг/табл. покрыта оболочкой | Заявлено на этикетке 100 мг/табл. | Заявлено на этикетке 150 мг/табл. | |
| Размер таблетки (мм) | 5,5·11,0 мм особой формы | 7,0 мм круглая | 8,0 мм круглая | 8,0·15,0 мм продолговатая | 8,0·15,0 мм продолговатая |
| Вес таблетки (мг) | 150 | 150 | 275 | 400 | 425 |
| Прочность на раздавливание (Н) | 83 | 75 | 144 | 71 | 90 |
| Разрушение (%) | не определяли | не определяли | не определяли | 0,4 | 0,05 |
| Профиль высвобождения | Табл.4 | Табл.4 | Табл.4 | Табл.4 | Табл.4 |
Пример 1b. Свойства ряда композиций по высвобождению
Высвобождение активного вещества из гидрофильной матрицы таблетки измеряют в USP аппарате II с использованием лопастей, вращающихся со скоростью 50 об/мин либо в буферной растворяющей среде USP при рН 6,8 и концентрацией 0,05 моль (М), 0,17 М и 0,34 М, полученных из вторичного кислого фосфата натрия ·2Н2О и лимонной кислоты ·1Н2О (обозначенных кодами F, G и Н соответственно), или в наполовину измененной растворяющей среде, полученной из 0,1 М водного раствора гидрохлорида, в первой части теста (90 мин), и затем 0,2 М при рН 6,8 при корректировке рН фосфатом тринатрия ·12Н2О, во второй части теста. Для увеличения ионной силы водного раствора в ходе теста к указанному раствору добавляют хлорид натрия. 1 литр растворяющей среды в части два содержит следующие количества хлорида натрия: 0 грамм (растворяющая среда А), 10 грамм (растворяющая среда В), 15 грамм (растворяющая среда С), 30 грамм (растворяющая среда D1 и D2) и 50 грамм (растворяющая среда Е1 и Е2) соответственно. В случае растворяющих сред В, С, D1 и Е1 хлорид натрия добавляют только во второй части теста. В случае растворяющих сред D2 и Е2 75% хлорида натрия добавляют в первой части теста и оставшиеся 25% - во второй части теста. Высвобождение активного вещества измеряют в течение 16 часов с интервалами между отбором образцов в один час в ходе первых двух часов и затем с интервалами между отбором образцов в два часа в ходе оставшегося времени тестирования. Образцы могут быть подвергнуты анализу в составе технологической цепочки вместе с системой ВЭЖХ или с помощью УФ спектроскопии. Данные по высвобождению разных активных веществ из композиции приведены в таблицах 4а-4с.
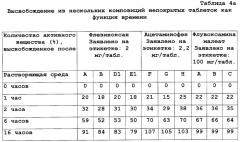
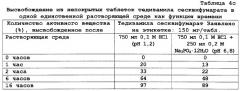
Из приведенных в таблицах 4а-4с данных по высвобождению можно сделать вывод о том, что высвобождение активного вещества из композиции согласно настоящему изобретению по существу не зависит от рН и ионной силы, поскольку разница в уровнях высвобождения меньше 20%. Далее можно сделать вывод об отсутствии существенной разницы по профилю высвобождения между вариантами повышения ионной силы при низком рН (рН 1,2) и при более высоких значениях рН (рН 6,8).
| Таблица 3Сводка данных по растворяющим средам | ||||||||
| Метод растворения | Растворяющая среда | |||||||
| А | В | С | D1 | D2 | Е1 | Е2 | ||
| 1) рН 1,2 | 1,5 часа | 750 мл 0,1 М HCl | ||||||
| добавлен NaCl (г) | 22,5 | 37,5 | ||||||
| 2) рН 6,8 | 14,5 час | 250 мл 0,2 М Na3PO4·12H2O | ||||||
| добавлен NaCl (г) | 0 | 10 | 15 | 30 | 7,5 | 50 | 12,5 | |
| Ионная сила (моль/л) в конечной растворяющей среде | 0,14 | 0,31 | 0,40 | 0,65 | 0,65 | 1,00 | 1,00 |
| Метод растворения | Растворяющая среда | |||
| F | G | Н | ||
| рН 6,8 | Na2HPO4·2Н2О + лимонная кислота ·1Н2О | 0,05 М | 0,17 М | 0,34 М |
| Ионная сила (моль/л) | 0,11 | 0,38 | 0,77 |
| Таблица 4bВысвобождение из нескольких композиций непокрытых таблеток как функция времени | ||||||||
| Количество активного вещества (%), высвобожденное после | Тедизамил·диHCl Заявлено на этикетке: 100 мг/табл. | Тедизамила сесквифумарат Заявлено на этикетке: 150 мг/табл. | ||||||
| Растворяющая среда | А | В | С | А | D1 | D2 | Е1 | Е2 |
| 0 часов | 0 | 0 | 0 | 2 | 0 | 0 | 2 | 0 |
| 1 час | 32 | 32 | 33 | 20 | 18 | 20 | 20 | 21 |
| 2 часа | 50 | 51 | 52 | 32 | 24 | 32 | 32 | 33 |
| 6 часов | 84 | 85 | 84 | 47 | 45 | 49 | 47 | 52 |
| 16 часов | 92 | 94 | 93 | 79 | 75 | 76 | 75 | 81 |
1. Фармацевтическая композиция гидрофильной гельобразующей матрицы, содержащая одно или более активных веществ и имеющая пролонгированное высвобождение указанного одного или более активных веществ при воздействии жидкостей желудочно-кишечного тракта, отличающаяся тем, что указанная фармацевтическая композиция содержит гидроксипропилметилцеллюлозу (ГПМЦ) высокой или средней вязкости и гидроксиэтилцеллюлозу (ГЭЦ) высокой или средней вязкости в соотношении ГПМЦ/ГЭЦ=1/0,85-1/1,2 и необязательно ГПМЦ низкой вязкости в соотношении ГПМЦ высокой или средней вязкости/ГПМЦ низкой вязкости = 1/0,01-1/0,2.
2. Композиция по п.1, отличающаяся тем, что указанная композиция содержит нанесенное на нее покрытие.
3. Композиция по пп.1 и 2, отличающаяся тем, что указанные одно или более активных веществ выбирают из группы, состоящей из активных веществ, применяемых при лечении заболеваний ЦНС, включая шизофрению, эпизодические приступы страха (ЭПС), такие, как обсессивно-компульсивное расстройство (ОКР), посттравматическое стрессовое расстройство (ПТСС), фобии и панические расстройства, большая депрессия, биполярное расстройство, болезнь Паркинсона, общее беспокойство, аутизм, делирий, множественный склероз, болезнь/деменция Альцгеймера и другие нейродегенеративные заболевания, тяжелую олигофрению и дискинезию, такие, как болезнь Хантингтона или болезнь Туретта, анорексию, булимию, удар, адикция/зависимость/пристрастие, расстройство сна, эпилепсию, мигрень, недостаточность внимания/гиперактивность (НВГ); сердечно-сосудистых заболеваний, включая сердечную недостаточность, стенокардию, аритмии, инфаркт миокарда, гипертрофию сердца, гипотензию, гипертензию, например, эссенциальную гипертензию, почечную гипертензию или легочную гипертензию, тромбоз, артериосклероз, церебральный вазоспазм, субарахноидальную геморрагию, церебральную ишемию, церебральный инфаркт, болезнь периферических сосудов, болезнь Рейно, заболевания почек, например почечную недостаточность, дислипидемии, ожирения, рвоты, расстройств желудочно-кишечного тракта, включая синдром раздраженной толстой кишки (СРТК), воспаление кишечника (ВК), гастроэзофагеальный рефлюкс (ГЭФР), расстройства перистальтики и состояния, связанные с задержкой опорожнения желудка, такие, как послеоперативный или диабетический гастропарез, и диабет, язвы, например язвы желудка, диареи, других заболеваний, включая гинекологические болезни, остеопороз, воспалений, инфекций, таких, как бактериальные, грибковые, протозойные и вирусные инфекции, в частности инфекции, вызванные ВИЧ-1 или ВИЧ-2, болевого синдрома, рака, повреждений, вызванных химиотерапией, инвазии опухоли, иммунных заболеваний, задержки мочи, астмы, аллергий, артрита, доброкачественной гипертрофии простаты, эндотоксинового шока, сепсиса, осложнения сахарного диабета.
4. Композиция по п.3, отличающаяся тем, что указанное активное вещество представляет собой активное вещество для лечения заболеваний ЦНС.
5. Композиция по п.4, отличающаяся тем, что указанное активное вещество представляет собой флувоксамин, или флезиноксан, или их фармацевтически приемлемую соль.
6. Композиция по п.5, отличающаяся тем, что указанное активное вещество представляет собой флезиноксана моногидрохлорид ((+)-бензамид, N-[2-[4-[(2R)-2,3-дигидро-2-(гидроксиметил)-1,4-бензодиоксин-5-ил]-1-пиперазинил]этил]-4-фтора моногидрохлорид).
7. Композиция по п.6, отличающаяся тем, что указанное активное вещество представляет собой активное вещество для лечения сердечно-сосудистых заболеваний.
8. Композиция по п.7, отличающаяся тем, что указанное активное вещество представляет собой тедизамил, или ацетоминофен, или их фармацевтически приемлемую соль.
9. Композиция по п.8, отличающаяся тем, что указанное активное вещество представляет собой сесквифумарат тедизамила (N,N'-дициклопропилметил-9,9-тетраметилен-3,7-диазабицикло[3.3.1]нонана 1,5-гидрофумарат).
10. Композиция по п.9, отличающаяся тем, что указанное активное вещество представляет собой активное вещество, используемое в гормонзаместительной терапии.
11. Композиция по п.10, отличающаяся тем, что указанное активное вещество представляет собой дидрогестерон, эстрадиол или конъюгированные эстрогены.
12. Способ получения композиции по пп.1-11, отличающийся тем, что (1) ядро прессуют из смеси, содержащей одно или более активных веществ, гидроксипропилметилцеллюлозы (ГПМЦ) высокой или средней вязкости и гидроксиэтилцеллюлозы (ГЭЦ) высокой или средней вязкости в соотношении ГПМЦ/ГЭЦ=1/0,85-1/1,2 и необязательно ГПМЦ низкой вязкости в соотношении ГПМЦ высокой или средней вязкости/ГПМЦ низкой вязкости = 1/0,01-1/0,2 с получением пролонгированного, по существу, нулевого порядка высвобождения активных веществ, и (2) на ядро необязательно наносят покрытие.