Фармацевтическая композиция, содержащая агонист 5ht1-рецепторов
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к фармацевтической композиции для лечения мигрени, в виде твердой дозированной лекарственной формы для перорального введения, содержащей 5НТ1-агонист суматриптан или его фармацевтически активную соль или сольват в качестве активного ингредиента (в количестве 20-150 мг суматриптана в виде основания), а также основный компонент шипучей пары, разрыхляющий агент и нерастворимый наполнитель, причем основный компонент составляет от примерно 5 до примерно 50% по массе, разрыхляющий агент составляет от примерно 0,5 до примерно 10% по массе и нерастворимый наполнитель составляет от примерно 35 до примерно 80% по массе. Также изобретение относится к применению указанной композиции для лечения мигрени. Композиция по настоящему изобретению может быть проглочена целиком с достижением эффекта от быстрого всасывания, свойственного шипучим составам. 2 н. и 6 з.п. ф-лы, 8 табл., 3 ил.
Реферат
Данное изобретение относится к фармацевтической композиции для перорального введения, способной к быстрому распаду и диспергированию в желудочно-кишечном тракте, содержащей агонист 5HT1-рецепторов, в частности к композиции в виде твердой лекарственной формы для проглатывания.
Агонисты 5HT1-рецепторов применяются в лечении состояний, связанных с головной болью, таких как мигрень, приступообразная головная боль с периодическими рецидивами, хроническая пароксизмальная гемикрания, головная боль, связанная с сосудистыми нарушениями, головная боль, связанная с веществами или их отменой, иррадиирующая головная боль и головная боль, связанная с артериальным давлением. Агонисты 5HT1-рецепторов хорошо известны в данной области, и в широком смысле данный термин объединяет агонисты 5HT1-рецепторов всех типов, включая, но не ограничиваясь агонистами 5HT1-подобного рецептора, агонистами 5HT1В-рецепторов, агонистами 5HT1D-рецепторовиагонистами 5HT1F-рецепторов. Особенно следует указать соединения суматриптана (описаны, например, в патенте GB No. 2162522, включены в данное описание в виде ссылки), наратриптан, ризатриптан, золмитриптан, фроватриптан, элетриптан, алмотриптан, авитриптан, донитриптан, алнидитан, ALX-0646, LY334370, U1092291, IS159 и PNY142633. Особенно следует отметить соединение суматриптан.
Широкая программа клинических испытаний, проведенная по всему миру, показала эффективность и устойчивость суматриптана (поставляемого на рынок в виде составов для подкожного, орального, интраназального и ректального применения) в качестве средства для экстренного лечения мигрени.
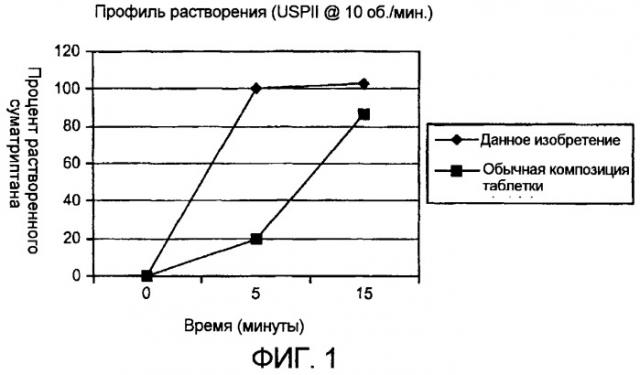
После подкожной инъекции суматриптана (6 мг) наблюдалось статистически значимое отличие от плацебо в уменьшении головной боли менее чем через 10 минут после введения; наблюдалось уменьшение головной боли в течение 2 часов после инъекции у 70-82% пациентов, применяющих данную лекарственную форму.
При применении назального спрея с 20 мг суматриптана наблюдалось статистически значимое отличие от плацебо в уменьшении головной боли менее чем через 15 минут после применения; наблюдалось уменьшение головной боли в течение 2 часов после применения у 55-64% пациентов, применяющих данную лекарственную форму.
При применении имеющихся в продаже таблеток суматриптана (50 и 100 мг) наблюдалось статистически значимое отличие от плацебо в уменьшении головной боли менее чем через 30 минут после приема; наблюдалось уменьшение головной боли в течение 4 часов после приема у 65-78% пациентов, применяющих данную лекарственную форму.
Включенный в данное изобретение в качестве ссылки патент WO 92/15295 (Glaxo Group Limited) раскрывает известные фармацевтические композиции твердых лекарственных форм и, в частности, таблетки, покрытые пленкой, применяемые в лечении состояний, связанных с головной болью.
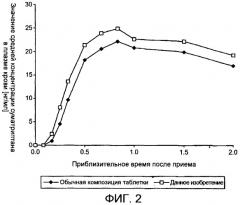
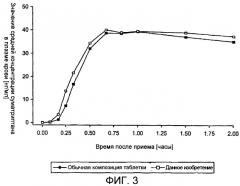
Фармакокинетика суматриптана хорошо известна. Всасывание лекарства происходит быстро при последовательном пероральном введении раствора суматриптана здоровым добровольцам с достижением максимальной концентрации в плазме в течение примерно часа. Композиции таблеток, имеющихся в продаже (обозначенные как Imigran® и Imitrex®), достигают среднего значения максимальной концентрации в плазме немного позднее, иногда вплоть до 2 часов после приема. Предыдущие исследования фармакокинетики с рядом композиций для перорального введения, включая растворы, показывали сходное выделение лекарства, судя по измерениям площади под кривой зависимости концентрация - время (AUC) в течение периода времени от 0 до бесконечности, и похожий максимум наблюдался при измерении концентраций в плазме (Cmax), в сравнении с имеющимися в продаже таблетками. Пища не влияет значительно на общую биодоступность перорально введенного суматриптана, но задерживает наступление Tmax (время до достижения максимальной концентрации в плазме крови) до примерно 0,5 часа; это явление типично для большинства соединений, всасывающихся в тонком кишечнике, из-за того, что пища задерживает опорожнение желудка. Сходное явление (задержка) наблюдается, когда суматриптан вводят пациентам во время обострения мигрени. Вероятно, желудочный стаз, являясь результатом обострения мигрени, ответственен за изменение фармакокинетического профиля. Данное замедление приводит к системно низким концентрациям в период первоначального всасывания. Сниженный уровень распадаемости в желудке (распад таблеток) для имеющихся в продаже таблеток суматриптана и замедленное опорожнение желудка, вероятно, являются следствиями желудочного стаза. Любое замедление всасывания при лечении мигрени, вероятно, задерживает наступление ослабления головной боли.
В работе Fuseau E. и др. в Clinical Therapeutics., 23 (2), 242-51, февраль 2001, изучалось влияние инкапсулирования на процесс всасывания таблеток суматриптана на здоровых добровольцах и пациентах при мигрени. Был сделан вывод, что инкапсулирование замедляет всасывание суматриптана; наблюдаемые концентрации в течение первых двух часов после приема не были эквивалентными и были ниже в случае инкапсулированной таблетки. Таким образом, инкапсулирование было связано с тенденцией к замедленному началу действия, критерием которого является ослабление головной боли и тошноты и времени до значительного облегчения головной боли.
В связи с тем, что пероральный путь введения является особенно удобным и приемлемым для пациентов, данный путь введения является предпочтительным для введения препаратов. К сожалению, как было указано выше, ранее упомянутые композиции агонистов 5HT1-рецепторов для перорального введения могут быть связаны с определенными неудобствами при лечении состояний, связанных с головной болью. Например, такие состояния, особенно мигрень, связаны с тошнотой, рвотой и желудочно-кишечной дисфункцией в виде гипокинезии желудка и замедленного опорожнения желудка, потенциально ведущих к уменьшению и/или ухудшению скорости всасывания лекарства.
Включенный в данное изобретение в качестве ссылки патент WO 92/11003 (Laboratories Glaxo) раскрывает шипучие фармацевтические композиции для перорального введения, применяемые в лечении состояний, связанных с головной болью. Данные шипучие композиции предназначены для растворения и/или диспергирования в водной среде непосредственно перед употреблением пациентом. Шипучие композиции, описанные в WO 92/11003, способствуют более быстрому поступлению лекарства в плазму, по сравнению с обычными составами таблеток.
Однако шипучая композиция таблеток требует для приема наличия воды, то есть должна быть растворена/суспендирована перед проглатыванием. Данный факт не является коммерчески привлекательным с точки зрения удобства применения пациентами и, для пациентов, страдающих ежедневно мигренями, возможно понадобится неоднократное применение такого вида состава.
Кроме того, в композициях, где активный ингредиент имеет от природы горький вкус (и особенно, где рекомендуемая терапевтическая доза такого горького активного ингредиента составляет 25 мг или выше, как в случае суматриптана и его фармацевтически приемлемых солей и сольватов), главным недостатком композиций, где шипучая таблетка сначала растворяется в воде перед проглатыванием, является то, что горечь делает раствор неприятным на вкус; маскировка вкуса таких растворов трудно выполнима. Прием неприятных на вкус препаратов особенно проблематичен для пациентов, страдающих от головной боли, особенно от мигрени, в связи с увеличением тошноты, которая приводит, в свою очередь, к увеличению вероятности возникновения рвоты.
Кроме того, обычные шипучие таблетки в основном должны приготовляться в особенно сухом помещении, то есть требуют большего контроля производства. Обычные шипучие таблетки также имеют тенденцию быть особенно хрупкими и, как правило, в коммерческом производстве должны быть быстро упакованы в непроницаемые упаковки во избежание проникновения влаги и/или разлома таблетки.
Несмотря на то, что обычные шипучие таблетки могут, теоретически, быть проглочены, практически, такое применение не рекомендуется и, кроме того, доставит другие неприятности. Данные шипучие таблетки часто имеют большие размеры и, таким образом, их трудно проглотить; такие шипучие таблетки также, в основном, без покрытия (и не покрыты простым покрытием обычными методами, и особенно не могут быть покрыты водной пленкой) и, как указано выше, являются особенно хрупкими. Таким образом, если активный ингредиент имеет от природы горький вкус (и особенно, где рекомендуемая терапевтическая доза такого горького активного ингредиента составляет 25 мг или выше, как в случае суматриптана и его фармацевтически приемлемых солей и сольватов), данные характеристики, вероятно, значат, что проглатываемая таблетка будет неприятной на вкус. Кроме того, будет существовать недостаток, связанный с продолжением газообразования при непосредственном проглатывании такой таблетки из-за раздражения желудка, увеличения газа в эзофагиальной области и усиления тошноты. Опять-таки, эти недостатки будут особенно ощутимыми для пациентов, страдающих от головной боли, особенно от мигрени, где неприемлемость вкуса, и/или усиление газообразования, и/или увеличение тошноты увеличат вероятность возникновения рвоты.
Было бы очень желательно иметь препарат, который бы совмещал в себе удобство композиции таблетки для пациента, которая может быть проглочена целиком с достижением эффекта от быстрого всасывания, свойственного шипучим составам. Такая композиция была бы особенно желательна в лечении состояний, связанных с желудочно-кишечной дисфункцией, таких как мигрень, и состояний, где требуется быстрый распад и диспергирование перорально введенной композиции.
Данное изобретение касается фармацевтической композиции твердой, быстро распадающейся и диспергирующейся лекарственной формы, которая имеет улучшенный фармакокинетический профиль (повышенную скорость всасывания) по сравнению с имеющейся на рынке композицей агонистов 5HT1-рецепторов в виде твердой формы (особенно ранее имеющиеся в продаже композиции таблетированной суматриптана); ожидается, что такая композиция обеспечит более быстрое начало действия и/или более высокие уровни эффективности для пациентов, страдающих от головной боли, особенно мигрени. Данное изобретение, таким образом, обеспечивает уникальное решение проблемы желудочного стаза у данных пациентов.
Неожиданно было обнаружено, что скорость высвобождения агониста 5HT1-рецепторов из введенной перорально композиции может быть увеличена за счет использования шипучих двухсоставных агентов (шипучей пары) в комбинации с разрыхляющим агентом, нерастворимым наполнителем и набухающим агентом. Повышенная скорость растворения, как было показано, всегда приводит к улучшению всасывания in vivo.
Таким образом, данное изобретение обеспечивает в первом аспекте фармацевтическую композицию в виде твердой лекарственной формы для перорального введения, включающую соединение, действующее как агонист 5HT1-рецепторов, или его фармацевтически приемлемое производное, в качестве активного ингредиента вместе с основным компонентом шипучей пары, разрыхляющим агентом и нерастворимым наполнителем, где основный компонент составляет от примерно 5 до примерно 50% по массе, разрыхляющий агент составляет от примерно 0,5 до примерно 10% по массе и нерастворимый наполнитель составляет от примерно 30 до примерно 99% по массе, где указанный нерастворимый наполнитель включает набухающий агент, который составляет от примерно 1 до примерно 99% по массе, из расчета сухого веса дозированной формы, причем более чем около 70%, предпочтительно около 80%, более предпочтительно около 90%, активного ингредиента растворяется в искусственном желудочном соке (ИЖС) в течение пяти минут в аппарате USPII при скорости вращения лопастей, равной 10 об/мин.
В предпочтительных воплощениях данного изобретения длительность продуцируемого газообразования (объема газа) сравнительно меньше, чем газообразование, продуцируемое обычными шипучими таблетками. В частности, как показано ниже, процентное содержание основного компонента может быть значительно меньшим, чем 50% и также абсолютное содержание этого компонента в одной единице дозированной формы обычно намного ниже, чем в обычных шипучих таблетках ввиду маленького общего размера дозированных форм (обычная единица дозированной формы имеет окончательный вес после прессования в интервале от примерно 100 до примерно 600 мг, предпочтительно между 150 и 450 мг).
В контексте данного изобретения термин «для перорального введения» означает, что фармацевтическая композиция представляет собой твердую дозированную форму, которая предназначена для проглатывания целиком, и нет непосредственной необходимости растворять или суспендировать ее в воде перед применением; однако, к композиции данного изобретения в определенных воплощениях могут быть предъявлены требования как к диспергируемой таблетке, соответствующей условиям мелкого размера дисперсионных частиц и скорости диспергирования, как это определено Европейской и/или Британской фармакопеей. Данные дозированные формы могут принимать вид таблеток и капсул и могут быть приготовлены в соответствии с обычными методиками получения твердых дозированных форм, хорошо известными в данной области фармации. Предпочтительной является композиция данного изобретения в форме «проглатываемой» таблетки. Во избежание недоразумений в толковании данного понятия «проглатываемая таблетка» является таблеткой, которая предназначена для проглатывания целиком (как правило, с малым количеством жидкости, например воды); данная форма не является первоначально обязательно растворяемой или суспендируемой в воде перед применением (как, например, таблетка, описанная в WO 92/11003, которая также содержит существенное количество обоих компонентов шипучей пары) и также не является изначально предназначенной для растворения «во рту» (в форме «тающей во рту»).
Термин «фармацевтически приемлемое производное» означает любую фармацевтически приемлемую соль, сольват, сложный эфир или амид, или соль сольвата данного сложного эфира или амида агониста 5HT1-рецепторов или любое другое соединение, которое после введения реципиенту способно обеспечить его (напрямую или опосредованно) агонистом 5HT1-рецепторов либо его активным метаболитом или остатком.
Подходящие фармацевтически приемлемые соли относительно данного изобретения включают соли присоединения кислоты, образованные неорганическими кислотами, такие как гидрохлориды, гидробромиды, фосфаты и сульфаты, и органическими кислотами, например тартраты, малеаты, фумараты, сукцинаты и сульфонаты.
Подходящие агонисты 5HT1-рецепторов для применения в соответствии с данным изобретением включают суматриптан, наратриптан, золмитриптан, элетриптан, ризатриптан, фроватриптан, алмотриптан, авитриптан, донитриптан, алнидитан, ALX-0646, LY334370, U1092291, IS159 и PNY142633. Предпочтительными являются наратриптан и суматриптан, при этом суматриптан особенно предпочтителен. Предпочтительной формой суматриптана является сукцинатная соль, особенно 1:1 сукцинат. Агонисты 5HT1-рецепторов могут быть использованы отдельно или в комбинации друг с другом.
Приемлемо, если агонист 5HT1-рецепторов при использовании в соответствии с данным изобретением содержит от примерно 0,001 до примерно 55% по массе, предпочтительно от примерно 0,01 до примерно 45%, более предпочтительно от примерно 0,1 до примерно 40%, особенно от примерно 1 до примерно 35%, в особенности от примерно 20 до примерно 35% от сухого веса дозированной формы.
Значение терминов «распад» и «диспергирование», используемых здесь, хорошо понятно квалифицированному пользователю.
В одном воплощении данного изобретения фармацевтическая композиция дополнительно содержит кислотный компонент шипучей пары.
Шипучая пара состоит в основном из кислотного компонента и основного компонента, которые взаимодействуют друг с другом в присутствии воды с образованием газа. Кислотный компонент может содержать, например, сам по себе агонист 5HT1-рецепторов или его фармацевтически приемлемое производное (обладающее при этом кислыми свойствами или могущее обеспечить компонент с кислотными свойствами в водной среде), или алифатическую карбоновую кислоту или ее соль, такую как лимонная или винная кислоты и их соли. Альтернативно, кислотный компонент может быть обеспечен кислотой желудка, а не являться частью фармацевтической композиции. Предпочтительно кислотным компонентом является агонист 5HT1-рецепторов или его фармацевтически приемлемое производное (такое как суматриптан или наратриптан, особенно в форме их солей, например сукцинатная соль, такая как сукцинат суматриптана (1:1)). Кислотные компоненты могут быть использованы отдельно или в комбинации друг с другом. Приемлемо, если кислотный компонент содержит агонист 5HT1-рецепторов или его фармацевтически приемлемое производное вместе с алифатической карбоновой кислотой или ее солью, такой как лимонная или винная кислоты и их соли. Приемлемо, если кислотный компонент (включающий агонист 5HT1-рецепторов или его фармацевтически приемлемое производное, когда оно функционирует как кислотный компонент) составляет до около 55% по массе, предпочтительно от примерно 5 до примерно 50%, более предпочтительно от примерно 10 до примерно 45%, особенно от примерно 15 до примерно 40%, в особенности от примерно 20 до примерно 35% от сухого веса дозированной формы. Основный компонент может содержать, например, карбонат или бикарбонат щелочного или щелочноземельного металла, такой как бикарбонат натрия, бикарбонат калия, карбонат магния или карбонат кальция. Предпочтительным основным компонентом является бикарбонат натрия. Основные компоненты могут быть использованы отдельно или в комбинации друг с другом. Приемлемо, если основный компонент составляет от примерно 5 до примерно 50% по массе, предпочтительно от примерно 7 до примерно 20%, более предпочтительно от примерно 8 до примерно 15%, особенно от примерно 9 до примерно 12% из расчета сухого веса дозированной формы. Кислоты могут быть монопротонными или полипротонными; аналогично основания могут быть моноосновными или полиосновными. Отношение кислотного компонента к основному компоненту, посчитанное в значениях кислотно/основных нормальностей (N), может приемлемо находиться в пределах от примерно 1:10 до примерно 10:1, предпочтительно от примерно 1:5 до примерно 5:1, более предпочтительно от примерно 1:3 до примерно 3:1, наиболее предпочтительно от примерно 1:2 до примерно 2:1.
Используемые в композициях данного изобретения разрыхляющие агенты при контакте с водой набухают. Подходящие разрыхляющие агенты, как хорошо известно квалифицированному специалисту в данной области, и неограниченный список примеров включают натрийкроскармелозу, натрий-гликолят крахмала, поперечносшитый поливинилпирролидон, повидон, крахмал (например, маисовый крахмал, прежелатинизированный крахмал), низкозамещенную гидроксипропилцеллюлозу, альгиновую кислоту, альгинат натрия, трехосновный фосфат кальция, сульфат кальция, кальцийкарбоксиметилцеллюлозу, микрокристаллическую целлюлозу, порошковую целлюлозу, коллоидный диоксид кремния, докусат натрия, гуаровую камедь, гидроксипропилцеллюлозу, алюмосиликат магния, метилцеллюлозу, полакрилат калия и поливинилпирролидон. Предпочтительной является натрийкроскармелоза. Разрыхляющие агенты могут быть использованы отдельно или в комбинации друг с другом. Приемлемо, если разрыхляющий агент составляет от примерно 0,5 до примерно 10% по массе, предпочтительно от примерно 2 до примерно 8%, более предпочтительно от примерно 3 до примерно 7%, особенно от примерно 4 до примерно 6%, в особенности от примерно 5% из расчета сухого веса дозированной формы.
Нерастворимые наполнители являются инертными веществами, которые обеспечивают массу и стабильность при использовании композиций данного изобретения. Некоторые нерастворимые наполнители могут также действовать как набухающие агенты. Набухающие агенты, при использовании их в композициях данного изобретения, имеют пористую структуру и пропускают воду внутрь и через твердую дозированную форму. Подходящие набухающие агенты должны быть хорошо известны специалисту в данной области, и неограниченный список примеров включает микрокристаллическую целлюлозу (доступную в виде, например, AvicelTM), натрийкроскармелозу, кросповидон, крахмал, кальцийкарбоксиметилцеллюлозу, силикатизированную микрокристаллическую целлюлозу, оксид магния и трагакант. Предпочтительной является микрокристаллическая целлюлоза. Набухающие агенты могут быть использованы отдельно или в комбинации друг с другом. Приемлемо, если набухающий агент составляет от примерно 1 до примерно 99% по массе, предпочтительно от примерно 1 до примерно 80%, более предпочтительно от примерно 5 до примерно 65%, особенно от примерно 12 до примерно 55%, в особенности от примерно 18 до примерно 50% от сухого веса дозированной формы. Другие подходящие нерастворимые наполнители включают дигидрат двухосновного фосфата кальция, безводный двухосновный фосфат кальция (доступный в виде, например, EmcompressTM), трехосновный фосфат кальция, карбонат кальция, карбонат магния, сульфат кальция, ацетат целлюлозы, порошковую целлюлозу, каолин, полиметакрилаты и тальк. Предпочтительным является безводный двухосновный фосфат кальция. Нерастворимые наполнители могут быть использованы отдельно или в комбинации друг с другом. Приемлемо, если нерастворимый наполнитель, включающий набухающий агент, составляет от примерно 30 до примерно 99% по массе, предпочтительно от примерно 35 до примерно 80%, более предпочтительно от примерно 40 до примерно 70%, в особенности от примерно 45 до 65% от сухого веса дозированной формы.
Таким образом, в одном воплощении данного изобретения предлагается, как описано здесь и выше, фармацевтическая композиция в виде твердой дозированной формы, в которой агонист 5HT1-рецепторов или его фармацевтически приемлемое производное составляет от примерно 0,001 до примерно 55% по массе, предпочтительно от примерно 0,01 до примерно 45%, более предпочтительно от примерно 0,1 до 40%, особенно от примерно 1 до примерно 35%, в особенности от примерно 20 до примерно 35%, основный компонент шипучей пары составляет от примерно 5 до примерно 50% по массе, предпочтительно от примерно 7 до примерно 20%, более предпочтительно от примерно 8 до примерно 15%, особенно от примерно 9 до примерно 12%, разрыхляющий агент составляет от примерно 0,5 до примерно 10% по массе, предпочтительно от примерно 2 до примерно 8%, более предпочтительно от примерно 3 до примерно 7%, особенно от примерно 4 до примерно 6%, в особенности примерно 5%, нерастворимый наполнитель, включающий набухающий агент, составляет от примерно 35 до примерно 80% по массе, предпочтительно от примерно 40 до примерно 70%, более предпочтительно от примерно 45 до примерно 65%, и набухающий агент составляет от примерно 1 до примерно 80% по массе, предпочтительно от примерно 5 до примерно 65%, более предпочтительно от примерно 12 до примерно 55%, особенно от примерно 18 до примерно 50% от сухого веса дозированной формы.
В следующем воплощении данного изобретения предложена, как описано здесь и выше, фармацевтическая композиция в виде твердой дозированной формы, в которой агонист 5HT1-рецепторов или его фармацевтически приемлемое производное включает суматриптан или наратриптан или их фармацевтически приемлемое производное, предпочтительно суматриптан или его фармацевтически приемлемое производное, более предпочтительно в форме его сукцината (1:1), основный компонент шипучей пары включает бикарбонат натрия, разрыхляющий агент включает натрийкроскармелозу и нерастворимый наполнитель, включающий микрокристаллическую целлюлозу.
В следующем воплощении данного изобретения, как описано здесь и выше, фармацевтическая композиция в виде твердой дозированной формы, в которой агонист 5HT1-рецепторов или его фармацевтически приемлемое производное включает суматриптан или наратриптан или их фармацевтически приемлемое производное, предпочтительно суматриптан или его фармацевтически приемлемое производное, более предпочтительно в форме его сукцината (1:1), основный компонент шипучей пары включает бикарбонат натрия, разрыхляющий агент включает натрийкроскармелозу и нерастворимый наполнитель включает двухосновный фосфат кальция, предпочтительно безводный двухосновный фосфат кальция.
В следующем воплощении данного изобретения предлагается, как описано здесь и выше, фармацевтическая композиция в виде твердой дозированной формы, в которой агонист 5HT1-рецепторов или его фармацевтически приемлемое производное включает суматриптан или наратриптан или их фармацевтически приемлемое производное, предпочтительно суматриптан или его фармацевтически приемлемое производное, более предпочтительно в форме его сукцината (1:1), основный компонент шипучей пары включает бикарбонат натрия, разрыхляющий агент включает натрийкроскармелозу и нерастворимый наполнитель включает безводный двухосновный фосфат кальция или микрокристаллическую целлюлозу или их смесь.
Включение одного или более нерастворимых наполнителей в композиции данного изобретения также обеспечивает получение композиции с улучшенными свойствами при производстве по сравнению с обычными составами таблеток (например, состав, который описан в WO 92/15295).
Кроме ингредиентов, описанных выше, фармацевтическая композиция данного изобретения может дополнительно содержать фармацевтически приемлемые носители и эксципиенты, такие как связывающие агенты (например, прежелатинизированный крахмал, поливинилпирролидон, гидроксипропилметилцеллюлозу) и смазывающие вещества (например, стеариновую кислоту, стеарат магния, тальк, бензоат натрия и гидрогенизированное растительное масло).
Несмотря на то, что фармацевтические композиции в соответствии с данным изобретением, в частности композиции таблеток в основном требуют непроницаемых (например, фольга/фольга) упаковок для коммерческого длительного хранения (и, в частности, в тех воплощениях, где агонистом 5HT1-рецепторов является сукцинат (янтарнокислая соль) суматриптана (1:1) и нет других и/или нет более сильного конъюгата кислотного компонента), данные композиции способны выдерживать хранение в открытой емкости при условиях окружающей среды 30°C/60% относительной влажности, по крайней мере, 1 месяц и могут быть в основном произведены на стандартном оборудовании для таблетирования, в том числе с нормальным контролем и без специальных трудно выполнимых требований пониженной влажности.
Многие лекарственные вещества имеют от природы горький вкус. Неприятный вкус, который иногда связан с пероральным введением композиции, содержащей агонист 5HT1-рецепторов или его фармацевтически приемлемое производное, может быть существенно смягчен использованием пленочного покрытия на твердой основе. Твердая основа содержит агонист 5HT1-рецепторов или его фармацевтически приемлемое производное. Более того, при использовании его в композициях данного изобретения пленочное покрытие задерживает распад твердой формы до достижения ею желудка. Пленочное покрытие может способствовать проглатыванию, может делать твердую форму эстетически более привлекательной и в общем делать твердую форму менее хрупкой.
В соответствии с одним воплощением данное изобретение предлагает фармацевтическую композицию, как описано здесь и ранее, в форме таблетки с пленочным покрытием.
Является приемлемым, чтобы пленочное покрытие содержало полимер. Подходящие полимеры известны специалистам в данной области, и неограниченный список примеров включает эфиры целлюлозы, например гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу или метилцеллюлозу, и сополимеры метакриловой кислоты и метилметакрилата. Предпочтительно, чтобы пленочное покрытие содержало гидроксипропилметилцеллюлозу.
Все твердые вещества в основном применяются для пленочных покрытий твердых форм, например, ядра таблетки, в количестве от примерно 0,5 до 10% по массе, предпочтительно от примерно 1 до примерно 4%, более предпочтительно от примерно 2 до примерно 3% от сухого веса дозированной формы. Например, примерно 8 мг покрытия используется для приготовления ядра таблетки, весящего примерно 300 или примерно 400 мг, и примерно 4 мг используется для приготовления ядра таблетки, весящего примерно 175 мг.
Пленочное покрытие может дополнительно содержать любые фармацевтически приемлемые окрашивающие вещества или вещества, придающие матовость, содержащие водорастворимые красители, алюминиевые лаки водорастворимых красителей и неорганические пигменты, такие как диоксид титана и оксид железа.
Пленочное покрытие может также содержать один или более пластифицирующих агентов, обычно используемых в покрытиях на основе полимерных пленок, например полиэтиленгликоль, пропиленгликоль, дибутилсебацат, минеральное масло, кунжутное масло, диэтилфталат и триацетин. Могут быть использованы сами материалы пленочных покрытий, такие как Opaspray и Opadry, которые закупают у Colorcon Ltd., UK.
Вкус композиций для перорального введения может быть также улучшен использованием ароматизирующих агентов и/или подсластителей. Подходящие ароматизирующие агенты должны быть хорошо известны специалисту в данной области, и неограниченный список примеров включает ароматизаторы с запахом лимона, апельсина, грейпфрута, ванили, карамели, ириса, ореха или мяты. Подходящие подсластители должны быть хорошо известны специалисту в данной области, и неограниченный список примеров включает сукрозу, сахарин, цикламат и его соли щелочных или щелочноземельных металлов, маннит, ацесульфам-К, стевиозид, тауматин и аспартам. Ароматизаторы и/или подсластители могут быть использованы отдельно или в комбинации друг с другом.
Во втором аспекте данное изобретение обеспечивает использование фармацевтической композиции твердой дозированной формы для перорального введения, как описано здесь и выше, в лечении состояний, связанных с головной болью, таких как приступообразная головная боль с периодическими рецидивами, хроническая пароксизмальная гемикрания, головная боль, связанная с сосудистыми нарушениями, головная боль, связанная с веществами или их отменой, иррадиирующая головная боль и головная боль, связанная с артериальным давлением, и, в частности, мигрени. Приемлемо, если агонист 5HT1-рецепторов или его фармацевтически приемлемое производное является суматриптаном или наратриптаном или их фармацевтически приемлемым производным, предпочтительно суматриптаном или его фармацевтически приемлемым производным, более предпочтительно суматриптан сукцинатом (1:1).
Следует понимать, что «лечение» предназначено как для профилактики, так и облегчения явных симптомов.
В соответствии с третьим аспектом данного изобретения предлагается использование фармацевтической композиции твердой дозированной формы для перорального введения, как описано здесь и выше, в производстве лекарственного препарата для лечения состояний, связанных с головной болью, таких как приступообразная головная боль с периодическими рецидивами, хроническая пароксизмальная гемикрания, головная боль, связанная с сосудистыми нарушениями, головная боль, связанная с веществами или их отменой, иррадиирующая головная боль и головная боль, связанная с артериальным давлением, и, в частности, мигрени. Приемлемо, если агонист 5HT1-рецепторов или его фармацевтически приемлемое производное является суматриптаном или наратриптаном или их фармацевтически приемлемым производным, предпочтительно суматриптаном или его фармацевтически приемлемым производным, более предпочтительно суматриптан сукцинатом (1:1).
Четвертый аспект данного изобретения предлагает способ лечения млекопитающего, включая человека, страдающего от чувствительности к состояниям, связанным с головной болью, таким как приступообразная головная боль с периодическими рецидивами, хроническая пароксизмальная гемикрания, головная боль, связанная с сосудистыми нарушениями, головная боль, связанная с веществами или их отменой, иррадиирующая головная боль и головная боль, связанная с артериальным давлением, и, в частности, мигрени, который включает, как описано здесь и выше, способ перорального введения фармацевтической композиции твердой дозированной формы. Приемлемо, если агонист 5HT1-рецепторов или его фармацевтически приемлемое производное является суматриптаном или наратриптаном или их фармацевтически приемлемым производным, предпочтительно суматриптаном или его фармацевтически приемлемым производным, более предпочтительно суматриптан сукцинатом (1:1).
Следует понимать, что количество соединений, применимых в качестве активных ингредиентов в фармацевтических композициях твердой дозированной формы данного изобретения, будет зависеть от конкретных используемых соединений. Более того, точная применяемая терапевтическая доза будет зависеть от возраста и состояния пациента, природы излечиваемого состояния и от окончательного решения лечащего врача.
Когда агонист 5HT1-рецепторов является суматриптаном или наратриптаном, количество применяемого соединения в композициях данного изобретения будет варьировать от 0,1 до 250 мг. Композиции могут вводиться от 1 до 4 раз в день, предпочтительно один или два раза. Когда агонист 5HT1-рецепторов является суматриптаном, количество суматриптана, предпочтительно в форме фармацевтически приемлемой соли, будет находиться в пределах от 1 до 200 мг, предпочтительно от 20 до 150 мг, например 25, 50 или 100 мг из расчета веса чистого основания. Когда агонистом 5HT1-рецепторов является наратриптан, количество наратриптана, предпочтительно в форме его фармацевтически приемлемой соли, будет варьировать от 0,1 до 25 мг, предпочтительно 1 или 25 мг из расчета веса чистого основания. Обычно при лечении головной боли, в частности мигрени, композицию вводят в разовой дозе; если пациент обычно страдает от иррадиирующей или повторной боли, тогда может быть введена следующая разовая доза после необходимого периода времени в соответствии с предписаниями лечащего врача. Таким образом, лечение головной боли, в частности мигрени, рассмотренное в контексте данного изобретения, сводится к введению ударной разовой дозы активного ингредиента.
Таким образом, для приготовления композиций в соответствии с данным изобретением активный ингредиент, кислотный компонент, если присутствует, и основный компонент могут быть смешаны с подходящими эксципиентами, такими как нерастворимый наполнитель и разрыхляющий агент. Если требуется, один или более компонентов этой порошковой смеси могут быть гранулированы. Таблетки могут быть приготовлены, например, прессованием порошковой смеси с использованием, если требуется, смазывающего вещества, такого как стеарат магния в качестве вспомогательного средства для таблетирования. Капсулы могут быть приготовлены, например, путем заполнения порошковой смесью подходящих быстрорастворимых створок капсул с использованием, если требуется, смазывающего вещества, такого как стеарат магния в качестве вспомогательного вещества для заполнения капсул.
Твердая дозированная форма (особенно таблетка) может затем быть покрыта пленочным покрытием с использованием суспензии, содержащей подходящий полимер в подходящем растворителе. Предпочтительным растворителем для компонентов пленочного покрытия является очищенная вода, но в данной области можно также использовать обычно применяемые различные классы органических растворителей, такие как спирты, кетоны, эфиры и хлорированные углеводороды, например, этанол, ацетон, дихлорметан и подобные растворители. Растворитель не обнаруживается в конечном продукте.
В лечении острых состояний, таких как мигрень, очень желательно, чтобы данные фармацевтические композиции имели хорошую биодоступность и быстрое начало действия. Было опр