Использование лигандов рецептора ер4 для лечения опосредованных il-6 заболеваний
Иллюстрации
Показать всеНастоящее изобретение относится к применению антагониста рецептора ЕР4 при получении лекарственного препарата для лечения заболевания, опосредованного IL-6, где заболевание выбрано из группы, включающей цирроз при алкоголизме, амилоидоз, атеросклероз, сердечное заболевание, склероз и реакции при трансплантации органов. 2 н. и 4 з.п. ф-лы, 8 ил.
Реферат
Область изобретения
Настоящее изобретение относится к новым способам использования лигандов рецепторов EP4. Данное изобретение также включает в себя способы идентификации агентов, которые влияют на активацию клеток периферической цельной крови, и конкретные способы идентификации соединений, которые влияют на секрецию IL-6 этими клетками периферической цельной крови, модулируя активность, опосредованную PGE2. Настоящее изобретение также относится к новым способам использования антагонистов рецептора EP4. Способы по данному изобретению включают в себя способы анализа активации клеток периферической цельной крови путем взаимодействия с соединениями и PGE2, которые могут идентифицировать клеточную активность, измеряя продукцию IL-6.
Предпосылки изобретения
Простагландин E2 (PGE2) является важнейшим модулятором, вовлеченным в патогенез артрита. PGE2 связывается, по крайней мере, с четырьмя подтипами рецептора PGE, обозначенными как EP1, EP2, EP3 и EP4. Молекулярные исследования показали, что все подтипы представляют собой 7-трансмембранные рецепторы, проходящие через бислой, которые относятся к суперсемейству рецепторов, связанных с G-белком (Robert et al., Am. Soc. Pharm. Exp. Ther. 46:205-29,1994). Активация EP1 стимулирует высвобождением внутриклеточного кальция с помощью механизма, опосредованного G-белком; оба EP2 и EP4, стимулируя G-белки, активируют аденилатциклазу, но отличаются ответом в отношении определенных лигандов; и EP3 ингибируют аденилатциклазу, ингибируя G-белки (Robert et al., supra, Negishi et al., Biochimica Biophys. Acta 1259:109-20,1995).
Было предположено, что повышение уровней интерлейкина-6 (IL-6), плейотропного цитокина воспаления, способствует возникновению многих патологических расстройств, таких как ревматоидный артрит, аутоиммунные заболевания и атеросклероз.
Интерлейкин-6 (IL-6) является ключевым цитокином, необходимым для индукции клеток плазмы, секреции атител, роста B-клеток, активации синтеза белков острой фазы, активации T-клеток, роста гематопоэтических стволовых клеток и поддержания оптимальной функции иммунной системы. Активность этого цитокина обеспечивает активацию и поддержание функции иммунной системы во время инфекций и в ответ на другие воспалительные стимулы. Было подробно описано, что IL-6 играет важную роль в развитии и поддержании хронического воспалительного заболевания, такого как ревматоидный артрит, у млекопитающих. В недавних клинических исследованиях было показано, что антитела к рецептору IL-6 улучают прочность сустава, уменьшают боль и опухание у больных ревматоидным артритом (Yoshizaki et al., Springer Semin Immunopathol. Vol. 20,247-259, 1998). Этот факт, предполагающий, что регуляция продукции IL-6 может влиять на течение заболевания, является многообещающей стратегией для лечения хронических воспалительных заболеваний.
Атеросклероз является комплексным заболеванием, которое характеризуется отложением холестерина и моноцитарной инфильтрацией субэндотелиального пространства, что приводит к образованию пенистых клеток (Ross R. (1993) Nature 362:801-809). Присутствие макрофагов и T-лимфоцитов в атеросклеротическом повреждении говорит о важной роли иммунной системы и воспалительного процесса в патогенезе атеросклероза (Libby et al.(1993) Curr. Opin. Lipidol. 4:355-363).
У человека в атеросклеротических повреждениях были определены транскрипты мРНК IL-6 (Seine et al. Cytokine. 1994, 6, 87-91). Эти наблюдения подтвердили и расширили иммуногистохимические исследования, которые продемонстрировали совместную локализацию экспрессии белка IL-6 и макрофагов, а также гладкомышечных клеток в атеросклеротических бляшках человека (Kishikawa Н. et al., Virchows. Arch. A Pathol. Anat. Histopathol. 1992, 423, 433-442). Более того, было показано, что IL-6 оказывает существенное влияние на типы клеток, которые являются компонентами атеросклеротических повреждений. IL-6 могут примировать макрофагальные клетки THP-1, что увеличивает количество продукции фактора некроза опухоли в ответ на липополисахарид (LPS) (Cochran FR et al., Immunopharmacology, 1992, 23, 97-103), тем самым предполагая, что IL-6 может играть роль в стимуляции макрофагов для достижения их максимальной воспалительной активности. Было показано, что IL-6 стимулирует рост гладкомышечных клеток под действием фактора роста тромбоцитов (Ikeda U. et al., Am. J. Physio. 1991, 260, H1713-H1717). Данные последних исследований показали, что у мышей с «нокаутом» аполипопротеина E развивается атеросклероз, сходный с атеросклерозом человека (Bourassa P-AK et al., Proc. Natl. Acad Sci USA 1996, 93, 10022-10027; Kauser K. et al., J. Vasc. Res, 1996, 33 (suppl 1) 48, Abstract). Секреция IL-6, выделенного из аорты мышей с «нокаутом» apoE, показала положительную корреляцию с областью поражения в аорте мышей с «нокаутом» apoE, а иммунногистохимическое окрашивание показало, что макрофаги преимущественно продуцируют IL-6 (Sukovich D. A. et al., Arterioscler Thromb Vase Biol. 1998, 18, 1498-1505). Таким образом, по-видимому, IL-6 играет важнейшую роль в развитии атеросклероза.
С другой стороны, данные последних исследований служат доказательством гипотезы воспалительной природы атеросклероза (Ross, R., et al., Nature, 1993, 362, 801-809; Alexander, R. W., et al., N. Engl. J. Med., 1994, 331, 468-469), и исследования маркеров воспаления показывают связь между увеличением воспаления и риском инфаркта миокарда (Rider, P. M. et al., N. Engl. J. Med., 1997, 336, 973-979; Liuzzo, G. et al., N. Engl. J. Med., 1994, 331, 417-424). Отрыв бляшки, приводящий к тромбозу, является ключевым событием инфаркта, и было показано, что отрыв связан с увеличивающимся в бляшке воспалении (van der Wal. A. C., et al., Circulation, 1994, 89, 36-44). Более того, снижение воспалительного ответа может быть связано со снижением риска последующих ишемических проявлений (Rider, P. M. et al., N. Engl. J. Med., 1997,336, 973-979), и было сделано предположение, что эффективное действие аспирина, ингибитора циклооксигеназы, в снижении риска инфаркта миокарда связано с его противовоспалительным действием. Эти факты обозначает, что кроме цитокинов и факторов роста, простагландины, по-видимому, также играют существенную роль в атеросклерозе.
Простагландины обычно продуцируются ферментом циклооксигеназой-1 (COX-1), который конституитивно экспрессируется эндотелием сосудов, тромбоцитами, в почках и в других местах (Monkada, S. et al., Nature, 1976, 263, 663-665). Кроме того, в различных типах клеток была выделена цитокин-индуцибельная циклооксигеназа, COX-2. Экспрессия COX-2 ограничивается основными условиями и не контролируема при воспалении, таком как ревматоидный артрит (Needeleman, P. et al., J. Rheumatol, 1997, 24 (suppl 49), 6-8). В атеросклеротических повреждениях у человека COX2 была обнаружена в макрофагах, в некоторых гладкомышечных клетках и в эндотелиальных клетках (Christopher, S. R., et al., Arterioscler Thromb. Vasc. Biol. 1999, 19, 646-655; Stemme, V. et al., Eur. J. Vasc. Endovasc, Surg., 2000, 20, 146-152). Так как при активации COX2 продуцируются простагландины E2 и I2, которые хорошо известны как ключевые и положительные факторы воспаления, такие как PGE2 и/или PGI2, то COX2 может играть важную роль в атеросклеротических заболеваниях.
На основании ряда данных можно сделать предположение, что простагландины и IL-6, продуцируемые макрофагами в очаге воспаления или атеросклеротическом повреждении, имеют отношение к развитию и поддержанию заболевания. В самом деле, ранее сообщалось, что при одновременной стимуляции моноцитов периферической крови человека PGE2 и частицами титана PGE2 усиливает продукцию IL-6 до максимального предела (Blaine, T. A. et al, J. Bone Joint Surgery, 1997, 10, 1519-1528). В настоящем исследовании авторами данного патента было показано, что PGE2 увеличивает продукцию IL-6 при обработке конканавалином A (ConA) мононуклеарных клеток периферической крови человека (PBMC). Авторами настоящего патента неожиданно было обнаружено, что селективные антагонисты рецептора подтипа EP4 ингибируют продукцию IL-6 как в PBMC, так и в периферической цельной крови, при одновременной стимуляции PGE2 и ConA (смотри подробное описание изобретения).
Краткое описание изобретения
Настоящее изобретение относится к способами использования лиганда рецептора EP4 в производстве лекарственного средства для лечения заболеваний, опосредованных IL-6. Предпочтительно, заболевание, опосредованное IL-6, выбрано из группы, включающей цирроз при алкоголизме, амилоидоз, атеросклероз, заболевание сердца, такое как стенокардия, инфаркт миокарда, миокардиопатия и миокардит, склероз, такой как рассеянный склероз, и реакции при трансплантации органов.
В соответствии с другим аспектом настоящее изобретение относится к способу лечения заболевания, опосредованного IL-6, у млекопитающих, включая человека, который заключается во введении эффективного количества лиганда рецептора EP4. Предпочтительно, заболевание, опосредованное IL-6, выбрано из группы, включающей цирроз при алкоголизме, амилоидоз, атеросклероз, сердечное заболевание, такое как стенокардия, инфаркт миокарда, миокардиопатия и миокардит, склероз, такой как рассеянный склероз, и реакции при трансплантации органов.
В соответствии с дополнительным аспектом данное изобретение относится к фармацевтической композиции, состоящей из лиганда рецептора EP4, для применения при лечении заболевания, опосредованного IL-6.
Предпочтительно, заболевание, опосредованное IL-6, выбрано из группы, состоящей из цирроза при алкоголизме, амилоидоза, атеросклероза, сердечного заболевания, такого как стенокардия, инфаркт миокарда, миокардиопатия и миокардит, склероза, такого как рассеянный склероз, и реакций при трансплантации органов.
Предпочтительно, лиганд рецептора EP4, используемый в данном изобретении, представляет собой селективный антагонист рецептора EP4.
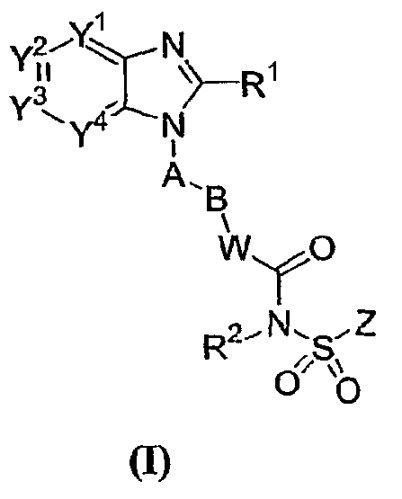
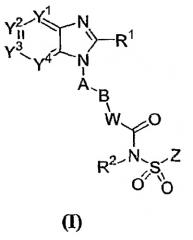
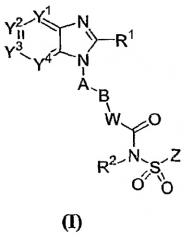
В соответствии с еще одним предпочтительным аспектом лиганд (антагонист) рецептора EP4 представляет собой арильное или гетероарильное конденсированное имидазольное соединение следующей формулы I
или его фармацевтически приемлемую соль,
где Y1, Y2, Y3 и Y4 независимо выбраны из N, CH или C(L);
R1 представляет собой H, C1-8алкил, C2-8алкенил, C2-8алкинил, C3-7циклоалкил, C1-8алкокси, галогензамещенный C1-8алкокси, C1-8алкил-S(O)m-, Q1-, пирролидинил, пиперидил, оксопирролидинил, оксопиперидил, амино, моно- или ди-(C1-8алкил)амино, C1-4алкил-C(=O)-N(R3)- или C1-4алкил-S(O)m-N(R3)-, где указанный C1-8алкил, C2-8алкенил и C2-8алкинил необязательно замещены галогеном, C1-3алкилом, гидрокси, оксо, C1-4алкокси-, C1-4алкил-S(O)m-, C3-7циклоалкил-, циано, инданилом, 1,2,3,4-тетрагидронафтилом, 1,2-дигидронафтилом, пирролидинилом, пиперидилом, оксопирролидинилом, оксопиперидилом, Q1-, Q1-С(=O)-, Q1-О-, Q1-S(O)m-, Q1-C1-4алкил-O-, Q1-C1-4алкил-S(О)m-, Q1-C1-4алкил-C(О)-N(R3)-, Q1-C1-4алкил-N(R3)- или C1-4алкил-C(O)-N(R3)-;
Q1 представляет собой 5-12-членное моноциклическое или бициклическое ароматическое кольцо, необязательно содержащее до 4 гетероатомов, выбранных из O, N и S, и необязательно замещенное галогеном, C1-4алкилом, галогензамещенным C1-4алкилом, гидрокси, C1-4алкокси, галогензамещенным C1-4алкокси, C1-4алкилтио, нитро, амино, моно- или ди-(C1-4алкил)амино, циано, HO-C1-4алкилом, C1-4алкокси-C1-4алкилом, C1-4алкилсульфонилом, аминосульфонилом, C1-4алкилС(=O)-, HO(O=)C-, C1-4алкил-O(O=)C-, R3N(R4)C(=O)-, C1-4алкилсульфониламино, C3-7циклоалкилом, R3C(=O)N(R4)- или NH2(HN=)C-;
A представляет собой 5-6-членное моноциклическое ароматическое кольцо, необязательно содержащее до 3 гетероатомов, выбранных из O, N и S, где указанное 5-6-членное моноциклическое ароматическое кольцо необязательно замещено до 3 заместителями, выбранными из галогена, C1-4алкила, галогензамещенного C1-4алкила, гидрокси, C1-4алкокси, галогензамещенного C1-4алкокси, C1-4алкилтио, нитро, амино, моно- или ди-(C1-4алкил)амино, циано, HO-C1-4алкила, C1-4алкокси-C1-4алкила, C1-4алкилсульфонила, аминосульфонил, ацетил, R3N(R4)C(=O)-, HO(O=)C-, C1-4алкил-O(O=)C-, C1-4алкилсульфониламино, C3-7циклоалкила, R3C(=O)N(R4)- и NH2(HN=)C-;
B представляет собой галогензамещенный C1-6алкилен, C3-7циклоалкилен, C2-6алкенилен, C2-6алкинилен, -O-C1-5алкилен, C1-2алкилен-O-C1-2алкилен или C1-6алкилен, необязательно замещенный оксогруппой или C1-3алкилом;
W представляет собой NH, N-C1-4алкил, O, S, N-OR5 или ковалентную связь;
R2 представляет собой H, C1-4алкил, OH или C1-4алкокси;
Z представляет собой 5-12-членное моноциклическое или бициклическое ароматическое кольцо, необязательно содержащее до 3 гетероатомов, выбранных из O, N и S, где указанное 5-12-членное моноциклическое или бициклическое ароматическое кольцо необязательно замещено галогеном, C1-4алкилом, галогензамещенным C1-4алкилом, C1-4алкенилом, C1-4алкинилом, гидрокси, C1-4алкокси, галогензамещенным C1-4алкокси, C1-4алкилтио, нитро, амино, моно- или ди-(C1-4алкил)амино, циано, HO-C1-4алкилом, C1-4алкокси-C1-4алкилом, C1-4алкилсульфонилом, аминосульфонилом, C1-4алкилС(=O)-, R3C(=O)N(R4)-, HO(O=)C-, C1-4алкил-O(O=)C-, C1-4алкилсульфониламино, C3-7циклоалкилом, NH2(HN=)C-, Q2-S(O)m-, Q2-O-, Q2-N(R3)- или Q2-;
L представляет собой галоген, C1-4 алкил, галогензамещенный C1-4 алкил, гидрокси, C1-4алкокси, галогензамещенный C1-4 алкокси, C1-4алкилтио, нитро, амино, моно- или ди-(C1-4алкил)амино, циано, HO-C1-4алкил, C1-4алкокси-C1-4алкил, C1-4алкилсульфонил, аминосульфонил, C1-4алкилС(=O)-, HO(O=)C-, C1-4алкил-O(O=)C-, C1-4алкилсульфониламино, C3-7циклоалкил, R3C(=O)N(R4)-, NH2(HN=)C-, R3N(R4)C(=O)-, R3N(R4)S(O)m-, Q2-, Q2-C(=O)-, Q2-O-, Q2-C1-4алкил-O-, или две соседние L группы необязательно присоединены друг к другу с образованием алкиленовой цепи, содержащей 3 или 4 члена, в которой один или два (несоседних) атома углерода необязаетльно земенены атомами кислорода;
m равно 0, 1 или 2;
R3 и R4 независимо выбраны из H и C1-4алкила;
R5 представляет собой H, C1-4алкил, C1-4алкил-(O=)C- или C1-4алкил-O-(O=)C-; и
Q2 представляет собой 5-12-членное моноциклическое или бициклическое ароматическое кольцо, или 5-12-членное трициклическое кольцо, необязательно содержащее до 3 гетероатомов, выбранных из O, N и S, где указанное 5-12-членное моноциклическое или бициклическое ароматическое кольцо необязательно замещено галогеном, C1-4алкилом, галогензамещенным C1-4алкилом, C1-4алкенилом, C1-4алкинилом, гидрокси, C1-4алкокси, галогензамещенным C1-4алкокси, C1-4алкилтио, нитро, амино, моно- или ди-(C1-4алкил)амино, циано, HO-C1-4алкилом, C1-4алкокси-C1-4алкилом, C1-4алкилсульфонилом, аминосульфонилом, C1-4алкил-(O=)C-, R3(R4)C(=O)N-, HO(О)C-, C1-4алкил-O(O=)C-, C1-4алкилсульфониламино, C3-7циклоалкилом, C1-4-алкил-C(=O)NH- или NH2(HN=)C-.
В соответствии с другим предпочтительным аспектом лиганд (антагонист) рецептора EP4, который описан в WO 00/16760, представляет собой арильное или гетерарильное конденсированное имидазольное соединение следующей формулы II
или его фармацевтически приемлемые соли,
где R1 представляет собой низший алкил, замещенный гидрокси, защищенным карбокси или карбокси; карбокси; защищенный карбокси, карбамоил; гетероциклическую группу; циано; галоген(низший)алкилсульфонилокси; низший алкокси, замещенный гидрокси или карбамоилом; арил, замещенный карбокси, защищенным карбокси, карбамоилом или гетероциклической группой; или амино, необязательно замещенный защищенным карбокси или низшим алкилсульфонилом,
R2 представляет собой водород или низший алкил,
R3 представляет собой арил, необязательно замещенный галогеном,
R4 представляет собой арил, необязательно замещенный галогеном,
Q представляет собой [где -A1- представляет собой единичную связь или низший алкилен, представляет собой цикло(C5-C9)алкен, цикло(C3-C9)алкан, бицикло(C6-C9)алкен или бицикло(C5-C9)алкан, и -A3- представляет собой единичную связь или низший алкилен], и X представляет собой О, NH или S.
В соответствии с еще одним аспектом данное изобретение относится к способу, который включает в себя культивирование цельной периферической крови с исследуемым соединением; и определение эффекта соединения на PGE2-индуцированную активацию клеток цельной крови. Предпочтительно, измеряемыми изменениями клеточной активности является повышение высвобождения цитокинов. Предпочтительно, действие соединения определяется путем сравнения с действием на контрольную культуру в отсутствие соединения.
В соответствии с другим аспектом данное изобретение относится к способу, который включает в себя активацию клеток цельной периферической крови сочетанием PGE2 и других стимулирующих агентов, таких как конканавалин A, CD3 или титан.
Специалисту в данной области будут совершенно понятны термины, используемые здесь в описании и прилагаемой формуле изобретения, описываемой настоящее изобретение. Однако, если не указано иного, следующие термины такие, как описаны сразу далее.
Под «заболеванием, опосредованным IL-6» понимают заболевание, вызванное IL-6, при котором IL-6 активируют и сохраняют функцию иммунной системы на протяжении инфекционных заболеваний.
Примеры таких заболеваний, опосредованных IL-6, включают в себя цирроз при алкоголизме, амилоидоз, атеросклероз, сердечное заболевание, такое как стенокардия, инфаркт миокарда, миокардиопатия и миокардит, склероз, такой как рассеянный склероз, и реакции при трансплантации органов.
Под «лигандом рецептора EP4» понимают соединение, которое связывается с рецептором EP4, включая стереоизомер этого соединения, фармацевтически приемлемую соль этого соединения или стереоизомер, пролекарство этого соединения или стереоизомер, или фармацевтически приемлемую соль этого пролекарства. Также понятно, что любое дополнительное фармацевтически активное соединение, используемое в сочетании с лигандом рецептора EP4, может быть стереоизомером этого дополнительного активного соединения, солью этого дополнительного активного соединения или ее стереоизомером, пролекарством дополнительного соединения или его стереоизомером, или солью этого пролекарства.
Под «антагонистом рецептора EP4» понимают химическое соединение, которое снижает или блокирует биологическую активность рецептора EP4. Такие антагонисты могут включать в себя белки, такие как анти-EP4 антитела, нуклеиновые кислоты, аминокислоты, пептиды, углеводороды, маленькие молекулы (органические или неорганические), или любое другое соединение или композицию, снижающую активность рецептора EP4 либо посредством снижения присутствующего в клетке количества рецептора EP4, либо посредством снижения связывающей или сигнальной активности рецептора EP4.
Использующийся здесь термин «алкил» обозначает прямой или разветвленный насыщенный моновалентный углеводородный радикал, включая, но ими не ограничиваясь, метил, этил, пропил, изопропил, н-бутил, изо-бутил, втор-бутил, трет-бутил, неопентил и тому подобное.
Использующийся здесь термин «алкенил» обозначает углеводородный радикал, содержащий, по крайней мере одну двойную связь, включая, но ими не ограничиваясь, этенил, пропенил, 1-бутенил, 2-бутенил и тому подобное.
Использующийся здесь термин «алкинил» обозначает углеводородный радикал, содержащий, по крайней мере, одну тройную связь, включая, но ими не ограничиваясь, этинил, пропинил, 1-бутинил, 2-бутинил и тому подобное.
Использующийся здесь термин «галоген» относится к F, Cl, Br или I, предпочтительно F или Cl.
Использующийся здесь термин «циклоалкил» обозначает насыщенный углеводородный радикал, включая, но ими не ограничиваясь, циклопропил, циклобутил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил и тому подобное.
Использующийся здесь термин «алкокси» обозначает О-алкильную группу, где «алкил» такой, как определено выше.
Использующийся здесь термин «моноциклическое ароматическое кольцо» обозначает моноциклическое ароматическое карбоциклическое или гетероциклическое кольцо (и содержащее 0-4 гетероатома, выбранных из О, N и S), включая, но ими не ограничиваясь, фенил, пиразолил, фурил, тиенил, оксазолил, тетразолил, тиазолил, имидазолил, тиадиазолил, пиридил, пиримидинил, пирролил, тиофенил, пиразинил, пиридазинил, изоксазолил, изотиазолил, триазолил, фуразанил и тому подобное.
Использующийся здесь термин «бициклическое ароматическое кольцо» обозначает моноциклическое или бициклическое ароматическое карбоциклическое или гетероциклическое кольцо (и содержащее 0-4 гетероатома, выбранных из О, N и S), включая, но ими не ограничиваясь, нафтил, бензофуранил, изобензофуранил, бензотиофенил, индолил, изоиндолил, бензоксазолил, бензотиазолил, индазолил, бензимидазолил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил, хиноксалинил и тому подобное.
Использующийся здесь термин «алкилен» обозначает насыщенный углеводород (прямая или разветвленная цепь), где атом водорода удален из каждого концевого углерода, такой как метилен, этилен, пропилен, бутилен, пентилен, гексилен и тому подобное.
Использующийся здесь термин «циклоалкилен» обозначает бивалентные циклоалкильные группы, включая, но ими не ограничиваясь, циклопропилен, циклобутилене, циклопентилен, циклогексилен и циклогептилен и тому подобное.
Использующийся здесь термин «алкенилен» обозначает промежуточной радикал прямой или разветвленной углеводородной цепи, содержащий, по крайней мере, одну двойную связь, включая, но ими не ограничиваясь, -CH=CH-, -CH=CHCH-, -CH=CHCH(CH3)- и тому подобное.
Использующийся здесь термин «алкинилен» обозначает промежуточный радикал прямой или разветвленной углеводородной цепи, содержащий, по крайней мере, одну тройную связь, включая, но ими не ограничиваясь, -C≡,-C-C≡H2-,-C≡CH(CH3)- и тому подобное.
Использующийся здесь термин «трициклическое кольцо» обозначает насыщенный углеводородный радикал, включая, но ими не ограничиваясь, адамантил, трицикло [5.2.1.02,6]декан и тому подобное.
Использующийся здесь термин «две соседние L группы, необязательно, присоединены друг к другу с образованием алкиленовой цепи, содержащей 3 или 4 члена, в которой один или два (несоседних) атома углерода необязательно заменены атомами кислорода» обозначает, но ими не ограничивается, -O-CH2-O-, -CH2-О-CH2-, -О-CH2CH2-, -CH2CH2-О-, -О-CH2CH2-О-, -CH2CH2CH2-О-, -О-CH2CH2CH2-, -CH2-О-CH2CH2-, -CH2CH2-О-CH2- и тому подобное.
Использующийся здесь термин «арил» обозначает ароматические радикалы, включая, но ими не ограничиваясь, фенил, нафтил, тетрагидронафтил, инданил, бифенил и тому подобное.
Использующийся здесь термин «защитные группы» обозначает гидрокси или аминозащитные группы, которые выбраны из обычных гидрокси или аминозащитных групп, описанных в Protective Groups in Organic Synthesis edited by T. W. Greene et al. (JohnWiley & Sons, 1991);
Использующийся здесь термин «лечение» относится к реверсии, облегчению, ингибированию развития или профилактике расстройства или состояния, к которому применяется этот термин, или одного или нескольких симптомов этого расстройства или состояния. Использующийся здесь глагол «лечение» относится к акту лечения, где «лечение» определено непосредственно выше.
Другие возможности и преимущества данного изобретения будут понятны из следующего подробного описания и из формулы изобретения. Хотя изобретение описано в связи с конкретными воплощениями, будет понятно, что в рамках данного изобретения, а также в пределах приложенной формулы изобретения, также могут быть осуществлены изменения и модификации. Данное изобретение включает в себя любые эквиваленты, варианты, применения или приспособления по данному изобретению, которые находятся, в целом, в принципе данного изобретения, включая отклонения от данного описания, которые согласуются в известной или обычной практикой в данной области. Дополнительное руководство относительно получения и использования нуклеиновых кислот и полипептидов могут быть получены из обычных учебников по молекулярной биологии, химии белка и иммунологии (смотри, например, Davis et al., Basic Methods in Molecular Biology, Elsevir Sciences Publishing, Inc., New York, NY, 1986; Hames et al., Nucleic Acid Hybridization, IL Press, 1985; Molecular Cloning, Sambrook et al., Current Protocols in Molecular Biology, Eds. Ausubel et al., John Wiley и Sons; Current Protocols in Human Genetics, Eds. Dracopoli et al., John Wiley и Sons; Current Protocols in Protein Science, Eds. John E. Coligan et al., John Wiley и Sons; and Current Protocols in Immunology, Eds. John E. Coligan et al., John Wiley и Sons). Все публикации приведены здесь в качестве ссылки в полном объеме.
Описание фигур
На фигуре 1 представлена гистограмма, показывающая секрецию IL-6 при стимулировании PGE2 ConA-обработанных PBMC человека (заштрихованная полоса) и ConA-необработанных PBMC человека (закрашенная полоса).
На фигуре 2 представлена гистограмма, показывающая зависимость стимуляции секреции IL-6 РВМС человека от концентрации PGE2 без и со стимуляцией ConA, и инибиторный эффект антагониста EP4, соединения A (N-[({2-[4-(2-этил-5,7-диметил-3H-имидазо[4,5-b]пиридин-3-ил)фенил]этил}амино)карбонил]-4-метилбензолсульфонамид). В PBMC, обрабатываемых ConA, соединение A значительно ингибировало секрецию IL-6.
На фигуре 3 представлена гистограмма, показывающая эффективность антагониста EP4, соединения A и соединения B (3-{[1S)-2-(4,5-дифенил-1,3-оксазол-2-ил)-2-циклогексен-1-ил]метил}бензойная кислота) при ингибировании секреции IL-6 в РВМС, обрабатываемых ConA.
На фигуре 4 представлена гистограмма, показывающая эффект на продукцию IL-6 при применении PGE2 на цельную кровь человека.
На фигуре 5 представлен график, показывающий эффекты EP2 (бутапрост), EP4 (11-деокси-PGE1) и EP1/EP3 (сульпростон) на продукцию IL-6 в HWB.
На фигуре 6 представлен график, показывающий эффект соединения B (320-40000 нМ) на продукцию IL-6 в HWB, стимулированной PGE2.
На фигуре 7 представлен график, показывающий эффект PGE2 на продукцию IL-6 в цельной крови человека (HWB), стимулированной ConA.
На фигуре 8 представлен график, показывающий эффект соединения C(N-[({2-[4-(5-ацетил-2-этил-1H-бензимидазол-1-ил)фенил]этил}амино)карбонил]-4-метилбензолсульфонамид) (16-50000 нМ) на продукцию IL-6 в HWB, стимулированной ConA и PGE2.
Подробное описание изобретения
Настоящее изобретение относится к применению лиганда рецептора EP4 при получении лекарственного средства для лечения заболеваний, опосредованных IL-6. Это изобретение основано на наблюдении относительной устойчивости к развитию симптомов артрита у мышей с «нокаутом» EP4 после индукции заболевания введением антител к коллагену типа II (экспериментальная модель ревматоидного артрита).
Данное изобретение также описывает способы скрининга для идентификации агентов, которые ингибируют активность EP4 in vivo, например, для применения в качестве препарата для лечения ревматоидного артрита.
Терапевтические способы
Агент, идентифицированный как лиганд рецептора EP4, вводили в дозе, эффективной для лечения заболеваний, опосредованных IL-6, выбранных из группы, состоящей из цирроза при алкоголизме, амилоидоза, атеросклероза, сердечного заболевания, склероза и реакций при пересадке органов. Такие терапевтически эффективные количества могут быть определены, используя обычные способы оптимизации, на основании конкретного состояния, лечение которого предполагается, состояния больного, пути введения, композиции, рекомендаций лечащего врача и других факторов, очевидных специалистам в данной области в свете данного описания.
Агент, который ингибирует активность EP4, может вводится в виде терапевтической композиции. Такие лиганды рецептора EP4 могут включать в себя небольшие молекулы, нуклеиновые кислоты, например антисмысловые нуклеиновые кислоты EP4, аминокислоты, пептиды, углеводороды и антитела против EP4. Предпочтительно, такие агенты объединяют с фармацевтически приемлемым транспортным агентом или носителем. Примеры антител против EP4 включают в себя, например, поликлональные, моноклональные, очеловеченные, анти-идиотопические, химерные или антитела с одинарной цепью, Fab, F(ab')2 и Fab из библиотеки фрагментов экспрессии, молекулы scFV и их фрагменты, связывающие эпитоп. Антисмысловой олигонуклеотид, который ингибирует экспрессию гена EP4 или мРНК, получают в соответствии со стандартными способами (смотри, например, Agrawal et al. Methods in Molecular Biology: Protocols for Oligonucleotides and Analogs, Vol. 20 (1993)).
Как используется здесь, фармацевтически приемлемый носитель включает в себя растворители, дисперсионную среду, агенты покрытия, антибактериальные и противогрибковые агенты и изотонические агенты и агенты, задерживающие абсорбцию, которые совместимы с фармацевтическим введением.
Носитель может также включать в себя другие активные или инертные компоненты, и/или может быть нацелен на ткань сустава в силу своей структуры.
Терапевтическую композицию составляли таким образом, чтобы она была совместимой для предназначенного пути введения. Неограниченные примеры путей введения включают в себя парентеральный, например внутривенный, чрескожный, подкожный, пероральный (например, прием или ингаляция), чрескожный (местный), через слизистую и ректальный пути. Растворы или суспензии могут быть получены, как описано в Remington's Pharmaceutical Sciences (18th ed., Gennaro, ed., Mack Publishing Co., Easton, PA, (1990)).
Терапевтическая эффективность таких ингибиторов EP4 может быть определена в свете данного описания стандартными терапевтическими способами в клеточных культурах или экспериментальных животных, например для определения ED50 (доза, терапевтически эффективная в 50% популяции).
Данные, полученные из анализов клеточной культуры и исследований на животных, могут быть использованы при определении диапазона доз у человека. Доза может изменяться в зависимости от композиции и пути введения. Для любого ингибитора EP4, используемого в способе по данному изобретению, терапевтически эффективная доза может сначала быть определена в экспериментах на клеточной культуре. Доза может быть определена на моделях животных для достижения уровня концентрации циркулирующей плазмы, которая включает в себя IC50, как определено в экспериментах на клеточной культуре. Эти данные могут использоваться для более точного определения эффективных доз человека. Уровни в плазме могут быть измерены, например с помощью высокоэффективной жидкостной хроматографии.
Специалисту в данной области будет понятно, что определенные факторы могут влиять на дозу и время, необходимое для эффективного лечения млекопитающих, включая, но этим не ограничиваясь, серьезность заболевания или расстройства, ранее проводимое лечение, общее состояние здоровья и/или возраст млекопитающего и наличие других заболеваний. Более того, лечение млекопитающих терапевтически эффективным количеством ингибитора EP4 может включать в себя один курс лечения или, предпочтительно, может включать в себя периодические курсы лечения.
В случае антител против EP4 предпочтительная доза обычно составляет от 10 мг/кг до 20 мг/кг массы тела. Обычно частично гуманизированные антитела и исключительно человеческие антитела имеют большое время полураспада в организме человека по сравнению с другими антителами. Следовательно, возможно применять более низкие дозы и вводить их не так часто. Для стабилизации антител и для повышения поглощения и всасывания в ткани можно применять модификации, такие как липидизация. Способ липидизации антител описан Cruikshank et al. (J. Acquired Immune Deficiency Syndromes Hum. Retrovirol. 14:193, 1997).
К лигандам рецептора EP4 (например, антагонисты), которые могут вводится, относятся лиганды формулы I, а также описанные ниже, и описанные в предварительной заявке США 60/241825, поданной 19 октября, 2000, и Akiyoshi et al., по не-предварительной заявке США, поданной приблизительно 10 октября, 2001 и называемой «Aryl or Heteroaryl Fused Imidazole Compound as Anti-Inflammatory and Analgesic Agents», приведенные здесь в качестве ссылки. Заявка была опубликована как WO 02/32900. В настоящей заявке WO 02/32900 приведена в полном объеме в качестве ссылки. К другим ингибиторам EP4, которые могут вводиться, относятся ингибиторы, описанные в EP0985663, WO 00/15608, WO 00/03980, WO 98/55468, WO 01/62708, WO 01/42281, WO 01/02855, WO 01/10426, WO 99/47497, WO 00/16760, WO 00/18744, WO 00/16760, WO 00/21532, WO 00/18405, EP 0855389, GB 2330307, GB 2342799 и GB 2075503.
Данное изобретение включает в себя как общее, так и конкретные описания вышеуказанных ссылок.
Пример A
Стимуляция PGE2 секреции IL-6 в РВМС человека, обработанных ConA
Инкубирование PBMC с 5 мкг/мл ConA в течение 24 часов усиливало секрецию IL-6 (фигура 1). Если клетки PBMC конкурентно стимулировали ConA и различными концентрациями PGE2 в течение 24 часов, секреция IL-6, кроме того, возрастала в 3,5, 5,7 и 10,1 раз при стимуляции 10, 100 и 1000 M PGE2, соответственно, по сравнению с секрецией IL-6 при стимуляции ConA без PGE2 (фигура 1). В отличие от этого, стимуляция 10-1000 нМ PGE2 РВМС, не обработанных ConA, не влияла на секрецию IL-6. PBMC стимулировали 5 мкг/мл только Con A или вместе с 10 нМ 1000 нМ PGE2 при 37°C в течение 24 часов. IL-6, секретированный в культуру, измеряли с помощью ELISA. Данные выражали как среднее значение ± s.d. (фигура 1).
Влияние антагонистов EP4 на секрецию IL-6 в PBMC
Зависимость секреции IL-6 клетками PBMC человека в зависимости от концентрации PGE2 без и совместно со стимуляцией ConA и ингибиторный эффект соединения A. PBMC стимулировали 5 мкг/мл только конканавалина A или вместе с 10 нМ - 1000 нМ PGE2 при 37°C в 5% CO2 в течение 24 часов. Для того, чтобы увидеть эффект соединения A, одновременно с добавлением ConA и PGE2 добавляли 50 мкМ соединения A и инкубировали в течение 24 часов. Данные в круглых скобках выражают % контроля активности митохондриальной дигидрогеназы (фигура 2).
Соединение A ингибировало продукцию IL-6, увеличенную при всех концентрациях PGE2 (10-1000 нМ) (фигура 2). Вместе с этим, для того чтобы удостовериться, что 50 мкМ соединения A являются нетоксичными для PBMC, через 24 часа инкубирования PBMC проверяли жизнеспособность клеток колориметрическим способом, используя набор для подсчета клеток. Клетки, обработанные соединением A, имели сходную жизнеспособность с жизнеспособностью необработанных клеток, что означает, что ингибиторный эффект соединения A на секрецию IL-6 не является следствием цитотоксичности. На фигуре 3 показана кривая доза/ответ для соединения A и соединения B при стимуляции PBMC 5 мкг/мл ConA и 100нМ PGE2 в течение 24 часов. Продукция IL-6 ингибировалась в зависимости от дозы соединения А и соединения В со значениями IC50, равными 13 и 32 нМ, соответственно. Соединение A и соединение B ингибировали секрецию IL-6 в РВМС, обработанных ConA (фигура 3). PBMC инкубировали с 5 мкг/мл Con A, 100 нМ PGE2 и различными дозами антагонистов EP4 при 37°С в течение 24 часов. Секрецию IL-6 в культуральной среде измеряли с помощью ELISA. Данные выражены как среднее значение ± s.d.
Пример B: Получение культур цельной крови человека (HWB) иактивация PGE2
Способы:
Цельную периферическую кровь человека (HWB) собирали у здоровых добровольцев в пробирки для образцов (девять объемов на один объем 3,8% тринатрий цитрата, Becton Dickinson) и охлаждали при 4°C до проведения эксперимента. HWB (50 мкл) помещали в экспериментальную плашку и перемешивали в течение 10 секунд с помощью мешалки для плашки (с уровнем интенсивности 4, TAITAC, Micromixer). Образцы оставляли в течение 3 минут при комнатной температуре, затем добавляли 45 мкл среды AIM и перемешивали в течение 10 секунд с помощью мешалки для плашки (с уровнем интенсивности 4). В течение 3 минут образцы находились при комнатной температуре. К образцам добавляли смесь (100 мкл) 10-10000 нМ PGE2 и 100 мкМ аргатробана и перемешивали в течение 10 сек мешалкой для плашки (с уровнем интенсивности 4). Образцы инкубировали в 5% CO2 при 37°С в течение 24 часов. Затем образцы перемешивали и центрифугировали при 200g в течение 10 минут. Супернатанты собирали, и величину конц. IL-6 измеряли с помощью набора для проведения ELISA (цито-скринирование).
Результаты:
В этом эксперименте авторами настоящего изобретения был осуществлен способ PGE2-индуцированной продукции IL-6, используя цельную кровь человека (HWB). Для предотвращения синтеза фибрина к культуральной среде добавляли аргатробан, ингибитор тромбина. Добавление 100 мкМ аргатробана ингиб